纯磨玻璃密度浸润前病变与浸润性肺腺癌的临床及CT鉴别
2017-06-05左玉强孟庆春田云霞左晓玲乔晓慧
左玉强,孟庆春,田云霞,左晓玲,乔晓慧,乔 青,赵 亮
(河北省石家庄市第一医院放射科 050011)
论著·临床研究
纯磨玻璃密度浸润前病变与浸润性肺腺癌的临床及CT鉴别
左玉强,孟庆春,田云霞,左晓玲,乔晓慧,乔 青,赵 亮
(河北省石家庄市第一医院放射科 050011)
目的 探讨CT对表现为纯磨玻璃密度结节(pGGN)的浸润前病变与浸润性肺腺癌(包括微浸润性肺腺癌和浸润性肺腺癌)的鉴别诊断价值。方法 回顾性分析经手术病理证实的CT影像表现为pGGN的病灶156例,其中浸润前病变组58例,浸润性肺腺癌(TNM分期为T1N0M0)组98例,比较两组病灶的CT征象及患者的性别并进行统计学处理;对CT征象及患者性别之间的差异进行χ2检验,对两组病灶大小做ROC曲线。结果 病灶形态、空泡征、空气支气管征、血管穿行征、瘤-肺界面清晰及血管集束征在两组间差异有统计学意义(P<0.05);ROC曲线显示当病灶大于15.35 mm时,浸润性肺腺癌的准确率为75.0%。结论 pGGN的病灶大小、形态、空泡征、空气支气管征、血管穿行征、瘤-肺界面及血管集束征有一定预测价值。
肺肿瘤;腺癌;磨玻璃密度;体层摄影术,X线计算机
肺部纯磨玻璃密度结节(pure ground-glass opacity nodules,pGGN)在以往多被认为是炎性结节、出血或不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)等非侵袭性结节[1-2]。而根据2011年国际多学科肺腺癌分类新标准(IASLC/ATS/ERS分类),pGGN病理结果可以是浸润前病变,如AAH和原位腺癌(adenocarcinoma in situ,AIS),也可以是微浸润腺癌(minimally invasive adenocarcinoma,MIA)和浸润性腺癌[2-3]。浸润前病变与浸润性肺腺癌的临床治疗方式存在一定的差异,AAH可以进行CT随访而不必手术,AIS可以短期内随访而不急于手术以排除AAH及其他良性病变,而浸润性肺腺癌则需及时手术切除[4],故二者的鉴别诊断显得尤为重要。本文回顾性分析CT影像表现为pGGN的浸润前病变58例与浸润性肺腺癌(TNM分期为T1N0M0)98例,重点观察其CT影像特征及临床资料,以提高二者的鉴别诊断能力。
1 资料与方法
1.1 一般资料 收集石家庄市第一医院(石家庄市肿瘤医院)2011年10月至2015年9月间经手术病理证实的CT表现为pGGN的病例156例,病灶最大径均小于或等于30 mm。其中浸润前病变组58例,男14例,女44例,年龄28~74岁,平均(56.17±10.96)岁;病灶大小5.6~21.4 mm,平均(11.78±3.24)mm。浸润性肺腺癌组98例,男34例,女64例,年龄32~77岁,平均(58.96±8.87)岁;病灶大小8.7~27.8 mm,平均(16.90±4.17)mm。临床表现:咳嗽22例,胸痛16例,发热12例,体检发现106例。病理结果显示浸润前病变组58例,其中AAH 16例,AIS 42例。浸润性肺腺癌组中MIA 32例;浸润性肺腺癌66例。
1.2 设备及扫描方法 采用美国GE公司生产的Lightspeed VCT 64排螺旋CT进行肺部扫描,患者取仰卧位,双手上举过头,扫描范围自双肺尖至膈下(包括双侧肾上腺)。扫描参数:管电压120 kV,管电流150 mA,螺距0.984,扫描层厚和层间隔为2.5 mm。扫描完成后对病灶区采用0.625 mm层厚和层间隔进行薄层扫描,并用高分辨率算法进行图像多平面重组(multi-planar reformation,MPR)。图像观察条件如下,肺窗:窗宽1 600 HU,窗位-600~-400 HU;纵隔窗:窗宽400 HU,窗位50 HU。
1.3 图像分析 所有图像处理结束后,由两名熟悉胸部疾病影像诊断的副主任医师对所有患者CT图像进行双盲观察,重点观察:病灶形态(圆/类圆形、不规则形)、大小(取病灶横断面最大截面的最大径)、密度[感兴趣区面积(region of interest,ROI)=10 mm,在病灶内3个不同位置分别测量,然后取三者平均值]、病灶内部结构(局部密度增高、空泡征、空气支气管征、血管穿行征)、病灶瘤-肺界面清晰与否以及病灶周围是否伴有血管集束征。两名影像诊断医师对CT征象评价意见不统一时需协商一致或找高一级专家分析评定并最终达成一致意见方可采用。
1.4 病理分型 依据2011年国际多学科肺腺癌分类(IASLC/ATS/ERS分类)[2-3],将病变分为浸润前病变组(包括AAH和AIS)和浸润性肺腺癌组(包括MIA和浸润性肺腺癌)。
1.5 统计学处理 采用SPSS 22.0软件进行统计学处理,患者性别及CT征象等计数资料采用χ2检验分析;患者年龄及病灶大小等计量资料采用t检验分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 CT影像结果 此次研究中156例病例均为单发病灶,病灶圆形/类圆形64例(图1A、1B)、不规则形92例(图2A、2B);局部密度增高47例、空泡征35例(图1A)、空气支气管征39例(图2A)、血管穿行征68例(图2A);病灶瘤-肺界面清晰91例(图3A、3B);病灶周围伴有血管集束征56例(图3A)。
将浸润前病变组与浸润性肺腺癌组病灶的CT征象进行χ2检验,结果显示病灶形态、空泡征、空气支气管征、血管穿行征、瘤-肺界面清晰及血管集束征在两组间差异有统计学意义(P<0.05),见表1。病灶大小测量时取病灶横断面图像中最大截面的最大径。浸润前病变组病灶5.6~21.4 mm,平均(11.78±3.24)mm;浸润性肺腺癌组病灶8.7~27.8 mm,平均(16.90±4.17)mm。将两组的病灶大小进行t检验,检验结果显示组间差异有统计学意义(t=8.540,P<0.001),见表2。病灶密度:分别在病灶内不同位置测量3次,取3者的平均值,测量时ROI=10 mm2。浸润前组病灶密度-730~-321HU,平均-(543.62±88.48)HU;浸润性肺腺癌组病灶密度-808~-307 HU,平均-(522.84±106.29)HU。将两组的病灶密度进行t检验,检验结果显示组间差异无统计学意义(P>0.05),见表2。

组别n男圆形/类圆形局部密度增高空泡征空气支气管征血管穿行征瘤-肺界面清晰血管集束征浸润前病变组581435168418256浸润性腺癌组983429312735537850P>0.05<0.05>0.05<0.05<0.05<0.05<0.05<0.05
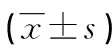
表2 浸润前病变组和浸润性肺腺癌组年龄、大小、CT值差异比较
a:P<0.01,与浸润前病变组比较。
对两组病灶大小做ROC曲线,结果显示阈值大小为15.35 mm(图2),灵敏度为67.3%;特异度为87.9%;阳性率为90.4%;阴性率为61.4%;正确率为75.0%;当病变大于15.35 mm时,75.0%可诊断为浸润性肺腺癌。
2.2 临床资料分析结果 对两组患者的临床资料进行统计学分析,发现两组病例在患者的性别和发病年龄方面差异无统计学意义(P>0.05)。

图2 病灶大小对浸润前病变与浸润性肺腺癌鉴别诊断的ROC曲线
3 讨 论
2011年国际多学科肺腺癌分类中将肺腺癌分为浸润前病变、MIA、浸润性腺癌和浸润性腺癌变异型三大类[2-3]。浸润前病变主要包括AAH和AIS,肺腺癌则包括MIA、浸润性腺癌和浸润性腺癌变异型。MIA指直径小于或等于30 mm以贴壁生长为主型肿瘤,并且肿瘤病灶在各方向的浸润范围小于或等于5 mm,此外MIA的确诊必须是整个肿瘤病灶全部取材。浸润性肺腺癌包括贴壁为主、腺泡为主、乳头为主、实性为主和微乳头为主5个类型[3,5]。
部分学者[6-8]研究结果显示肺腺癌的CT征象与其病理机制和生物学行为关系密切,且对其治疗方式的选择、治疗效果及预后有重要的提示作用。此次研究发现瘤-肺界面清晰在浸润前病变组和浸润性肺腺癌组差异有统计学意义,浸润性肺腺癌组的瘤-肺界面清晰的发生率较浸润前病变组高。金鑫等[9]曾报道表现为pGGN的浸润性肺腺癌的瘤-肺界面清晰的显示率高达86.84%,此次研究中浸润性肺腺癌组瘤-肺界面清晰的显示率为79.59%,略低于文献报道,可能与两次研究的样本量均较小、统计结果存在一定偏差有关,或者与瘤-肺界面清晰的界定标准存在一定差异有关。目前国内外关于瘤-肺界面清晰的病理机制的报道较少,主要是缺乏影像学与相应的大体组织标本的对照研究。金鑫等[9]认为由于浸润性病变时,病变区域的正常肺组织被肿瘤细胞占据,肿瘤细胞在肺泡壁的排列较紧密所致;也有学者[10-11]认为导致瘤-肺界面清晰的病理机制是肿瘤细胞沿肺泡壁生长导致肺泡壁厚度的增加或肿瘤组织的浸润导致肺泡壁厚度的突然变化所致。笔者结合以上研究结果认为肿瘤细胞沿肺泡壁生长时,细胞排列比较紧密使得肺泡壁组织结构更加致密和(或)肺泡壁厚度增加,从而导致瘤-肺界面清晰。
此次研究发现空气支气管征在浸润前病变组与浸润性肺腺癌组差异有统计学意义,浸润性肺腺癌组空气支气管征的发生率更高,此结果与部分学者[9,12-13]研究结果基本一致。陈天忠等[12]认为空气支气管征发生的病理机制有以下3种可能:(1) 肿瘤细胞直接通过肺泡孔、淋巴道、小气道以直接浸润方式向周围扩展,而支气管不受累而形成;(2) 肿瘤组织对支气管的浸润以及肿瘤内纤维化反应的牵拉导致支气管扩张、扭曲而形成; (3)肿瘤组织本身产生一定量的黏液阻塞支气管导致阻塞近端的支气管扩张而形成。高丰等[13]研究发现浸润前病变的组织病理显示异形细胞或肿瘤细胞沿肺泡壁或呼吸性细支气管壁呈贴壁式生长,但其对周围无浸润,亦不会导致肺泡塌陷,故其多不影响支气管。结合此次研究结果,笔者认为肿瘤组织对周围基质的浸润以及肿瘤内纤维化反应对支气管的牵拉是导致浸润性肺腺癌组空气支气管征发生率高的主要原因。浸润前病变由于不受肿瘤组织的浸润,亦无纤维化牵拉的作用,走行于病灶边缘的支气管可自然通过,所以空气支气管征的发生率较低。
此次研究发现浸润前病变组病灶形态多呈圆形/类圆形,其发生比例明显高于浸润性肺腺癌组,且两组间差异有统计学意义。导致该征象的病理机制为浸润前病变多沿肺泡壁呈伏壁式生长,其对周围基质无浸润或浸润较小,故多呈圆/类圆形。而浸润性病灶则对周围基质浸润较明显,同时由于肿瘤边缘向各方向生长速度不同,导致其边缘多呈不规则形。
血管集束征在CT图像上表现为病灶边缘聚拢的扩张的动、静脉分支,这些血管分支主要反映肿瘤的血供较为丰富。此次研究中发现浸润性腺癌组中血管集束征的发生率明显高于浸润前病变组,且两组间有显著差异,说明浸润性腺癌组较浸润前病变组的病灶血供更加丰富,更加容易引发周围侧枝血管的增生或直接侵犯周围血管,此结果与Gao等[14]研究结果基本一致。另外,此次研究发现浸润性肺腺癌组血管穿行征的发生率明显高于浸润前病变组,此结果与Gao等[14]研究结果亦较为一致。究其病理机制可能为浸润性腺癌对邻近血管的浸润或牵拉所导致。
空泡征指CT影像上pGGN内大小1~2 mm的小圆形或不规则形的小透亮区。范丽等[15]认为其病理学基础为:(1)未受肿瘤组织侵犯的正常含气的肺组织;(2)局部扩张的终末细支气管;(3)受肿瘤组织侵犯、破坏而扩张的肺泡腔。此次研究发现浸润性肺腺癌组空泡征的发生率明显高于浸润前病变组,且组间差异有统计学意义。导致该征象的病理机制可能与肿瘤细胞呈伏壁式生长有关,因肿瘤细胞沿肺泡壁呈伏壁式生长导致肺泡腔未被完全填充故而形成空泡。
Nitadori 等[16]研究报道pGGN病灶大小也是选择治疗方案时需要参考的重要指标之一。尽管此次研究显示浸润性肺腺癌组病灶平均直径较浸润前病变组大,且两组间差异有统计学意义,但部分浸润性肺腺癌的病灶直径小于浸润前病变的平均直径,提示临床工作中应对较小pGGN进行密切随访观察。
此次研究的不足之处在于病例的选择存在偏差,研究中病例仅选自外科手术病例作为研究对象,不能反映pGGN的整体情况;此外,此次研究中,未将浸润前病变与微浸润腺癌、微浸润腺癌与浸润性腺癌分别进行对比分析,有待以后工作中进一步探讨。
总之,此次研究发现表现为pGGN的病灶中,浸润性肺腺癌所占比例较高,浸润前病变与浸润性肺腺癌的病灶大小临界值为15.35 mm,当病灶大于15.35 mm时诊断浸润性肺腺癌的准确率为75.0%;浸润性肺腺癌的病灶多呈不规则形,病灶内空泡征、空气支气管征、血管穿行征,瘤-肺界面清晰及血管集束征出现的概率较高。
[1]Chang B,Hwang JH,Choi YH,et al.Nature history of pure ground-glass opacity lung nodules detected by low-dose CT scan[J].Chest,2013,143(1):172-178.
[2]Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/American thoracic society/European respiratory society international multidisciplinary classification of lung adenocarcinoma[J].J Thorac Oncol,2011,6(2):244-285.
[3]Austin JH,Garg K,Aberle D,et al.Radiologic implications of the 2011 classification of adenocarcinoma of the lung[J].Radiology,2013,266(1):62-71.
[4]肖时满,张玉,强金伟,等.超高分辨率CT(UHRCT)鉴别肺原位腺癌(AIS)与微浸润腺癌(MIA)[J].复旦学报(医学版),2014,41(3):285-290.
[5]Van Schil PE,Sihoe AD,Travis WD.Pathologic classification of adenocarcinoma of lung[J].J Surg Oncol,2013,108(5):320-326.
[6]Lee HY,Lee KS.Ground-glass opacity nodules:histopathology,imaging evaluation,and clinical implications[J].J Thorac Imaging,2011,26(2):106-118.
[7]Inoue M,Minami M,Sawabata N,et al.Clinical outcome of resected solid-type small-sized c-stage IA non-small cell lung cancer[J].Eur J Cardiothorac Surg,2010,37(6):1445-1449.
[8]Lederlin M,Puderbach M,Muley T,et al.Correlation of radio and histomorphological pattern of pulmonary adenocarcinoma[J].Eur Respir J,2013,41(4):943-951.
[9]金鑫,赵绍宏,高洁,等.纯磨玻璃密度肺腺癌病理分类及影像表现特点分析[J].中华放射学杂志,2014,48(4):283-287.
[10]孟庆成,贾丙鑫,张建伟,等.微浸润型肺腺癌的高分辨率CT表现[J].中国医学影像学杂志,2013,21(7):536-538,542.
[11]景瑞,赵绍宏,蔡祖龙,等.纯磨玻璃密度浸润性肺腺癌CT表现[J].中国介入影像与治疗学,2014,11(6):353-356.
[12]陈天忠,韦乐心,余绍立,等.多层螺旋CT对肺磨玻璃结节与支气管关系的初探[J].临床放射学杂志,2014,33(5):711-715.
[13]高丰,葛虓俊,李铭,等.经多层螺旋CT探讨肺磨玻璃结节与支气管的关系[J].中华放射学杂志,2013,47(2):157-161.
[14]Gao F,Li M,Ge X,et al.Multi-detector spiral CT study of the relationships between pulmonary ground-glass nodules and blood vessels[J].Eur Radiol,2013,23(12):3271-3277.
[15]范丽,于红,刘士远,等.3 cm以下肺恶性局灶性磨玻璃结节与实性结节螺旋CT征象对照[J].中华放射学杂志,2010,44(1):16-19.
[16]Nitadori J,Bograd AJ,Kadota K,et al.Impact of micropapillary histologic subtype in selecting limited resection vs lobectomy for lung adenocarcinoma of 2 cm or smaller[J].J National Cancer Institute,2013,105(16):1212-1220.
Clinical and CT identification between preinvasive and invasive lung adenocarcinoma presented as pure ground-glass opacity
Zuo Yuqiang,Meng Qingchun,Tian Yunxia,Qiao Xiaohui,Qiao Qing,Zhao Liang
(Department of Radiology,Shijiazhuang Municipal No.1 Hospital,Shijiazhuang,Hebei 050011,China)
[Abstract] Objective To investigate the diffevential diagnostic value of preinvasive and invasive lung adenocarcinoma (including minimally invasive adenocarcinoma and invasive adenocarcinoma) presented as pure ground-glass nodules(pGGN) by CT.Methods One hundred and fifty-six cases of pGGN verified by operative pathology were retrospectively analyzed,including 58 cases of preinvasive adenocarcinoma and 98 cases of invasive adenocarcinoma(TNM staging were T1N0M0).The CT features and sex were statistically processed.The difference between the CT features and sex were performed by theχ2test.The ROC curve of lesion focus size was drawn.Results Statistically significant differences were found in the lesion shape,vacuole sign,air bronchogram,blood vessel through,tumor-lung interface and vascular cluster sign between the two groups(allP<0.05).The ROC curve showed that the accuracy rate of invasive adenocarcinoma was 75.0% when the size of the pGGN lesions was larger than 15.35 mm.Conclusion The lesion size,shape,vacuole sign,air bronchogram,blood vessels through and vascular cluster sign have some predictive value.
lung neoplasms;adenocarcinoma;ground-glass opacity;tomography,X-ray computed
10.3969/j.issn.1671-8348.2017.13.018
左玉强(1981-),硕士,主治医师,主要从事胸部疾病影像诊断方面的研究。
R445.3
A
1671-8348(2017)13-1782-04
2016-12-08
2017-01-26)
