RhoA/ROCK信号通路在胃癌中的表达及其与胃癌生物学行为的关系
2017-06-05廖山婴王蓓蓓沙卫红
廖山婴,刘 超,王蓓蓓,马 娟,沙卫红
广东省人民医院(广东省医学科学院) 1.消化内科; 2.病理科,广东 广州 510080
RhoA/ROCK信号通路在胃癌中的表达及其与胃癌生物学行为的关系
廖山婴1,刘 超2,王蓓蓓1,马 娟1,沙卫红1
广东省人民医院(广东省医学科学院) 1.消化内科; 2.病理科,广东 广州 510080
目的检测人胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α及血清血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,了解RhoA/ROCK信号通路在胃癌发病过程中是否活化及其与胃癌新生血管形成、临床病理分期之间的关系。方法选取广东省人民医院2010年10月-2012年10月行手术切除癌组织的胃癌患者60例,收集手术切除的胃癌组织60份和距癌边缘>10 cm的正常胃组织60份,并留取前述60例胃癌患者及本院同期胃镜检查正常的20名健康人群血清标本。应用免疫组化及Western blotting检测胃癌组织及癌旁正常组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白表达,ELISA法检测胃癌组及正常对照组血清VEGF水平,分析各指标与胃癌分化程度、肿瘤大小、淋巴结转移、远处转移、浸润深度和临床分期及患者性别、年龄之间的关系。结果胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α表达水平高于癌旁正常组织(P<0.05),胃癌组血清VEGF水平明显高于对照组(P<0.05)。胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α表达量及血清VEGF水平与患者性别、年龄、肿瘤大小及分化程度无关,而与胃癌的TNM分期、侵犯浆膜、淋巴结转移及远处转移相关(P<0.05)。结论RhoA、ROCK-Ⅰ在胃癌中高表达,其可能通过激活PI3K/Akt/mTOR信号转导通路上调HIF-1α、VEGF表达而影响胃癌的发生、发展、侵袭和转移,为临床发现胃癌的治疗新靶点提供了参考依据。
RhoA;ROCK;HIF;PI3K;血管内皮生长因子;胃癌;临床病理参数
胃癌是最常见的恶性肿瘤之一,近年来胃癌发病率有逐年上升的趋势,且发病日益年轻化,严重影响人们健康。目前胃癌的病因和发病机制尚未完全阐明[1]。PTEN/PI3K/Akt信号转导通路是细胞增殖和凋亡最为密切的通路之一,与多种肿瘤的发病及预后密切相关[2]。我们的前期研究[3-5]表明PPARγ等多种细胞因子基因多态性与胃癌的发生有关,进一步的动物实验结果显示,PPARγ配体Rosiglitazone能显著降低MNNG诱导的大鼠腺胃癌发生率,人胃癌组织中PPARγ、PTEN、Akt 存在异常表达且与胃癌的TNM分期、侵犯浆膜、淋巴结转移及远处转移密切相关,其机制与抑制Akt/mTOR信号通路有关。谭莉莉等[6]研究发现,HIF-1α在胃癌根治性切除术后患者中呈高表达,可作为评估胃癌术后复发的指标,与患者的总体生存期相关。本研究采用免疫组化、Western blotting检测胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α的表达及ELISA法检测胃癌患者血清VEGF水平,分析各指标与胃癌生物学行为的相关性,进一步探讨PTEN/PI3K/Akt的上游调控分子RhoA/ROCK及下游调控分子HIF-1α/VEGF信号通路在胃癌发生、发展中的作用及可能的作用机制。
1 资料与方法
1.1 一般资料选取2010年10月-2012年10月广东省人民医院胃肠外科行胃癌根治术并均经术后病理检查证实为胃癌标本60例,并留取相应的癌旁正常组织(距肿瘤边缘≥10 cm,手术后经HE染色证实无癌及癌前病变),组织取材后立即放入液氮冻存备用。所有患者术前均未予放化疗。男38例,女22例,平均年龄53岁;高、中分化腺癌36例,低分化腺癌24例;临床分期采用国际抗癌联盟(UICC)胃癌TNM分期方法,其中Ⅰ/Ⅱ期28例,Ⅲ/Ⅳ期32例;有淋巴结转移41例,无淋巴结转移19例;远处转移13例,无远处转移47例;肿瘤浸润未侵及浆膜层者26例,浸润超过浆膜层者34例。另以本院同期胃镜检查正常的20名健康人群为正常对照,留取前述60例胃癌患者及20名正常对照组的血清标本。所有病例均经我院伦理委员会验证,患者均签署知情同意书。
1.2 主要试剂RhoA、ROCK-Ⅰ及PI3K的一抗购自美国Abcam公司,HIF-1α的一抗购自Santa公司,辣根过氧化物酶标记的IgG二抗、DAB显色剂、MaxvisionTM试剂购自福州迈新生物技术有限公司,人VEGF酶联免疫吸附试验检测试剂盒购自美国R&D公司。
1.3 免疫组织化学染色检测RhoA、ROCK-Ⅰ、PI3K、HIF-1α表达石蜡切片常规脱蜡至水,每张切片滴加50 μl一抗RhoA、ROCK-Ⅰ、PI3K、HIF-1α,一抗浓度分别为RhoA 1∶100,ROCK-Ⅰ 1∶150,PI3K 1∶200,HIF-1α 1∶250,37 ℃孵育1 h,PBS冲洗,滴加50 μl辣根过氧化物酶标记的IgG二抗,PBS冲洗,滴加50 μl MaxvisionTM试剂,室温下孵育10 min;PBS冲洗,滴加50 μl新鲜配制的DAB,室温下孵育10 min;苏木精对比染色,梯度酒精脱水,二甲苯透明,中性树胶封固。DAB显色阳性表达为棕色。每份标本随机选取5个高倍视野(200×),采用Image-pro Plus Version 6.0软件进行图像分析,结果以平均光密度(MOD)表示。
1.4 Western blotting检测RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白的表达常规提取蛋白,考马斯亮蓝G-250染色法进行蛋白定量。经120 g/L十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转膜,5%脱脂奶粉封固,加入一抗抗体RhoA、ROCK-Ⅰ、PI3K、HIF-1α,4 ℃过夜;去一抗,PBS冲洗4次,再加入辣根过氧化物酶标记二抗,室温孵育2 h,加入电化学发光试剂显影、定影。扫描成像,计算各个条带的灰度值,以累积吸光度(IA)比值表示表达量(目的蛋白条带/内参蛋白条带)。
1.5 血清VEGF测定采集空腹静脉血2.0 ml不加抗凝剂,30 min后1 000 r/min离心15 min,离心半径12 cm,小心吸取血清,-20 ℃保存,采用双抗夹心ELISA法测定VEGF。

2 结果
2.1 RhoA、ROCK-Ⅰ、PI3K、HIF-1α在胃癌及癌旁正常组织中的表达RhoA阳性染色主要位于胞膜和胞质中,ROCK-Ⅰ及PI3K阳性染色主要位于胞质中,HIF-1α阳性位于胞质和胞核。免疫组化及Western blotting检测结果显示,胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白表达水平明显高于癌旁正常组织,差异有统计学意义(P<0.05,见图1~2、表1~2)。
2.2 胃癌组及对照组血清VEGF水平ELISA检测结果显示,胃癌组血清VEGF为(375.17±43.28)pg/ml,正常对照组为(74.60±21.62)pg/ml,胃癌组明显高于正常对照组,差异有统计学意义(P<0.05)。
2.3 胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α表达及血清VEGF水平与临床病理因素的关系胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白表达量及血清VEGF水平与患者性别、年龄、肿瘤大小及分化程度无相关性(P>0.05),而与胃癌的TNM分期、浆膜侵犯、淋巴结转移及远处转移相关(P<0.05,见表3)。
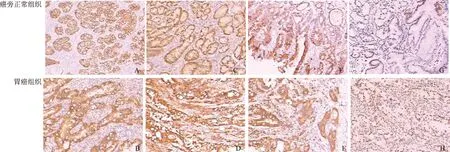
图1 胃癌组织及癌旁正常组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白的表达(免疫组化200×)
A:RhoA胞膜着色,阳性;B:RhoA胞膜、胞浆着色,强阳性;C:ROCK-Ⅰ胞浆着色,阳性;D:ROCK-Ⅰ胞浆着色,强阳性;E:PI3K胞浆着色,阳性;F:PI3K胞浆着色,强阳性;G:HIF-1α胞核着色,阳性;H:HIF-1α胞核着色,强阳性
Fig 1 RhoA, ROCK-Ⅰ, PI3K and HIF-1α expressions in gastric carcinoma tissues and adjacent normal gastric tissues (IHC 200×)
A: expression of RhoA in adjacent normal gastric tissue; B: expression of RhoA in gastric carcinoma; C: expression of ROCK-Ⅰ in adjacent normal gastric tissue; D: expression of ROCK-Ⅰ in gastric carcinoma; E: expression of PI3K in adjacent normal gastric tissue; F: expression of PI3K in gastric carcinoma; G: expression of HIF-1α in adjacent normal gastric tissue; H: expression of HIF-1α in gastric carcinoma

图2 胃癌组织及癌旁正常组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白的表达(Western blotting)
Fig 2 Expressions of RhoA, ROCK-Ⅰ, PI3K and HIF-1α in gastric carcinoma tissues and adjacent normal gastric tissues (Western blotting)
3 讨论
RhoA是Ras超家族中具有GTP酶活性的一种小G蛋白分子,与GTP结合时活化,又称Rho GTP酶,在细胞内起到分子开关的作用。Rho激酶(Rho-kinase,ROCK)属于丝氨酸/苏氨酸蛋白激酶家族成员,是RhoA的主要下游效应分子,以2种高度同源性的异构体形式存在(ROCK-Ⅰ和ROCK-Ⅱ),它们在氨基酸水平有65%的同源性,在激酶区有92%的同源性。ROCK接受Rho转导的活化信号,发生多个氨基酸位点的磷酸化而激活,并介导其下游一系列磷酸化/脱磷酸化反应。RhoA/ROCK信号通路参与了多种细胞生物学过程,包括细胞周期、细胞骨架的调控、细胞生长和凋亡等[7]。
研究[8]发现,RhoA在肿瘤组织的高表达与肿瘤的恶性程度密切相关。RhoA蛋白在乳腺癌、膀胱癌、卵巢癌和胃癌等组织中的表达水平显著高于正常组织,且RhoA/ROCK蛋白表达在膀胱癌从Ⅰ级到Ⅲ级的发生、发展过程中显著升高。由此可见,RhoA及其下游效应蛋白组成的信号通路影响肿瘤的发展与恶化。Kakinuma等[9]研究表明,在肿瘤细胞中RhoA参与调控微丝(microfilament,MF)重组,进而诱导应力纤维的形成。深入研究发现,RhoA通过上调moesin蛋白表达和磷酸化水平,促进伪足、黏着斑和膜状突起等结构形成,最终导致宫颈癌细胞迁移显著性增加[10]。研究[11]表明,咔唑生物碱处理肝癌HepG2细胞后抑制细胞增殖,其机制与细胞内PKCδ(Ser 643)磷酸化水平降低后下调RhoA活性,引起MF解聚和细胞周期受阻有关。

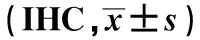

组别例数RhoAROCK-ⅠPI3KHIF-1α癌旁正常组织600.019±0.0060.021±0.0070.024±0.0080.027±0.010胃癌组织600.062±0.0070.067±0.0130.071±0.0150.080±0.022t值4.4525.6676.02610.523P值0.0450.0250.0210.003


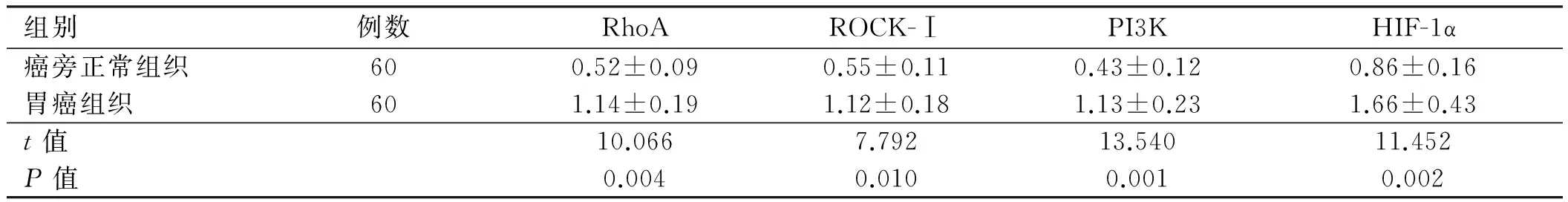
组别例数RhoAROCK-ⅠPI3KHIF-1α癌旁正常组织600.52±0.090.55±0.110.43±0.120.86±0.16胃癌组织601.14±0.191.12±0.181.13±0.231.66±0.43t值10.0667.79213.54011.452P值0.0040.0100.0010.002



临床病理因素例数RhoAP值t值ROCK-ⅠP值t值PI3KP值t值HIF-1αP值t值VEGFP值t值性别 男381.22±0.200.4851.21±0.180.5591.16±0.220.0941.83±0.380.720377.94±49.690.744 女221.06±0.160.5201.02±0.150.3611.12±0.253.1461.65±0.420.135372.44±42.800.112年龄(岁) <60241.00±0.090.2711.09±0.160.2781.11±0.210.0851.51±0.390.652368.78±49.960.302 ≥60361.28±0.161.3311.15±0.221.2891.13±0.293.5321.81±0.440.214381.59±41.561.164淋巴结转移 有411.30±0.120.0111.31±0.140.0141.48±0.250.0262.00±0.300.003410.01±20.240.046 无190.98±0.077.4800.97±0.076.9730.93±0.145.5931.31±0.1510.908340.36±31.064.397肿瘤大小(cm) ≥5351.22±0.170.7871.26±0.180.4991.21±0.240.9361.83±0.380.804393.87±40.850.607 <5251.07±0.180.0741.03±0.150.4691.04±0.210.0071.49±0.400.063356.50±42.840.279分化程度 高、中分化361.10±0.200.7501.04±0.130.0691.09±0.210.0951.60±0.440.622362.14±44.820.686 低分化241.18±0.170.1041.29±0.213.5901.15±0.273.0071.72±0.410.249388.24±43.740.171TNM分期 Ⅰ/Ⅱ期281.00±0.060.0310.98±0.100.0141.09±0.130.0001.22±0.280.002324.69±62.700.037 Ⅲ/Ⅳ期321.37±0.105.2221.34±0.246.9431.31±0.4517.2872.01±0.3111.558427.50±34.244.825浆膜侵犯 无260.97±0.070.0180.96±0.130.0231.06±0.160.0011.28±0.210.020311.84±67.510.026 有341.31±0.146.3181.37±0.285.8861.32±0.4614.1812.08±0.356.184427.36±34.215.580远处转移 无470.95±0.080.0060.93±0.140.0211.01±0.150.0341.25±0.190.038314.70±63.390.013 有131.33±0.158.9371.43±0.286.0431.40±0.335.0002.11±0.334.769423.79±29.117.179
我们的前期研究结果表明,IL-1、IL-6、PPARγ等多种细胞因子基因多态性与胃癌的发生有关,动物实验结果显示,PPARγ配体Rosiglitazone能显著降低MNNG诱导的大鼠腺胃癌发生率,明显抑制大鼠胃癌组织AKT及VEGF的表达。同时体内研究显示,胃癌患者的肿瘤组织中PPARγ、PTEN、Akt表达量明显增高,且与胃癌的TNM分期、侵犯浆膜、淋巴结转移及远处转移相关[3-5],提示PPARγ可能通过PTEN-磷脂酰肌醇3-激酶(PI3K)-Akt信号转导通路,参与肿瘤的发生、发展。然而关于PI3K/Akt信号通路的上游、下游调控机制目前尚不明确。
缺氧是肿瘤发生、发展微环境中的重要因素,缺氧诱导因子-1(hypoxia induced factor,HIF-1)广泛存在于哺乳动物和人体内,是细胞在缺氧条件下产生的一种调节机体内细胞对缺氧的反应的核转录因子,调控着其下游众多基因如VEGF、促红细胞生成素(EPO)、胰岛素样生长因子-Ⅱ(IGF-Ⅱ)、内皮素-1(ET-1)等的转录和表达,是低氧诱导基因转录信息传递的最主要途径,HIF-1的活性主要由HIF-1α决定。研究[12]表明,HIF-1α活性的抑制剂2-methoxyoestradiol(2ME2)可抑制体外培养肿瘤细胞的HIF-1和VEGF的表达,而体内试验中2ME2能降低肿瘤的异质性生长和血管生长。PI3K/Akt的激活对缺氧时HIF-1α的表达和活化起重要作用,体外及体内研究发现,PI3K/Akt信号通路可调控HIF-1α表达,进而调控其下游靶基因VEGF,参与缺氧性脑损伤的发生[13]。PI3K/Akt信号通路在肿瘤细胞中是否能通过调控HIF-1α的活性,进而促进VEGF的表达,从而参与肿瘤的发生、发展、转移,是目前肿瘤研究的热点。
关于RhoA/ROCK信号通路与PI3K/Akt信号通路关系的研究不多,Del Re等[14]对心肌细胞的研究发现机械牵张可通过RhoA/ROCK信号通路活化导致FAK的磷酸化,进而活化PI3K/Akt信号通路介导心肌细胞的保护作用。Ghosh等[15]研究发现RhoA通过PI3K/Akt通路促进小鼠前列腺癌细胞的增生。Hamamura等[16]对成骨细胞的研究也发现机械刺激可通过RhoA/ROCK信号通路介导PI3K/Akt信号的活化,以上研究均提示RhoA/ROCK是PI3K/Akt的上游信号通路,通过PI3K/Akt信号的活化发挥作用。对滋养层细胞、人胃癌细胞株的研究均发现,缺氧可通过RhoA的活化上调HIF-1α的表达,进而增加VEGF的表达[17]。结合我们前期结果推测,PPARγ可能通过上游调控分子RhoA/ROCK,经PTEN/PI3K/Akt信号转导通路,调控下游HIF-1α、VEGF的表达,从而参与胃癌的发生、发展。
我们在前期研究的基础上进一步检测了RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白在胃癌患者及正常人群体内表达情况,结果表明,与癌旁正常组织相比,胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α蛋白水平明显升高,且与血清VEGF增高水平密切相关。进一步结合胃癌患者的临床病理特征分析,结果显示,胃癌组织中RhoA、ROCK-Ⅰ、PI3K、HIF-1α表达量及血清VEGF水平与患者性别、年龄、肿瘤大小及分化程度无相关性,而与胃癌的TNM分期、侵犯浆膜、淋巴结转移及远处转移相关。
因此,我们认为,RhoA、ROCK-Ⅰ在胃癌中的高表达与胃癌的生物学行为密切相关,RhoA/ROCK可能通过调控PI3K/Akt信号通路,进而影响HIF-1α、VEGF的表达,促进肿瘤新生血管形成,参与肿瘤的发生、发展、转移。明确RhoA/ROCK信号通路在胃癌发病过程中的作用,有助于从分子水平进一步阐明的胃癌发病机制,为胃癌的临床治疗提供新的靶点。
[1]Piazuelo MB, Epplein M, Correa P. Gastric cancer: an infectious disease [J]. Infect Dis Clin North Am, 2010, 24(4): 853-869.
[2]Gonzalez-Angulo AM, Ferrer-Lozano J, Stemke-Hale K, et al. PI3K pathway mutations and PTEN levels in primary and metastatic breast cancer [J]. Mol Cancer Ther, 2011, 10(6): 1093-1101.
[3]Liao SY, Zeng ZR, Leung WK, et al. Peroxisome proliferator-activated receptor-gamma Pro12Ala polymorphism, Helicobacter pylori infection and non-cardia gastric carcinoma in Chinese [J]. Aliment Pharmacol Ther, 2006, 23(2): 289-294.
[4]陈白莉, 廖山婴, 曾志荣, 等. PPARγ配体罗格列酮预防MNNG诱导的大鼠胃癌发生的实验研究[J]. 中国病理生理杂志, 2009, 25(8): 1522-1527. Chen BL, Liao SY, Zeng ZR, et al. Effects of rosiglitazone, a PPARγ ligand, on chemoprevention of MNNG-induced gastric cancer in rats [J]. Chinese Journal of Pathophysiology, 2009, 25(8): 1522-1527.
[5]廖山婴, 朱小波, 王蓓蓓, 等. PPARγ、PTEN、Akt在胃癌中的表达及其与胃癌生物学行为的关系[J]. 新医学, 2014, 45(6): 394-398. Liao SY, Zhu XB, Wang BB, et al. Relationship between expression of PPARγ, PTEN and Akt and biologic behaviors of gastric carcinoma [J]. New Medicine, 2014, 45(6): 394-398.
[6]谭莉莉. HIF-1α的表达与胃癌根治性切除术后复发的关系[J]. 胃肠病学和肝病学杂志, 2014, 23(12): 1402-1405. Tan LL. Relationship between the expression of HIF-1α and the recurrence of gastric cancer after surgery [J]. Chin J Gastroenterol Hepatol, 2014, 23(12): 1402-1405.
[7]Sorokina EM, Chernoff J. Rho-GTPases: new members, new pathways [J]. J Cell Biochem, 2005, 94(2): 225-231.
[8]Kamai T, Tsujii T, Arai K, et al. Significant association of Rho/ROCK pathway with invasion and metastasis of bladder cancer [J]. Clin Cancer Res, 2003, 9(7): 2632-2641.
[9]Kakinuma N, Roy BC, Zhu Y, et al. Kank regulates RhoA-dependent formation of actin stress fibers and cell migration via 14-3-3 in PI3K-Akt signaling [J]. J Cell Biol, 2008, 181(3): 537-549.
[10]He M, Cheng Y, Li W, et al. Vascular endothelial growth factor C promotes cervical cancer metastasis via up-regulation and activation of RhoA/ROCK-2/moesin cascade [J]. BMC Cancer, 2010, 10: 170.
[11]Lin W, Wang Y, Lin S, et al. Induction of cell cycle arrest by the carbazole alkaloid Clauszoline-I from Clausena vestita D. D. Tao via inhibition of the PKCδ phosphorylation [J]. Eur J Med Chem, 2012, 47(1): 214-220.
[12]Ricker JL, Chen Z, Yang XP, et al. 2-methoxyestradiol inhibits hypoxia-inducible factor 1alpha, tumor growth, and angiogenesis and augments paclitaxel efficacy in head and neck squamous cell carcinoma [J]. Clin Cancer Res, 2004, 10(24): 8665-8673.
[13]Li L, Qu Y, Mao M, et al. The involvement of phosphoinositid 3-kinase/Akt pathway in the activation of hypoxia-inducible factor-1alpha in the developing rat brain after hypoxia-ischemia [J]. Brain Res, 2008, 1197: 152-158.
[14]Del Re DP, Miyamoto S, Brown JH. Focal adhesion kinase as a RhoA-activable signaling scaffold mediating Akt activation and cardiomyocyte protection [J]. J Biol Chem, 2008, 283(51): 35622-35629.
[15]Ghosh PM, Bedolla R, Mikhailova M, et al. RhoA-dependent murine prostate cancer cell proliferation and apoptosis: role of protein kinase Czeta [J]. Cancer Res, 2002, 62(9): 2630-2636.
[16]Hamamura K, Swarnkar G, Tanjung N, et al. RhoA-mediated signaling in mechanotransduction of osteoblasts [J]. Connect Tissue Res, 2012, 53(5): 398-406.
[17]Xue Y, Li NL, Yang JY, et al. Phosphatidylinositol 3′-kinase signaling pathway is essential for Rac1-induced hypoxia-inducible factor-1(alpha) and vascular endothelial growth factor expression [J]. Am J Physiol Heart Circ Physiol, 2011, 300(6): H2169-H2176.
(责任编辑:李 健)
Relationship between expression of RhoA/ROCK signaling pathway and biologic behaviors of gastric carcinoma
LIAO Shanying1, LIU Chao2, WANG Beibei1, MA Juan1, SHA Weihong1
1.Department of Gastroenterology and Hepatology; 2.Department of Pathology, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
Objective To detect the expressions of RhoA, ROCK-Ⅰ, PI3K, HIF-1α in human gastric carcinoma and the level of serum vascular endothelial growth factor (VEGF), then explore the relationship between these biomarkers and clinicopathological characteristics.Methods From Oct. 2010 to Oct. 2012 in Guangdong General Hospital, 60 cases of pathologically confirmed gastric cancer after surgical treatment were enrolled, gastric cancer tissues and adjacent normal tissues (over 10 cm from cancer tissues) were collected. Immunochemical stain (IHC) and Western blotting were used to detect the expressions of RhoA, ROCK-Ⅰ, PI3K, HIF-1α in the tissues. The serum samples of 60 gastric cancer patients and 20 healthy controls were collected and enzyme-linked immunosorbent assay (ELISA) was used to assess the serum level of VEGF. The correlations between the expressions of these biomarkers and the clinicopathological parameters including tumor differentiation grade, size, lymph node metastasis, distant metastasis, depth of invasion, TNM stage, gender and age were analyzed.Results Expressions of RhoA, ROCK-Ⅰ, PI3K, HIF-1α in gastric carcinoma were significantly higher than those in adjacent normal gastric tissues and serum VEGF was highly expressed in gastric cancer patients than healthy controls (P<0.05). Expressions of RhoA, ROCK-Ⅰ, PI3K, HIF-1α in gastric carcinoma and serum VEGF were related with TNM stage, serosal invasion, lymph node metastasis and distant metastasis (P<0.05), but not correlated with the gender, age, tumor size and differentiation grade.Conclusion RhoA and ROCK-Ⅰ are highly expressed in gastric carcinoma, and may increase the expressions of HIF-1α and VEGF by activating the PI3K/Akt/mTOR signaling pathway and then influence the occurrence, development, invasion and metastasis of gastric cancer. This may be a potential therapeutic target in gastric cancer treatment.
RhoA; ROCK; HIF; PI3K; Vascular endothelial growth factor; Gastric carcinoma; Clinicopathological parameter
广东省建设中医药强省科研课题(20151016)
廖山婴,博士研究生,副主任医师,研究方向:消化道肿瘤的综合防治。E-mail:docshanying@163.com
10.3969/j.issn.1006-5709.2017.03.003
R735.2
A 文章编号:1006-5709(2017)03-0251-05
2016-12-15
