丹皮酚通过下调COX-2表达及PGE2合成降低大肠癌细胞侵袭能力
2017-06-05谭诗云
李 明, 谭诗云
武汉大学人民医院消化内科,湖北 武汉 430060
论著·大肠癌
丹皮酚通过下调COX-2表达及PGE2合成降低大肠癌细胞侵袭能力
李 明, 谭诗云
武汉大学人民医院消化内科,湖北 武汉 430060
目的观察丹皮酚对结肠癌LoVo细胞侵袭能力的影响,并探讨其是否通过下调环氧合酶-2(COX-2)表达及PGE2合成发挥抗肿瘤作用。方法分别用0、30、60、120 mg/L的丹皮酚体外处理LoVo细24 h,Transwell小室法检测细胞侵袭能力;ELISA法检测细胞上清液中PGE2的含量;Western blotting检测COX-2、基质金属蛋白酶-9(MMP-9)、NF-κB/p65、IKKα和IκBα的表达。结果丹皮酚处理后,LoVo细胞侵袭能力降低,MMP-9表达下调;COX-2的表达及PGE2合成降低,NF-κB/p65表达下调。结论丹皮酚可能通过抑制NF-κB、COX-2表达、PGE2合成,下调MMP-9表达,降低LoVo细胞侵袭能力。
丹皮酚;结肠癌;LoVo细胞;侵袭;环氧合酶-2;前列腺素E2
研究[1-2]证实,COX-2在包括大肠癌在内的多种肿瘤细胞中均呈过表达状态。而作为前列腺素E2(PGE2)合成的限速酶,过表达的COX-2又可大量产生PGE2。二者共同参与肿瘤发生与进展。COX-2被认为是肿瘤治疗的潜在靶点。流行病学研究[3]也已证实,非选择性COX抑制剂或选择性COX-2抑制剂在一定程度上均可有效预防胃肠道肿瘤。三项随机对照研究[4-6](PreSAP、APC、Approve)评估了COX-2特异性抑制剂在散发结肠腺瘤患者复发中的预防作用及安全性,结果发现三项研究中均可有效降低结肠腺瘤的复发率,特别是降低了进展期结肠腺瘤的复发率。然而,临床研究表明短期使用非选择性COX抑制剂不良反应较少,但长期应用时不良反应则较多,因此,更为安全有效的COX-2抑制剂有待进一步发现和研究。
丹皮酚,又称牡丹酚,是从中草药牡丹、芍药根皮和徐长卿干燥根或全草中提取的小分子酚类化合物。研究[7-11]表明,丹皮酚具有广泛的药理学活性,包括抗炎、肝肾保护、降血糖、免疫调节、心血管保护、抗菌、解热镇痛、抗过敏、抑制血小板聚集和中枢抑制作用等。在肿瘤防治方面的研究,丹皮酚对皮肤癌、乳腺癌及肝癌等多种肿瘤细胞均有抑制作用[12-15]。然而,目前关于丹皮酚抗肿瘤作用的分子机制知之甚少,对细胞因子、基因调控和信号传导通路等方面的研究还有待进一步深入研究。
Chou等[16]研究发现丹皮酚可抑制角叉菜聚糖诱导的大鼠热觉过敏反应,减少大鼠爪部皮肤渗出液中中性粒细胞浸润和TNF-α、IL-β、IL-10、COX-2和PGE2的含量。Chae等[17]研究发现丹皮酚可显著拮抗脂多糖诱导的炎症反应。但是,丹皮酚对于肿瘤中特别是大肠癌中COX-2的作用及其意义未见报道,因此,本研究以COX-2及其产物PGE2为切入点,对丹皮酚在大肠癌中特别是侵袭转移中的作用及其作用机制进行探讨。
1 材料与方法
1.1 主要材料结肠癌LoVo细胞由中国科学院上海细胞库提供;主要试剂:丹皮酚购自宁波天真药业有限公司(纯度>98%);胎牛血清购自GBICO;Transwell小室、培养板购于Corning公司;Matrigel胶购自BD公司;PGE2ELISA试剂盒购自美国BPB公司;COX-2、p-NF-κB(p65)、IKKα、IκBα、MMP-9及β-actin抗体购自Cell Signaling Technology公司。DMEM/F-12培养液、辣根酶标记山羊抗兔或山羊抗鼠IgG购自碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养及分组:用含10%胎牛血清的DMEM/F-12培养基培养,置于37 ℃,体积分数5% CO2条件细胞培养箱中,取生长状态良好并处于对数期的细胞进行实验。该实验分为4组:对照组(0 mg/L丹皮酚)、30 mg/L丹皮酚组、60 mg/L丹皮酚组和120 mg/L丹皮酚组,作用时间均为24 h。
1.2.2 Transwell法检测细胞侵袭能力:取对数生长期的细胞,用不完全培养基处理使细胞饥饿12 h后消化离心后收集细胞,用细胞计数板计数调整细胞浓度为2×105个/ml;在Transwell下室中加入含不同浓度药物的血清培养基600 μl,上室中分别加入150 μl细胞悬液,置于细胞培养箱中培养24 h,每组设3个复孔;培养24 h后,弃掉小室内培养基,用PBS湿润的棉签轻轻拭小室内未迁移过膜的细胞;加入4%多聚甲醛固定,室温10 min;再结晶紫染色,室温15 min;小心切下滤膜,用中性树胶封片;显微镜下观察并拍照计数穿过滤膜的细胞数,每个滤膜取5个随机视野计数,统计结果。
1.2.3 ELISA法检测PGE2:按照预定分组处理24 h后,吸取培养基离心后将上清液移至高压消毒的EP管中备用。加入标准品至酶标板中,设置梯度,分别取各组上清液样品100 μl,加入至酶标板中,再分别将每孔加入酶标液50 μl,室温放置90 min。具体操作步骤根据试剂盒要求进行,根据标准品曲线计算样品中PGE2浓度。
1.2.4 Western blotting检测COX-2、p-NF-κB(p65)IKKα、IκBα及MMP-9蛋白表达:消化离心收集各组处理24 h后的细胞,预冷PBS液洗涤,加入预冷蛋白裂解液200 μl,4 ℃裂解30 min,置于冰上超声裂解;4 ℃,12 000 r/min离心10 min,小心吸取上清,移至高压消毒过的EP管中,分装后置于-80 ℃储存。采用BCA法测定蛋白质;取40 μg样品并加入等体积上样缓冲液,SDS-PAGE电泳,再转膜至PVDF膜,37 ℃条件下用浓度百分比5% BSA封闭1 h,分别加入兔抗人COX-2、p-NF-κB(p65)、IKKα、IκBα及MMP-9抗体,4 ℃摇床上孵育过夜;次日TBST洗膜,再加入辣根酶标记的山羊抗兔二抗,37 ℃条件下孵育2 h,TBST洗膜,暗室曝光、显影、定影,拍照并分析结果。
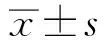
2 结果
2.1 丹皮酚对LoVo细胞侵袭能力的影响30、60、120 mg/L的丹皮酚处理LoVo细胞24 h后,穿过Trasnwell小室基底膜的细胞数随着浓度的增加而逐渐减少,与对照组比较,差异有统计学意义(P<0.05);同时,Western blotting检测显示基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)表达下调(见图1)。表明丹皮酚可降低结肠癌LoVo细胞侵袭能力。
2.2 丹皮酚对LoVo细胞COX-2表达及PGE2合成的影响30、60、120 mg/L丹皮酚分别处理LoVo细胞24 h后,Western blotting结果显示随着丹皮酚浓度的升高,COX-2蛋白表达量逐渐降低。细胞上清液中PGE2浓度随着药物浓度的增加而逐渐降低,与对照组比较,差异均有统计学意义(P<0.05,见图2)。
2.3 丹皮酚对LoVo细胞NF-κB表达的影响30、60、120 mg/L的丹皮酚分别处理LoVo细胞24 h后,Western blotting检测结果发现核内NF-κB/p65表达降低,同时胞浆IκBα表达升高,而胞浆IKKα表达降低(见图3)。
3 讨论
大肠癌是常见消化道恶性肿瘤。全球大肠癌发病率位居恶性肿瘤的第3位,每年有超过120万新增病例,并有超过60万病例死亡[18]。欧美等发达国家和地区大肠癌发病率位居恶性肿瘤第3位,病死率则高居恶性肿瘤相关死亡的第2位[19]。在我国,每年新发大肠癌病例约13万,并以平均4%的增幅不断攀升[20]。大肠癌已经成为我国发病率增长速度最快,且发病年龄逐渐年轻化的恶性肿瘤,其病死率已位居我国恶性肿瘤的第4位[21]。早期发现、早期诊断和早期治疗是提高大肠癌患者疗效及改善预后的关键。然而,大部分大肠癌患者在临床诊断时已属中或晚期。

注:与对照组(0 mg/L丹皮酚)比较,#P<0.05。
图1 丹皮酚对LoVo细胞侵袭能力的影响
A:Tanswell小室检测丹皮酚(0、30、60、120 mg/L)对LoVo细胞侵袭能力(200×);B:与对照组比较,60、120 mg/L的丹皮酚处理后,穿过人工基底膜的LoVo细胞数显著减少;C:丹皮酚(0、30、60、120 mg/L)处理后MMP-9表达下调
Fig 1 The effect of Paeonol on the cell invasiveness in LoVo colorectal cancer cells
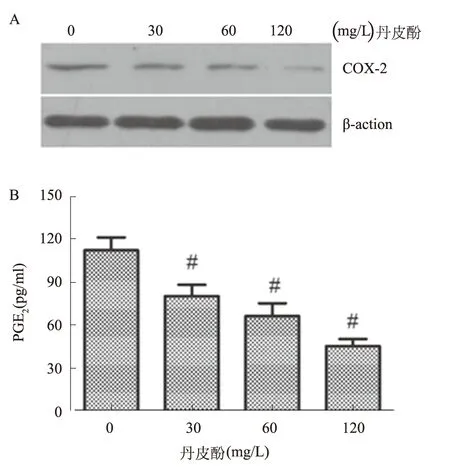
注:与对照组(0 mg/L丹皮酚)比较,#P<0.05。
图2 丹皮酚对LoVo细胞COX-2表达和PGE2合成的影响
A:丹皮酚下调LoVo细胞COX-2表达;B:丹皮酚降低LoVo细胞上清液中PGE2浓度
Fig 2 The effect of Paeonol on the expression of COX-2 and synthesis of PGE2
转移是导致治疗失败和患者死亡的最主要原因,绝大多数肿瘤患者死于肿瘤转移。因此,人们一直在努力寻找新方法和策略来抑制肿瘤侵袭和转移。
基质金属蛋白酶(matrix metalloproteinases,MMPs)可通过降解细胞外基质并破坏基底膜,促进肿瘤细胞从原发灶向周围组织及远处转移。MMPs家族中的MMP-9在多种肿瘤中过表达,降解细胞外基质中的Ⅳ型胶原[22-23]。本实验Tanswell侵袭结果显示丹皮酚处理后,LoVo细胞侵袭能力随着药物浓度的增加逐渐降低,MMP-9表达量也逐渐降低。

图3 丹皮酚对LoVo细胞NF-κB活性的影响Fig 3 Effect of Paeonol on the activity of NF-κB
COX-2在包括大肠癌在内的多种肿瘤细胞中均呈过表达状态。而作为PGE2合成的限速酶,过表达的COX-2又可大量产生PGE2。二者共同参与肿瘤发生与发展。下调COX-2及PGE2表达后可促进细胞凋亡、抑制血管新生、促进细胞免疫而发挥抗肿瘤作用。且特异性COX-2抑制剂在一定程度上可预防胃肠道肿瘤及其他肿瘤。因此,COX-2被认为是肿瘤治疗的潜在靶点。本实验发现丹皮酚能显著降低LoVo细胞COX-2蛋白表达,并抑制PGE2的合成。
NF-κB作为炎症反应的调控基因,参与了COX-2的催化反应,因此本实验进一步检测丹皮酚对NF-κB/p65表达的影响,结果显示,丹皮酚处理后,LoVo细胞核内NF-κB/p65表达降低,同时胞浆IκBα表达升高,而胞浆IKKα表达降低,且呈浓度依赖性,提示丹皮酚可抑制NF-κB的表达。
综上所述,本研究结果提示丹皮酚可降低结肠癌LoVo细胞侵袭能力,其作用机制可能是通过抑制炎症调控因子NF-κB,继而抑制COX-2表达和PGE2合成,下调MMP-9表达。
[1]Wang D, Wang H, Brown J, et al. CXCL1 induced by prostaglandin E2 promotes angiogenesis in colorectal cancer [J]. J Exp Med, 2006, 203(4): 941-951.
[2]Chell S, Kaidi A, Williams AC, et al. Mediators of PGE2synthesis and signalling downstream of COX-2 represent potential targets for the prevention/treatment of colorectal cancer [J]. Biochim Biophys Acta, 2006, 1766(1): 104-119.
[3]Rostom A, Dubé C, Lewin G, et al. Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force [J]. Ann Intern Med, 2007, 146(5): 376-389.
[4]Arber N, Eagle CJ, Spicak J, et al. Celecoxib for prevention of colorectal adenomas [J]. N Engl J Med, 2006, 355(9): 885-895.
[5]Baron JA, Sandler RS, Bresalier RS, et al. A randomized trial of rofecoxib for the chemoprevention of colorectal adenomas [J]. Gastroenterology, 2006, 131(6): 1674-1682.
[6]Bertagnolli MM, Eagle CJ, Zauber AG, et al. Celecoxib for the prevention of sporadic colorectal adenomas [J]. N Engl J Med, 2006, 355(9): 873-884.
[7]Park J, Kim HY, Lee SM. Protective effects of moutan cortex radicis against acute hepatotoxicity [J]. Afr J Tradit Complement Altern Med, 2011, 8(5 Suppl): 220-225.
[8]Hu S, Shen G, Zhao W, et al. Paeonol, the main active principles of Paeonol moutan,ameliorates alcoholic steatohepatitis in mice [J]. J Ethnopharmacol, 2010, 128(1): 100-106.
[9]Lee H, Lee G, Kim H, et al. Paeonol, a major compound of moutan cortex, attenuates Cisplatin-induced nephrotoxicity in mice [J]. Evid Based Complement Alternat Med, 2013, 2013: 310989.
[10]Fu PK, Wu CL, Tsai TH, et al. Anti-inflammatory and anticoagulative effects of paeonol on LPS-induced acute lung injury in rats [J]. Evid Based Complement Alternat Med, 2012, 2012: 837513.
[11]Ha do T, Trung TN, Hien TT, et al. Selected compounds derived from Moutan Cortex stimulated glucose uptake and glycogen synthesis via AMPK activation in human Hep G2 cells [J]. J Ethnopharmacol, 2010, 131(2): 417-424.
[12]Horng CT, Shieh PC, Tan TW, et al. Paeonol suppresses chondrosarcoma metastasis through up-regulation of miR-141 by modulating PKCδ and c-Src signaling pathway [J]. Int J Mol Sci, 2014, 15(7): 11760-11772.
[13]Peng LH, Xu SY, Shan YH, et al. Sequential release of salidroside and paeonol from a nanosphere-hydrogel system inhibits ultraviolet B-induced melanogenesis in guinea pig skin [J]. Int J Nanomedicine, 2014, 9: 1897-1908.
[14]Lin X, Yi Z, Diao J, et al. ShaoYao decoction ameliorates colitis-associated colorectal cancer by downregulating proinflammatory cytokines and promoting epithelial-mesenchymal transition [J]. J Transl Med, 2014, 12: 105.
[15]Cai J, Chen S, Zhang W, et al. Paeonol reverses paclitaxel resistance in human breast cancer cells by regulating the expression of transgelin 2 [J]. Phytomedicine, 2014, 21(7): 984-991.
[16]Chou TC. Anti-inflammatory and analgesic effects of paeonol in carrageenan-evoked thermal hyperalgesia [J]. Br J Pharmacol, 2003, 139(6): 1146-1152.
[17]Chae HS, Kang OH, Lee YS, et al. Inhibition of LPS-induced iNOS, COX-2 and inflammatory mediator expression by paeonol through the MAPKs inactivation in RAW 264.7 cells [J]. Am J Chin Med, 2009, 37(1): 181-194.
[18]Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[19]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[20]Center MM, Jemal A, Ward E. International trends in colorectal cancer incidence rates [J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(6): 1688-1694.
[21]Ganapathi S, Kumar D, Katsoulas N, et al. Colorectal cancer in the young: trends, charactistics and outcome [J]. Int J Colorectal Dis, 2011, 26(7): 927-934.
[22]Yie Y, Zhao S, Tang Q, et al. Ursolic acid inhibited growth of hepatocellular carcinoma HepG2 cells through AMPKα-mediated reduction of DNA methyltransferase 1 [J]. Mol Cell Biochem, 2015, 402(1-2): 63-74.
[23]Qiao ZK, Li YL, Lu HT, et al. Expression of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in renal cell carcinoma [J]. World J Surg Oncol, 2013, 11: 1.
(责任编辑:马 军)
Paeonol inhibits cell invasiveness through inhibiting the expression of COX-2 and PGE2synthesis in LoVo colorectal cancer cells
LI Ming, TAN Shiyun
Department of Gastroenterology, Renmin Hospital of Wuhan University, Wuhan 430060, China
Objective To explore the effect of Paeonol on the cell invasiveness in LoVo colorectal cancer cells and investigate the mechanisms. Methods The experiments were divided into two groups, including control group and Paeonol treatment group. The control group only received the culture medium. After treatment by Paeonol in different concentrations (30, 60 and 120 mg/L), respectively for 24 h, the invasion of LoVo cells was tested by Transwell assay. The expression of PGE2in the culture medium was detected by ELISA. Western blotting was used to detect expressions of COX-2, MMP-9, NF-κB/p65, IKKα and IκBα protein. Results Compared with control group, the invasion of LoVo cells was significantly decreased in Paeonol treatment group. Paeonol inhibited the PGE2synthesis. Western blotting showed that Paeonol decreased the expressions of NF-κB/p65, COX-2 and MMP-9. Conclusion Paeonol inhibits the cell invasion in LoVo cells, and the effects of antitumor may be associated with inhibition of the expressions of NF-κB, COX-2 and PGE2synthesis, thus down-regulate the expression of MMP-9.
Paeonol; Colorectal cancer; LoVo cells; Invasiveness; COX-2; PGE2
10.3969/j.issn.1006-5709.2017.02.002
李明,主治医师,博士,研究方向:消化道肿瘤的防治。E-mail: liming870221@sina.com
谭诗云,博士,主任医师,教授,博士研究生导师,研究方向:消化道肿瘤的防治。E-mail: tanshiyun1962@163.com
735.3+4
A 文章编号:1006-5709(2017)02-0124-04
2016-07-14
