土壤、地下水中重金属和多环芳烃复合污染及修复研究进展
2017-06-05杨悦锁陈煜李盼盼武宇辉赵传起
杨悦锁,陈煜,李盼盼,武宇辉,赵传起
土壤、地下水中重金属和多环芳烃复合污染及修复研究进展
杨悦锁1,2,陈煜1,李盼盼1,武宇辉1,赵传起2
(1吉林大学地下水资源与环境教育部重点实验室,吉林长春130021;2沈阳大学区域污染环境生态修复教育部重点实验室,辽宁沈阳110044)
随着人们对环境污染调查研究的不断深入,对其认识也不断加深。目前,仅对某单一污染物的研究已经无法解决日趋复杂的环境污染问题,多种污染物的复合污染得到越来越多的关注。重金属和多环芳烃是环境中常见的污染物,其复合污染的情况在环境中广泛存在,而且二者之间复杂的相互作用,增加了复合污染的修复难度。土壤和地下水是重金属和多环芳烃的主要富集场所,同时也是生物生存的重要依托,一旦被污染将严重威胁人类及其他生物的生存。对重金属和多环芳烃复合污染的来源、分布、迁移、转化及其生态毒性进行了介绍,简要概括了重金属和多环芳烃复合污染之间的相互作用机理及其修复方法,并对重金属和多环芳烃复合污染的进一步研究提出展望。
重金属;多环芳烃;复合污染;降解;修复;相互作用
引 言
复合污染是指生态系统中多种化学污染物同时存在,且各污染物之间发生相互作用或反应,从而影响它们在环境中的各种行为及毒性的污染现象[1]。土壤和地下水是我国经济和社会发展以及人民生活不可替代的重要资源,近年来随着人类社会生产活动的高速发展,土壤和地下水环境均面临着严重污染的现状。而且土壤和地下水的污染具有持久性、隐蔽性、复杂性和难以治理等特点,因此受到国内外科研人员和政府机构的高度关注。对此,我国分别于2015年和2016年制定了《水污染防治行动计划》(简称“水十条”)和《土壤污染防治行动计划》(简称“土十条”)对土壤和地下水污染进行控制和修复。因此,对土壤和地下水复合污染的特性及其修复手段的了解具有重要的理论与实际意义。
重金属(heavy metals, HMs)作为典型的无机污染物,不能被降解,只能被转化;多环芳烃(polycyclic aromatic hydrocarbons, PAHs)属于持久性有机污染物,具有性质稳定、难降解、毒性强等特点;二者均易被土壤颗粒吸附,并能长期存在于土壤与水环境中,不断累积,具有很强的生态毒性。同时,二者可以通过食物链转移与富集,最终威胁人类的健康[2]。HMs和PAHs作为土壤和地下水污染中典型的污染物,其物理化学性质相差较大,且二者复合时存在着阳离子-π作用、竞争吸附和氧化还原等复杂的相互作用,使得彼此的行为特性发生变化,增加了其复合污染特征研究和修复的难度[3]。HMs和PAHs可由矿山开采和化石燃料燃烧等分别产生,先后进入环境中,或通过电子垃圾处理和污水灌溉等途径同时进入环境中形成复合污染,二者的复合污染在环境中普遍存在[4]。
随着环境污染的日益严重化、复杂化,复合污染问题也逐渐为人们所关注。在前人的努力下,HMs和PAHs复合污染的研究已有了长足的发展。近年来,该领域的研究工作也逐渐从表观的现象、结果研究深入到内在机理层面,尤其是二者之间相互作用的机理[5-6]。对于二者复合污染的修复,也逐渐转向不同学科多手段的组合修复[7-8]。
本文以HMs和PAHs复合污染为代表,从二者的来源、分布及其复合污染的特征、迁移转化规律和生态毒性等几个方面进行概述,总结了近年来相关研究中发现的HMs和PAHs之间相互作用及其作用机理,以及HMs和PAHs复合污染的修复手段,最后对于HMs和PAHs复合污染的进一步研究提出展望。希望通过本文的综述,为今后有关HMs和PAHs复合污染的系统研究及其修复方法和修复效率的进一步提升提供理论基础和技术支撑。
1 HMs和PAHs复合污染来源和分布
1.1 主要污染来源
1.1.1 HMs来源 HMs在工业生产和日常生活中都有广泛的应用,无论是点源污染还是非点源污染,HMs都是较典型的污染物,在水体和土壤中被频繁检出[9]。HMs的点源污染主要来源于工业三废的排放,包括采矿、冶炼、塑料、印刷、制药、电池等工业,非点源则包括农业活动中化肥及农药的使用、污水灌溉、汽车尾气、公路扬尘、化石燃料的燃烧等[10-12]。Chen等[13]利用多元统计和地质统计手段,对西安北部污灌区HMs污染来源进行了分析,发现该区域土壤中的Hg主要来源于长期的污水灌溉,而Cr、Ni和Zn则主要来源于附近的工业活动和大气沉降,汽车尾气和汽油泄漏等是Pb和Cu的主要来源。Turner[14]检测了英格兰西南海滨漂浮的塑料垃圾中HMs的浓度,发现Pb、Cd超标,主要是因为在塑料生产过程中使用了含HMs的稳定剂。
1.1.2 PAHs来源 美国环境保护局(US EPA)列出的16种优先监测的PAHs及其主要理化性质见表1[15]。PAHs的产生主要有3种途径:一是由高温形成,有机质在缺氧环境下的不完全燃烧;二是自然界底层沉积过程形成,例如煤、石油的形成过程,因此煤、石油及一系列衍生产品中都含有较多的PAHs存在;三是由某些植物和微生物合成。PAHs还被用于医药、农药、杀虫剂、树脂、润滑剂、染料、人工色素等化工产品的制备,生产使用过程中的泄漏也是环境中PAHs污染的重要来源[16-17]。
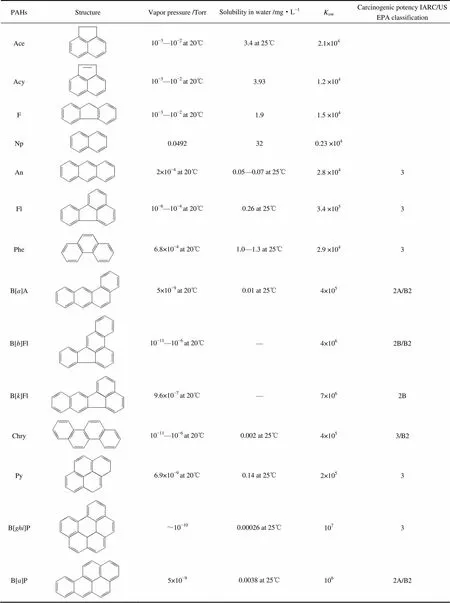
表1 美国环保局列出的16种优先监测的多环芳烃及其主要物化性质

Table 1(continued)
Note: 2A/B2:Probably carcinogenic to humans/Probable human carcinogen; 2B:Possibly carcinogenic to humans; 3:Not classifiable as to human carcinogenicity; Blank: Not tested for human carcinogenicity. IARC: International Agency for Research on Cancer.
Acenaphthene, Ace; Acenaphthylene, Acy; Fluorene, F; Naphthalene, Np; Anthracene, An; Fluoranthene, Fl; Phenanthrene, Phe; Benzo[]anthracene, B[]A; Benzo[]fluoranthene, B[]Fl; Benzo[]fluoranthene, B[]Fl; Chrysene, Chry; Pyrene, Py; Benzo[]perylene, B[]P; Benzo[]pyrene, B[]P; Dibenzo[,]anthracene, D[,]A; Indeno[1,2,3-]pyrene, I[1,2,3-]P.
1Torr=133.3 Pa.
Musa Bandowe等[18]测定了德国埃菲尔山地区沉积岩中的PAHs含量,以研究各历史时期的PAHs贡献率,发现20世纪60年代工业化高峰期,由于各种工业活动的兴起,环境中PAHs浓度快速增加。Peng等[19]研究了煤、燃气、城市固体废物等燃烧过程中PAHs的释放,其中城市固废燃烧时产生的PAHs量高达10047.22 μg·g-1。Zhang等[20]分析了中国北方大气中PAHs的来源,发现焦化过程,煤炭、生物质等的燃烧过程是中国北方大气中PAHs的主要来源。
1.1.3 复合污染来源 HMs和PAHs具有持久性,容易被吸附沉积,可由不同污染源排放后同时或先后进入同一环境中形成复合污染。因此,HMs和PAHs单一的污染源都是潜在的复合污染源。原本受单一污染物污染的场地很可能转变成复合污染场地,而且由于二者具有一定的迁移性,来源不同的污染物可能经过迁移后在某地混合形成复合污染,污染来源和污染场地之间的关系难以把握。例如水流对污染物有携带作用,沿途可将不同来源的HMs和PAHs冲刷、携带并混合,之后在河湖或河流入海口等地共同沉积进入底泥中,形成二者的复合污染[21-22]。对于火力发电厂的燃料和污水灌溉的污水等,其来源较为复杂,其中包含的潜在污染物也较复杂,这二者也常作为HMs和PAHs复合污染的污染源[4,23]。石油行业废水的排放和电子垃圾的处理等过程能向环境中同时释放HMs和PAHs而形成复合污染[24-25]。
1.2 复合污染特点
1.2.1 普遍性 在各种污染问题频发的今天,环境中的污染物很少单独存在,各种污染物同时或先后进入同一环境中并相互影响,形成复合污染的情况十分常见。HMs和PAHs分别作为无机和有机的典型污染物,污染物的来源广泛,二者物化性质较稳定,在环境中不易去除,存在时间长,很容易出现二者复合污染的情况。有许多研究都发现在污水灌溉区、河湖底泥中存在HMs和PAHs的复合污染(表2)。
1.2.2 复杂性 当HMs和PAHs同时存在于同一环境中时,二者之间会发生各种直接或间接的相互作用,原本单一污染物在土壤、地下水中的各种界面行为将改变。复合污染的毒性机理也更加复杂,部分复合污染的毒性远大于单一污染物的毒性之和。Bliss[34]在1939年就提出复合污染物的毒性存在独立联合作用、相似联合和协同作用(包括正协同和负协同作用)。而且二者的相互作用因HMs和PAHs种类和浓度的不同而存在不同的作用机制和效果,在研究过程中,要考虑各种不同的组合情况,这将使得实验工作量成倍增加,难度加大。
1.2.3 修复困难 由于HMs和PAHs复合污染的污染物之间相互作用的存在,加上二者物化性质的差异,其复合污染的同时修复也更加困难。用于复合污染修复的材料要同时对二者具有毒性抗性和稳定性,因此针对单一污染的修复技术,不一定能同时去除HMs和PAHs;复合污染可能对生物材料具有更大的毒性,影响生物材料的修复能力[35]。因此,对于复合污染的同时修复,不仅要考虑修复材料对某一污染物的去除,还要研究污染物之间的相互作用机制,更好地把握其在复合污染修复过程中产生的影响。
1.3 复合污染的环境分布
HMs和PAHs是环境中普遍存在的污染物,在中国乃至世界各地均有分布。根据国土资源部1999~2014年的调查,有2.5%的调查点位(约覆盖面积2.33×104km2)存在中度甚至重度的HMs超标,主要分布在我国西南区、南方的湘鄂皖赣区和闽粤琼区[36]。中国国家海洋局对77条入海河流的监测数据显示,2015年HMs年入海量达21×106kg[22]。Shen等[37]研究了从1960年到2008年来地球上PAHs的排放量,最高年排放量达到592×106kg,2008年为499×106kg,亚洲东南部的排放量最大。在我国山西、河北、山东、北京、天津、渤海、广州等地也都发现有不同程度的PAHs污染[20,38-39]。
排放到环境中的HMs和PAHs可以是气体、固体或液体的形式,分布于大气、土壤、水等各圈层,但由于二者一般难挥发,水溶性差,在大气和水中的HMs和PAHs常吸附于固体悬浮物上,随之沉降到土壤或底泥中,土壤和底泥成为HMs和PAHs的主要积累场所,目前国内外发现的HMs和PAHs复合污染主要都分布于河湖沉积物和污灌农田或工厂周边的土壤中(表2)。
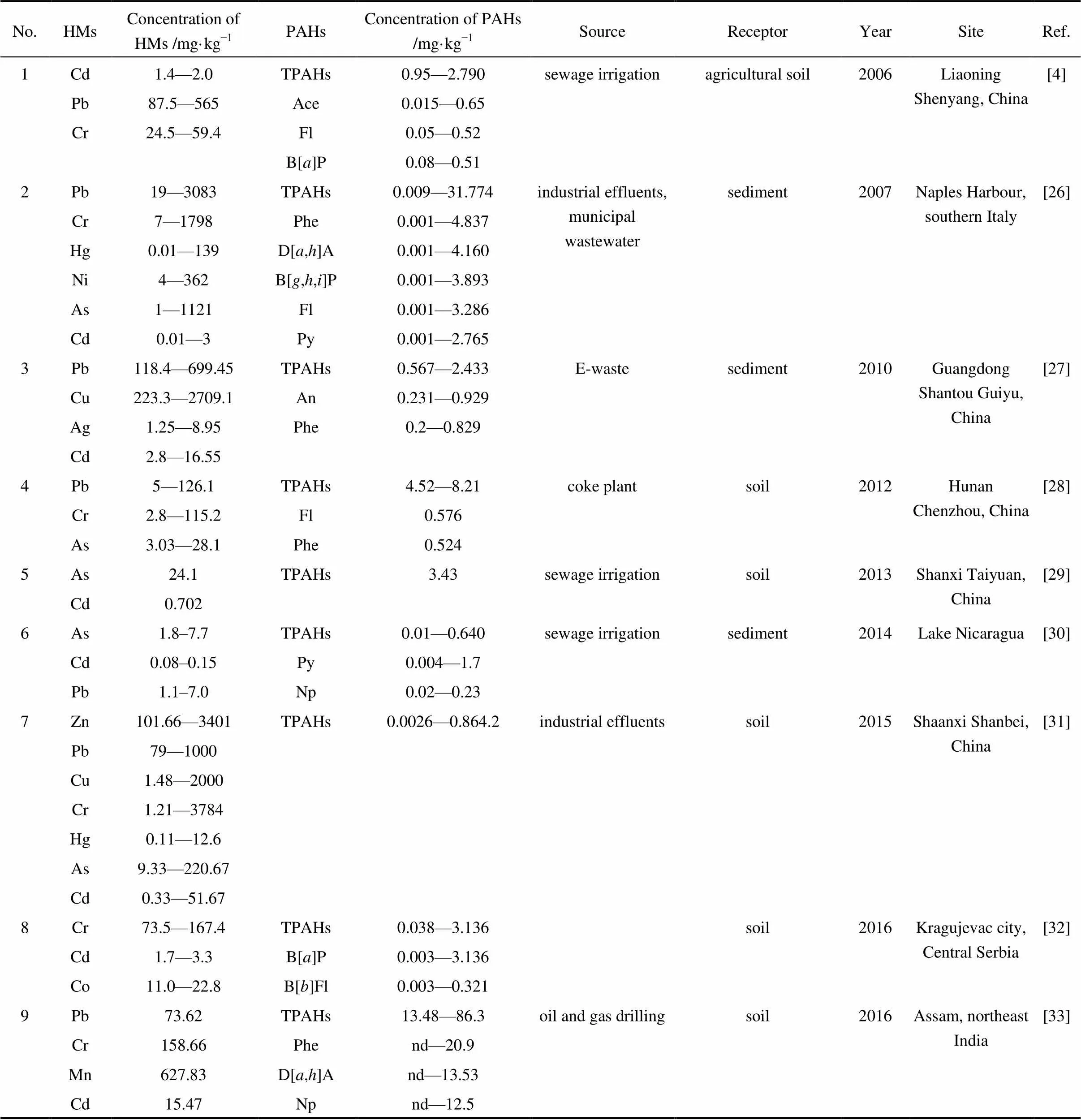
表2 HMs和PAHs复合污染现状
Note: Value is pollutants concentration in dry soil. Range of values means the lowest and highest for multiple sampling points. Single one means average value as research area. Blank means pollution source is unknown.
2 HMs和PAHs复合污染生态毒性
2.1 土壤复合污染的生态毒性
2.1.1 对土壤微生物的毒性 土壤是环境中微生物的主要生长基质,存在于土壤中的HMs和PAHs能与土壤微生物直接接触,二者都能通过细胞膜进入微生物细胞,在胞内累积,影响胞内的生化反应,破坏遗传物质。而且二者对细胞膜具有破坏作用,能够改变细胞膜的通透性,促进对方的胞内积累,增加对微生物的毒性。Lu等[40]实验发现Cd和芘的复合污染对土壤微生物的毒害作用明显强于二者的单一污染。Thavamani等[41]对澳大利亚某污染场地中的微生物量及微生物种类进行检测,并与未污染土壤对比,发现HMs和PAHs的存在严重抑制了土壤微生物的生长,微生物的种类和数量都明显低于控制组,其中生物量只有控制组的20%左右。不同种类和浓度的HMs和PAHs对微生物的抑制效果也不尽相同。
2.1.2 对植物的毒性 土壤中的HMs和PAHs能随着地下水沿植物根系进入植物体内,分布并富集于植物各组织细胞中。HMs和PAHs复合污染对植物的毒性,因植物种类及生长阶段的不同差别较大。Li等[42]研究了Cd和荧蒽单一及复合作用对大豆发芽率和根茎叶长度、干重的影响,发现在单一和复合的情况下,大豆的发芽率和各组织的生长都受到不同程度的抑制;对实验结果进行独立模型分析发现,当荧蒽浓度较低(1 mg·L−1)时,荧蒽与Cd之间为拮抗作用,而当荧蒽浓度和Cd浓度都较高时,二者之间为协同作用。
2.1.3 对土壤酶的抑制 土壤中各种生物地球化学反应的进行和土壤功能的发挥都离不开土壤酶的作用,而HMs和PAHs复合污染将影响这些土壤酶的活性。Thavamani等[41]在研究HMs和PAHs复合污染对土壤微生物的毒性的同时,还检测了土壤中脱氢酶和脲酶的活性,发现HMs和PAHs复合污染对两种土壤酶都有一定的抑制作用,而且脲酶对其的敏感性明显高于脱氢酶。Santos等[43]的研究表明在含有PAHs的原油污染下,土壤脱氢酶的活性甚至高于无污染的对照组,但当有重金属存在时,其活性则受到明显抑制。而Gong等[44]发现菲、芘和Cd、Zn组合时,对脲酶、磷酸酶、过氧化氢酶的活性均有抑制作用。
2.2 对人类健康的危害
2.2.1 HMs和PAHs的摄入 环境中的HMs和PAHs能够被微生物和植物吸收,从而进入食物链,在食物链中迁移并不断富集,最终,大量的污染物将进入人类身体。Khillare等[45]研究了蔬菜对某火力发电厂周边土壤中HMs和PAHs的富集,及其对人类的危害。在研究的各种蔬菜中,HMs含量均超过其安全上限,其中菠菜和萝卜对二者的富集能力较强,居民在食用该蔬菜后癌症发病率升高。除了食物链的富集外,分布于地下水及地表水体中的HMs和PAHs很可能通过人类直接饮用进入人体。
2.2.2 对人类的毒性 PAHs是脂溶性的有机物,能够通过细胞膜,HMs因其与细胞必需金属元素的相似性,也能够经由细胞离子通道进入胞内影响细胞的正常生理活性[45]。许多研究表明PAHs能诱发肿瘤,能通过影响人体的其他生化反应而引发心脑血管疾病,或抑制单核细胞转化为巨噬细胞,破坏人体免疫系统[2, 46]。HMs能够占据人体必需元素的结合位点,影响相关酶的功能。HMs和PAHs都能够促进环境中活性氧的形成,氧化DNA和蛋白质[47-48]。
在复合条件下,HMs和PAHs之间存在各种相互作用,其对人类健康的毒性可能较单一污染的毒性低,也可能高于各单一污染的毒性之和。Wang等[49]检测了1333名焦炉工尿液中的HMs和PAHs、代谢物8-OHdG(DNA损害标志物)和8-iso-PGF2α(高氧性肺损伤指标)的含量,结果显示PAHs对人体细胞的DNA和肺等器官具有较大的损害,而且HMs的存在多数情况下有增强这类氧化性损害的效果。
3 复合污染的共迁移和转化归趋
3.1 吸附和解吸
土壤颗粒比表面积较大,而且土壤中大量的腐殖质包含各种官能团,能够吸附HMs和PAHs,再加上HMs和PAHs在水中的溶解度有限,当含有HMs和PAHs的废水或是灌溉水流经土壤空隙时,大部分的HMs和PAHs将吸附于土壤颗粒表面。土壤对PAHs的吸着存在两种形式:一种是PAHs在固相和液相中的分配过程,即PAHs通过溶解作用进入土壤的有机质中;另一种是土壤颗粒对有机物的吸附,主要靠氢键、范德华力、配位键等结合[50]。流经土壤空隙的HMs离子,受其他阴离子的影响,会转化为沉淀,或与土壤颗粒表面的官能团等发生络合或螯合作用吸附于土壤表面。
吸附于土壤中的HMs和PAHs并不会永远固定在土壤中,PAHs在固-液相间的分配和HMs的沉淀、吸附都是动态平衡的过程,在一定条件下,吸附在土壤表面的污染物能够从土壤表面解吸,再次进入液相,随之迁移。
3.2 淋滤和迁移作用
在降水过程中,大气中的HMs和PAHs随水相沉降到地表,到达地表后,部分降水以地面径流的形式不断汇集,最后汇入地表水体。在这一汇流过程中,地表及地表固体废弃物中的HMs和PAHs将随之运移,汇入地表水体。因此,雨洪水的汇水区也经常能检测出HMs和PAHs[51]。降水中的大部分会向地下入渗,流经含HMs和PAHs的土壤或固体废物,使部分HMs和PAHs从土壤表面解吸进入水中,随着水流向下运移。在入渗水的作用下,二者的迁移能力明显加强,原本停留在地表或包气带土壤中的HMs和PAHs将向下迁移,污染晕向下扩散,最终到达地下含水层,进入地下水系统,污染区域地下水。地下水作为重要的饮用水水源,一旦被污染将难以更新、修复,对人类的生命安全产生威胁[52]。
3.3 生物降解和转化
3.3.1 PAHs的降解 微生物对PAHs的降解有两种形式:一种是生长代谢,即微生物把PAHs当作唯一碳源,在降解过程中提供自身生长所需能量;另一种是共代谢,PAHs不作为唯一碳源和能源,微生物依靠其他物质获取能源来降解PAHs。许多研究表明微生物对四环以下低分子量PAHs的降解,多为生长代谢形式,而对四环及以上高分子量的PAHs主要是以共代谢的形式[53]。在微生物的作用下,PAHs能够被降解为分子量较小的代谢产物,并通过矿化作用最终转化为无机的H2O、CO2(有氧)或CH4(无氧),这一过程中,微生物合成的加氧酶、脱氢酶、木素降解酶等各种生物酶是必不可少的催化剂[54]。
根据PAHs种类和分子量大小的不同,其降解途径也存在一定差异。但一般都是先将苯环氧化成顺式二氢二醇的结构,再氧化为儿茶酚类芳香族二羟基化合物,再逐步裂解。有研究发现在无氧条件下,低分子量PAHs也能通过微生物发酵或呼吸作用而降解[55-56]。
3.3.2 HMs的转化 由于微生物比表面积较大,而且细胞膜表面及其胞外聚合物含有各种官能团,能够吸附土壤或地下水中的HMs,部分HMs还能通过细胞膜上的离子通道进入微生物细胞内,在胞内累积[48, 57]。而且微生物产生的各种生物酶中,大部分是氧化还原相关的催化酶,在这些酶的作用下,HMs离子将发生氧化还原反应。被氧化或还原的HMs离子物化性质也随之改变,部分HMs能够向无毒或低毒的形态转化,或转化为难溶的金属化合物,固定于土壤中[58]。HMs与PAHs复合污染的主要来源及在环境中的迁移转化归趋如图1所示。
4 复合污染物之间的相互作用
共存于环境中的HMs和PAHs之间,以及二者与环境中的其他物质之间常发生复杂的相互作用,主要有阳离子-π相互作用、吸附位点的竞争、氧化还原作用等(表3)。对于复合污染之间相互作用机理和条件的掌握,有利于复合污染修复的研究,合理地利用这些作用能够在减轻其不利影响的同时提高污染修复效率。

表3 HMs和PAHs相互作用研究成果
4.1 阳离子-π相互作用
苯环是由6个碳原子以1个大π键结合在一起形成的,这个π键能使苯环偶极化,在π键周围形成一个负电势区,这样一个区域对周围的阳离子有一定的吸引力,吸引力的大小随着离子半径的增大而减小[65]。因此在复合污染中,PAHs中的苯环能够与HMs离子产生阳离子-π相互作用。Yorita等[66]的研究证实了Cu离子与色氨酸中的苯环之间阳离子-π相互作用的存在。Tao等[67]研究了Cu、Cd离子对蓝藻吸附菲的影响,发现在低浓度(<0.04 mmol·L−1)HMs存在时,蓝藻对菲的吸附受到明显抑制,单位质量的蓝藻对菲的吸附量均降至25%左右。但随着Cu浓度的继续升高,吸附量又开始逐渐上升,结合傅里叶红外光谱数据分析发现与蓝藻菌细胞表面羧基、羟基等络合的Cu离子能通过阳离子-π相互作用吸引菲,使其间接附着于蓝藻表面。此后,Tao等[63]还发现Cu、Ag离子的存在能使菲的辛醇-水分配系数分别下降至59.0%、20.8%,增强PAHs在水中的溶解,增加溶液中的游离PAHs,从而增加其与微囊藻的有效碰撞而提高吸附量。
4.2 吸附位点竞争
环境中的HMs和PAHs大部分都是以吸附态的形式存在于大气或水中的悬浮颗粒、土壤颗粒及微生物等的表面,吸附是HMs和PAHs复合污染修复的一个重要过程[68]。由于HMs和PAHs在各种吸附介质上存在相同或不同的优势吸附位点,例如磷酸基、羧基和羟基等,当两种污染物在吸附质上存在相同吸附位点时,二者之间将对共同的吸附位点发生竞争,吸附的优先顺序与污染物与吸附位点之间的作用力有关[69]。
在污染修复过程中,吸附剂对污染物的吸附量直接影响着修复效果,在复合污染条件下,由于存在吸附位点的竞争,吸附剂对某单一污染物的吸附量将减少,复合污染的修复效率降低。Chen等[61]在研究Cu对嗜麦芽窄食单胞菌降解苯并[]芘的影响时,认为低浓度Cu存在时,微生物会先吸附Cu,使得PAHs的吸附位点被占据,PAHs的去除率降低。
4.3 氧化还原作用
PAHs的降解过程是一个在生物酶或光等的催化下的氧化还原过程[55],而环境中的HMs多以阳离子形态存在,部分HMs还存在多个价态的改变,这些HMs可作为氧化还原过程中的氧化剂,接受电子。HMs氧化剂的存在能够促进PAHs的氧化还原,促进其降解,同时HMs在得电子价态改变的同时其自身性质也得以改变,部分HMs能够向低毒或无毒的价态转化,起到HMs污染修复的效果[1]。而且HMs和PAHs互相诱导形成的活性氧,也能够促进PAHs的氧化降解[2,58]。Shen等[70]对6价、3价Cr之间的转化和苯酚等苯酸盐降解之间的相关关系进行了研究,发现Cr的转化与苯酚降解密切相关,而且通过测定,二者的实测化学计量数与它们之间进行氧化还原作用时的理论值一致。
4.4 微生物降解作用
HMs除了作为氧化剂参与PAHs的降解外,还能通过其他作用影响PAHs的降解。如抑制PAHs降解所需生物酶的活性,从而抑制PAHs的降解[41]。HMs和PAHs对生物膜都有一定的破坏作用,能够改变细胞膜的通透性,使得HMs更容易进入细胞内部,毒害微生物,因为微生物量的减少,PAHs的降解也将受到抑制。Gauthier等[2]就HMs和PAHs破坏生物膜,促进HMs和PAHs进入生物细胞和影响生物内部新陈代谢的相关作用机理进行了综述,指出PAHs能够通过诱导产生活性氧等途径破坏细胞膜结构,增加膜的流动性,或改变与HMs跨膜运动相关的蛋白酶(例如Na+/K+-ATPase)的活性从而影响细胞对HMs的吸收。Chen等[61]的研究还发现,在Cu和苯并[]芘共同存在时,Cu诱导生成的降解酶具有加氧酶类似特性,能够通过另一条路径降解苯并[]芘,产生新的降解产物苯甲酸和酮等。
5 复合污染的修复
目前对于HMs或PAHs单一污染的修复手段有很多,如HMs的热脱附[71]、电动修复[72]和PAHs的微生物降解等[73]。但HMs和PAHs复合污染的修复比单一污染修复更为复杂,因为HMs和PAHs之间存在复杂的相互作用,而且二者物理化学性质相差较大,所以对复合污染修复手段的要求也更高。现有的关于HMs和PAHs复合污染修复的研究还较少[74],已研究的方法中主要包括物理化学修复和生物修复两大类。换土法和淋洗法是主要的物理化学修复手段,生物修复有植物修复、微生物修复。此外,将以上修复方法进行组合使用发展了另一种联合修复法。
5.1 淋洗修复
用于HMs和PAHs复合污染的物理化学修复法主要有换土法和淋洗修复法。换土法虽然修复快,但并未从根本上把污染物从土壤中去除。淋洗修复是目前复合污染土壤修复中较为有效的方法[75]。淋洗修复是利用淋洗剂流经被污染土壤或与其混合,淋洗剂能够增强土壤中HMs和PAHs的溶解性,使污染物大量溶于淋洗剂中,并随淋洗剂流出,最后再对淋洗剂集中处理,使污染土壤得以修复。淋洗修复又可分为原位淋洗技术和异位淋洗技术两种。淋洗修复HMs和PAHs的污染,主要是利用淋洗液通过溶解、离子交换、脱附、螯合等作用将吸附于土壤颗粒表面的HMs分离出来,PAHs的淋洗则主要通过淋洗剂的包覆携带或是增溶作用将其从土壤中洗脱[76-77]。
酸、表面活性剂和合成螯合物是常用的淋洗剂,酸包括硫酸、盐酸、碳酸等,螯合剂有人工合成的乙二胺四乙酸(EDTA)、苯基乙酸钠(EDDHA-Na)等,常用的表面活性剂有十二烷基硫酸钠(SDS)、辛基苯基聚氧乙烯醚(TX-100)、鼠李糖脂等[77]。目前对HMs和PAHs复合污染具有同时修复效果的淋洗剂有环糊精的衍生物、鼠李糖脂、皂角苷等表面活性剂[74,76]。环糊精因其外缘亲水而内腔疏水的特殊环状结构,能同时洗脱土壤中的菲和Cd。Yang等[74]研究了谷氨酸--环糊精(GluCD)和乙二胺--环糊精(EDCD)对Cd和蒽的同时去除。宋赛赛[78]利用皂角苷对HMs和PAHs复合污染进行淋洗修复,发现不同浓度的皂角苷对土壤中HMs和PAHs的去除率不同,浓度为1200 mg·L−1时,对土壤中的芘、菲、Cu、Cd、Zn均有较好的洗脱效果。
以前许多针对单一污染的淋洗剂,对单一的HMs或PAHs有较好的去除效果,但用于二者的复合污染却效果不佳,近年来,越来越多的学者将目光放在不同淋洗剂之间的组合淋洗修复上[77]。在不同淋洗剂组合使用的过程中,淋洗剂的淋洗顺序和不同的组合浓度对淋洗效果有较大影响[79-80]。张杰西[81]研究了聚氧乙烯脱水山梨醇单油酸酯(TW80)和EDTA-2Na修复芘-Cd复合污染土壤时,不同淋洗顺序对芘、Cd的淋洗效果,发现两种淋洗剂混合同时加入时的洗脱效果比单独先后加入效果好。Khodadoust等[79]发现先用5% TW80再用浓度为1 mol·L−1的柠檬酸或先加5%的TW80再加浓度为0.2 mol·L−1的EDTA的组合淋洗对菲、Pb、Zn均有较好的洗脱效果。
淋洗法对于有机和无机污染的修复均有很高的修复效率,但也存在它的局限性。首先,部分淋洗剂本身也是一种污染物质,大量使用将引起二次污染问题;其次,对于土壤颗粒较细,渗透系数低的土壤,淋洗液无法顺利流经污染土壤,二者不能充分混合,因此无法将污染物从污染土壤中洗脱出来[82]。对于生物表面活性剂,其在淋洗修复过程中与污染物之间的迁移转化规律还需要进一步的研究[77]。
5.2 生物修复
生物修复作为HMs和PAHs单一污染的重要修复手段,在二者复合污染的修复中也同样因其成本低、无二次污染等优势被人们所重视。复合污染的生物修复中所用生物材料的来源,主要有从复合污染场地直接筛选得到的生物[83],或从那些已经研究的能够对单一污染起到修复作用的生物材料中挑选既能够修复HMs污染又能修复PAHs污染的材料,研究其对HMs和PAHs复合污染的修复效果[3]。
5.2.1 微生物修复 环境中的微生物数量和种类都十分庞大,在环境中分布广泛,甚至在高温,低温、高盐度、无氧等极端条件下均有微生物生存[84]。在这些种类丰富的微生物中,部分微生物能够在降解PAHs的同时吸收或吸附一定量的HMs,同时去除复合污染中的HMs和PAHs,而且微生物修复具有材料来源广、成本低等优点,在复合污染的修复领域越来越被重视[85]。
微生物对HMs和PAHs复合污染的修复主要分为对PAHs的吸附降解和对HMs的累积和转化。微生物在自身生长代谢过程中可以把PAHs作为碳源,将其降解的同时为自身提供能量。环境中的HMs无法像有机物一样被降解,只能通过改变其存在形态和迁移能力,将其转化为无害或低毒的物质从而达到改善环境的目的。微生物能够将环境中的HMs固定在微生物细胞膜表面,或富集于细胞内,降低HMs的迁移转化能力,达到污染修复的目的[57]。能够修复HMs和PAHs复合污染的微生物包括细菌、真菌和藻类。陈烁娜等[86]通过实验室筛选,获得了一株对Cu-苯并[]芘复合污染具有较强的吸附和降解作用的嗜麦芽窄食单胞菌,并研究发现该菌在对Cu-苯并[]芘复合污染的处理时,受污染物影响,细胞形态及细胞膜通透性改变甚至破裂;Jiang等[87]利用白黄侧耳修复Cd和菲复合污染的土壤,该菌对于复合污染适应性较强,对二者均有较高的去除率,而且菲的加入能够缓解Cd的毒性,促进该菌对Cd的富集,而Cd则对菲的去除起抑制作用。
微生物修复虽然存在各种优点,但目前还主要集中于室内研究,而实际场地与实验室条件存在较大的差距,应用微生物进行实际场地修复的实例还较少,在实际场地的应用过程中,微生物的固定化、再生利用等都还需要进一步研究[9]。
5.2.2 植物修复 植物修复的主要作用机制有根际修复、植物提取和根系过滤。根际修复主要是借助于植物根系的分泌物刺激微生物生长,使得植物根系周围的微生物丰度大于其他区域,这些丰富的微生物群落能促进PAHs的降解[7,88],此外,部分分泌物还能直接作为PAHs降解的催化剂[89];植物提取和根系过滤即利用植物根系吸附土壤和地下水中的污染物,再从根系随水进入植物体内并在植物体内运移和富集。已有研究表明玉米[29]、东南景天[90]、紫花苜蓿[8]等对HMs和PAHs复合污染均具有一定的修复效果。Feng等[91]研究的蜈蚣草对As(1 mmol·L−1)和菲(75 mg·L−1)的复合污染土壤具有一定的修复作用,培养12 d后植株地下部分的污染物累积量分别达170和220 mg·kg−1(干基)。
除单一植物的修复手段外,多种植物间作能够增加可修复污染物的种类,提高修复效率[29,92]。Wang等[92]发现与东南景天单独种植相比,其与黑麦草或蓖麻间作能够降低根系中HMs的累积量,并提高土壤中蒽和芘的去除率。
植物修复是一种生态友好型的修复手段,不仅具有材料来源广、成本低的优点,同时还能美化环境、保持水土,高大植物还能起到防风固沙的作用。然而植物修复也存在一定的缺陷,它所针对的污染场地主要是低浓度污染,因为高浓度的污染物会抑制植物的生长;而且植物修复的周期一般较长[93]。
5.3 联合修复
物理化学修复、微生物修复和植物修复各有各的特点,将不同的修复手段组合用于复合污染的修复往往能够取长补短,提高复合污染的修复效率。常见的组合形式有淋洗剂强化植物修复,投加微生物强化植物修复[8,94],物理化学修复与生物修复之间的组合修复方法等[7]。
淋洗剂能够将吸附于土壤颗粒上的HMs和PAHs解吸,增加污染物的水溶态从而提高污染物的生物可利用性,有利于植物修复过程,部分淋洗剂还能够起到促进PAHs降解的作用。Yang等[95]在利用龙葵对Cd和PAHs复合污染进行修复的过程中,利用EDTA、半胱氨酸和水杨酸的组合处理能够增强其修复效果。在植物修复过程中,植物根际微生物发挥了很大作用,在修复过程中人为添加某些对HMs或PAHs毒性具有抗性,或对其有吸附、降解作用的微生物能够增强植物根际的微生物作用,提高修复效率[8,96]。Chen等[3]在利用东南景天与黑麦草间作的同时,加入假单胞菌KL5和热带念珠菌C10能够促进植物的生长,而且细菌产生的有机酸等增加了植物对HMs的吸收,由于细菌的辅助降解,土壤PAHs的去除率也显著提高。
但在联合修复过程中,不仅要考虑复合污染物之间的相互作用,还要考虑不同修复手段,修复材料的联合过程中是否会产生相互抑制的作用。
6 展 望
(1)目前,对HMs和PAHs单一污染的研究较多,但二者复合污染的研究较少,特别是对二者复合污染的修复研究。需要加强对复合污染的研究,寻找能够同时修复复合污染中HMs和PAHs的植物或微生物,优化联合修复,使其能够更高效去除环境中的HMs和PAHs。
(2)对于HMs和PAHs复合污染的修复研究,室外实际场地应用的研究较少,主要集中于室内的实验研究,但室内实验条件与室外实际场地条件之间差别较大,各修复方法在实际场地应用过程中还存在许多问题需要解决,例如微生物修复中,微生物的固定方法和材料等。
(3)深入研究HMs和PAHs复合污染联合效应的作用机理,进而利用它们之间的相互作用趋利避害,提高复合污染的修复效率,或降低其毒性。例如对相应的修复材料进行活化改造,或考虑通过不同种类的污染体系间的混合来提高修复效率。
(4)对于生物修复,从分子生物学的角度深入研究HMs和PAHs的修复机理,研究在复合污染条件下相关基因的表达量变化。从基因水平上寻找相关污染物的抗性生物和可用于污染修复的生物。
References
[1] 沈国清, 陆贻通, 周培. 土壤环境中重金属和多环芳烃复合污染研究进展[J]. 上海交通大学学报(农业科学版), 2005, 23(1): 102-106. SHEN G Q, LU Y T, ZHOU P. Advances of research on combined pollution of heavy metals with polycyclic aromatic hydrocarbons (PAHs) in soil environment[J]. J. Shanghai Jiaotong University(Agricultural Science), 2005, 23(1): 102-106.
[2] GAUTHIER P T, NORWOOD W P, PREPAS E E,. Metal-PAH mixtures in the aquatic environment: a review of co-toxic mechanisms leading to more-than-additive outcomes[J]. Aquatic Toxicology, 2014, 154(5): 253-269.
[3] CHEN F, TAN M, MA J,. Efficient remediation of PAH-metal co-contaminated soil using microbial-plant combination: a greenhouse study[J]. Journal of Hazardous Materials, 2015, 302: 250-261.
[4] SONG Y F, WILKE B M, SONG X Y,. Polycyclic aromatic hydrocarbons (PAHs), polychlorinated biphenyls (PCBs) and heavy metals (HMs) as well as their genotoxicity in soil after long-term wastewater irrigation[J]. Chemosphere, 2006, 65(10): 1859-1868.
[5] LIU S H, ZENG G M, NIUQ Y,. Bioremediation mechanisms of combined pollution of PAHs and heavy metals by bacteria and fungi: a mini review[J]. Bioresource Technology, 2016, 224 (2017): 25-33.
[6] LU M, ZHANG Z Z, WANG J X,. Interaction of heavy metals and pyrene on their fates in soil and tall fescue ()[J]. Environ. Sci. Technol., 2014, 48(2): 1158-1165.
[7] MMAMI M T, PORTET-KOLTALO F, BENAMAR A,. Application of biosurfactants and periodic voltage gradient for enhanced electrokinetic remediation of metals and PAHs in dredged marine sediments[J]. Chemosphere, 2015, 125: 1-8.
[8] GNELLO A C, BAGARD M, HULLEBUSCH E D V,. Comparative bioremediation of heavy metals and petroleum hydrocarbons co-contaminated soil by natural attenuation, phytoremediation, bioaugmentation and bioaugmentation-assisted phytoremediation[J]. Science of the Total Environment, 2016, 563/564: 693-703.
[9] IJAYARAGHAVAN K, BALASUBRAMANIAN R. Is biosorption suitable for decontamination of metal-bearing wastewaters? A critical review on the state-of-the-art of biosorption processes and future directions[J]. Journal of Environmental Management, 2015, 160: 283-296.
[10] ANG Y, LI T Q, WU C X,. An integrated approach to assess heavy metal source apportionment in peri-urban agricultural soils[J]. Journal of Hazardous Materials, 2015, 299: 540-549.
[11] CHOWDHURY S, MAZUMDER M A, AL-ATTAE O,. Heavy metals in drinking water: occurrences, implications, and future needs in developing countries[J]. Science of the Total Environment, 2016, 569/570: 476-488.
[12] DEMIRAK A, YILMAZ F, TUNA A L,. Heavy metals in water, sediment and tissues offrom a stream in southwestern Turkey[J]. Chemosphere, 2006, 63(9): 1451-1458.
[13] CHEN T, CHANG Q R, LIU J,. Identification of soil heavy metal sources and improvement in spatial mapping based on soil spectral information: a case study in northwest China[J]. Science of the Total Environment, 2016, 565: 155-164.
[14] TURNER A. Heavy metals, metalloids and other hazardous elements in marine plastic litter[J]. Mar. Pollut. Bull., 2016, 111(1/2): 136-142.
[15] MANOLI E, SAMARA C. Polycyclic aromatic hydrocarbons in natural waters: sources, occurrence and analysis[J]. TrAC Trends in Analytical Chemistry, 1999, 18(6): 417-428.
[16] ABDEL-SHAFY H I, MANSOUR M S M. A review on polycyclic aromatic hydrocarbons: source, environmental impact, effect on human health and remediation[J]. Egyptian Journal of Petroleum, 2016, 25(1): 107-123.
[17] BANDEIRA G C, MENESES H E. Handbook of Polycyclic Aromatic Hydrocarbons: Chemistry, Occurrence and Health Issues[M]. New York: Nova Science Publishers, 2013.
[18] MUSA BANDOWE B A, SRINIVASAN P, SEELGE M,. A 2600-year record of past polycyclic aromatic hydrocarbons (PAHs) deposition at Holzmaar (Eifel, Germany)[J]. Palaeogeography Palaeoclimatology Palaeoecology, 2014, 401(5): 111-121.
[19] PENG N N, LI Y, LIU Z G,. Emission, distribution and toxicity of polycyclic aromatic hydrocarbons (PAHs) during municipal solid waste (MSW) and coal co-combustion[J]. Science of the Total Environment, 2016, 565: 1201-1207.
[20] ZHANG Y J, LIN Y, CAI J,. Atmospheric PAHs in North China: spatial distribution and sources[J]. Science of the Total Environment, 2016, 565: 994-1000.
[21] BROWN J N, PEAKE B M. Sources of heavy metals and polycyclic aromatic hydrocarbons in urban stormwater runoff[J]. Science of the Total Environment, 2006, 359(1/2/3): 145-155.
[22] 2015年中国海洋环境状况公报[R]. 北京: 中国海洋局, 2016. Bulletin of China’s marine environmental status of China for the year of 2015[R]. Beijing: State Oceanic Administration, People’s Republic of China, 2016.
[23] DONAHUE W F, ALLEN E W, SCHINDLER D W. Impacts of coal-fired power plants on trace metals and polycyclic aromatic hydrocarbons (PAHs) in lake sediments in Central Alberta, Canada[J]. Journal of Paleolimnology, 2006, 35(1): 111-128.
[24] WU Q H, LEUNG J Y S, GENG X H,. Heavy metal contamination of soil and water in the vicinity of an abandoned E-waste recycling site: implications for dissemination of heavy metals[J]. Science of the Total Environment, 2015, 506/507: 217-225.
[25] WONG M H, WU S C, DENG W J,. Export of toxic chemicals – a review of the case of uncontrolled electronic-waste recycling[J]. Environmental Pollution, 2007, 149(2): 131-140.
[26] SPROVIERI M, FEO M L, PREVEDELLO L,. Heavy metals, polycyclic aromatic hydrocarbons and polychlorinated biphenyls in surface sediments of the Naples harbour (southern Italy)[J]. Chemosphere, 2007, 67(5): 998-1009.
[27] 邓军. 氧化节杆菌对水体中苯并[]芘-镉复合污染的生物修复及机理研究[D]. 广州: 暨南大学, 2010. DENG J. Study of bioremediation and mechanism of the combined pollution of B[]P-Cd in water body by arthrobacter oxydans[D]. Guangzhou: Ji’nan University, 2010.
[28] 朱岗辉, 孙璐, 廖晓勇, 等. 郴州工业场地重金属和PAHs复合污染特征及风险评价[J]. 地理研究, 2012, 31(5): 831-839. ZHU G H, SUN L, LIAO X Y,. Characteristics and risk assessment PAHs and heavy metals co-contamination in industrial field in Chenzhou, China[J]. Geographical Research, 2012, 31(5): 831-839.
[29] 赵颖, 刘利军, 党晋华, 等. 不同植物与玉米间作对玉米吸收多环芳烃和重金属的影响[J]. 环境工程, 2014, 32(7): 138-141. ZHAO Y, LIU L J, DANG J H,. Effects of intercropping different crops with maize on its uptake of the PAHs and heavy metal[J]. Environmental Engineering, 2014, 32(7): 138-141.
[30] SCHEIBYE K, WEISSER J, BORGGAARD O K,. Sediment baseline study of levels and sources of polycyclic aromatic hydrocarbons and heavy metals in Lake Nicaragua[J]. Chemosphere, 2013, 95(1): 556-565.
[31] 袁文淼. 陕北能源化工基地土壤中重金属与多环芳烃污染现状及其污染风险分析[D]. 西安: 西安建筑科技大学, 2015. YUAN W M. Study on pollution status and risk of heavy metals and PAHs in soil of Northern Shaanxi Energy Chemical Industry Base[D]. Xi’an: Xi’an University of Architecture and Technology, 2015.
[32] STAJIC J M, MILENKOVIC B, PUCAREVIC M,. Exposure of school children to polycyclic aromatic hydrocarbons, heavy metals and radionuclides in the urban soil of Kragujevac city, Central Serbia[J]. Chemosphere, 2015, 146: 68-74.
[33] SARMA H, ISLAM N F, BORGOHAIN P,. Localization of polycyclic aromatic hydrocarbons and heavy metals in surface soil of Asia’s oldest oil and gas drilling site in Assam, north-east India: implications for the bio-economy[J]. Emerging Contaminants, 2016, 2(3): 119-127.
[34] BLISS C I. The toxicity of poisons applied jointly[J]. Ann. Appl. Biol., 1939, 26: 585-615.
[35] DEARY M E, EKUMANKAMA C C, CUMMINGS S. Development of a novel kinetic model for the analysis of PAH biodegradation in the presence of lead and cadmium co-contaminants[J]. Journal of Hazardous Materials, 2016, 307: 240-252.
[36] 中国耕地地球化学调查报告(2015年)[R]. 北京: 中国地质调查局, 2015. Geochemical survey of China’s arable land (2015)[R]. Beijing: China Geological Survey, 2015.
[37] SHEN H Z, HUANG Y, WANG R,. Global atmospheric emissions of polycyclic aromatic hydrocarbons from 1960 to 2008 and future predictions[J]. Environ. Sci. Technol., 2013, 47(12): 6415-6424.
[38] QIAN X, LIANG B C, FU W J,. Polycyclic aromatic hydrocarbons (PAHs) in surface sediments from the intertidal zone of Bohai Bay, Northeast China: spatial distribution, composition, sources and ecological risk assessment[J]. Mar. Pollut. Bull., 2016, 112(1/2): 349-358.
[39] YU H, YU J Z. Polycyclic aromatic hydrocarbons in urban atmosphere of Guangzhou, China: size distribution characteristics and size-resolved gas-particle partitioning[J]. Atmospheric Environment, 2012, 54(5): 194-200.
[40] LU M, XU K, CHEN J. Effect of pyrene and cadmium on microbial activity and community structure in soil[J]. Chemosphere, 2013, 91(4): 491-7.
[41] THAVAMANI P, MALIK S, BEER M,. Microbial activity and diversity in long-term mixed contaminated soils with respect to polyaromatic hydrocarbons and heavy metals.[J]. Journal of Environmental Management, 2012, 99(5): 10.
[42] LI Q S, LU Y L, SHI Y J,. Combined effects of cadmium and fluoranthene on germination, growth and photosynthesis of soybean seedlings[J]. Journal of Environmental Sciences, 2013, 25(9): 1936-1946.
[43] SANTOS E D C D, SILVA I S, SIMOES T H N,. Correlation of soil microbial community responses to contamination with crude oil with and without chromium and copper[J]. International Biodeterioration & Biodegradation, 2012, 70(5): 104-110.
[44] GONG X, CHEN X. Effect of PAHs and heavy metals-combined pollution on soil enzyme activity[C]// Conference on Environmental Pollution and Public Health. Wuhan, China, 2011.
[45] KHILLARE P S, JYETHI D S, SARKAR S. Health risk assessment of polycyclic aromatic hydrocarbons and heavy metalsdietary intake of vegetables grown in the vicinity of thermal power plants[J]. Food and Chemical Toxicology, 2012, 50(5): 1642-1652.
[46] GUO Y, WU K, HUO X,. Sources, distribution, and toxicity of polycyclic aromatic hydrocarbons[J]. Journal of Environmental Health, 2011, 73(9): 22.
[47] TOYOOKA T, IBUKI Y. DNA damage induced by coexposure to PAHs and light[J]. Environ. Toxicol. Pharmacol., 2007, 23(2): 256-63.
[48] VANGRONSVELD J, CLIJSTERS H. Toxic effects of metals[M]// Farago M E. Plants and the Chemical Elements: Biochemistry, Uptake, Tolerance and Toxicity. Hoboken: Wiley, 2008: 149-177.
[49] WANG T, FENG W, KUANG D,. The effects of heavy metals and their interactions with polycyclic aromatic hydrocarbons on the oxidative stress among coke-oven workers[J]. Environmental Research, 2015, 140: 405-413.
[50] 孙大志. 地下环境中多环芳烃(菲)水文地球化学行为及归趋模拟研究[D]. 长春: 吉林大学, 2008. SUN D Z. Study on the hydrogeochemistry behavior and transforming simulation of polycyclic aromatic hydrocarbons (PAHs) in subsurface environment[D]. Changchun: Jilin University, 2008.
[51] BROWN J N, PEAKE B M. Sources of heavy metals and polycyclic aromatic hydrocarbons in urban stormwater runoff[J]. Science of the Total Environment, 2006, 359(1/2/3): 145-155.
[52] LIGARAY M, BAEK S S, KWON H O,. Watershed-scale modeling on the fate and transport of polycyclic aromatic hydrocarbons (PAHs)[J]. Journal of Hazardous Materials, 2016, 320: 442-457.
[53] 李政, 顾贵洲, 赵朝成, 等. 高相对分子质量多环芳烃的生物共代谢降解[J]. 石油学报(石油加工), 2015, 31(3): 720-725. LI Z, GU G Z, ZHAO C C,. Co-metabolism biodegradation of polycyclic aromatic hydrocarbons with high relative molecular mass[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2015, 31(3): 720-725.
[54] HARITASH A K, KAUSHIK C. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15.
[55] LEJA K, LEWANDOWICZ G. Polymer biodegradation and biodegradable polymers—a review[J]. Polish Journal of Environmental Studies, 2010, 19(2): 255-266.
[56] ARUN A, EYINI M. Comparative studies on lignin and polycyclic aromatic hydrocarbons degradation by basidiomycetes fungi[J]. Bioresource Technology, 2011, 102(17): 8063-8070.
[57] POKROVSKY O S, MARTINEZ R E, KOMPANTSEVA E I,. Interaction of metals and protons with anoxygenic phototrophic bacteria[J]. Chemical Geology, 2013, 335(1): 75-86.
[58] VANBROEKHOVEN K, VAN ROY S, GIELEN C,. Microbial processes as key drivers for metal (im)mobilization along a redox gradient in the saturated zone[J]. Environmental Pollution, 2007, 148(3): 759-769.
[59] SHEN G Q, LU Y T, ZHOU Q X,. Interaction of polycyclic aromatic hydrocarbons and heavy metals on soil enzyme[J]. Chemosphere, 2005, 61(8): 1175-1182.
[60] KE L, LUO L J, WANG P,. Effects of metals on biosorption and biodegradation of mixed polycyclic aromatic hydrocarbons by a freshwater green alga[J]. Bioresour. Technol., 2010, 101(18): 6950-6961.
[61] CHEN S N, YIN H, YE J S,. Effect of copper(Ⅱ) on biodegradation of benzo[]pyrene by[J]. Chemosphere, 2013, 90(6): 1811-1820.
[62] CHIGBO C, BATTY L, BARTLETT R. Interactions of copper and pyrene on phytoremediation potential ofin copper-pyrene co-contaminated soil[J]. Chemosphere, 2013, 90(10): 2542-2548.
[63] TAO Y Q, XUE B, YANG Z,. Effects of metals on the uptake of polycyclic aromatic hydrocarbons by the cyanobacterium[J]. Chemosphere, 2015, 119: 719-726.
[64] BISWAS B, SARKAR B, MANDAL A,. Specific adsorption of cadmium on surface-engineered biocompatible organoclay under metal-phenanthrene mixed-contamination[J]. Water Research, 2016, 104: 119-127.
[65] DOUGHERTY D A. The cation-pi interaction[J]. Acc. Chem. Res., 2013, 46(4): 885-893.
[66] YORITA H, OTOMO K, HIRAMATSU H,. Evidence for the cation-pi interaction between Cu2+and tryptophan[J]. Journal of the American Chemical Society, 2008, 130(46): 15266-15267.
[67] TAO Y Q, LI W, XUE B,. Different effects of copper (Ⅱ), cadmium (Ⅱ) and phosphate on the sorption of phenanthrene on the biomass of cyanobacteria[J]. Journal of Hazardous Materials, 2013, 261(5/6): 21.
[68] ZHANG X K, WANG H L, HE L Z,. Using biochar for remediation of soils contaminated with heavy metals and organic pollutants[J]. Environ. Sci. Pollut. Res. Int., 2013, 20(12): 8472-8483.
[69] YE J S, YIN H, XIE D P,. Copper biosorption and ions release byin the presence of benzo[]pyrene[J]. Chemical Engineering Journal, 2013, 219(3): 1-9.
[70] SHEN H, PRITCHARD P H, SEWELL G W. Microbial reduction of Cr(Ⅵ) during anaerobic degradation of benzoate[J]. Environ. Sci. Technol., 1996, 30(5): 1667-1674.
[71] NAVARRO A, CAÑADAS I, MARTINEZ D,. Application of solar thermal desorption to remediation of mercury-contaminated soils[J]. Solar Energy, 2009, 83(8): 1405-1414.
[72] NEGRETE J L M, BARBOZA E L. Electrokinetic remediation of mercury- contaminated soil, from the mine El Alacran-San Jorge river basin, Cordoba- Colombia[J]. Revista Facultad De Ingenieria Universidad De Antioquia, 2013, 64(68): 136-146.
[73] USMAN M, HANNA K, HADERLEIN S. Fenton oxidation to remediate PAHs in contaminated soils: a critical review of major limitations and counter-strategies[J]. Science of the Total Environment, 2016, 569/570: 179-190.
[74] YANG C J, ZENG Q R, WANG Y Z,. Simultaneous elution of polycyclic aromatic hydrocarbons and heavy metals from contaminated soil by two amino acids derived from-cyclodextrins[J]. Journal of Environmental Sciences, 2010, 22(12): 1910-1915.
[75] 金一凡, 周连杰, 杰克, 等. 污染土壤修复技术的探讨[J]. 环境科技, 2012, 25(5): 68-72. JIN Y F, ZHOU L J, BAMODU O,. An analysis of several remediation technologies of the contaminated soils[J]. Environmental Science and Technology, 2012, 25(5): 68-72.
[76] 彭立君, 杨涛, 刘云国, 等. 淋洗修复重金属和多环芳烃复合污染土壤的研究进展[J]. 化工环保, 2008, 28(5): 418-423. PENG L J, YANG T, LIU Y G,. Chemical leaching remediation of soil contaminated by heavy metals and PAHs[J]. Environmental Protection of Chemical Industry, 2008, 28(5): 418-423.
[77] MAO X H, JIANG R, XIAO W,. Use of surfactants for the remediation of contaminated soils: a review[J]. Journal of Hazardous Materials, 2014, 285: 419.
[78] 宋赛赛. 皂角苷对重金属-PAHs复合污染土壤的强化修复作用及机理[D]. 杭州: 浙江大学, 2014. SONG S S. The role and mechanism for saponin to remediate co-contaminated soils with heavy metals and PAHs[D]. Hangzhou: Zhejiang University, 2014.
[79] KHODADOUST A P, REDDY K R, MATURI K. Effect of different extraction agents on metal and organic contaminant removal from a field soil[J]. Journal of Hazardous Materials, 2005, 117(1): 15-24.
[80] 钟金魁, 赵保卫, 朱琨, 等. 化学强化洗脱修复铜、菲及其复合污染黄土[J]. 环境科学, 2011, 32(10): 3106-3112. ZHONG J K, ZHAO B W, ZHU K,. Remediation of Cu/phenanthrene and combined contaminated loess soil by chemical-enhanced washing[J]. Environmental Science, 2011, 32(10): 3106-3112.
[81] 张杰西. 表面活性剂-螯合剂对多环芳烃/重金属复合污染土壤的柱淋洗研究[D]. 兰州: 兰州交通大学, 2014. ZHANG J X. Column leaching of PAHs/heavy metal in soil by surfactant and chelating agent[D]. Lanzhou: Lanzhou Jiaotong University, 2014.
[82] 高彦波, 蔡飞, 谭德远, 等. 土壤重金属污染及修复研究简述[J]. 安徽农业科学, 2015, (16): 93-95. GAO Y B, CAI F, TAN D Y,. Discussion of soil heavy metal pollution and remediation[J]. Journal of Anhui Agri. Sci., 2015, (16): 93-95.
[83] 段燕青, 岳秀萍, 白凡玉, 等. 耐受重金属的芘降解真菌的筛选及芘降解动力学研究[J]. 环境工程学报, 2015, 9(2): 977-982. DUAN Y Q, YUE X P, BAI F Y,. Screening and degradation kinetics of heavy metal tolerance and pyrene-degrading fungi[J]. Chinese Journal of Environmental Engineering, 2015, 9(2): 977-982.
[84] 袁林江. 环境工程微生物学[M]. 北京: 化学工业出版社, 2012. YUAN L J. Microbiology of Environmental Engineering[M]. Beijing: Chemical Industry Press, 2012.
[85] MIRSAL I A. Soil Pollution: Origin, Monitoring & Remediation[M]. Berlin: Springer, 2008.
[86] 陈烁娜, 尹华, 叶锦韶, 等. 嗜麦芽窄食单胞菌处理苯并[]芘-铜复合污染过程中细胞表面特性的变化[J]. 化工学报, 2012, 63(5): 1592-1598. CHEN S N, YIN H, YE J S,. Change of cell surface features of stenotrophomonas maltophiliain treating benzo[]pyrene-copper combined pollution[J]. CIESC Journal, 2012, 63(5): 1592-1598.
[87] JIANG J, LIU H Y, LI Q,. Combined remediation of Cd-phenanthrene co-contaminated soil byandFQ1 and the antioxidant responses in[J]. Ecotoxicology & Environmental Safety, 2015, 120: 386-393.
[88] SUN T R, CANG L, WANG Q Y,. Roles of abiotic losses, microbes, plant roots, and root exudates on phytoremediation of PAHs in a barren soil[J]. J. Hazard. Mater., 2010, 176(1/2/3): 919-925.
[89] YI H, CROWLEY D E. Biostimulation of PAH degradation with plants containing high concentrations of linoleic acid[J]. Environ. Sci. Technol., 2007, 41(12): 4382-8.
[90] 李廷强, 董增施, 姜宏, 等. 东南景天对镉-苯并[]芘复合污染土壤的修复效果[J]. 浙江大学学报(农业与生命科学版), 2011, 37(4): 465-472. LI T Q, DONG Z S, JIANG H,. Remediation efficiency of Cd-B[]P combined polluted soil by[J]. Journal of Zhejiang University (Agric. & Life Sci.), 2011, 37(4): 465-472.
[91] FENG T, LIN H, GUO Q,. Influence of an arsenate-reducing and polycyclic aromatic hydrocarbons-degrading, isolate on growth and arsenic accumulation in, L. and removal of phenanthrene[J]. International Biodeterioration & Biodegradation, 2014, 94(94): 12-18.
[92] WANG K, HUANG H G, ZHU Z Q,. Phytoextraction of metals and rhizoremediation of PAHs in co-contaminated soil by co-planting ofwith ryegrass () or castor ()[J]. Int. J. Phytoremediation, 2013, 15(3): 283-98.
[93] United States Environmental Protection Agency. A citizen’s guide to phytoremediation, Office of solid waste and emergency response, Technology Innovations office[EB]. Technology Fact Sheet (5102G) EPA, 2006.
[94] SINGER A C, BELL T, HEYWOOD C A,. Phytoremediation of mixed-contaminated soil using the hyperaccumulator plant: evidence of histidine as a measure of phytoextractable nickel[J]. Environ. Pollut., 2007, 147(1): 74-82.
[95] YANG C J, ZHOU Q X, WEI S H,. Chemical-assisted phytoremediation of CD-PAHs contaminated soils usingL[J]. Int. J. Phytoremediation, 2011, 13(8): 818-833.
[96] BANESHI M M, REZAEI KALANTARY R, JONIDI JAFARI A,. Effect of bioaugmentation to enhance phytoremediation for removal of phenanthrene and pyrene from soil withand[J]. J. Environ. Health Sci. Eng., 2014, 12(1): 173-183.
Research progress on co-contamination and remediation of heavy metals and polycyclic aromatic hydrocarbons in soil and groundwater
YANG Yuesuo1,2, CHEN Yu1, LI Panpan1, WU Yuhui1, ZHAO Chuanqi2
(1Key Laboratory of Groundwater Resources and Environment of Ministry of Education, Jilin University, Changchun 130021, Jilin, China;2Key Laboratory of Eco-restoration of Regional Contaminated Environment of Ministry of Education, Shenyang University, Shenyang 110044, Liaoning, China)
The understanding of environmental contamination is gradually improved as better investigation and research are achieved. Previous study on single contaminants was no longer adequate in coping with the increasing occurrences of complex environmental co-contaminations, which have been addressed more and more. Heavy metals (HMs) and polycyclic aromatic hydrocarbons (PAHs) are ubiquitous contaminants in the environment, whose co-contaminations are frequently detected in the environment and their interactions have often made the remediation problematic. Soil and groundwater, the major bio-habitats, are the venues where such co-contaminations of HMs and PAHs occur. The co-contaminations of soil and groundwater will seriously threaten human and other ecological health. This paper hence reviews the source, distribution, migration, transformation and eco-toxicity of the co-contaminations of HMs and PAHs. It also briefly summarizes the interactions between contaminants and potential remediation technologies of the co-contaminations. The perspective research directions of such co-contaminations are proposed based upon the literature review.
heavy metals; polycyclic aromatic hydrocarbons; co-contamination; degradation; remediation; interaction
10.11949/j.issn.0438-1157.20161805
X 53
A
0438—1157(2017)06—2219—14
杨悦锁(1962—),男,教授。
国家自然科学基金项目(41272255,41472237);辽宁省创新团队项目(LT201502);沈阳市科技计划项目(F14-133-9-00)。
2016-12-26收到初稿,2017-02-26收到修改稿。
2016-12-26.
Prof. YANG Yuesuo, YangYuesuo@jlu.edu.cn
supported by the National Natural Science Foundation of China (41272255, 41472237) and the Shenyang Sci. & Tech. Plan Project(F14-133-9-00).
