心肌缝隙连接蛋白43、40在拟交感心房颤动模型中表达水平变化的研究
2017-06-05舒成霖何燕曾志羽刘浩李金轶黄伟强罗程许键黄艳群
舒成霖,何燕,曾志羽,刘浩,李金轶,黄伟强,罗程,许键,黄艳群
心肌缝隙连接蛋白43、40在拟交感心房颤动模型中表达水平变化的研究
舒成霖,何燕,曾志羽,刘浩,李金轶,黄伟强,罗程,许键,黄艳群
目的:通过建立拟交感性心房颤动(房颤)模型,探讨心肌缝隙连接蛋白(Cx)43和Cx40表达水平的变化。
方法:选择杂种犬15只,随机分为3组,即:对照组(N组)、快速心房起搏组(RAP组)和快速心房起搏+异丙肾上腺素(ISO)灌流组(RAP+ISO组),每组5只,处死后取出心脏,建立langendorff心脏离体灌流模型。3组分别检测心房有效不应期(AERP)及房颤诱发率,免疫组化检测神经生长因子、酪氨酸羟化酶在细胞内的表达及分布,蛋白免疫印记法检测Cx43和Cx40总蛋白水平,透射电镜检测线粒体形态,荧光比色法检测线粒体内活性氧簇(ROS)生成量。
结果:与N组AERP [(166±5.1)ms]比较,RAP组AERP[(160±3.2)ms]无明显改变,无法诱发出房颤,RAP+ISO组AERP [(148±3.7)ms]明显缩短(P<0.05),并可成功诱发房颤。与N组比较,RAP组线粒体轻度肿胀,基质基本完整,RAP+ISO组线粒体明显肿胀,部分基质透明。RAP组和RAP+ISO组Cx43和Cx40总蛋白含量均低于N组(P<0.05),且RAP+ISO组蛋白含量低于RAP组(P<0.05)。RAP+ISO组神经生长因子、酪氨酸羟化酶分布和含量以及线粒体内ROS生成量显著高于RAP组和N组(P<0.05),而 RAP组则高于N组(P<0.05),差异均有统计学意义。
结论:交感性房颤的发生与Cx43和Cx40蛋白含量的变化有关,交感神经可能通过氧化应激下调Cx43和Cx40的蛋白含量来介导房颤的发生。
交感神经系统;心房颤动;缝隙连接蛋白
(Chinese Circulation Journal, 2017, 32:502.)
心房颤动(房颤)是临床中最常见的心律失常。它主要通过三种机制,即电重构、结构重构和自主神经重构来诱导和维持。目前普遍认为神经机制在房性心动过速和房颤的发生和维持中发挥着重要作用。大量的研究表明交感神经的再生与重构和房颤的发生密切相关[1]。缝隙连接蛋白(Cx)是相邻心肌细胞重要的连接结构,其在细胞间的信号传导中发挥着重要作用。在心房肌中,Cx43和Cx40构成了维持心房肌细胞信号传导的主要成分。已有的研究表明,同正常组相比,在阵发性房颤和持续性房颤的患者中,Cx40均出现明显降低[2]。在利用高频起搏构建的动物房颤模型中,Cx43出现明显下调[3]。但交感神经是否通过影响Cx43、Cx40的变化来介导房颤的发生和维持,目前尚不清楚。本研究旨在通过构建离体心脏的拟交感房颤模型来研究Cx43和Cx40同交感性房颤的关系,从而更好地了解交感性房颤发生的内在机制。
1 材料与方法
材料与主要试剂:实验杂种犬(中华田园犬)15只,雌雄不分,重约2~3 kg。异丙肾上腺素注射液,戊巴比妥钠粉剂,肝素注射液,改良台氏液(北京索来宝),鼠抗-Cx43单克隆抗体(santa cruz),兔抗—神经生长因子(北京博奥森),兔抗—酪氨酸羟化酶(北京博奥森),DF-5A电生理刺激仪,凋亡试剂盒(Roche),兔抗-Cx40多克隆抗体(abcam)。
模型的建立与分组:15只犬随机分成3组,每组5只。对照组(N组):将实验犬以3%戊巴比妥钠腹腔注射后麻醉,固定于手术台上,行胸骨正中切开术,向左心室注射8 000 U肝素,取出心脏,快速连接至心脏离体灌流仪,37.5℃下以改良台氏液灌注心脏(250 r/min),灌流过程中使用人工按压心脏,使心率恢复至100次/min左右。分别于左右心耳、心尖部放置针状电极,连接电生理仪、刺激仪,记录心电图,持续灌流约1 h后留取心房组织。快速心房起搏组(RAP组):灌注方法同N组,仅在灌流时用电生理刺激仪以800次/min频率起搏30 s,共30次。快速心房起搏+异丙肾上腺素灌流组(RAP+ISO组):以含0.1μmol/L异丙肾上腺素的改良台氏液灌流心脏,余同RAP组。
电生理参数的检测:离体心脏搏动稳定后行电生理参数检测,以S1S2心脏程序期前刺激法检测心房有效不应期(AERP),S1S2偶联间期从基础刺激周长300 ms开始,刺激比例为8:1,10 ms步长递减,脉宽2 ms,刺激强度为2倍的舒张阈值强度。直至不能夺获心房的最长S1S2间期为AERP,重复3次,取平均值。记录除N组外房颤的诱发次数,诱发出的房颤定义为持续时间大于2 s的快速不规则心房电活动。
心房肌神经生长因子、酪氨酸羟化酶免疫组化染色和分析:取下部分左心房组织,生理盐水洗净迅速于10%福尔马林中固定。常规石蜡纵向切片,脱蜡后于柠檬酸盐缓冲盐中高温高压修复3 min,3%过氧化氢孵育10 min,磷酸盐缓冲液(PBS)浸泡5 min×3次,滴加一抗(神经生长因子:1:500、酪氨酸羟化酶:1:300),置于4℃孵育过夜。采用二步法行神经生长因子、酪氨酸羟化酶免疫组织化学染色(按试剂盒说明书操作),光镜下阳性为棕褐色。
蛋白免疫印记法检测Cx43、Cx40总蛋白含量:将冻存左心房组织用液氮研磨,匀浆,使用放射免疫沉淀试验(RIPA)裂解液,再加入100 mg/L 苯甲基磺酰氟(PMSF),提取总蛋白,用二辛可宁酸(BCA)法行蛋白浓度测定。按每泳道加总蛋白40 μg,在12%分离胶和5%浓缩胶上电泳后以100 mA×2 h湿转将蛋白条带转至聚偏二氟乙烯(PVDF)膜上。5%脱脂奶粉的缓冲液室温摇动封闭1 h,分别加入小鼠单克隆Cx43抗体(Santa,1:1 000),兔多克隆Cx40抗体(abcom,1:1 000)及小鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(1:10 000),4℃孵育过夜,室温下加相应二抗(1:10 000)孵育2 h,室温下TBST溶液清洗蛋白膜3次,用增强化学发光法显色,X线胸片曝光显影。凝胶成像系统摄像分析。
透射电镜下观察线粒体形态:将左心房组织切成体积<1 mm×1 mm×1 mm的组织块,迅速放入2.5%戊二醛中固定2 h,透射电镜观察线粒体超微结构变化,并照片分析。
荧光比色法测活性氧簇(ROS):3组左心房肌组织在取下后,1 h内于冰上快速剪碎,采用碧云天公司线粒体提取试剂盒分离线粒体。随后参照Korde等[4]的方法测定线粒体ROS。取线粒体量约为75 μg,加入呼吸缓冲液(5 mmol/L丙酮酸,2.5 mmol/L苹果酸,10 μmol/L 二氯荧光素(H2DCF/DA)及5 μmol/L辣根过氧化物酶),室温避光孵育30 min,用荧光分光光度计检测荧光强度,激发波长485 nm,发射波长532 nm。
统计学方法:采用SPSS17.0统计学软件对实验数据进行分析。计量资料用均值±标准差表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 3组AERP的比较:与N组AERP [(166±5.1)ms]比较,RAP组[(160±3.2)ms]缩短,差异无统计学意义(P>0.05),RAP+ISO组AERP [(148±3.7)ms]明显缩短,差异有统计学意义(P<0.05)。
2.2 3组房颤诱发率的比较(图1):N组与RAP组均无法诱发出房颤(0%、0%),RAP组仅出现短暂心房电紊乱现象。与N组和RAP组比较,RAP+ISO组则可诱发出房颤[(8.6±0.8)%],差异有统计学意义(P<0.05)。
2.3 3组神经生长因子、酪氨酸羟化酶免疫组化检测结果(图2):神经生长因子阳性呈棕黄色;与N组比较,可见RAP组和RAP+ISO组胞浆染色程度逐渐加深,且RAP+ISO组染色深于RAP组。酪氨酸羟化酶阳性为细胞核特异性着色,呈棕褐色;与N组相比,RAP组和RAP+ISO组酪氨酸羟化酶阳性逐渐增多,且RAP+ISO组明显多于RAP组。
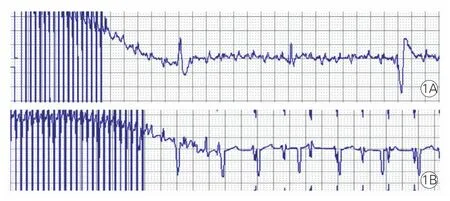
图1 快速起搏心房心电图
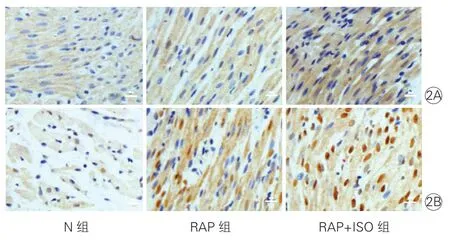
图2 3组神经生长因子、酪氨酸羟化酶免疫组化检测结果
2.4 蛋白免疫印记法检测Cx43、Cx40总蛋白含量的表达水平(图3): 与N组相比,RAP组和RAP+ISO组 Cx43、Cx40总蛋白含量均降低,且呈逐渐下降趋势,相邻各组间差异均有统计学意义(P<0.05)。
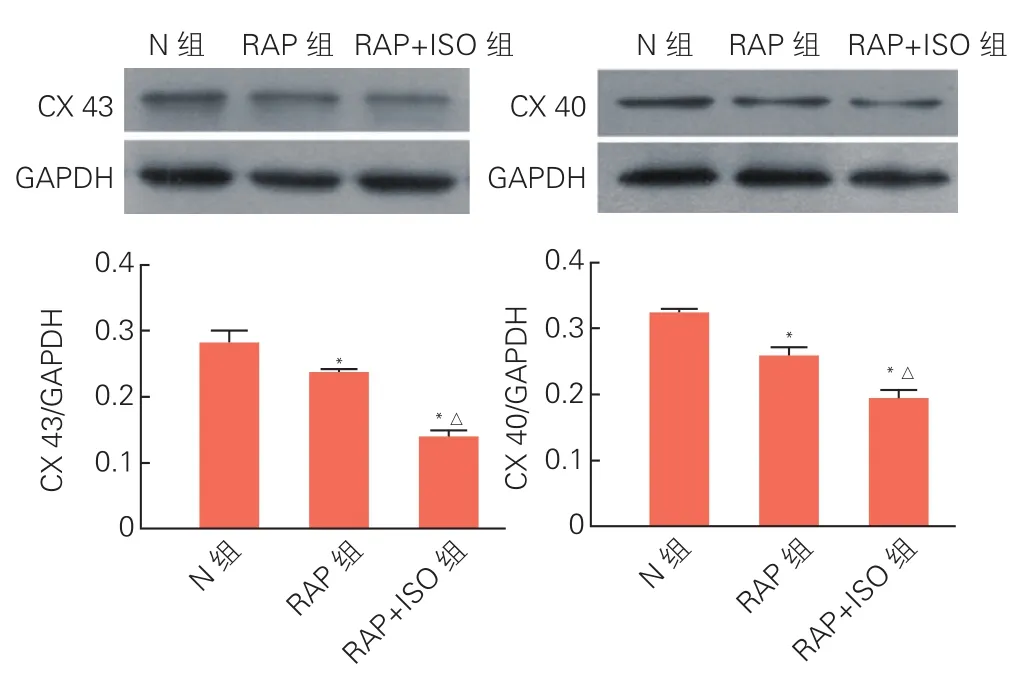
图3 3组缝隙连接蛋白43、40总蛋白含量的表达水平的比较(n=5)
2.5 3组透射电镜线粒体形态的比较(图4): N组线粒体无肿胀,嵴突规则致密。RAP组线粒体轻度肿胀,基质基本完整,嵴排列欠整体,少部分断裂。RAP+ISO组部分线粒体出现明显肿胀,部分基质透明,嵴突紊乱、断裂或溶解消失。

图4 3组透射电镜线粒体形态的比较(20 000×)
2.6 3组 ROS生成量比较:与N组ROS生成量(108.2±2.4)比较,RAP组(288.1±2.4)和RAP+ISO组(337.4±2.6)均明显增加(P<0.05),且RAP+ISO组ROS生成量高于RAP组(P<0.05),差异均有统计学意义。
3 讨论
已有的研究表明,交感神经的重构和再生与房颤的维持和发生密切相关,但其具体的内在机制目前研究较少。在本研究中,我们利用构建心脏离体灌流模型,使心脏脱离了机体神经体液系统的影响,并利用异丙肾上腺素灌流来模拟交感神经兴奋的效应,以期能够探索交感神经与房颤发生的内在机制。研究表明,短时的高频刺激并不会对AERP产生显著影响[5]。本研究也发现,N组、RAP组AERP未出现明显改变,而RAP+ISO组AERP则显著缩短,同时RAP+ISO组可以成功诱发出房颤。TH是儿茶酚胺合成过程中第一个限速酶,同时也起到催化作用,其检测为阳性的部位可代表交感神经的分布。这表明高频起搏和异丙肾上腺素灌流均可促进交感神经增生,且RAP+ISO组的增生效应更强。这证实了交感神经与房颤的密切关系,同时也提示其可对心房电重构产生影响,从而增加了房颤的易感性。交感神经是体内重要的生理调节系统,其张力会随昼夜交替发生周期变化,因此单纯的张力增高不会导致房颤,因此由交感神经兴奋介导的房颤中应该存在结构病变的基础。
细胞缝隙连接(GJ)结构是相邻心肌细胞重要的连接结构。GJ由Cx环绕排列而成,构成了心肌细胞间代谢偶联和电偶联的重要组成部分[6]。缝隙连接通道的重新分布和功能改变会导致相应传导速度和各向异性传导发生改变,从而引起心律失常环路[7]。Cx43和Cx40是构成心房肌细胞信号传导的主要成分,且均为pH敏感性Cx,当出现氧化应激损伤及随后内环境pH发生变化,Cx43及Cx40含量即会发生改变,进而增加心律失常的易感性[8]。ISO是人工合成非选择性β-肾上腺素能受体激动剂,可引起氧化应激损伤,使ROS生成量增加及内环境发生改变[9]。实验中我们也发现RAP+ISO组的ROS生成量明显增高,ROS的生成场所主要在线粒体,在电镜下观察各组线粒体超微结构,与N组比较,RAP组线粒体仅出现形态上的变化,而RAP+ISO组线粒体则出现了明显的肿胀,嵴突的断裂和溶解。Lenaerts等[10]的研究发现,房颤和氧化应激的水平呈正相关。但氧化应激是否通过影响Cx的变化诱导和维持房颤的发生,目前尚不十分明确。在我们此次离体心脏灌流实验中,借助ISO模拟交感神经的激活,通过高频起搏成功构建了拟交感房颤模型,并发现了RAP组Cx43和Cx40蛋白含量较N组降低,RAP+ISO组Cx43、Cx40蛋白含量与N组及RAP组比较均显著降低。这也验证了Cx43及Cx40在心电传导中的作用,当二者含量下降时,会出现电传导的紊乱,当伴随氧化应激损伤进一步加重,Cx43、Cx40出现明显降低时,则会诱发出房颤。
综上所述,我们认为交感神经可能通过影响氧化应激下Cx43和Cx40的变化来介导房颤的发生。但本研究过程中,我们主要探讨了心房组织Cx43及Cx40总蛋白含量,但众所周知,Cx43总蛋白含量并不能完全代表Cx43的功能状态,磷酸化的Cx43在其中也发挥着极其重要的作用[11],而这也是未来我们将继续深入研究的方向。
[1] 黄欣淼, 曲秀芬. 心房颤动与自主神经的相关性研究进展. 中国循环杂志, 2015, 30: 1027-1029.
[2] Gemel J, Levy AE, Simon AR, et al. Connexin40 abnormalities and atrial fibrillation in the human heart. J Mol Cell Cardiol, 2014, 76: 159-168.
[3] Yan J, Kong W, Zhang Q, et al. c-Jun N-terminal kinase activation contributes to reduced connexin43 and development of atrial arrhythmias. Cardiovasc Res, 2013, 97: 589-597.
[4] Korde AS, Yadav VR, Zheng YM, et al. Primary role of mitochondrial Rieske iron-sulfur protein in hypoxic ROS production in pulmonary artery myocytes. Free Radic Biol Med, 2011, 50: 945-952.
[5] Zhang L, Po SS, Wang H, et al. Autonomic Remodeling: How Atrial Fibrillation Begets Atrial Fibrillation in the First 24 Hours. JCardiovasc Pharmacol, 2015, 66: 307-315.
[6] Palatinus JA, Rhett JM. Gourdie RG The connexin43 carboxyl terminus and cardiac gap junction organization. Biochim Biophys Acta, 2012, 1818: 1831-1843.
[7] 王粮山, 顾承雄. 心肌梗死后缝隙连接蛋白43重构与室性心律失常. 中国循环杂志, 2015, 30: 1120-1122.
[8] Tribulova N, Egan Benova T, Szeiffova Bacova B, et al. New aspects of pathogenesis of atrial fibrillation: remodelling of intercalated discs. J Physiol Pharmacol, 2015, 66: 625-634.
[9] Davel AP, Brum PC, Rossoni LV. Isoproterenol induces vascular oxidative stress and endothelial dysfunction via a Gialpha-coupled beta2-adrenoceptor signaling pathway. PLoS One, 2014, 9: e91877.
[10] Lenaerts I, Driesen RB, Hermida N, et al. Role of nitric oxide and oxidative stress in a sheep model of persistent atrial fibrillation. Europace, 2013, 15: 754-760.
[11] Adam O, Lavall D, Theobald K, et al. Rac1-induced connective tissue growth factor regulates connexin 43 and N-cadherin expression in atrial fibrillation. J Am Coll Cardiol, 2010, 55: 469-480.
Expression of Myocardial Levels of Connexin 43, 40 in Experimental Dog Model of Sympathomimetic Atrial Fibrillation
SHU Cheng-lin, HE Yan, ZENG Zhi-yu, LIU Hao, LI Jin-yi, HUANG Wei-qiang, LUO Cheng, XU Jian, HUANG Yan-qun.
Department of Geriatrics Cardiology, First Aff i liated Hospital of Guangxi Medical University, Nanning (530021), Guangxi, China
HE Yan, Email: hyxjwxy@126.com
Objective: To explore the expression of myocardial levels of connexin 43(Cx43), Cx40 in experimental dog model of sympathomimetic atrial fi brillation (AF).
Methods: 15 mongrels dogs were randomly divided into 3 groups: Control group, Rapid atrium pacing (RAP) group and RAP+isoprenaline (ISO) perfusion group. n=5 in each group. The hearts were taken to establish in vitro langendorff cardiac perfusion model. Atrial effective refractory period (AERP) and AF inducing rate were tested; intracellular expression and distribution of nerve growth factor (NGF) and tyrosine hydroxylase (TH) were examined by immunohistochemistry, total protein contents of Cx43 and Cx40 were measured by Western blot analysis, mitochondria morphology was observed by transmission electron microscope and mitochondria reactive oxygen species (ROS) generation was detected by f l uorescent colorimetric method.
Results: AERP was similar between Control group and RAP group (166±5.1) ms vs (160±3.2) ms which cannot induce AF; while it was shortened in RAP+ISO group (148±3.7) ms, P<0.05 which may successfully induce AF.Compared with Control group, mitochondria was slightly swollen in RAP group and the matrix was intact, while mitochondria was obviously swollen in RAP+ISO group and part of matrix was transparent; total protein contents of Cx43 and Cx40 were lower in both RAP group and RAP+ISO group, P<0.05; in addition, they were even lower in RAP+ISO group than RAP group, P<0.05. Compared with Control group and RAP group, RAP+ISO group had increased expression and distribution of NGF, TH and mitochondria ROS generation, P<0.05; NGF, TH and ROS in RAP group were higher than Control group, P<0.05.
Conclusion: Sympathetic AF has been related to the contents and changes of myocardial levels of CX43 and Cx40; sympathetic nerve might trigger AF by oxidative stress induced down-regulation of myocardial CX43 and Cx40 in experimental dog model.
Sympathetic system; Atrial fi brillation; Connexin; Qxidative stress
2016-06-28)
(编辑:漆利萍)
国家自然科学基金(81260039);广西自然科学基金(2013GXNSFAA278005);第一批广西医学高层次骨干人才培养“139”计划经费
530021 广西壮族自治区南宁市,广西医科大学第一附属医院 老年心内科(舒成霖、何燕、曾志羽、许键、黄艳群);心血管病研究所(李金轶、刘浩、黄伟强);心胸外科(罗程)
舒成霖 硕士研究生 主要从事心律失常研究 Email:360045198@qq.com 通讯作者:何燕 Email:hyxjwxy@126.com
R54
A
1000-3614(2017)05-0502-05
10.3969/j.issn.1000-3614.2017.05.019
