择期经皮冠状动脉介入治疗术后围术期心肌梗死的原因及相关危险因素分析
2017-06-05丰雷张冬尹栋王昊赵志勇高国峰窦克非
丰雷,张冬,尹栋,王昊,赵志勇,高国峰,窦克非
冠心病研究
择期经皮冠状动脉介入治疗术后围术期心肌梗死的原因及相关危险因素分析
丰雷,张冬*,尹栋,王昊,赵志勇,高国峰,窦克非
目的:根据美国心血管造影及介入协会(SCAI)新标准评估经皮冠状动脉介入治疗(PCI)术后围术期心肌梗死(PMI)的相关危险因素。
方法:根据最新的SCAI标准选取我院PCI术后PMI的患者3 371例(3 516例次择期PCI),回顾性分析所有患者的临床基线特征、造影结果以及操作特点,应用多因素回归分析识别PMI的独立危险因素。
结果:入选患者共发生108次(3.1%)PMI。经多因素回归分析,年龄[比值比(OR)=1.037,95%可信区间(CI):1.016~1.058]、处理多支血管病变(OR=1.697,95% CI:1.095~2.629)、至少处理一处分叉病变(OR=1.869,95% CI:1.213~2.878)以及靶病变总长度(OR=1.016,95% CI:1.009~1.024)是PMI的独立危险因素。
结论:年龄、多支病变PCI、至少处理一处分叉病变以及靶病变总长度是发生PMI的独立危险因素。
血管成型术,经腔,经皮冠状动脉;心肌梗死;危险因素;围术期
(Chinese Circulation Journal, 2017,32:431.)
全球每年有数百万患者进行了经皮冠状动脉介入治疗(PCI),围术期心肌梗死(PMI)是最常见的介入并发症之一,可以导致非常严重的后果[1]。根据不同的诊断标准,2.6%~30.0%的患者在PCI术后早期发生了心肌梗死[2,3]。此前已有研究发现:术后早期心肌标记物的轻度异常即与远期死亡率的增高表现出一定的相关性[4-7]。医务工作者及时发现危险因素,识别PMI的高危患者,早期应用足量的抗血小板及他汀类药物,将给患者带来更多的获益[2,8-10]。
关于PMI的诊断曾先后出现三个标准:心肌梗死全球统一定义[11]、第三次心肌梗死全球统一定义[12]以及最新的美国心血管造影及介入协会(SCAI)定义[13]。与前两者相比,SCAI新标准的诊断阈值明显升高,根据该标准诊断出的PMI很可能与更高的远期死亡率和心肌梗死发生率相关[3],具有更多的实际意义。目前还缺少大样本量的临床研究尝试分析新标准下PMI的相关危险因素。我们据此设计了本次研究,目的在于识别出符合SCAI新定义的PMI危险因素。
1 资料与方法
1.1 研究对象
自2013-01至2013-12,我院共进行11 761例次PCI(10 724例患者),3 516例次PCI(3 371例患者)符合入选标准被选作研究对象。其中108例次PCI(107例患者)出现PMI,为PMI组;其余3 408例次PCI(3 264例患者) 为非PMI组。
本研究的入选标准为:(1)进行择期PCI治疗;(2)在PCI前后行心肌酶学标记物[肌酸激酶同工酶(CK-MB)及血清肌钙蛋白(cTn)]的定量测定。因急性冠状动脉综合征进行急诊PCI的患者被排除在本研究之外。
1.2 介入策略及相关用药
入选患者的介入策略及器械的选用由术者决定。围术期抗血小板及抗凝治疗的方案均基于当前指南,若患者服用阿司匹林或氯吡格雷的时间不足7天,将在手术前24 h内给予氯吡格雷300 mg和阿司匹林300 mg进行负荷给药。所有术后的患者均需长期口服阿司匹林(100 mg/d)和氯吡格雷(75 mg/d),至少服用至术后1年。
1.3 数据采集及围术期心肌梗死的定义
研究者根据病历收集临床数据。独立的核心实验室对所有的基线资料及影像资料进行复核及分析。以下造影结果将被收集:病变位置、心肌梗死溶栓治疗临床试验(TIMI)血流分级、血栓性病变、靶血管直径、狭窄程度以及钙化程度。需要记录的操作特点包括:处理多支血管病变、靶病变总长度以及至少处理一处分叉病变。同时采集的还有术前实验室检查及围术期用药情况。所有患者均在术前及术后(6~18 h)进行心电图及心肌酶学(CK-MB及cTn)检测以及时识别PMI。所有化验均在我院生化检验室进行,应用酶联免疫抑制法检测CK-MB及cTn,并以质谱分析法进行确认。对于有缺血症状或酶学指标升高的患者,需要动态监测心肌酶的变化以及时判断酶峰出现的时间。
本研究以SCAI新定义为标准,若CK-MB升高程度≥10倍参考值上限(URL),且(或)cTn≥70倍URL,方可诊断为PMI。其他补充标准可参考既往研究[13]。
1.4 随访
研究人员在术后30天、12个月和24个月对所有患者进行门诊或电话随访,比较分析两组患者在术后24个月的主要不良心脏事件(MACE,包括全因死亡、心肌梗死以及靶血管血运重建)。所有终点事件均根据学术研究联合会(ARC) 标准进行定义[14]。
1.5 统计学分析
统计学分析均在SAS 9.4系统中进行。连续资料以均值±标准差表示,以t检验进行比较。分类资料以数量均数±标准差或百分数(%)记录,计数资料采用χ2检验,必要时采用Fisher精确检验。应用多因素Logistic回归分析以确定PMI的独立预测因素,以秩和检验(log-rank)比较MACE的Kaplan-Meier生存曲线。所有P值均为双向,P<0.05为差异有统计学意义。以方差膨胀因子(VIF)评估各因素的多重共线性;以受试者工作特征(ROC)曲线下面积判断模型的预测能力,以Hosmer-Lemeshow法检验模型的拟合优度[15,16]。
2 结果
2.1围术期心肌梗死的发生率及病因
3 516例次PCI中有108例(3.1%)发生PMI,其潜在的致病原因有分支血管闭塞(66次,61.1%),慢血流或无复流(14次,12.96%)以及急性血栓形成(2次,1.85%)。有24.1%(26次)的患者未能识别出可能的心肌梗死原因。
2.2 两组患者基线特征、病变及操作特点
两组患者基线特征(表1):PMI组患者平均年龄(61.95±10.45)岁,非PMI组为(58.59±9.98)岁(P<0.01);PMI组的肌酐清除率为(91.10±30.60)ml/min, 而 非 PMI组 为(97.55±27.08) ml/min(P=0.03)。除此以外的两组患者基线特征差异均无统计学意义(P均>0.05)。
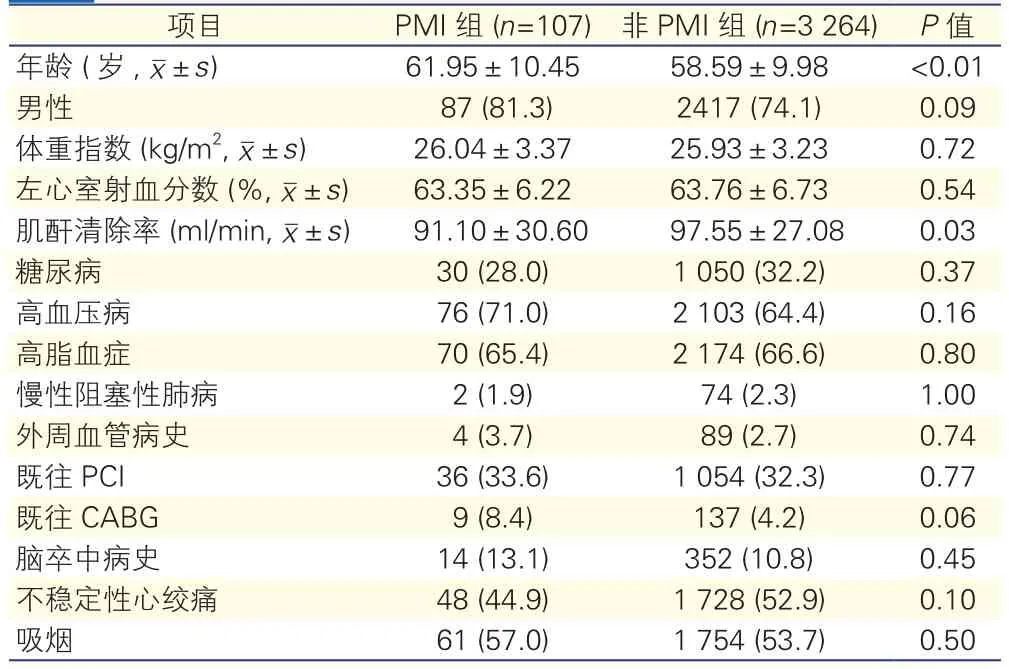
表1 两组患者基线特征[例(%)]
两组患者病变及操作特点(表2):PMI组中左主干病变为10.2%(11例),非PMI组为4.3%(148例),两组比较差异有统计学意义(P<0.01)。左前降支病变在两组中的比例分别为63.0%(68例)和51.9%(1 770例)(P=0.02)。操作特点中,处理多支血管病变[PMI组与非PMI组分别为39.8%(43例)和19.8%(674例)]、靶病变总长度[PMI组与非PMI组分别为(47.3±24.0)mm和(34.0±21.4)mm]以及至少处理一处分叉病变[PMI组与非PMI组的比例分别为32.4%(35例)和17.3%(588例)],两组比较差异均有统计学意义(P均<0.01)。表2
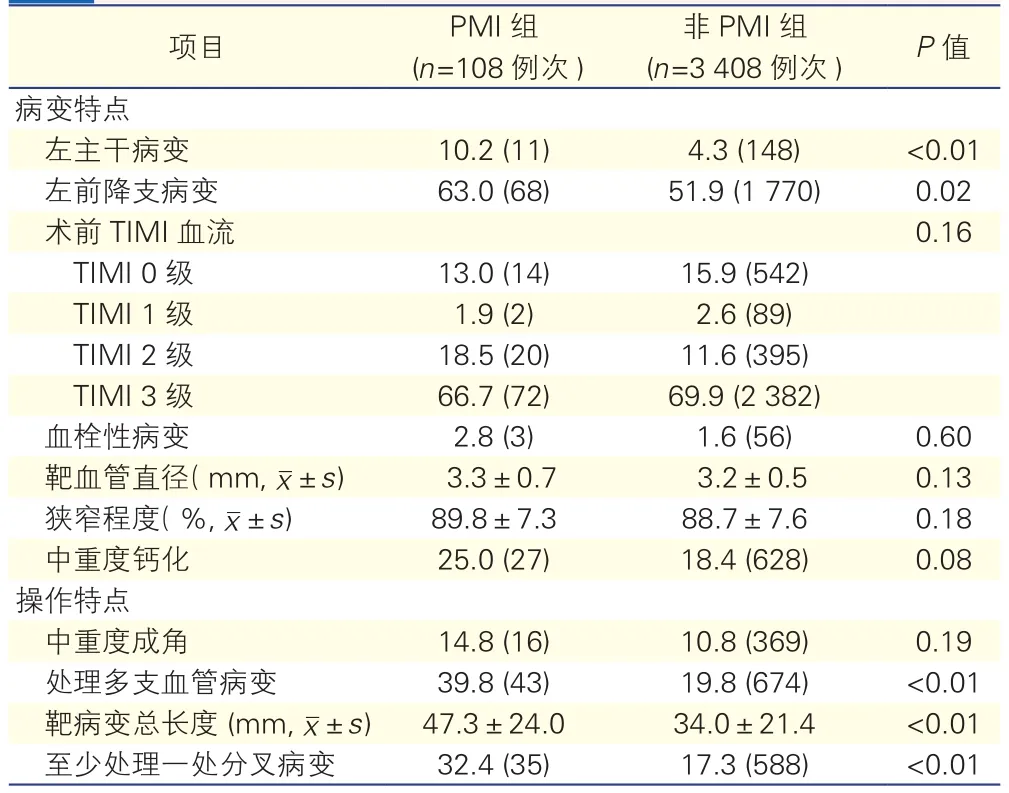
表2 两组患者病变及操作特点[%(例次)]
2.3 两组患者实验室检查及围术期用药
两组患者实验室检查(表3):PMI组的B型利钠肽平均值为(653.9±199.0)pmol/L,略低于非PMI组[(690.6±404.7)pmol/L,P=0.07],两组其余实验室检查结果差异均无统计学意义(P均>0.05)。
表3 两组患者实验室检查
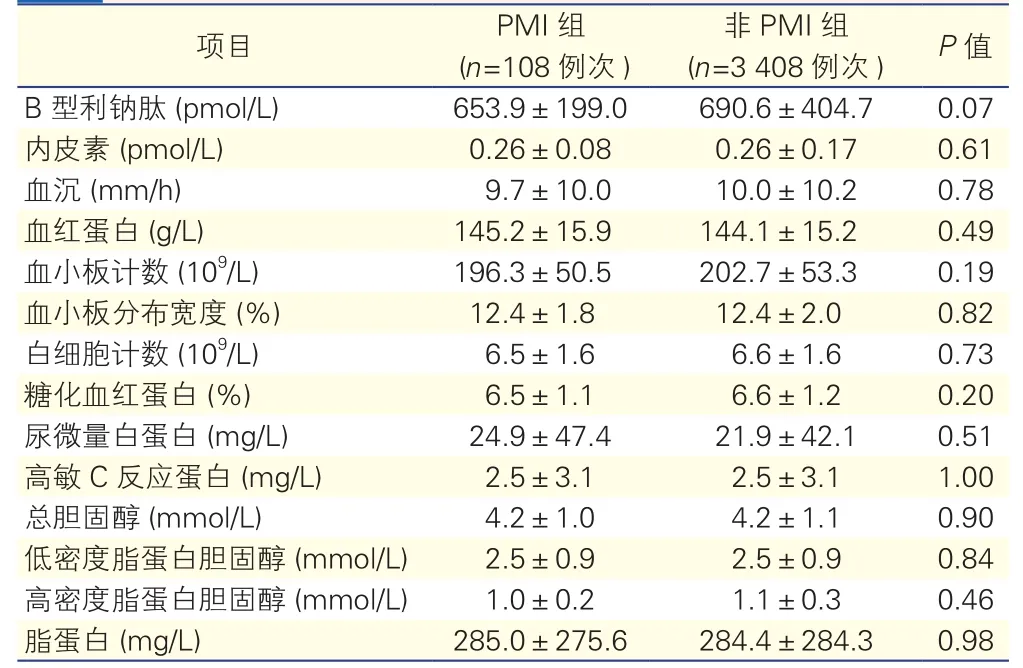
表3 两组患者实验室检查
注:PMI:围术期心肌梗死
项目 PMI组(n=108例次)非PMI组(n=3 408例次) P值B型利钠肽 (pmol/L) 653.9±199.0 690.6±404.7 0.07内皮素 (pmol/L) 0.26±0.08 0.26±0.17 0.61血沉 (mm/h) 9.7±10.0 10.0±10.2 0.78血红蛋白 (g/L) 145.2±15.9 144.1±15.2 0.49血小板计数 (109/L) 196.3±50.5 202.7±53.3 0.19血小板分布宽度 (%) 12.4±1.8 12.4±2.0 0.82白细胞计数 (109/L) 6.5±1.6 6.6±1.6 0.73糖化血红蛋白 (%) 6.5±1.1 6.6±1.2 0.20尿微量白蛋白 (mg/L) 24.9±47.4 21.9±42.1 0.51高敏C反应蛋白 (mg/L) 2.5±3.1 2.5±3.1 1.00总胆固醇 (mmol/L) 4.2±1.0 4.2±1.1 0.90低密度脂蛋白胆固醇 (mmol/L) 2.5±0.9 2.5±0.9 0.84高密度脂蛋白胆固醇 (mmol/L) 1.0±0.2 1.1±0.3 0.46脂蛋白 (mg/L) 285.0±275.6 284.4±284.3 0.98
两组患者围术期用药(表4):PMI组患者中应用糖蛋白Ⅱb/Ⅲa受体拮抗剂的比例更高(38.0% vs 25.5%,P<0.01),其他药物应用比例相近,差异均无统计学意义(P均>0.05)。
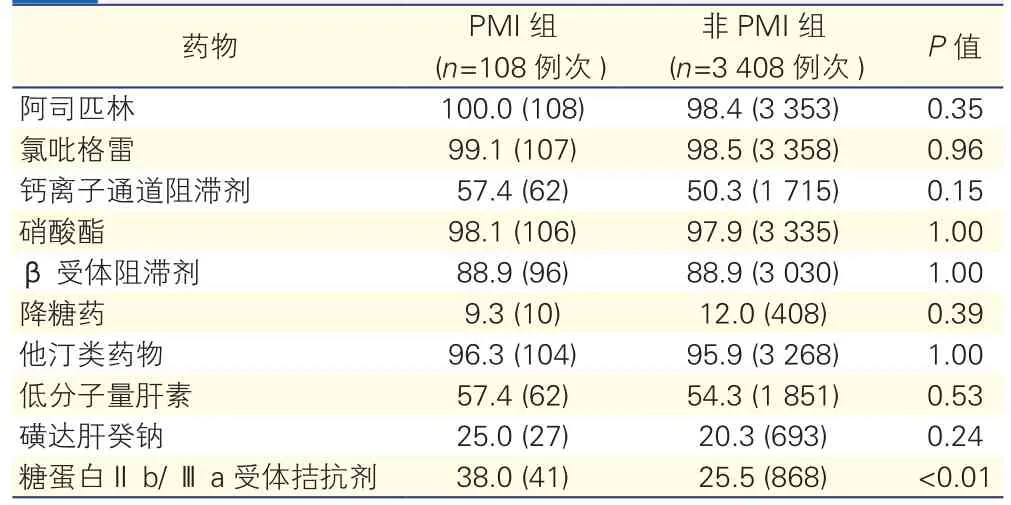
表4 两组患者围术期用药[%(例次)]
2.4 围术期心肌梗死的危险因素分析
经单因素及多因素分析(表5),年龄(OR=1.037,95%CI:1.016~1.058)、处理多支血管病变(OR=1.697,95%CI:1.095~2.629)、至少处理一处分叉病变(OR=1.869,95%CI:1.213~2.878)以及靶病变总长度(OR=1.016,95%CI:1.009~1.024)是PMI的独立危险因素。
PMI各危险因素之间未见明显相关性;方差膨胀因子远小于5,表明模型中的各因素之间没有多重共线性。多因素回归模型的受试者工作特征(ROC)曲线下面积为0.72(95%CI:0.67~0.77,图1),Hosmer-Lemeshow检验证实了理想的拟合优度(P=0.28)。
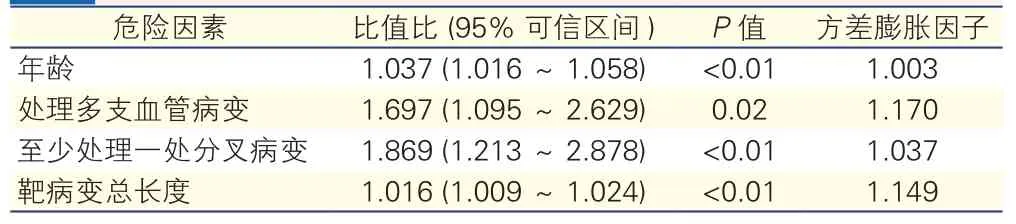
表5 围术期心肌梗死多因素回归分析
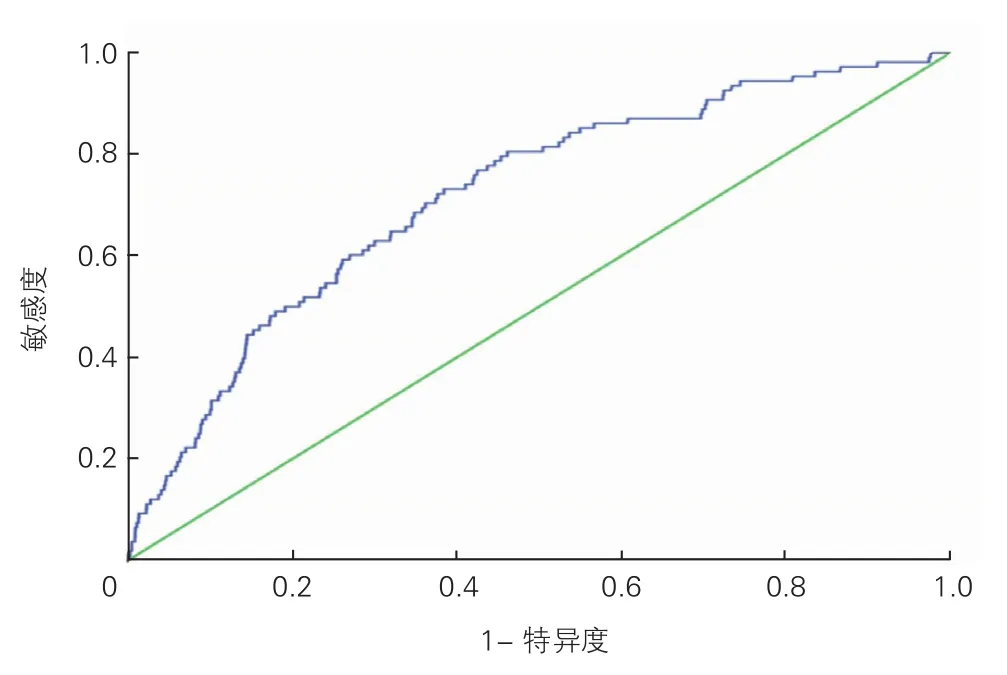
图1 围术期心肌梗死多因素回归模型的受试者工作特征曲线
2.5 围术期心肌梗死与主要不良心脏事件
两组患者在全因死亡、心肌梗死、靶血管血运重建及MACE方面的Kaplan-Meier生存曲线显示(图2),PMI组患者在靶血管血运重建和MACE方面的发生率有所增加(P均<0.05),差异均有统计学意义。
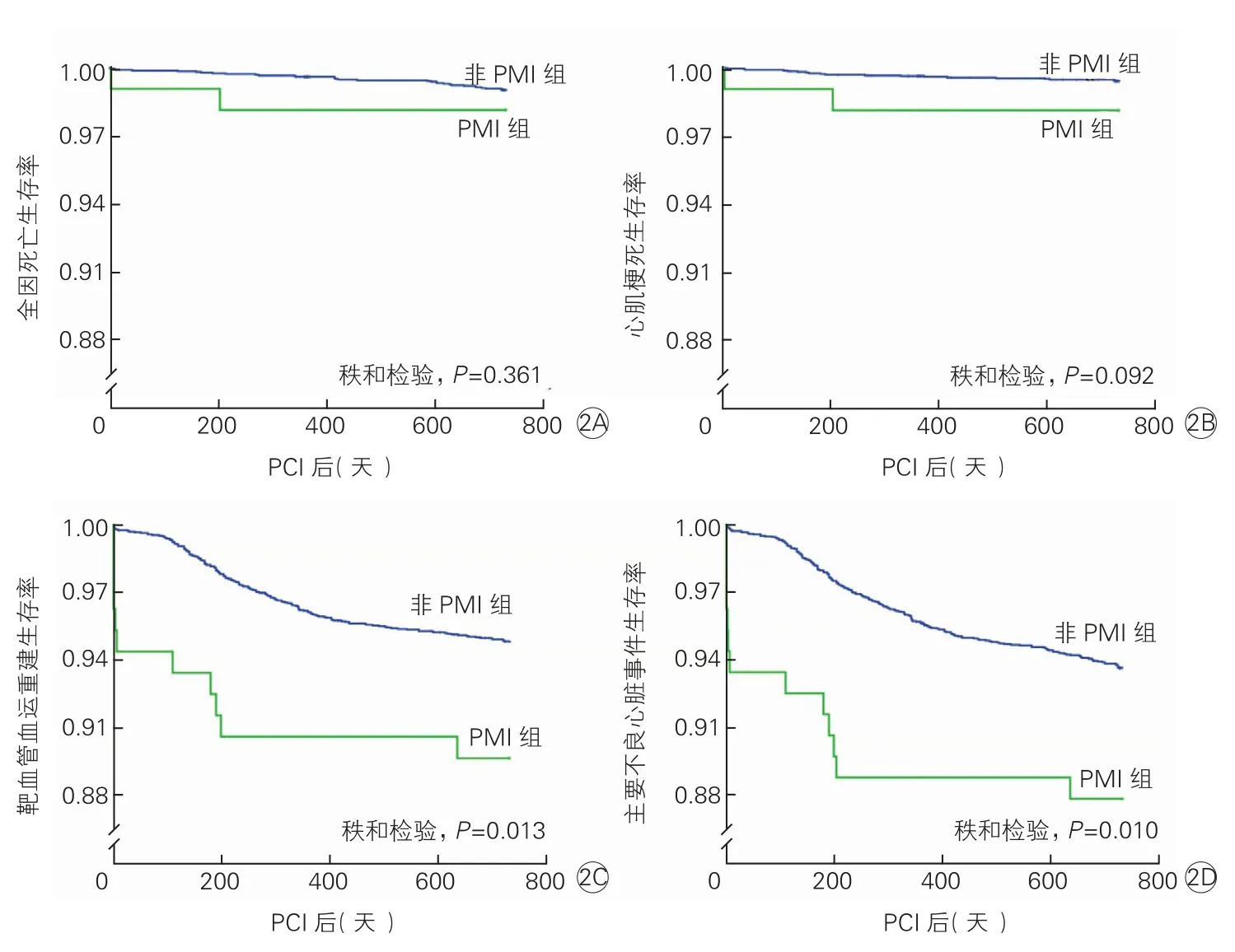
图2 两组患者在全因死亡(2A)、心肌梗死(2B)、靶血管血运重建(2C)及主要不良心脏事件(2D)方面的Kaplan-Meier生存曲线
3 讨论
本研究通过单中心大规模临床数据的分析,首次以SCAI定义为标准,分析了PMI的发生原因及独立危险因素。
术中冠状动脉造影可以发现分支血管闭塞、无复流以及急性血栓形成等导致PMI的原因,然而尚有相当多的PMI患者(本研究中占比24.1%)未能明确发病机制[17]。曾有研究通过磁共振检查发现围术期心肌损伤最常累积靶病变相邻及以远区域[2]。前者应与分叉病变的分支血管闭塞有关,后者与血栓或粥样物质脱落造成微循环栓塞有关。本研究所发现的分叉病变PCI、多支血管病变PCI以及靶病变总长度等危险因素,反映了手术过程对分支血管及斑块负荷干预的程度。
既往研究在PMI与预后的关系方面未能得出一致结论[18,19]。不同的诊断标准很可能是导致不同结论的原因。首次心肌梗死全球统一定义于2000年问世并在2007年进行修订,将心肌酶学标记物异常升高与心电图改变和临床表现一起作为诊断心肌梗死的三大依据,但未就PMI进行特殊说明[11]。2012年发布的第三次全球定义把PMI定义为4a型,其诊断依据为:PCI术后48 h内cTn水平升高>5倍URL,且有心肌缺血临床表现及相应的心电图或影像学证据[12]。2013年SCAI提出新的PMI定义:PCI术后48 h内CK-MB升高>10倍URL与(或)cTn升高>70倍URL[13]。SCAI新标准的制定过程中大量参考了循证医学的证据,提高了诊断阈值。2014年澳大利亚的一项单中心研究,分别根据2007年、2012年版全球统一定义以及SCAI新标准进行诊断,PMI的发生率分别为23.2%、13.3%及 2.6%(P<0.0001)。术后2年时,分别依据上述三个诊断标准,PMI组与非PMI组的死亡/心肌梗死发生率分别为14.7% vs 10.1%(P=0.087)、16.9% vs 10.3%(P=0.059)以及29.4% vs 10.7%(P=0.015)。SCAI新标准下的PMI发生率明显下降,且与更多的远期死亡/心肌梗死有关[3]。本研究中的两组患者虽然在死亡/心肌梗死发生率方面未见统计学差异,但PMI组表现出更高的趋势,同时MACE明显增加。
临床医生根据术中造影结果,及时发现PMI的危险因素,有助于识别高危患者,通过给予早期干预措施如强化抗血小板治疗、增大他汀类药物用量以及应用曲美他嗪、尼可地尔等药物以改善预后[2,8,9,20]。对于多支血管病变的患者,如果术前PMI的危险因素较多,术者在介入策略的选择上应避免同期处理全部靶病变。对于病变复杂、PCI结果不满意或出现并发症的高危患者,应延长住院时间,动态监测心肌酶学标记物及心电图的变化。一旦发生严重PMI,应按照急性冠状动脉综合征的相关指南进行处理,必要时及时复查冠状动脉造影并进行必要的处理以控制心肌梗死的程度和范围。由于PMI的程度与患者的远期预后相关,术后出现严重心肌梗死的患者在冠心病二级预防方面也应给予足够的重视。
由于本研究是单中心进行的回顾性分析。选择偏倚和未知的混杂因素无法完全排除。而且很多患者由于缺少酶学标记物的定量检测而未能入选,非连续性的入选过程势必造成一定程度的选择偏倚。今后有必要进行前瞻性的研究以确定上述危险因素对预测PMI的准确度。
年龄、多支病变PCI、至少处理一处分叉病变以及靶病变总长度是PMI的独立预测因子。及时识别上述危险因素并加以干预可以减少MACE的出现。建立定量化的危险度评分将会更准确地预测PMI的风险。
[1] Writing Group M, Mozaffarian D, Benjamin EJ, et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation, 2016, 133: e38-60.
[2] Prasad A, Herrmann J. Myocardial infarction due to percutaneous coronary intervention. N Engl J Med, 2011, 364: 453-464.
[3] Idris H, Lo S, Shugman IM, et al. Varying definitions for periprocedural myocardial infarction alter event rates and prognostic implications. J Am Heart Assoc, 2014, 3: e001086.
[4] Jang JS, Jin HY, Seo JS, et al. Prognostic value of creatine kinasemyocardial band isoenzyme elevation following percutaneous coronary intervention: a meta-analysis. Catheter Cardiovasc Interv, 2013, 81: 959-967.
[5] Kong TQ, Davidson CJ, Meyers SN, et al. Prognostic implication of creatine kinase elevation following elective coronary artery interventions. JAMA, 1997, 277: 461-466.
[6] Akkerhuis KM, Alexander JH, Tardiff BE, et al. Minor myocardial damage and prognosis: are spontaneous and percutaneous coronary intervention-related events different?. Circulation, 2002, 105: 554-556.
[7] Ioannidis JP, Karvouni E, Katritsis DG. Mortality risk conferred by small elevations of creatine kinase-MB isoenzyme after percutaneous coronary intervention. J Am Coll Cardiol, 2003, 42: 1406-1411.
[8] Herrmann J, Lerman A, Baumgart D, et al. Preprocedural statin medication reduces the extent of periprocedural non-Q-wave myocardial infarction. Circulation, 2002, 106: 2180-2183.
[9] Di Sciascio G, Patti G, Pasceri V, et al. Efficacy of atorvastatin reload in patients on chronic statin therapy undergoing percutaneous coronary intervention: results of the ARMYDA-RECAPTURE (Atorvastatin for Reduction of Myocardial Damage During Angioplasty) Randomized Trial. J Am Coll Cardiol, 2009, 54: 558-565.
[10] Tandjung K, Lam MK, Sen H, et al. Value of the SYNTAX score for periprocedural myocardial infarction according to WHO and the third universal definition of myocardial infarction: insights from the TWENTE trial. EuroIntervention, 2016, 12: 431-440.
[11] Thygesen K, Alpert JS, White HD, et al. Universal definition of myocardial infarction. J Am Coll Cardiol, 2007, 50: 2173-2195.
[12] Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. J Am Coll Cardiol, 2012, 60: 1581-1598.
[13] Moussa ID, Klein LW, Shah B, et al. Consideration of a new definition of clinically relevant myocardial infarction after coronary revascularization: an expert consensus document from the Society for Cardiovascular Angiography and Interventions (SCAI). J Am Coll Cardiol, 2013, 62: 1563-1570.
[14] Cutlip DE, Windecker S, Mehran R, et al. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation, 2007, 115: 2344-2351.
[15] Cook NR. Use and misuse of the receiver operating characteristic curve in risk prediction. Circulation, 2007, 115: 928-935.
[16] Hosmer DW, Hosmer T, Le Cessie S, et al. A comparison of goodnessof-fit tests for the logistic regression model. Stat med, 1997, 16: 965-980.
[17] Park DW, Kim YH, Yun SC, et al. Frequency, causes, predictors, and clinical significance of peri-procedural myocardial infarction following percutaneous coronary intervention. Eur Heart J, 2013, 34: 1662-1669.
[18] Farooq V, Serruys PW, Vranckx P, et al. Incidence, correlates, and significance of abnormal cardiac enzyme rises in patients treated with surgical or percutaneous based revascularisation: a substudy from the Synergy between Percutaneous Coronary Interventions with Taxus and Cardiac Surgery (SYNTAX) Trial. Int J Cardiol, 2013, 168: 5287-5292.
[19] Jeremias A, Baim DS, Ho KK, et al. Differential mortality risk of postprocedural creatine kinase-MB elevation following successful versus unsuccessful stent procedures. J Am Coll Cardiol, 2004, 44: 1210-1214.
[20] 裴玮娜, 谢瑞芹, 崔炜, 等. 曲美他嗪与尼可地尔对经皮冠状动脉介入治疗相关心肌损伤干预作用的比较. 中国循环杂志,2014,29: 256-260.
Analysis for the Cause of Peri-procedural Myocardial Infarction and Risk Factors in Patients After Elective Percutaneous Coronary Intervention
FENG Lei, ZHANG Dong, YIN Dong, WANG Hao, ZHAO Zhi-yong, GAO Guo-feng, DOU Ke-fei.
Department of Cardiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
YIN Dong, Email: pumcyd@163.com
Objective: To assess the risk factors for peri-procedural myocardial infarction (PMI) occurrence in patients after percutaneous coronary intervention (PCI) based on the new standard of US Society for cardiovascular angiography and interventions (SCAI).
Methods: According to SCAI standard, a total of 3371 relevant patients with 3516 elective PCI in our hospital were enrolled. The baseline clinical features, coronary angiography (CAG) findings and PCI procedural elements were retrospectively studied, the independent risk factors for PMI occurrence were identif i ed by multivariate Logistic regression analysis.
Results: There was 108/3516 (3.1%) PMI occurred in all patients. Multivariate Logistic regression analysis presented that age (OR=1.037, 95% CI 1.016-1.058), treating multi-vessel lesions (OR=1.697, 95% CI 1.095-2.629), treating at least 1 bifurcation lesion (OR=1.869, 95% CI: 1.213-2.878) and the total length of lesion (OR=1.016, 95% CI 1.009-1.024) were the independent risk factors for PMI occurrence.
Conclusions: Age, treating multi-vessel lesions, at least one bifurcation lesion and the total length of lesion were the independent risk factors for PMI occurrence in patients after elective PCI.
Angioplasty, transluminal, percutaneous coronary; Myocardial infarction; Risk factors; Peri-operative period
2016-10-19)
(编辑:漆利萍)
首都临床特色应用与研究推广(No.Z161100000516095)
100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 心内科
丰雷 主治医师 学士 主要研究方向为冠心病介入诊疗 Email:fenglei0712@163.com 通讯作者:尹栋 Email:pumcyd@163.com*为共同第一作者
R54
A
1000-3614(2017)05-0431-05
10.3969/j.issn.1000-3614.2017.05.004
