冠状动脉微血管疾病诊断和治疗的中国专家共识
2017-06-05中华医学会心血管病学分会基础研究学组中华医学会心血管病学分会介入心脏病学组中华医学会心血管病学分会女性心脏健康学组中华医学会心血管病学分会动脉粥样硬化和冠心病学组
中华医学会心血管病学分会基础研究学组,中华医学会心血管病学分会介入心脏病学组,中华医学会心血管病学分会女性心脏健康学组,中华医学会心血管病学分会动脉粥样硬化和冠心病学组
指南与共识
冠状动脉微血管疾病诊断和治疗的中国专家共识
中华医学会心血管病学分会基础研究学组,中华医学会心血管病学分会介入心脏病学组,中华医学会心血管病学分会女性心脏健康学组,中华医学会心血管病学分会动脉粥样硬化和冠心病学组
1 背景
近年来,随着循证医学和介入性心脏病学的迅速发展,冠状动脉微血管疾病(coronary microvascular disease, CMVD)的临床意义日益受到人们的高度重视。虽然在医学文献中出现CMVD的报道已有43年的历史,但有关此病的诊断和治疗建议一直未写入国际心血管病指南。2013年,欧洲心脏病学会稳定性冠状动脉疾病治疗指南中正式将此病列入冠心病的临床类型,并提出了初步的诊断和治疗建议[1]。但迄今为止,国际上尚无专门针对CMVD的指南或共识,我国临床医师对于此病的病因、发病机制、临床分型、诊断、治疗和预后等诸方面的认识仍有很多误区。鉴于此,2015年3月,中华医学会心血管病学分会组织基础研究学组、介入心脏病学组、女性心脏健康学组以及动脉粥样硬化和冠心病学组的专家,着手编写本共识。专家组在广泛搜集国内外文献的基础上,经过分工撰写、集体讨论、反复修改并认真征求10余位在CMVD领域具有较深造诣的资深专家的意见,最终完成了本文的定稿。尽管如此,专家组认为,CMVD是一个较新的研究领域,相关临床证据明显不足,本共识的内容仍然是粗略和初步的,希望本共识和建议对于该领域更加深入的基础和临床研究,能够起到引领和推动作用。
2 CMVD的定义和流行病学
CMVD是指在多种致病因素的作用下,冠状前小动脉和小动脉的结构和(或)功能异常所致的劳力性心绞痛或心肌缺血客观证据的临床综合征。1973年,Kemp HG首次将此病命名为X综合征(syndrome X),1985年,Cannon RO将此病命名为微血管性心绞痛(microvascular angina), 2007年,Camici PG将此病命名为微血管功能异常(microvascular dysfunction), 2013年欧洲心脏病学会稳定性冠状动脉疾病治疗指南中正式将此病命名为微血管功能异常[1]。本专家组认为,微血管功能异常一词未能涵盖本病的微血管结构异常,因此建议命名为CMVD。
目前尚无大样本人群的CMVD的流行病学资料。以往小样本的临床研究显示,在具有心肌缺血症状但冠状动脉造影显示非阻塞性病变的患者中,CMVD的发生率约为45%~60%。2012年欧洲一项包括11 223例稳定型心绞痛患者的7.5年随访研究显示,入院时近1/3的男性和2/3的女性患者冠状动脉造影未发现阻塞性冠状动脉疾病,但无论在男性或女性,冠状动脉造影显示正常和非阻塞性冠状动脉病变患者的主要心血管事件和全因死亡率显著高于对照人群[2],研究者推测,CMVD可能是导致这些患者不良预后的重要原因。2014年发表的一项研究发现,在无冠心病病史和无正电子发射型计算机断层显像(positron emission computed tomography,PET)心肌灌注显像异常的405例男性和813例女性患者中,以PET测量的冠状动脉血流储备(coronary flow reserve, CFR)<2作为判定标准, CMVD的发生率男性为51%,女性为54%, 且CFR<2是不良心血管事件的独立预测因素[3]。因此, CMVD的检出和治疗具有十分重要的临床意义。
3 CMVD的病理生理学
3.1 冠状动脉微血管的结构和功能: 冠状动脉包括三个节段:(1)心外膜下冠状动脉:血管内径0.5 mm~5 mm,主要功能是担负血流传导。(2)前小动脉:血管内径约为0.1 mm~0.5 mm,主要功能是当心外膜冠状动脉灌注压或血流量发生改变时,通过血管舒缩稳定冠状小动脉的压力,其中近端前小动脉对于压力的变化敏感而远端前小动脉对于流量的变化敏感。(3)小动脉:血管内径< 0.1 mm,主要功能是根据心肌代谢的需求调节血管张力和血流量。前小动脉和小动脉构成了冠状动脉微血管[4]。
3.2 CFR: 1974年Gould KL首次提出CFR的概念,CFR是指冠状动脉接近最大程度扩张时,冠状动脉血流量(coronary blood flow,CBF)或心肌血流量(myocardial blood flow,MBF)与静息状态下相应指标的比值,是测量整个冠状动脉系统储备功能的整体指标。CFR的大小受到4个因素的影响:静息状态的冠状动脉血流量(静息状态血流量增大可使CFR降低)、单位体积心肌内阻力血管的横截面积(管壁增厚可使CFR降低)、冠状动脉血管外的压力(室壁张力增加可使CFR降低)和冠状动脉灌注压(血压下降可使CFR降低)[5]。
3.3 冠状动脉微血管的结构异常: 冠状动脉微血管结构异常常见于肥厚型心肌病和高血压病,表现为室壁间小动脉由于平滑肌细胞肥厚和胶原沉积所致的中膜肥厚,常伴有内膜增厚,从而导致小动脉管腔面积的轻度缩小。
3.4 冠状动脉微血管的功能异常:(1)内皮细胞依赖性血管舒张异常:常见于糖尿病、肥胖、吸烟以及其他心血管疾病危险因素携带者,主要机制是一氧化氮(NO)的产生和释放异常。(2)内皮细胞非依赖性血管舒张异常:主要机制是血管活性物质通过刺激血管平滑肌细胞膜受体和细胞内信号通路而产生的血管舒张异常。(3)微血管缩窄:某些血管活性物质可导致微血管弥漫性缩窄和心肌缺血而对心外膜冠状动脉无影响。(4)微血管栓塞:冠状动脉微循环的血管内栓塞可由斑块碎片、微栓子或嗜中性粒细胞-血小板聚集物所产生。(5)血管外机制:可见于左心室舒张压明显升高的疾病如左心室肥厚、左心室纤维化等,以及可直接降低冠状动脉舒张压的疾病如主动脉瓣狭窄、冠状动脉重度狭窄、前小动脉缩窄、低血压等。
4 CMVD的诊断技术
4.1 评价冠状动脉微血管功能的血管活性药物:冠状动脉微血管功能常通过检测冠状动脉微血管对血管扩张剂的反应来评估,常用的测量指标是冠状动脉微血管呈最大限度扩张时的冠状动脉血流量与基础状态下冠状动脉血流量的比值。血管扩张剂包括内皮非依赖性血管扩张剂(主要作用于血管平滑肌细胞)及内皮依赖性血管扩张剂(主要作用于血管内皮细胞)。临床上常用的冠状动脉舒张剂:
腺苷:腺苷是最常用的检测冠状动脉微血管功能的非内皮依赖性舒张血管的药物,静脉注射剂量140 μg/(kg·min),冠状动脉内注射剂量2~16 μg/(kg·min),注射时间1.5~6.0 min。常见的不良反应有房室传导阻滞或窦房阻滞导致的心动过缓及支气管痉挛。腺苷的半衰期很短,仅为10 s,不良反应可很快消失[6]。
双嘧达莫:此药通过抑制腺苷降解而发挥作用,故药理作用类似于腺苷。静脉注射剂量0.56~0.84 mg/kg。应用腺苷或双嘧达莫后CFR<2.5提示冠状动脉微血管舒张功能异常[7],临床上推荐CFR<2.0作为判断微血管功能障碍的临界值[8]。
乙酰胆碱:是最常用的检测内皮依赖性冠状动脉微血管功能的舒张血管的药物,但需要冠状动脉内注射。乙酰胆碱具有双重作用:(1)通过刺激内皮细胞释放NO扩张血管。(2)通过结合毒蕈碱样乙酰胆碱受体刺激平滑肌细胞收缩血管。在内皮功能正常的情况下,乙酰胆碱的血管扩张作用占主导地位,但如出现内皮功能异常,乙酰胆碱的血管收缩作用占有优势,从而可导致血管痉挛。2010年日本循环器学会和2013年欧洲心脏病学会推荐的乙酰胆碱注射方法是:将乙酰胆碱溶于5 ml 37℃的生理盐水中,通过导管冠状动脉内剂量递增式注射,每次注射时间应长于20 s,两次注射间隔5 min。左冠状动脉内注射剂量分别为20、50、100 μg,右冠状动脉内注射剂量分别为20、 50 μg[1,9]。我国学者的研究表明,采用10、30、60 μg的冠状动脉内注射乙酰胆碱递增剂量,每次间隔3 min,可满足诊断需要亦可减少并发症[10]。每次注射乙酰胆碱1 min后,应立即进行冠状动脉造影,利用定量造影法测量冠状动脉直径以明确有无心外膜下冠状动脉痉挛,同时观察心绞痛症状和心电图变化。如注射后未见心外膜下冠状动脉痉挛但出现心绞痛症状和缺血型ST-T改变,可诊断为CMVD,同时应立即冠状动脉内注射硝酸甘油或尼可地尔以对抗冠状动脉微血管痉挛。
4.2 评价冠状动脉微血管功能的无创伤性技术
4.2.1 经胸超声冠状动脉血流显像(transthoracic Doppler echocardiography,TTDE):利用这一技术可测量心外膜冠状动脉血流速度,后者与CBF正相关[11]。应用现代的彩色多普勒技术,可在>90%患者中清晰显示左前降支(LAD)远端的血流,如静脉注射声学造影剂,LAD血流显像成功率接近100%[12]。后降支血流显像的成功率为54%~86%,左旋支血流显像的成功率则更低。在记录到静息状态下LAD舒张期流速后,静脉注射腺苷或双嘧达莫,测量冠状动脉最大充血状态下的LAD舒张期流速,然后可计算得出CFR,即冠状动脉充血状态下舒张期峰值或平均流速与冠状动脉静息状态下相应测值的比值。研究发现,TTDE的 CFR测值与冠状动脉内多普勒测量的CFR具有良好的一致性。在确诊和疑诊的冠心病患者中,TTDE测量的LAD的CFR >2.17时提示预后良好[13]。
TTDE评价冠状动脉微血管功能的优点为无创、省时、可床旁检查、花费较低和可重复测量等,但有其限制性:仅在评价LAD的微血管功能时具有较好的可靠性,并非所有患者都能获得满意的超声窗,超声医生必须具有操作经验。
4.2.2 单光子发射计算机断层成像术(single-photon emission computed tomography,SPECT):这一技术利用201铊或99m鍀标记的示踪剂,记录静息和负荷状态下心肌中的放射活性,进而可发现两种状态下的节段性心肌灌注减低、灌注缺损或灌注再分布征象,在心外膜下冠状动脉无明显狭窄的情况下,有助于诊断CMVD所致的心肌缺血。这一技术的优点是有较高的诊断敏感性和阴性预测价值,其缺点是无法定量测定CFR、空间分辨率低和放射性损伤。
4.2.3 PET:这一技术采用静脉注射的放射性核素标记的示踪剂,可连续监测血液循环及心肌中的放射活性,通过记录心肌摄取核素动态变化的左心室腔和心肌的时间-放射活性曲线,可准确计算出每克心肌每分钟单位体积的血流量[MBF,ml/(min· g)]。心肌负荷增加时心肌耗氧量增加,MBF会增加3~4倍,在冠状动脉微循环功能异常时,MBF不能随需求而增加,出现供求失衡,从而导致心肌缺血。使用血管扩张剂使冠状动脉充分扩张状态下的MBF与测定静息状态下MBF的比值即为CFR。心外膜冠状动脉的明显狭窄可导致CFR下降,但如冠状动脉造影未见明显狭窄,CFR减少则反映了冠状动脉微循环功能异常。研究结果显示,在冠心病患者中,如CFR<2则10年内主要不良心血管事件发生率和心血管死亡率增加[14]。新一代的3D PET成像提供了更高的空间分辨率,降低了辐射剂量[15]。
PET的优点是可测量静息和充血状态下的MBF,能对整个心脏及局部心肌的微血管功能状态进行评价。其限制性是:耗时、花费高、技术要求高、不能反复测量、空间分辨率低以及放射性损伤[16]。
4.2.4 心脏磁共振成像(cardiovascular magnetic resonance,CMR):这一技术通过心肌与血池信号对比或者注射顺磁性造影剂引起的信号强度改变来评价冠心病确诊或疑诊患者的心肌缺血和微血管阻塞状况。
在T1加权像中,正常心肌显示随钆造影剂首过信号强度均匀上升,如存在微循环障碍,缺血部位信号强度上升速度较邻近心肌节段延迟,从而表现为肉眼可见的相对低信号区域,也可以通过绘制感兴趣区域的强度曲线,测量静息及充血状态的MBF[ml/(min· g)][17]。
腺苷负荷状态下的CMR心肌灌注成像,对于已知或可疑冠心病的患者具有较好的诊断价值[18]。在心肌梗死患者,CMR可以有效鉴别再灌注后冠状动脉微血管阻塞(coronary microvascular obstruction,CMVO),表现为两种形式:在T1加权像中,钆造影剂注入后滞留在梗死区域,形成与正常洗脱造影剂的存活心肌之间的信号对比以及高信号梗死心肌中的低信号区域;在部分患者,微血管完整性遭到破坏,血红蛋白进入心肌内引起T2弛豫时间的缩短,形成T2加权像明亮区域中的低信号区域[19]。
CMR的优点是空间分辨率较高、无离子辐射危险、无信号衰减、可同时检测心肌功能、组织形态、心肌水肿和心肌灌注,能准确评价心内膜及心外膜下的心肌灌注、冠状动脉阻力及舒张期充盈时间,已逐渐成为无创评价心肌病变的金标准。这一技术的主要限制性是钆造影剂在肾功能不全患者中引起的不良反应。
4.3 评价冠状动脉微血管功能的创伤性技术
4.3.1 选择性冠状动脉造影:这一方法可从心外膜冠状动脉显影速度和心肌显影速度两个方面评价冠状动脉微血管功能。心外膜冠状动脉显影速度的评价指标包括两种方法:(1)心肌梗死溶栓治疗临床试验(TIMI)血流分级:TIMI(0~3级)广泛地用于评价心外膜下冠脉血流的通畅状态,但仅为半定量分析指标[20]。(2)TIMI血流计帧法 (TIMI frame count,TFC):TFC测量从冠状动脉开始显影至标准化的远端标记显影所需的帧数,虽然克服了TIMI血流分级半定量分析的缺点,但仍不能直接反映微血管的血流状态[21]。
心肌显影速度的评价指标包括三种方法:(1)TIMI心肌显影分级(TIMI myocardial blush grading,TMBG):分析造影剂进入心肌组织后心肌出现毛玻璃样显影的持续时间,据此分为0~3级,可作为反映冠状动脉微循环灌注状态的半定量指标[22]。(2)心肌显影密度分级(myocardial blush grade,MBG):分析造影剂进入心肌组织后心肌显影密度的改变,然后分为0~3级,可作为反映冠状动脉微循环灌注状态的半定量指标[23]。(3) TIMI心肌灌注帧数(TMPFC):我国学者提出的这一指标,系测量从造影剂进入心肌至排空所需的帧数,可定量评价经皮冠状动脉介入术(PCI)后即刻心肌的再灌注水平[24]。研究表明,TMPFC延长可预测PCI后MRI钆显像所定义的微血管阻塞[25]。
选择性冠状动脉造影技术的优点是在PCI后可对微血管功能即刻评价,技术可行,分析简便,但这些基于血流显影速度的指标均受到冠状动脉灌注压和心率的影响,且不能反映冠状动脉血流储备。
4.3.2 温度稀释法:这一技术基于Fick法原理,将已知温度和注射速率的冷盐水由导管注入冠状静脉窦,在导管下游测量血液的温度,血液温度下降的幅度表明示踪剂稀释的程度,与CBF成正比,由此可推算CBF。由温度稀释曲线可记录到生理盐水离开指引导管至导丝传感器的时间,即平均传导时间(mean transit time,T), T值与CBF成反比,记录基线状态和充血状态时的T值之比即为CFR(T基础/ T充血)[26]。研究证实了温度稀释法与冠状动脉内多普勒测量的CFR具有良好的相关性。
冠状动脉微血管阻力指数(index of microvascular resistance,IMR)是近年来提出的评价冠状动脉狭窄病变远端微血管功能的新指标,IMR定义为冠状动脉充血状态下狭窄病变远端的压力Pd除以1/T,即压力与流量的比值,Pd和T可用带有温度感受器的压力导丝来测量。对比研究表明,目前临床上所广泛采用的评价冠状动脉狭窄病变功能意义的血流储备分数(fractional flow reserve, FFR)受到狭窄病变本身及其远端侧枝循环和微血管阻力的影响,而IMR可特异性地评价狭窄病变远端的微血管功能,可准确预测急性心肌梗死再灌注治疗后的心肌组织灌注水平、心室重构及心功能的恢复[27,28],但IMR测值与心血管事件的关系尚不明了,需要大样本和多中心的随访研究来确定IMR的合理界限值。
温度稀释法的主要限制性有:Pd和T测值受到压力、温度、盐水注射剂量和速度、盐水与血液混合不匀等因素的影响,因而测值有一定变异。
4.3.3 冠状动脉内多普勒血流导丝:冠状动脉内多普勒血流导丝技术是评价冠状动脉微血管功能的可靠方法。这一技术应用多普勒血流速度描记仪及其配套的多普勒导丝,经动脉插管至冠状动脉远端,记录血流频谱,然后冠状动脉内注入腺苷,测量充血状态下的冠状动脉血流速度[29]。计算充血状态和基础状态的舒张期冠状动脉血流速度即可得出CFR。联合应用压力导丝,还可得出冠状动脉微血管阻力(coronary microvascular resistance, CMR),计算方法为:CMR=Pd/DFV,其中Pd为冠状动脉远端的压力,DFV为冠状动脉舒张期血流速度。CMR的临床价值和限制性同IMR。
冠状动脉内多普勒血流导丝技术的主要优点是可准确地测量各条冠状动脉内的血流速度、CFR和CMR,其缺点是血流速度受到导丝在管腔中的位置、管腔中的流速分布、注射血管扩张剂后管腔面积的变化等因素的影响。
临床研究表明,在上述评价冠状动脉微血管功能的技术中,PET或冠状动脉内多普勒测量的CFR以及冠状动脉内注射乙酰胆碱的激发试验可预测CMVD患者的心血管事件,二者结合可全面评价冠状动脉微血管功能,其他技术和指标与CMVD心血管事件的关系尚不明了,有待进一步研究。
临床上常用的冠状动脉微血管功能评价的技术比较见表1[30]。
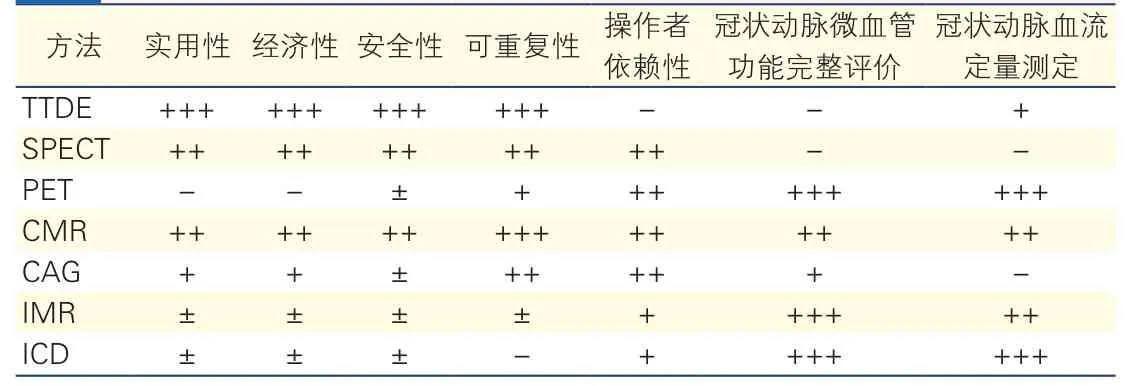
表1 冠状动脉微血管功能评价的技术比较[30]
【专家建议一】
(1)在临床疑诊CMVD的患者,在排除心外膜下冠状动脉狭窄和痉挛病变后,应首先采用静脉注射腺苷或双嘧达莫的方法并选用TTDE、CMR或PET等无创性影像技术测量CFR,目前PET是测量CFR的无创性技术金标准。(2)在上述患者中,如无创性技术测量的CFR ≥ 2.0,可在冠状动脉注射腺苷前后,采用冠状动脉内多普勒血流导丝技术测量CFR和CMR,目前冠状动脉内多普勒血流导丝是测量CFR的创伤性技术金标准。(3)如临床疑诊CMVD但冠状动脉内多普勒血流测量的CFR≥2.0, 应选择冠状动脉内注射乙酰胆碱的方法,如心外膜下冠状动脉无痉挛但出现心绞痛症状和缺血型ST-T改变,可诊断为CMVD,同时应立即冠状动脉内注射硝酸甘油或尼可地尔对抗冠状动脉微血管的痉挛。
5 CMVD的分类和临床表现
按照CMVD的不同病因,本专家组将CMVD分为以下3种类型:不合并阻塞性冠状动脉疾病的CMVD、合并阻塞性冠状动脉疾病的CMVD以及其他类型的CMVD。
5.1 不合并阻塞性冠状动脉疾病的CMVD
危险因素:此类CMVD又称为原发性微血管心绞痛,常伴有动脉粥样硬化的多种危险因素如糖尿病、高血压、高脂血症、吸烟、慢性炎症等,这些危险因素可通过内皮细胞依赖性和非依赖性机制导致微血管功能异常,表现为冠状动脉CFR降低和微血管收缩[31]。女性围绝经期雌激素缺乏是女性微血管病变的主要发病机制之一。类似于一般冠心病心绞痛的分类,原发性微血管心绞痛可分为稳定型和不稳定型两个类型。
5.1.1 原发性稳定型微血管心绞痛:(1)定义:原发性稳定型微血管心绞痛是指临床表现为劳力性稳定型心绞痛并伴有冠状动脉微血管功能异常的实验室证据,同时排除心外膜下阻塞性冠状动脉病变或其他心血管疾病的综合征。(2)临床表现:主要症状是劳力相关的胸痛发作,很难与严重冠状动脉狭窄患者的胸痛症状相区分,但以下特点提示CMVD的可能性:①女性多见,约占CMVD患者的56%~79%[32],多数发生在绝经期后;②胸痛绝大多数系劳力诱发,单纯表现为静息性胸痛的冠状动脉微血管病患者较少;③单次胸痛持续时间较长,半数以上超过10 min,停止运动后胸痛症状仍持续数分钟;④胸痛发作时含服硝酸甘油效果不佳甚至恶化。(3)诊断:原发性微血管稳定型心绞痛的诊断需要具备以下几点:①主要或仅由劳力诱发的典型心绞痛症状,胸痛持续时间常大于10 min,硝酸甘油治疗效果不佳;②具有如下至少一项心肌缺血的客观证据但负荷超声心动图检查无节段性室壁运动异常:自发或劳力诱发的典型胸痛伴随心电图ST段压低、心肌负荷SPECT示可逆性的心肌灌注缺损、多普勒超声或CMR检查发现负荷相关的CFR减低(<2.0)、CMR或PET检查发现有心肌缺血的代谢性证据;③冠状动脉造影正常、接近正常、管壁不规则或小于20%以下的管腔狭窄;④如临床高度疑诊CMVD但CFR≥ 2.0,可在严密监护下冠状动脉内注射乙酰胆碱进行激发试验,如心外膜下冠状动脉无痉挛但出现心绞痛症状和心电图缺血型ST-T改变可确诊CMVD;⑤排除非心原性胸痛和其他心脏疾病如变异性心绞痛、心肌病、心肌炎或瓣膜病。(4)预后:虽然以往小样本的临床研究显示CMVD患者的预后良好[33],但近年大样本人群的长期随访研究证明,CMVD患者的主要心血管事件和全因死亡率显著高于对照人群,表明这些患者的早期诊断和正确治疗具有重要的临床意义。
[专家建议二】
原发性稳定型微血管心绞痛的建议诊断标准:(1)典型劳力性心绞痛症状但硝酸甘油疗效不佳。(2)静息或负荷状态下心肌缺血的客观证据(ST段压低、心肌灌注缺损或心肌代谢产物增多)但无节段性室壁运动异常。(3)无创或创伤性影像技术测量的CFR< 2.0。(4)冠状动脉造影或冠状动脉计算机断层摄影检查无明显心外膜下冠状动脉狭窄(<20%)。(5)排除非心原性胸痛和其他心脏疾病。此5点为诊断原发性稳定型微血管心绞痛的必备条件。如其他条件均具备但影像技术测量的CFR≥ 2.0,可行冠状动脉内注射乙酰胆碱的激发试验,如心外膜下冠状动脉无痉挛但出现心绞痛症状和心电图缺血型ST-T改变,可确诊原发性稳定型微血管心绞痛。
5.1.2 原发性不稳定型微血管心绞痛:(1)定义: 原发性不稳定型微血管心绞痛是指临床表现为不稳定型心绞痛或非ST段抬高型急性心肌梗死并伴有冠状动脉微血管功能异常的实验室证据,同时排除心外膜下阻塞性和痉挛性冠状动脉病变、一过性冠状动脉血栓形成、心肌病变或其他心血管疾病的综合征。(2)临床表现:主要临床表现为反复发生的胸痛,常出现在静息状态,相当一部分患者可于凌晨痛醒,亦可表现为轻度体力活动后的胸痛,但诱发心绞痛的体力活动阈值不恒定,胸痛持续时间可长达1~2 h,含服硝酸甘油无效。胸痛发作时或Holter监测可记录到心电图缺血型ST-T改变并呈动态演变。5%~10%非ST段抬高型急性冠状动脉综合征患者虽有急性胸痛但冠状动脉造影正常或接近正常,女性患者这一比例可高达30%[34],微血管心绞痛是导致这些患者症状的重要原因。(3)诊断:患者有典型的不稳定性心绞痛或非ST段抬高型急性心肌梗死的症状,但硝酸甘油疗效不佳,心电图出现缺血型ST-T改变并呈现动态演变,可伴有血清肌钙蛋白水平轻度升高,冠状动脉造影正常或接近正常,乙酰胆碱激发试验心外膜下冠状动脉无痉挛但出现典型心绞痛和心电图缺血型ST-T改变,排除冠状动脉一过性血栓形成或急性心肌炎,可以诊断原发性不稳定型微血管心绞痛。(4)预后:回顾性研究显示,非ST段抬高型急性冠状动脉综合征患者合并冠状动脉正常或接近正常者,1年随访中死亡/心肌梗死和再次住院率分别是1.2%和8.4%,但其中原发性不稳定型微血管心绞痛所占的比例不明,因此此病的长期预后尚不明了。
【专家建议三】
原发性不稳定型微血管心绞痛的建议诊断标准:(1)患者有典型不稳定性心绞痛或非ST段抬高型急性心肌梗死症状但硝酸甘油疗效不佳。(2)心电图缺血型ST-T改变并呈动态演变,血清肌钙蛋白水平可有轻度升高。(3)冠状动脉造影检查无明显心外膜下冠状动脉狭窄。(4)冠状动脉内注射腺苷或静脉注射双嘧达莫测量CFR < 2.0。(5)排除冠状动脉痉挛、一过性血栓形成和急性心肌炎。此5点为诊断原发性不稳定型微血管心绞痛的必备条件。如其他条件均具备但影像技术测量的CFR≥ 2.0,可行冠状动脉内注射乙酰胆碱的激发试验,如心外膜下冠状动脉无痉挛但出现心绞痛症状和心电图缺血型ST-T改变,可确诊原发性不稳定型微血管心绞痛。
5.2 合并阻塞性冠状动脉疾病的CMVD
5.2.1 稳定型心绞痛: 当CMVD和心外膜下阻塞性冠状动脉病变共同导致稳定型心绞痛时,临床表现为:(1)心绞痛发作时间较长,诱发心绞痛的体力活动阈值变异较大,含服硝酸甘油无效。(2)心绞痛发作程度重于冠状动脉狭窄程度所预期的症状。(3)在成功的PCI后早期负荷试验仍呈阳性,提示存在CMVD,而晚期负荷试验阳性常提示存在再狭窄病变。(4)在PCI解除心外膜冠状动脉狭窄病变后,如CFR<2.0或冠状动脉内乙酰胆碱激发试验后心外膜下冠状动脉无痉挛但出现典型心绞痛和心电图缺血型ST-T改变,可确诊合并存在的CMVD[35]。
5.2.2 急性冠状动脉综合征:近年研究发现破裂斑块远端的微血管出现缩窄而非扩张,可能是由于斑块破裂后激活血小板,导致微栓塞或释放缩血管、促炎和促黏附因子,使微血管阻力升高,而抗血小板药物可改善微血管灌注[36]。因此,CMVD可能参与了急性冠状动脉综合征的发病机制。
5.2.3 急诊PCI后CMVD: 在接受直接PCI治疗的ST段抬高型急性心肌梗死患者中,如术后心外膜下冠状动脉再通但心肌再灌注未恢复,这种现象称为“无复流”(no-reflow)或CMVO,取决于不同的检测技术和人群, CMVO的发生率为5%~50%。发生CMVO的急诊PCI患者预后较差,表现为心肌梗死早期并发症、左心室重构、晚期心力衰竭住院率和死亡率的升高[37]。下列情况提示存在CMVO:(1)PCI后TIMI血流分级0~2级。(2)PCI后TMPG 0~2级。(3)术后90 min心电图ST段上抬幅度的回降<50%。(4)出院前SPECT显示心肌局部无灌注区,MRI显像显示钆首次通过灌注缺损或钆延迟显像增强。此外,在因急性冠状动脉综合征或大隐静脉旁路移植术后再狭窄而接受PCI治疗的患者中,受压斑块的粥样物质流向远端可引起微栓塞和小范围心肌坏死。研究表明,在成功的PCI后心肌坏死标记物轻度升高的患者心血管事件的发生率显著升高。
【专家建议四】
(1)在阻塞性冠状动脉病变所导致稳定型心绞痛的患者,如心绞痛发作时间较长、发作程度较重、诱发心绞痛的体力活动阈值变异较大且舌下含服硝酸甘油无效,应考虑到合并CMVD的可能性。(2)在PCI治疗解除心外膜冠状动脉狭窄病变后,如注射腺苷或双嘧达莫后测量的CFR<2.0或冠状动脉内注射乙酰胆碱后心外膜下冠状动脉无痉挛但出现典型心绞痛和心电图缺血型ST-T改变,可诊断合并阻塞性冠状动脉病变的CMVD。(3)在接受直接或择期PCI后的患者,如TIMI血流分级<3级和(或)TMPG <3级,应考虑CMVO的可能性。(4)PCI后出院前SPECT显像显示心肌局部无灌注区或MRI显像显示心肌灌注缺损或钆延迟显像增强,可诊断为CMVO。
5.3 其他类型的CMVD
近年研究表明,在应激性心肌病(Takotsubo心肌病)、肥厚型心肌病、扩张型心肌病、心肌炎、主动脉瓣狭窄、Anderson-Fabry病、心肌淀粉样变性的患者中,存在着CMVD的临床表现和实验室证据,提示CMVD参与了这些疾病的发病机制,但CMVD与这些心肌和瓣膜疾病的预后关系尚不明了,目前亦缺乏针对这些CMVD的特异性的治疗方法。
6 CMVD的治疗
目前,文献中尚无以CMVD为研究对象并以心血管事件为观察终点的大样本随机临床试验,因此何种治疗能够降低CMVD的心血管事件率尚不明了。尽管如此,文献中已有以CMVD为研究对象并以冠状动脉微血管功能为终点的小样本随机临床研究或非随机观察研究[38],本专家组将依据这些小样本的替代终点研究初步推荐可能获益的治疗方法。
6.1 不合并阻塞性冠状动脉疾病的CMVD治疗
6.1.1 原发性稳定型微血管心绞痛的治疗:(1)危险因素的控制:高血压患者首选血管紧张素转化酶抑制剂(ACEI)和血管紧张素受体阻滞剂(ARB)治疗,奈比洛尔和卡维地洛也可改善冠状动脉微血管功能[39]。高胆固醇血症患者建议应用他汀类调脂药物,口服降糖药或应用胰岛素控制血糖可改善冠状动脉微血管内皮功能。肥胖患者还可通过减轻体重改善CFR[40]。(2)抗心肌缺血的经典药物:一线治疗药物是β-受体阻滞剂或非二氢吡啶类钙离子拮抗剂,若效果欠佳可联合应用上述两种药物,若不能耐受β-受体阻滞剂可应用伊伐布雷定替代[41]。β-受体阻滞剂在交感兴奋性增强的患者中效果较好[42]。钙离子拮抗剂对以微血管痉挛为主的心绞痛疗效好,而增加CBF的效果较差。硝酸酯类药物对合并存在心外膜下冠状动脉狭窄和痉挛的患者效果好,但对单纯的CMVD含服硝酸甘油疗效较差。(3)抗心肌缺血的其他药物:尼可地尔是三磷酸腺苷(ATP)敏感性钾通道开放剂,在结构上属于硝酸盐类,可有效扩张心外膜下冠状动脉和冠状小动脉,随机和安慰剂对照的临床试验显示尼可地尔可改善心绞痛症状和心电图运动试验结果,因此尼可地尔应作为冠状动脉微血管心绞痛的首选推荐药物[43]。在小样本的CMVD患者的临床研究中,晚期钠通道阻滞剂雷诺嗪可显著改善心绞痛症状和左心室舒张功能、增加经胸超声或冠状动脉内多普勒测量的CFR[44,45]。初步的临床研究显示,窦房结起搏电流阻滞剂伊伐布雷定具有改善冠状动脉微血管心绞痛症状的作用。在高脂血症以及炎性活性和氧化应激水平增加的患者,他汀类药物治疗可改善血管内皮功能和心肌缺血症状。此外,ACEI可改善CMVD患者的心绞痛症状。
6.1.2 原发性不稳定型微血管心绞痛的治疗:初步研究证实,T型钙离子通道阻滞剂咪贝拉地尔(mibefradil)可改善原发性不稳定型微血管心绞痛患者的心绞痛症状和冠状动脉微血管功能,可作为一线治疗[46]。在少数微血管痉挛所致ST段上抬和心绞痛(微血管“变异型心绞痛”)的患者,Rho激酶抑制剂法舒地尔(fasudil)可抑制乙酰胆碱诱发的微血管痉挛,减少心绞痛发作。
【专家建议五】
(1)对于原发性稳定型微血管心绞痛的治疗,首先应控制动脉粥样硬化的危险因素,然后可选用β-受体阻滞剂、钙离子拮抗剂、尼可地尔、伊伐布雷定、雷诺嗪和ACEI控制心绞痛症状。(2)对于原发性不稳定型微血管心绞痛的治疗,可选用咪贝拉地尔和法舒地尔治疗。(3)需要开展大样本、随机、双盲、以心血管事件为观察终点的临床研究,以明确原发性CMVD的最佳治疗方法。
6.2 合并阻塞性冠状动脉疾病的CMVD的治疗
ST段抬高型急性心肌梗死合并CMVO的预防和治疗:(1)术前预防:积极控制高胆固醇血症和高血糖可能有助于减轻此类患者的CMVO病变程度。应避免影响缺血预处理的有害物质如磺脲类药物和高浓度酒精。研究发现,与二甲双胍相比,磺脲类药物与心血管事件的发生明显相关,这可能与磺脲类药物对缺血预处理有抑制作用有关[47]。一些机械方法已用于预防PCI后的远端栓塞,包括介入治疗过程中的远端闭塞球囊、远端滤网以及血栓抽吸,虽然已有的随机临床研究未能证明这些方法减低心血管事件的疗效,但在接受直接PCI治疗的ST段抬高型急性心肌梗死患者,如冠状动脉血栓负荷较重,血栓抽吸术可能有助于改善心肌微循环和再灌注[48]。在大隐静脉桥血管介入术中应用远端和近端保护装置可显著降低围手术期心肌梗死的发生率[49,50]。(2)药物治疗:①血小板糖蛋白IIb/IIIa受体拮抗剂:已有的随机临床试验和汇总分析研究证实,在血栓负荷较大的ST段抬高型急性心肌梗死而接受直接PCI的患者,冠状动脉内使用血小板糖蛋白IIb/IIIa受体拮抗剂,可能通过改善CMVO而减小梗死面积、改善心肌灌注、减少再梗死率和死亡率[51], 因而目前的欧美指南已推荐在高危的急性心肌梗死患者中使用血小板糖蛋白IIb/IIIa受体拮抗剂;②腺苷:随机临床研究显示,ST段抬高型急性心肌梗死早期(<3~4 h)患者冠状动脉内大剂量使用腺苷可改善CMVO,但近期汇总分析显示,与安慰剂相比,腺苷未能降低患者的远期死亡风险[52],故仍需大规模研究进一步证实其临床获益;③钙通道阻滞剂:非随机的观察性研究表明,ST段抬高型急性心肌梗死合并CMVO的患者,冠状动脉内使用维拉帕米或地尔硫可改善TIMI血流,但对于长期预后的影响尚不明确;④尼可地尔:在小样本的ST段抬高型急性心肌梗死患者的临床试验中,尼可地尔可改善CBF、局部室壁运动和梗死区大小,减少无复流现象的发生[53],但对于患者长期预后的影响尚不明了;⑤硝普钠:研究表明,冠状动脉内注射硝普钠可显著扩张冠状动脉微血管,改善心肌微循环[54];⑥山莨菪碱:我国学者的研究表明[55,56],冠状动脉内注射山莨菪碱可增加冠状动脉血流,改善心肌灌注,有效逆转冠状动脉无复流现象。冠状动脉内联合应用地尔硫和山莨菪碱可进一步改善心肌灌注,减少低血压及缓慢性心律失常的发生[57];⑦前列地尔:研究提示,直接PCI前应用前列地尔,可显著降低TFC,增加TMBG,减少慢血流现象的发生,改善心功能[58];⑧曲美他嗪:研究显示,血管再通前30 min口服负荷量曲美他嗪可显著降低术后血清肌钙蛋白水平[59],但这一作用还需更多的临床研究加以证实;⑨综合疗法:我国学者的研究表明,在接受直接PCI治疗的ST段抬高型急性心肌梗死患者中,术前口服大剂量阿托伐他汀、术中使用血栓抽吸、血小板糖蛋白IIb/IIIa受体拮抗剂和冠状动脉注射腺苷,可显著降低无复流的发生率和术后6个月心血管事件的发生率[60];⑩中药治疗:我国学者的研究表明, ST段抬高型急性心肌梗死患者直接PCI前服用负荷剂量的通心络可显著减少术中无复流的发生率和术后6个月心肌梗死面积,但对术后心血管事件无明显影响[61]。(3)缺血适应:缺血预适应(ischemic preconditioning)是指在冠状动脉病变支架置入术前,首先使用球囊多次、短时阻塞冠状动脉,造成短暂性心肌缺血,诱导机体对PCI后缺血再灌注损伤的保护作用。缺血后适应(ischemic postconditioning)是指在冠状动脉支架置入术后,在梗死相关动脉使用球囊多次反复阻塞冠状动脉,造成短暂性心肌缺血,进而诱导机体对PCI后缺血再灌注损伤的保护作用。远隔缺血预处理(remote ischemic preconditioning)是指在ST段抬高型急性心肌梗死患者中,利用袖带在上肢多次充气和放气,导致上肢短暂缺血,局部产生心肌缺血保护物质,从而增加心肌存活的作用。初步临床研究表明,这三种缺血适应方法均可有效改善心肌灌注、减少心肌梗死标志物的释放、缩小梗死区面积,但这些疗法对于临床长期预后的影响尚不明确。
【专家建议六】
(1)在接受直接PCI治疗的ST段抬高型急性心肌梗死患者,如冠状动脉血栓负荷较重可使用血栓抽吸术;在大隐静脉桥血管介入术中可使用远端和近端保护装置,以减少无复流的发生。(2)在接受直接PCI治疗的ST段抬高型急性心肌梗死患者,术前或术中应用血小板糖蛋白IIb/IIIa受体拮抗剂、腺苷、尼可地尔、维拉帕米、地尔硫、硝普钠、山莨菪碱、前列地尔、曲美他嗪、通心络等药物可降低CMVO的发生率。(3)在接受直接PCI治疗的ST段抬高型急性心肌梗死患者,可采用缺血预适应、后适应或远隔预适应改善心肌灌注。(4) 应开展随机临床研究进一步检验上述疗法对于直接PCI后患者长期预后的影响。
撰写专家:张运 陈韵岱 傅向华 陈文强 李丹丹 谷新顺季晓平 刘昱琪 李伟 黄东
审阅专家:高润霖 霍勇 葛均波 韩雅玲 沈卫峰 高炜杨跃进 吕树铮 何奔 向定成 周玉杰 张抒扬 袁祖贻
[1] Task Force Members, Montalescot G, Sechtem U, et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J, 2013, 34: 2949-3003.
[2] Jespersen L, Hvelplund A, Abildstrøm SZ, et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. Eur Heart J, 2012, 33: 734-744.
[3] Murthy VL, Naya M, Taqueti VR, et al. Effects of sex on coronary microvascular dysfunction and cardiac outcomes. Circulation, 2014, 129: 2518-2527.
[4] Chilian WM. Coronary microcirculation in health and disease. Summary of an NHLBI workshop. Circulation, 1997, 95: 522-528.
[5] Hoffman JI. A critical review of coronary reserve. Circulation, 1987, 75: 6-11.
[6] Webb CM, Collins P, Di Mario C. Normal coronary physiology assessed by intracoronary Doppler ultrasound. Herz, 2005, 30: 8-16.
[7] McGuinness ME, Talbert RL. Pharmacologic stress testing: experience with dipyridamole, adenosine, and dobutamine. Am J Hosp Pharm, 1994, 51: 328-346.
[8] Chareonthaitawee P, Kaufmann PA, Rimoldi O, et al. Heterogeneity of resting and hyperemic myocardial blood flow in healthy humans. Cardiovasc Res, 2001, 50: 151-161.
[9] JCS Joint Working Group. Guidelines for diagnosis and treatment of patients with vasospastic angina (coronary spastic angina) (JCS 2008): digest version. Circ J, 2010, 74: 1745-1762.
[10] Xiang DC, Gong ZH, He JX, et al. Dose protocols of acetylcholine test in Chinese. Chin Med J (Engl), 2004, 117: 1564-1566.
[11] Camici PG, d'Amati G, Rimoldi O. Coronary microvascular dysfunction: mechanisms and functional assessment. Nat Rev Cardiol, 2015, 12: 48-62.
[12] Lethen H, Tries HP, Kersting S, et al. Validation of noninvasive assessment of coronary flow velocity reserve in the right coronary artery. A comparison of transthoracic echocardiographic results with intracoronary Doppler flow wire measurements. Eur. Heart J, 2003, 24: 1567-1575.
[13] Takeuchi M, Ogawa K, Wake R, et al. Measurement of coronaryflow velocity reserve in the posterior descending coronary artery by contrast-enhanced transthoracic Doppler echocardiography. J Am Soc Echocardiogr, 2004, 17: 21-27.
[14] Ziadi MC, Dekemp RA, Williams KA, et al. Impaired myocardial flow reserve on rubidium-82 positron emission tomography imaging predicts adverse outcomes in patients assessed for myocardial ischemia. J Am Coll Cardiol, 2011, 58: 740-748.
[15] Danad I, Raijmakers PG, Appelman YE, et al. Coronary risk factors and myocardial blood flow in patients evaluated for coronary artery disease: a quantitative [15O]H2O PET/CT study. Eur J Nucl Med Mol Imaging, 2012, 39: 102-112.
[16] Titterington JS, Hung OY, Wenger NK. Microvascular angina: an update on diagnosis and treatment. Future Cardiol, 2015, 11: 229-242.
[17] Cheng AS, Pegg TJ, Karamitsos TD, et al. Cardiovascular magnetic resonance perfusion imaging at 3tesla for the detection of coronary artery disease: a comparison with 1.5-tesla. J Am CollCardiol, 2007, 49: 2440-2449.
[18] Petersen SE, Jerosch-Herold M, Hudsmith LE, et al. Evidence for microvascular dysfunction in hypertrophic cardiomyopathy: new insights from multiparametric magnetic resonance imaging. Circulation, 2007, 115: 2418-2425.
[19] Motwani M, Jogiya R, Kozerke S, et al. Advanced cardiovascular magnetic resonance myocardial perfusion imaging: high-spatial resolution versus 3dimensional whole-heart coverage. Circ Cardiovasc Imaging, 2013, 6: 339-348.
[20] The TIMI Study Group. The Thrombolysis in Myocardial Infarction (TIMI) trial. N Engl J Med, 1985, 312: 932-936.
[21] Gibson CM, Cannon CP, Daley WL, et al. TIMI frame count: a quantitative method of assessing coronary artery flow. Circulation, 1996, 93: 879-888.
[22] Molloi S, Ersahin A, Tang J, et al. Quantification of volumetric coronary blood flow with dual-energy digital subtraction angiography. Circulation, 1996, 93: 1919-1927.
[23] van 't Hof AW, Liem A, Suryapranata H, et al. Angiographic assessment of myocardial reperfusion in patients treated with primary angioplasty for acute myocardial infarction: myocardial blush grade. Zwolle Myocardial Infarction Study Group. Circulation, 1998, 97: 2302-2306.
[24] Ding S, Pu J, Qiao ZQ, et al. TIMI myocardial perfusion frame count: a new method to assess myocardial perfusion and its predictive value for short-term prognosis. Catheter Cardiovasc Interv, 2010, 75: 722-732.
[25] Ge H, Ding S, An D, et al. Frame counting improves the assessment of post-reperfusion microvascular patency by TIMI myocardial perfusion grade: Evidence from cardiac magnetic resonance imaging. Int J Cardiol, 2016, 203: 360-366.
[26] Pijls NH, De Bruyne B, Smith L, et al. Coronary thermodilution to assess flow reserve: validation in humans. Circulation, 2002, 105: 2482-2486.
[27] Fearon WF, Shah M, Ng M, et al. Predictive value of the index of microcirculatory resistance in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol, 2008, 51: 560-565.
[28] Ito N, Nanto S, Doi Y, et al. High index of microcirculatory resistance level after successful primary percutaneous coronary intervention can be improved by intracoronary administration of nicorandil. Circ J, 2010, 74: 909-915.
[29] 张梅, 张运. 冠状动脉内注射罂粟碱测量冠状动脉血流储备的研究. 中国超声医学杂志, 1998, 14: 14-16.
[30] Crea F, Lanza GA, Camici PG. Coronary microvascular dysfunction. Milan: Springer-Verlag Italia, 2014. 100.
[31] Sestito A, Lanza GA, Di Monaco A, et al. Relation between cardiovascular risk factors and coronary microvascular dysfunction in cardiac syndrome X. J Cardiovasc Med (Hagerstown), 2011, 12: 322-327.
[32] Rosano GM, Collins P, Kaski JC, et al. Syndrome X in women is associated with oestrogen def i ciency. Eur Heart J, 1995, 16: 610-614.
[33] Lamendola P, Lanza GA, Spinelli A, et al. Long-term prognosis of patients with cardiac syndrome X. Int J Cardiol, 2010, 140: 197-199.
[34] Bugiardini R, Manfrini O, De Ferrari GM. Unanswered questions for management of acute coronary syndrome: risk stratification of patients with minimal disease or normal findings on coronary angiography. Arch Intern Med, 2006, 166: 1391-1395.
[35] Fox K, Garcia MA, Ardissino D, et al. Guidelines on the management of stable angina pectoris: executive summary: The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J, 2006, 27: 1341-1381.
[36] Topol EJ, Yadav JS. Recognition of the importance of embolization in atherosclerotic vascular disease. Circulation, 2000, 101: 570-580.
[37] Brosh D, Assali AR, Mager A, et al. Effect of no-reflow during primary percutaneous coronary intervention for acute myocardial infarction on six-month mortality. Am J Cardiol, 2007, 99: 442-445.
[38] Crea F, Camici PG, Bairey Merz CN. Coronary microvascular dysfunction: an update. Eur Heart J, 2014, 35: 1101-1111.
[39] Xiaozhen H, Yun Z, Mei Z, et al. Effect of carvedilol on coronary flow reserve in patients with hypertensive left ventricular hypertrophy. Blood Press, 2010, 19: 40-47.
[40] Nerla R, Tarzia P, Sestito A, et al. Effect of bariatric surgery on peripheral flow-mediated dilation and coronary microvascular function. Nutr Metab Cardiovasc Dis, 2012, 22: 626-634.
[41] Mumma B, Flacke N. Current diagnostic and therapeutic strategies in microvascular angina. Curr Emerg Hosp Med Rep, 2015, 3: 30-37.
[42] Samim A, Nugent L, Mehta PK, et al. Treatment of angina and microvascular coronary dysfunction. Curr Treat Options Cardiovasc Med, 2010, 12: 355-364.
[43] Lanza GA, Parrinello R, Figliozzi S. Management of microvascular angina pectoris. Am J Cardiovasc Drugs, 2014, 14: 31-40.
[44] Tagliamonte E, Rigo F, Cirillo T, et al. Effects of ranolazine on noninvasive coronary flow reserve in patients with myocardial ischemia but without obstructive coronary artery disease. Echocardiography, 2015, 32: 516-521.
[45] Bairey Merz CN, Handberg EM, Shufelt CL, et al. A randomized, placebo-controlled trial of late Na current inhibition (ranolazine) in coronary microvascular dysfunction (CMD): impact on angina and myocardial perfusion reserve. Eur Heart J, 2016, 37: 1504-1513.
[46] Beltrame JF, Turner SP, Leslie SL, et al. The angiographic and clinical benefits of mibefradil in the coronary slow flow phenomenon. J Am Coll Cardiol, 2004, 44: 57-62.
[47] Tomai F, Crea F, Gaspardone A, et al. Ischemic preconditioning during coronary angioplasty is prevented by glibenclamide, a selective ATP-sensitive K channel blocker. Circulation, 1994, 90: 700-705.
[48] Lagerqvist B, Frobert O, Olivecrona GK, et al. Outcomes 1 year after thrombus aspiration for myocardial infarction. N Engl J Med, 2014, 371: 1111-1120.
[49] Baim DS, Wahr D, George B, et al. Randomized trial of a distal embolic protection device during percutaneous intervention of saphenous vein aorto-coronary bypass grafts. Circulation, 2002, 105: 1285-1290.
[50] Mauri L, Cox D, Hermiller J, et al. The PROXIMAL trial: proximal protection during saphenous vein graft intervention using the Proxis Embolic Protection System: a randomized, prospective, multicenter clinical trial. J Am Coll Cardiol, 2007, 50: 1442-1449.
[51] Zhu TQ, Zhang Q, Qiu JP, et al. Beneficial effects of intracoronary tirofiban bolus administration following upstream intravenous treatment in patients with ST-elevation myocardial infarction undergoing primary percutaneous coronary intervention: the ICT-AMI study. Int J Cardiol, 2013, 165: 437-443.
[52] Bulluck H, Sirker A, Loke YK, et al. Clinical benefit of adenosine as an adjunct to reperfusion in ST-elevation myocardial infarction patients: An updated meta-analysis of randomized controlled trials. Int J Cardiol, 2015, 202: 228-237.
[53] Sakata Y, Kodama K, Komamura K, et al. Salutary effect of adjunctive intracoronary nicorandil administration on restoration of myocardial blood flow and functional improvement in patients with acute myocardial infarction. Am Heart J, 1997, 133: 616-621.
[54] Zhao S, Qi G, Tian W, et al. Effect of intracoronary nitroprusside in preventing no reflow phenomenon during primary percutaneous coronary intervention: a meta-analysis. J Interv Cardiol, 2014, 27: 356-364.
[55] 蔚永运, 傅向华, 刘君, 等. 冠状动脉内注射山莨菪碱对急性心肌梗死经皮冠脉介入术后缓再血流现象的影响. 中国中西医结合杂志, 2008, 28: 295-299.
[56] Fu XH, Fan WZ, Gu XS, et al. Effect of intracoronary administration of anisodamine on slow reflow phenomenon following primary percutaneous coronary intervention in patients with acute myocardial infarction. Chin Med J (Engl), 2007, 120, 1226-1231.
[57] Peng Y, Fu X, Li W, et al. Effect of intracoronary anisodamine and diltiazem administration during primary percutaneous coronary intervention in acute myocardial infarction. Coron Artery Dis, 2014, 25: 645-652.
[58] Wei LY, Fu XH, Li W, et al. Effect of intravenous administration of liposomal prostaglandin E1 on microcirculation in patients with ST elevation myocardial infarction undergoing primary percutaneous intervention. Chin Med J (Engl), 2015, 128: 1147-1150.
[59] Minners J, van den Bos EJ, Yellon DM, et al. Dinitrophenol, cyclosporin A, and trimetazidine modulate preconditioning in the isolated rat heart: support for a mitochondrial role in cardioprotection. Cardiovasc Res, 2000, 47: 68-73.
[60] Zhou SS, Tian F, Chen YD, et al. Combination therapy reduces the incidence of no-reflow after primary per-cutaneous coronary intervention in patients with ST-segment elevation acute myocardial infarction. J Geriatr Cardiol, 2015, 12: 135-142.
[61] Zhang HT, Jia ZH, Zhang J, et al. No-reflow protection and long-term efficacy for acute myocardial infarction with Tongxinluo: a randomized double-blind placebo-controlled multicenter clinical trial (ENLEAT Trial). Chin Med J, 2010, 123: 2858-2864.
2016-11-28)
(编辑:宁田海)
张运 Email:zhangyun@sdu.edu.cn
R54
C
1000-3614(2017)05-0421-10
10.3969/j.issn.1000-3614.2017.05.003
