跨膜受体-整合素β5亚基在胃腺癌中低表达与预后的关系
2017-06-05郑国淀陈佳辉滕飞郑国威吕航程向东
郑国淀 陈佳辉 滕飞 郑国威 吕航 程向东*
跨膜受体-整合素β5亚基在胃腺癌中低表达与预后的关系
郑国淀 陈佳辉 滕飞 郑国威 吕航 程向东*
目的检测整合素β5(ITGB5)在胃癌中的表达情况,探讨其与胃癌发生发展的关系,以寻找胃癌新的诊断和治疗靶点。方法采用组织芯片技术构建包含101例胃癌组织和72例配对的癌旁组织共173点阵石蜡组织芯片,用免疫组化法检测该芯片中整合素β5的表达,分析其与胃癌临床病理及预后的关系。结果整合素β5在胃癌组织和癌旁组织高表达率分别为50.5%(51/101)和 94.4%(68/72),差异有统计学意义(χ2=37.82,P<0.001),低表达的整合素β5与肿瘤分化程度、淋巴结转移和临床分期有关(P<0.05),单因素分析显示低表达组的生存率比高表达组低,差异有统计学意义(P=0.003),并且COX风险模型中提示整合素β5是胃癌预后的独立危险因素(P=0.026)。结论整合素β5的低表达与胃癌发生发展有密切关系,可能是新的治疗靶点或预后评估指标。
胃癌 整合素β5 组织芯片 免疫组织化学
胃癌是病死率最高的恶性肿瘤之一[1]。尽管手术仍然是胃癌最主要的治疗方式,但是由于大部分胃癌发现时都已经处于进展期,因此多得不到令人满意的预后[2]。目前分子靶向药物对胃癌的治疗效果有限。因此,亟待寻找新的诊断及预后的肿瘤标志物和治疗靶点。整合素β5是一种重要的细胞粘附分子,其表达能力减弱使细胞间粘附能力降低,有利于癌细胞从原发部位脱落、转移,可能是促使肿瘤转移的原因之一[3]。已有研究显示整合素β5参与一些肿瘤的耐药、血管生成、上皮间质转换等作用[4-6],但其在胃癌中的研究仍然较少,因此本研究通过组织芯片(highdensity tissue microarrays,TMAs)以及免疫组化技术(immunohistochemistry,IHC)检测了整合素β5在胃癌组织和癌旁组织中的表达情况,分析其与胃癌临床病理因素及预后的关系,为今后的肿瘤治疗和预后评估提供借鉴意义。
1 临床资料
1.1 一般资料 浙江省肿瘤医院2008年8月至2011年3月的胃癌术后患者101例,均为腺癌,其中胃癌组织101例,癌旁组织72例,均经过病理确诊,胃癌患者未患有其它肿瘤,均为Ⅱ期和Ⅲ期患者,并且未经过放化疗等干预治疗。所有病例临床资料完整,包括年龄、性别、肿瘤大小、分化程度、静脉侵犯及TNM分期等。其中男75例,女26例;年龄31~80岁,平均年龄(61±10)岁;按分化程度不同分为高分化组11例、中分化组41例和低分化组49例;TNM分期:Ⅱ期25例,Ⅲ期76例。所有对象通过电话随访生存情况,随访终止日期2016年4月30日。
1.2 TMA芯片组制作 构建10×14点阵的组织芯片,包含101例胃癌组织和72例配对的癌旁组织共173点阵,对所制成芯片的所有组织(须有与其匹配的标记完成的HE片)进行点阵。根据标记,利用点阵仪对标记完成的组织进行打点取样,粘附于涂有多聚赖氨酸的载玻片上。每例胃癌标本和癌旁组织标本均取1个点。烤片6h,芯片制作完成。
1.3 免疫组织化学染色SP法染色 选用抗体:Integrin β5单克隆抗体(购自美国cell signaling technology公司),二抗为HRP标记的山羊抗兔鼠(购自丹麦DAKO公司)。主要染色步骤:(1)TMA切片常规脱蜡至水。(2)组织切片置于盛满柠檬酸抗原修复缓冲液(PH6.0)的修复盒中于微波炉内进行抗原修复。(3)3% H2O2阻断内源性过氧化物酶。(4)3%BSA室温封闭30min。(5)一抗4℃孵育过夜。(6)二抗室温孵育50min。(7)DAB显色。(8)复染细胞核。(9)脱水封片。
1.4 结果判定 整合素β5染色主要是细胞膜出现棕黄色颗粒为阳性染色,细胞浆及细胞核表达较少,根据阳性表达细胞数占肿瘤实质细胞的百分比区分表达等级:低表达(低)为阳性表达细胞数<25%,高表达(高)为阳性表达细胞数≥25%。
1.5 统计学方法 采用SPSS 17.0软件和prism 6.0进行统计学分析和作图,整合素β5在胃癌组织与癌旁组织中高表达率的比较及整合素β5与病理资料的相关性用连续矫正χ2检验(或者Fisher概率法),运用Kaplan-Meier和log rank方法进行单因素生存分析并绘制生存曲线,Cox回归分析法进行多因素生存分析。P<0.05为差异具有统计学意义。
2 结果
2.1 整合素β5在胃癌组织和癌旁组织中的表达情况 整合素β5蛋白主要表达于细胞胞膜,在胃癌及癌旁组织均有不同程度的表达(如图1A-D),显色为棕黄色颗粒,其高表达率分别为50.5%(51/101)和94.4%(68/72 ),因此整合素β5在癌旁组织中的表达高于胃癌组织,两者差异具有统计学意义(P<0.001),见表1。101例胃癌组织和72例(缺失2例)癌旁组织芯片染色所有结果见图1E。

表1 胃癌组织、癌旁组织中整合素β5的表达
2.2 整合素β5表达与胃癌临床病理参数之间的关系 101例胃癌组织整合素β5的表达与肿瘤分化程度、淋巴结转移和临床分期有关(P<0.05),而与性别、年龄、脉管侵犯、肿瘤大小、浸润深度均无相关性(P>0.05),见表2。


图1 A:整合素β5在胃癌组织中的表达(×100);B:整合素β5在癌旁组织中的表达(×100);C:整合素β5在胃癌组织中的表达(×400);D:整合素β5在癌旁组织中的表达(×400);E:(左)101例胃癌组织和72例癌旁组织的染色结果,(右)阵列排列示意图,蓝色为胃癌组织,黄色为癌旁组织

表2 整合素β5表达与临床病理参数的关系(n)
2.3 胃癌组织整合素β5的表达与预后的关系 胃癌组织中整合素β5高表达患者的5年生存率高于低表达患者,分别为64.7%(33/51)和36.0%(18/50),两者间差异有统计学意义(P=0.004)。影响胃癌总生存时间的单因素分析显示整合素β5蛋白低表达与患者术后预后较差显著相关(P=0.003);另外术前临床分期、淋巴结转移、浸润深度、分化程度与胃癌患者总生存期相关,性别、年龄、肿瘤大小、脉管侵犯、浸润深度与总生存期无关。将单因素分析有意义的变量淋巴结转移、浸润深度、分化程度、整合素β5进行COX风险模型分析显示淋巴结转移、浸润深度、整合素β5表达为胃癌预后的独立危险因素(P<0.05),见表3。
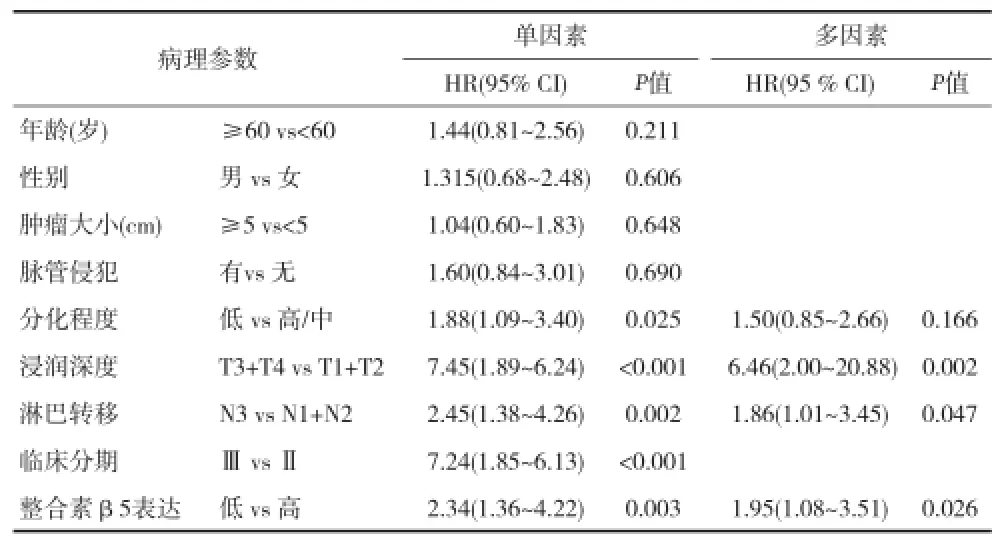
表3 胃癌预后因子的单因素与多因素分析
3 讨论
整合素是细胞表面重要的粘附分子,其由α和β两个糖蛋白亚单位构成的跨膜蛋白,是许多细胞外基质成分的受体,参与和调节肿瘤的增殖、浸润、迁移和转移等[7]。在肿瘤细胞中,整合素可出现异常升高和降低,或者出现新的整合素表达[8]。同时整合素对肿瘤细胞的作用复杂多样,其在不同肿瘤中的表达和作用不同,比如,卵巢癌中高表达的整合素α5β1促进其转移、侵袭及影响预后[9],而其在肝癌中高表达后可抑制肝癌细胞的生长和侵袭[10]。整合素β5是整合素家族中重要的亚单位,能与不同的α亚单位结合,与一些肿瘤的发生发展有密切关系,尤其与肿瘤转移的关系更加密切。有文献报道高表达的整合素β5可促进肿瘤增殖、转移和血管生成等[11-12]。
作者发现整合素β5在胃癌组织中的高表达率低于癌旁组织,胃癌组织中低表达的整合素β5与肿瘤分化程度、淋巴结转移和临床分期有关(P<0.05),而与性别、年龄、脉管侵犯、肿瘤大小、浸润深度均无相关性(P>0.05)。单因素分析显示整合素β5与胃癌患者生存时间相关(P=0.003),而且COX回归分析证明整合素β5是胃癌患者预后的独立危险因子(P=0.026)。有研究发现在乳腺癌中,具有高转移力的肿瘤中整合素αvβ5的表达降低后,使肿瘤细胞与基底膜的粘附作用降低,从而使肿瘤细胞易于脱落,促进肿瘤的转移[13]。张琦等的研究发现结肠癌细胞中肿瘤细胞整合素αvβ5的降低可能与整合素αvβ6之间的内吞胞吐循环有关[14]。殷莲华等[15]发现过表达的整合素β5可抑制造血干细胞的增殖并且与细胞凋亡有关。因此,整合素β5表达降低可能参与恶性肿瘤的发生发展,本研究为其提供了更详实有效的依据。
总之,本资料结果提示,胃癌组织中整合素β5表达的检测可用作临床诊断及预后判断的重要指标。深入研究整合素β5的功能及其调节机制,将能更好地对肿瘤的复发和转移做出预测,更好地指导临床治疗,有助于开发以胃癌肿瘤干细胞为靶点的肿瘤治疗新方法。当然,本研究的样本量较小,样本在各组间的分布不均,需要加大样本量来进一步证实结果。
[1] Chen W, Zheng R, Zeng H, et al. Annual report on status of cancer in China, 2011. Chinese Journal of Cancer Research, 2015, 27(1):2-12.
[2] Nakamura J, Tanaka T, Kitajima Y, et al. Methylation-mediated gene silencing as biomarkers of gastric cancer: A review. World Journal of Gastroenterology, 2014, 20(34):11991-12006.
[3] 高建莉, 贺凯. 佛波酯对人乳腺癌细胞MDA-MB-231黏附作用的影响. 医学信息, 2013, 26(6):222-224.
[4] Anna Bianchi, Megan E. Gervasi, Andrei Bakin. Role of β5-integrin in epithelial-mesenchymal transition in response to TGF-β. Cell Cycle, 2010, 9(8):1647-1659.
[5] Mochmann LH, Neumann M, Ek Von, et al. ERG induces a mesenchymal-like state associated with chemoresistance in leukemia cells. Oncotarget, 2014, 5(2):351-362.
[6] Bianchismiraglia A, Paesante S, Bakin AV. Integrin β5 contributes to the tumorigenic potential of breast cancer cells through the Src-FAK and MEK-ERK signaling pathways. Oncogene, 2012, 32(25): 3049-3058.
[7] Desgrosellier JS, Cheresh DA. Integrins in cancer: biological implications and therapeutic opportunities. Nature Reviews Cancer, 2010, 10(1):9-22.
[8] Eble JA, Haier J. Integrins in cancer treatment. Current Cancer Drug Targets, 2006, 6(2):89-105.
[9] Mitra AK, Sawada K, Tiwari P, et al. Ligand independent activation of c-Met by fibronectin and α5β1-integrin regulates ovarian cancer invasion and metastasis. Oncogene, 2010, 30(13):1566-1576.
[10] Fang Z, Yao W, Yi F, et al. Increased integrin alpha5beta1 heterodimer formation and reduced c-Jun expression are involved in integrin beta1 overexpression-mediated cell growth arrest. Journal of Cellular Biochemistry, 2009, 109(2):383-395.
[11] Bianchi-Smiraglia A, Paesante S, Bakin AV. Integrin β5 contributes to the tumorigenic potential of breast cancer cells through the Src-FAK and MEK-ERK signaling pathways. Oncogene, 2012, 32(25):3049-3058.
[12] Schittenhelm J, Klein A, Tatagiba MS, et al. Comparing the expression of integrins αvβ3, αvβ5, αvβ6, αvβ8, fibronectin and fibrinogen in human brain metastases and their corresponding primary tumors. International Journal of Clinical & Experimental Pathology, 2013, 6(12):2719-2732.
[13] Gui GP, Puddefoot JR, Vinson GP, et al. Altered cell-matrix contact: a prerequisite for breast cancer metastasis? British Journal of Cancer, 1996, 75(5):623-633.
[14] 张琦,王健,陈融,等.整合素αvβ6对结肠癌细胞中整合素αvβ5内吞胞吐循环的影响.中国病理生理杂志,2012, 28(12):2154-2159.
[15] 殷莲华, 赵新永, 付四清, 等. β5整合素在造血细胞上的表达和诱导细胞凋亡的作用. 中华血液学杂志, 2001, 22(1):13-16.
ObjectivesTo investigate the expression of integrinβ5(ITGB5)in gastric adenocarcinoma(GC) for assessing the correlation between ITGB5 and clinical pathological characteristics,and identifying therapeutic targets for diagnosis and treatment of gastric adenocarcinoma.MethodsLevels of ITGB5 were detected in 101 cases of GC tissues and 72 cases of corresponding adjacent non-neoplastic tissues by using tissue microarray and immunohistochemistry(IHC)technique. Then,the correlation between expression of ITGB5 and clinicopathological features as well as prognosis of GC patients was evaluated.ResultsThe expressions of ITGB5 in gastric adenocarcinoma tissues were signifi cantly lower than adjacent non-neoplastic tissues(overexpression rate is 50.5% and 94.4%,respectively,χ2=37.82,P<0.001). The low expression of ITGB5 was related to low differentiation of the tissues、tumor node metastasis classifi cation and clinical stage. Cox regression analysis indicated that low expression of ITGB5 was signifi cantly related to lower survival,and both Kaplan Meier survival and Cox regression analysis showed that low ITGB5 expression(HR=1.95,95%CI 1.08 to 3.51,P=0.026)was an independent prognosis factor.ConclusionsITGB5 is closely related to the occurrence and progression of GC patients,suggesting that it may be a potential therapeutic target and prognosis index in GC.
Gastric adenocarcinoma Integrinβ5 Tissue microarray Immunohistochemistry
国家自然科学基金项目(81573953),浙江省卫生厅
基金项目(2016KYB220,2013KYA029,2017PY009)
310053 浙江中医药大学第一临床医学院(郑国淀 陈佳辉 滕飞 郑国威)
310006 浙江中医药大学附属第一医院胃肠外科(吕航程向东)
*通信作者
