可得然胶酸法降解寡糖的HPLC/ESI-MS分析
2017-06-01孙玉姣戚歆宇陈雪峰
孙玉姣, 戚歆宇, 张 涵, 侯 令, 陈雪峰
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
可得然胶酸法降解寡糖的HPLC/ESI-MS分析
孙玉姣, 戚歆宇, 张 涵, 侯 令, 陈雪峰
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
以可得然胶为原料,利用TLC(thin layer chromatography)和HPLC(high performance liquid chromatography)技术对酸降解后获得的可得然胶寡糖的各组分进行了分离分析, 并结合ESI-MS(electrospray ionization ion-trap mass spectrometry)技术对其结构进行了鉴定.结果表明,酸法可以有效降解可得然胶,获得结构完整的β-(1→3)-D-葡寡糖.酸降解可获得聚合度为Dp1~Dp12的葡寡糖,而随着酸降解时间的延长,单糖和二糖的相对含量明显升高,而高聚合度葡寡糖(Dp8~Dp12)的相对含量逐渐减少.此外,相比作用于可得然胶多糖使其降解为大片段的寡糖,酸更容易作用于大片段的寡糖使其降解为单糖、二糖和低聚糖.本文可为进一步优化可得然胶的酸法降解以及制备功能性可得然胶寡糖提供理论指导.
可得然胶; 寡糖; 酸降解; 结构鉴定
0 引言
可得然胶(curdlan)是一种天然的直链型微生物发酵多糖,由葡萄糖结构单元以β-(1→3)糖苷键链接而成的葡聚糖,如图1所示.这种大分子由300~500个葡萄糖残基组成,其平均聚合度(degree of polymerization,DP)约为450,相对分子量(Molecular weight,Mr)约为74 000 Da,分子式为(C6H10O5)n[1].可得然胶为白色粉末,不溶于水,具有独特的凝胶特性,是一种常见的食品添加剂,可作为膨胀剂、稳定剂、增稠剂和持水剂等用于肉类、面类、水产类和预制食品等的加工[2].研究发现,可得然胶是一种不被人体消化、不产生热量的微生物多糖.随着对可得然胶性质的深入研究,开发可得然胶及其衍生物在医药、功能性食品方面的潜能受到了越来越多的关注.

图1 可得然胶的结构
可得然胶独特的大分子结构及其特殊的三股螺旋高级立体分子构像,具有抗肿瘤、抗细菌、抗病毒及提高机体的免疫力的生理功能.但可得然胶不溶于水、黏度大的特性,使得其活性低,限制了它的实际应用[3].而将可得然胶降解后得到的寡糖,水溶性增强,生物活性也明显增强.研究发现,可得然胶可降解产生β-(1→3)-D-葡聚寡糖,且聚合度(DP)为2~10时活性显著.不仅在动物体内具有较强的免疫调节活性,在植物体内也可作为诱导子激发植物的抗病能力[4-6].
目前,对可得然胶进行降解,常见的降解方法有酶解法、酸降解法和自由基降解法.酶解法虽然条件温和,但需要专一性的酶,成本较高[7,8].此外,一些非专一性酶如蛋白酶、溶菌酶、淀粉酶、脂肪酶、葡萄糖酶也可作用于可得然胶,但单一酶类作用时降解效率低,往往需要几种酶类混合作用,不利于其降解机制的研究[9,10].过氧化氢氧化降解法虽能降解可得然胶,得到寡聚糖,但反应的稳定性和重复性较差[11].酸降解法可以有效获得结构稳定的可得然胶寡糖,且重复性好.然而,可得然胶在酸溶液中产物结构的变化规律以及组分分析的研究较少[12-14].
本文以可得然胶为原料,采用三氟乙酸(trifluoroacetic acid,TFA)酸水解体系进行降解.通过薄层层析(thin layer chromatography,TLC)、高效液相色谱(high performance liquid chromatography,HPLC)和电喷雾质谱技术(electrospray ionization ion-trap mass spectrometry,ESI-MS)研究产物的降解规律,比较降解前后产物的相对分子质量分布和结构的变化情况,为进一步改进和优化酸水解条件提供理论依据.该研究将为研究寡糖结构和生物活性之间的关系提供物质基础.
1 材料与方法
1.1 试剂与仪器
(1)主要试剂:可得然胶(食品级),日本武田-麒麟食品公司;麦芽糖糊精(maltodextrin)、3-氨基-9-乙基咔唑(3-amino-9-ethylcarbazole,AEC)和色谱纯乙腈, Sigma 公司;TLC薄层硅胶板(分析型),德国Macherey-Nagel公司;其余试剂为国产分析纯.
(2)主要仪器:Waters Alliance 2487液相色谱-质谱联用仪,美国Waters公司;RP C18色谱柱(250 mm × 4.6 mm i.d.,5μm),安捷伦公司;Thermo Scientific LTQ-XL液相色谱-质谱联用仪,美国Thermo Scientific公司;Milli-Q超纯水系统,美国Millipore公司.
1.2 可得然胶的TFA降解
经过对已报导的方法[15]进行改进,称取8.0 g可得然胶,溶解到800 mL的0.1 mol/L三氟乙酸(TFA)中,60 ℃水浴加热反应.分别在0 h、2 h、4 h、6 h、8 h、10 h、12 h、16 h、20 h、24 h、36 h和48 h取30 mL样品置于50 mL离心管中.用氨水将其pH调至中性,除盐,冷冻干燥,备用.
1.3 可得然胶降解产物的TLC分析
将每个时间点取出的降解产物配制浓度为2 mg/mL,进行TLC分离分析.展开剂是正丁醇∶甲酸∶水=4∶7∶1(v/v/v).分离结束后,将薄层板浸染在地衣酚-浓硫酸显色液中,在150 ℃下持续加热,直到所有的条带显现出来为止[16].显色液为0.2 g地衣酚溶于100 mL的甲醇中,加入20 mL的浓硫酸(98%,w/v).
1.4 可得然胶降解产物的HPLC分析
1.4.1 AEC柱前衍生化标记
取5 mg不同时间点制备的降解产物溶于500μL的去离子水中,依次加入200μL的0.2 mol/L AEC溶液(AEC溶解在甲醇)、25μL的0.5 mol/L NaBH3CN溶液和50μL的冰醋酸,混匀后在70 ℃条件下加热1 h.反应结束后,用1 mol/L NaOH中和,N2吹干.然后加入1 mL二氯甲烷和1 mL蒸馏水对样品萃取,弃有机相,保留水相,重复三次[17].取水相冻干,配置成5 mg/mL进行HPLC分析.
1.4.2 HPLC分离条件
流动相A:0.01 mol/L 乙酸铵水溶液(pH 4.5),流动相B:乙腈;梯度洗脱程序:0~60 min,20%(v/v)B~40%(v/v)B;流速为0.5 mL/min.柱温:40 ℃;紫外检测器检测波长:254 nm;进样量:10μL[18].
1.5 可得然胶降解产物的ESI-MS分析
以N2作载气,鞘气(sheath gas)、辅助气(auxiliary gas)和反吹气(ion sweep gas)的流速分别为30 arb、5 arb和0 arb;用2μL定样环进样,流动相为50%(v/v)甲醇溶液,流速为200μL/min;喷雾电压(spray voltage)为4 kV;在正离子模式下进行检测,离子透镜电压(tube lens voltage)为250 V;离子传输毛细管温度(capillary temperature)和电压(capillary voltage)分别为350 ℃和48 V;扫描速度(scan rate)为normal,扫描类型(scan type)为full;质谱范围(mass range)为m/z200~2 000[19].
2 结果与讨论
2.1 可得然胶降解产物的TLC分析
反应0 h的降解产物是无色粘稠状液体,其余的时间段(2~48 h)的降解产物均为淡黄色澄清液体.对其进行的TLC分析结果如图2所示.随着时间的延长,原点处的多糖显色逐渐变浅,而展开的寡糖显色逐渐变深,说明多糖含量逐渐减少,寡糖含量逐渐增加,可得然胶被逐步降解为寡糖.

a-l:代表取样时间点分别为0 h、2 h、4 h、6 h、8 h、10 h、12 h、16 h、20 h、24 h、36 h和48 h图2 可得然胶降解产物的TLC分析结果
2.2 可得然胶降解产物的HPLC分析
由于寡糖本身不带有发色基团,通常需要对其进行柱前衍生使其带上紫外或荧光基团,提高检测的灵敏度.因此,采用已建立的3-氨基-9-乙基咔唑(3-amino-9-ethylcarbazole,AEC)衍生化方法[17]对不同酸解时间得到的可得然胶降解产物进行柱前衍生,然后进行反相HPLC分离.如图3所示,以葡萄糖和maltodextrin为参考标准,对可得然胶降解产物各组分的保留时间进行分析比较,结果表明可得然胶在酸体系中可得到有效降解.随着时间的延长,保留时间分别在6.000~10.000 min和小于6.000 min的大片段可得然胶寡糖和未降解可得然胶的峰面积不断减小,在酸水解12 h时,大片段可得然胶寡糖的峰面积几乎降为0;而保留时间在11.000~28.000 min的可得然胶各寡糖(Dp1~Dp12)的峰面积变化趋势更加多样.
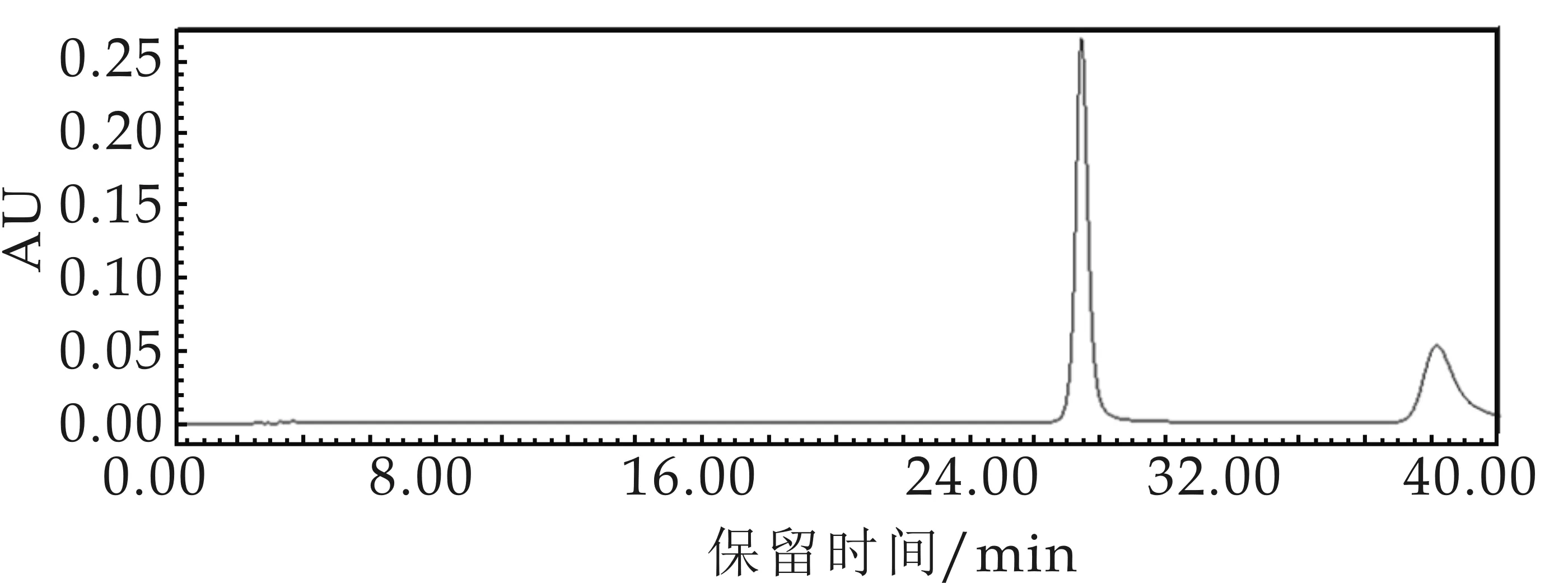
(a)葡萄糖标准
(b)maltodextrin标准

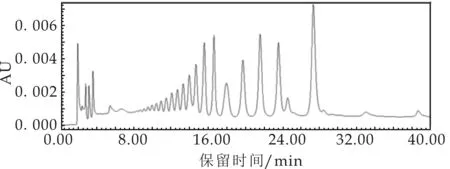
(c)可得然胶降解2 h

(d)可得然胶降解4 h

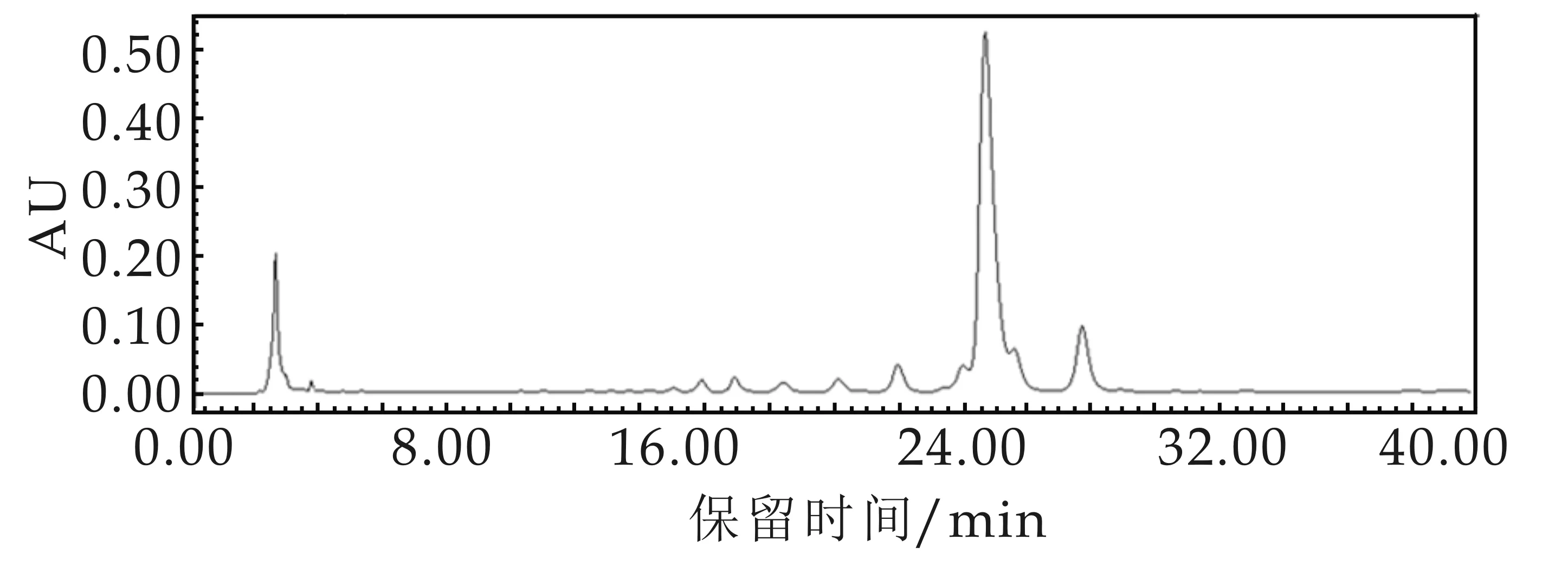
(e)可得然胶降解6 h

(f)可得然胶降解12 h
(g)可得然胶降解24 h

(h)可得然胶降解48 h图3 可得然胶降解产物的AEC衍生物的高效液相色谱图谱
例如,如图4所示,在酸降解4 h时,可得然胶单糖的相对含量为72.99%,相较于酸降解2 h的9.78%出现了大幅增加;在酸降解4 h时,可得然胶二糖和三糖的相对含量分别为2.11%和1.26%,相较于酸降解2 h的39.95%和9.62%出现了明显减少;此外,在酸降解4 h时,Dp4~Dp11的相对含量也呈下降趋势;而在酸降解4 h时,可得然胶十二糖的相对含量为18.95%,相较于酸降解2 h的18.63%出现了小幅增长.这可能是由于购买的可得然胶原材料就含有少量寡糖,使得在酸降解初期TFA不仅作用于多糖,产生十二糖等大分子量寡糖,还作用于原材料包含的寡糖,导致单糖的相对含量明显增加,且单糖的增幅明显大于十二糖的增幅.在酸降解6~48 h范围内,随着降解时间的延长,可得然胶单糖的相对含量逐渐增加,二糖的相对含量先增加后减少,而分子量较大的寡糖如Dp7~Dp12的相对含量则持续下降.结合酸降解2~4 h和6~48 h的现象,可说明可得然胶的酸水解并不是逐级降级的,而是包含两个过程,一个过程是将可得然胶多糖降解为大片段的寡糖,另一过程是将大片段的寡糖降解为单糖、二糖和低聚糖,并且这两个过程是同步、持续进行的,但TFA对寡糖的水解作用更强烈,明显优于对多糖的水解作用.
根据图3(c)中各聚合度可得然胶寡糖的峰面积可知,降解2 h时,Dp 1∶Dp 2∶Dp 3∶Dp 4∶Dp 5∶Dp 6∶Dp 7∶Dp 8∶Dp 9∶Dp10∶Dp 11∶Dp 12的比例为1∶4.13∶0.99∶0.42∶0.35∶0.60∶0.50∶0.20∶0.09∶0.07∶0.06∶1.92;根据图3(d)中各聚合度可得然胶寡糖的峰面积可知,降解4 h时,Dp 1∶Dp 2∶Dp 3∶Dp 4∶Dp 5∶Dp 12的比例为1∶0.03∶0.02∶0.04∶0.02∶0.26;根据图3(e)中各聚合度可得然胶寡糖的峰面积可知,降解6 h时,Dp 1∶Dp 2∶Dp 3∶Dp 4∶Dp 5∶Dp 6∶Dp 7∶Dp 8∶Dp 9∶Dp10∶Dp 12的比例为1∶8.66∶0.61∶0.25∶0.24∶0.36∶0.31∶0.11∶0.06∶0.11∶1.44;根据图3(f)中各聚合度可得然胶寡糖的峰面积可知,降解12 h时, Dp 1∶Dp 2∶Dp 3∶Dp 4∶Dp 5∶Dp 6∶Dp 7∶Dp 12为1∶5.92∶0.27∶0.12∶0.11∶0.15∶0.13∶0.28;根据图3(g)中各聚合度可得然胶寡糖的峰面积可知,降解24 h时,Dp 1∶Dp 2∶Dp 3∶Dp 4∶Dp 5∶Dp 6∶Dp 7∶Dp 8为1∶6.18∶0.37∶0.18∶0.14∶0.17∶0.13∶0.04;根据图3(h)中各聚合度可得然胶寡糖的峰面积可知,降解48 h时,Dp 1∶Dp 2∶Dp 3∶Dp 4∶Dp 5∶Dp 6∶Dp 7为1∶0.75∶0.06∶0.03∶0.02∶0.03∶0.02.在酸水解6~24 h时,二糖所占的比例最高,分别是66.00%、74.15%和75.09%.当反应时间过长,在酸水解48 h时,产生的单糖含量为52.36%,明显高于二糖含量(39.50%),并且寡糖种类也显著减少,只检测出了Dp1~Dp7聚合度的寡糖.由此可知,酸水解6~12 h为最佳反应时间.
2.3 可得然胶降解产物的ESI-MS分析
电喷雾质谱(ESI-MS)作为一种软电离技术,已经被广泛用于糖类物质的检测和结构分析中.由图5可知,以酸降解2 h为例,可得然胶降解产物为一系列的己糖聚糖,含有Dp1~Dp12的成分,每个聚合度的寡糖分子量相差162 Da.结合HPLC分离结果,对ESI-MS图谱上的各质谱峰进行归属,结果见表1所示.各聚合度的分子离子峰多形成与Na+、K+的加成峰.结合高效液相色谱分离和质谱鉴定结果可知,酸法可以有效降解可得然胶,也不破坏寡糖的结构,从而获得结构完整的可得然胶寡糖,即β-(1→3)-葡寡糖(如图1所示).
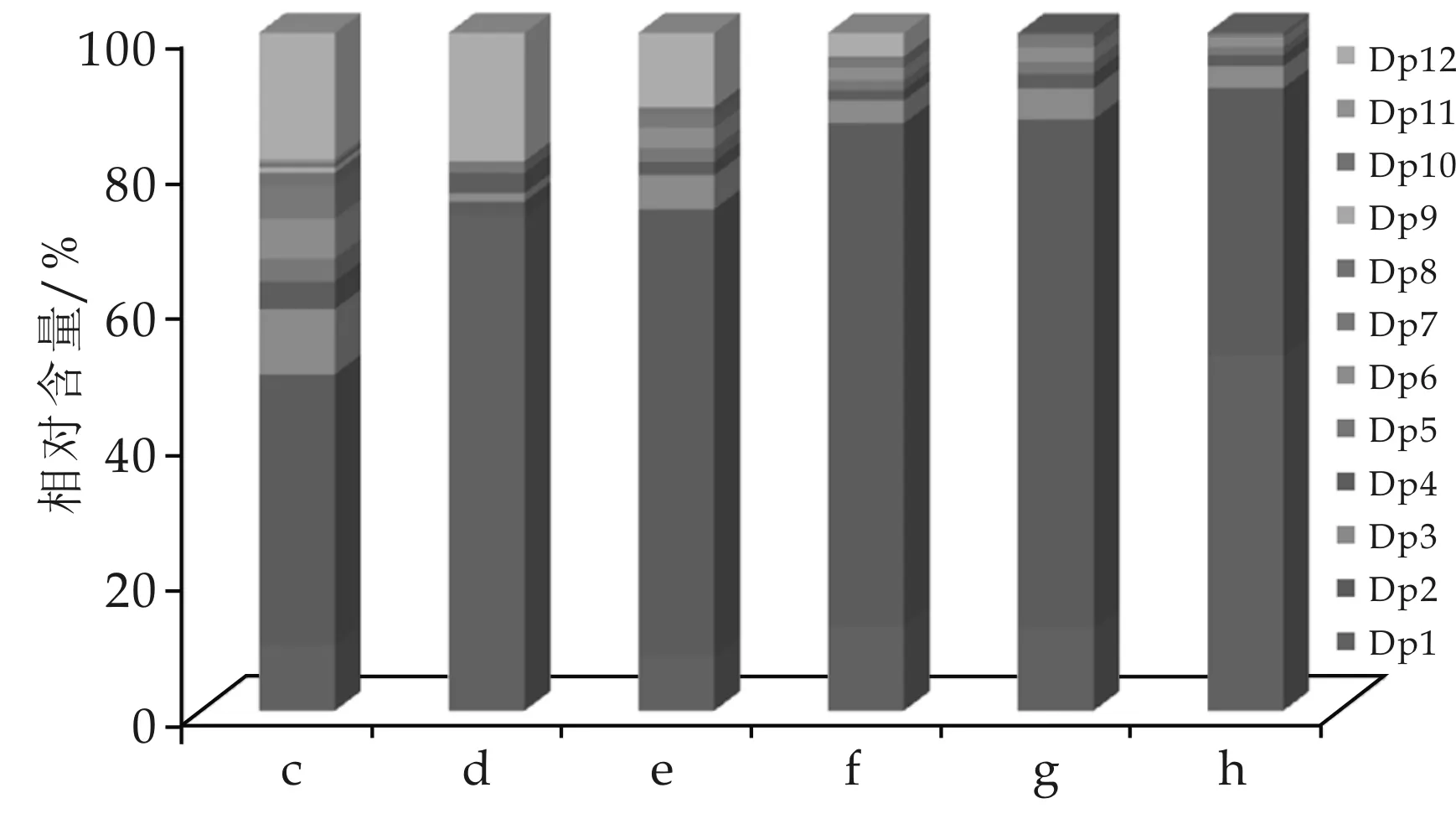
c:酸降解2 h;d:酸降解4 h;e:酸降解6 h;f:酸降解12 h;g:酸降解24 h;h:酸降解48 h图4 不同酸水解时间获得的可得然胶各聚合度寡糖相对含量变化的柱状图

图5 可得然胶降解2 h产物的ESI-MS分析图谱

表1 酸降解获得的可得然胶寡糖的ESI-MS分析归属结果
续表1

保留时间/(min)a聚合度m/z离子寡糖类型所在分离图谱14.753Dp81337.25[Glc8Na]+八糖图3(c、e、g)1353.17[Glc8K]+14.034Dp91499.25[Glc9Na]+九糖图3(c、e)1515.17[Glc9K]+13.374Dp101661.25[Glc10Na]+十糖图3(c、e)12.750Dp111823.33[Glc11Na]+十一糖图3(c)12.142Dp121985.42[Glc12Na]+十二糖图3(c、d、e、f)6.000~10.000大片段可得然胶寡糖图3(c、d、e)<6.000未降解可得然胶图3(c、d、e、f、g、h)
a以maltodextrin的高效液相色谱分离保留时间为参考标准.
3 结论
本文以可得然胶为原料,利用HPLC和ESI-MS技术对酸降解后获得的可得然胶寡糖的各组分进行了分离分析和结构鉴定.结果表明酸法可以有效降解可得然胶,获得结构完整的β-(1→3)-葡寡糖.此外,可得然胶的酸水解包含两个过程,一个过程是将可得然胶多糖降解为大片段的寡糖,另一过程是将大片段的寡糖降解为单糖、二糖和低聚糖.
目前研究发现,β-(1→3)-葡寡糖的活性与其聚合度的大小密切相关.例如,从海带中提取的β-(1→3)-葡寡糖中五糖是诱导植物抗病性的最小基本结构单元,从香菇中提取的β-(1→3)-葡聚糖中六糖具有较强的抗肿瘤活性[5,20,21].
因此,本文通过研究可得然胶的酸降解产物,可为进一步制备和筛选功能性可得然胶寡糖提供理论指导,将为揭示寡糖结构和生物活性之间的关系提供物质基础.
[1] 张海龙,关志炜,杨俊杰.可得然胶的性质及应用[J].中国食物与营养,2010(1):36-39.
[2] Cai Z,Zhang H. Recent progress on curdlan provided by functionalization strategies[J].Food Hydrocolloids,2017(68):128-135.
[3] 张 琦,张洪斌,丛峰松,等.β-(1→3)-D-葡聚糖可德胶化学改性的研究进展[J].高分子通报,2009(5):20-29.
[4] Hida T H,Ishibashi K,Miura N N,et al.Cytokine induction by a linear 1,3-glucan,curdlan-oligo,in mouse leukocytes in vitro[J].Inflammation Research,2009,58(1):9-14.
[5] Aziz A,Gauthier A,Bezler A,et al.Elicitor and resistance-inducing activities ofβ-1,4-cellodextrins in grapevine,comparison withβ-1,3-glucans and α-1,4-oligogalacturonides[J].Journal of Experimental Botany,2007,58(6):1 463-1 472.
[6] Fu Y,Yin H,Wang W,et al.β-1,3-glucan with different degree of polymerization induced different defense responses in tobacco[J].Carbohydrate Polymers,2011,86(2):774-782.
[7] Fu Y,Cheng L,Meng Y,et al.Cellulosimicrobium cellulans strain E4-5 enzymatic hydrolysis of curdlan for production of (1→3)-linkedβ-D-glucan oligosaccharides[J].Carbohydrate Polymers,2015,134(5):740-744.
[8] Kumgai Y,Okuyama M,Kimura A.Heat treatment of curdlan enhances the enzymatic production of biologically activeβ-(1,3)-glucan oligosaccharides[J].Carbohydrate Polymers,2016,146:396-401.
[9] Chen Y,Zhu Q,Wu S.Preparation and gel properties of low molecular weight curdlan by hydrolysis of curdlan with commercialα-amylase[J].Carbohydrate Polymers,2014,113(113):362-364.
[10] Qian Z,Wu S,Pan S,et al.Preparation of (1→3)-β-D-glucan oligosaccharides by hydrolysis of curdlan with commercialα-amylase[J].Carbohydrate Polymers,2012,87(3):2 362-2 364.
[11] Wu S,Cai R,Sun Y.Degradation of curdlan using hydrogen peroxide[J].Food Chemistry,2012,135(4):2 436-2 438.
[12] 王英杰,苏 理,兰文忠,等.水溶性β-1,3-葡聚糖制备及应用研究的进展[J].食品与药品,2014,16(3):222-226.
[13] 王英杰,赵双枝,苏 理,等.水溶性可得然寡糖的制备及其活性研究[J].现代食品科技,2013,29(11):2 735-2 741.
[14] 傅赟彬,刘启顺,李曙光,等.可德兰寡糖的制备及其组分分析[J].食品科学,2011,32(3):6-9.
[15] Grandpierre C,Janssen H G,Laroche C,et al.Enzymatic and chemical degradation of curdlan targeting the production ofβ-(1→3) oligoglucans[J].Carbohydrate Polymers,2008,71(2):277-286.
[16] Skipski V P,Smolowe A F,Barclay M.Separation of neutral glycosphingolipids and sulfatides by thin-layer chromatography[J].Journal of Lipid Research,1967,8(4):295-299.
[17] 孙玉姣,王承建,耿腾飞,等.κ-卡拉胶寡糖AEC柱前衍生物的LC-ESI-MS/MSn分离分析[J].化学学报,2011,69(14):1 697-1 704.
[18] Sun Y,Liu Y,Jiang K,et al.Electrospray ionization mass spectrometric analysis of κ-carrageenan oligosaccharides obtained by degradation with κ-carrageenase from pedobacter hainanensis[J].Journal of Agricultural and Food Chemistry,2014,62(11):2 398-2 405.
[19] Sun Y,Yang B,Wu Y,et al.Structural characterization and antioxidant activities of κ-carrageenan oligosaccharides degraded by different methods[J].Food Chemistry,2015,178:311-318.
[20] Klarzynski O,Plesse B,Joubert J M,et al.Linearβ-1,3-glucans are elicitors of defense responses in tobacco[J].Plant Physiology,2000,124(3):1 027-1 037.
[21] 张志平,衣悦涛,宁 君.香菇多糖核心片段六糖的合成研究[J].有机化学,2005,25(10):1 240-1 243.
【责任编辑:蒋亚儒】
Analysis on the oligosaccharide products of curdlan from acidic hydrolysis by using HPLC and ESI-MS
SUN Yu-jiao, QI Xin-yu, ZHANG Han, HOU Ling, CHEN Xue-feng
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
In this study,curdlan was subjected to acidic degradation.The oligosaccharide compounds were monitored and separated in detail by thin layer chromatography (TLC) and high performance liquid chromatography (HPLC),and their structures were identified by electrospray ionization ion-trap mass spectrometry (ESI-MS).The results demonstrated that the hydrolysates were composed ofβ-(1→3)-D-glucan oligosaccharides of Dp1~Dp12 and the structure of oligosaccharides was not changed.The relative proportion of monosaccharide and disaccharide continuously increased,while higher molecular weight fractions (e.g.Dp8~Dp12) gradually decreased during the increase of time course.In addition,acidic hydrolysis would prefer to work on higher molecular weight oligosaccharides to produce monosaccharide,disaccharide and smaller oligosaccharides,than to degrade curdlan polysaccharide to obtain high molecular weight oligosaccharides.This study may be helpful to further optimize acidic hydrolysis condition and control large scale production of functional curdlan oligosaccharides.
curdlan; oligosaccharide; acidic hydrolysis; structural identification
2017-01-07
陕西科技大学博士科研启动基金项目(BJ16-17); 陕西省科技厅科技统筹创新工程计划项目(2016KTCL02-32)
孙玉姣(1988-),女,陕西西安人,讲师,博士,研究方向;糖化学与糖生物学
2096-398X(2017)03-0143-05
TS201.2
A
