柠檬酸-反相微胶团法提取虾壳中甲壳素的研究
2017-06-01高佳欣
张 钟,高佳欣
(广东石油化工学院,广东茂名 525000)
柠檬酸-反相微胶团法提取虾壳中甲壳素的研究
张 钟,高佳欣
(广东石油化工学院,广东茂名 525000)
以虾壳为原料,采用柠檬酸反向微胶团法研究出一种新型的制备甲壳素的方法。首先用食品级的柠檬酸结合超声波辅助萃取技术脱除虾壳中的无机盐,再用微胶团萃取技术脱除虾壳中的蛋白质,再用30%的双氧水脱色,从而制得甲壳素。在单因素实验的基础上,通过响应面设计,得到柠檬酸反相微胶团法提取虾壳中甲壳素的最优条件。并将该法与酸碱法和酶法制备甲壳素产率进行了对比。结果表明,最优条件为:40 mL反相微胶团中虾壳的原料添加量为0.62 g、KCl浓度为0.15 mol/L、萃取时间为116 min,产率为 47.32%。柠檬酸反相微胶团法甲壳素产率极显著低于传统的酸碱法,但极显著高于酶法。该方法可行,可为甲壳素生产工艺的改进提供理论基础。
虾壳,柠檬酸,反相微胶团,甲壳素
我国虾类资源十分丰富,虾仁加工后,虾头、虾壳成为加工废弃物[1]。甲壳素又名几丁质、甲壳质等,化学名为β-(1,4)-2-乙酰氨基-2-脱氧-D葡聚糖,分子式为(C8H15NO6)n。甲壳素广泛存在于节肢动物门甲壳纲动物的甲壳,其中虾壳中甲壳素含量为20%~25%,蟹壳为15%~20%之间[2]。虾壳中主要有蛋白质、矿物质、色素和甲壳素四类物质[1],因此,除去前三类物质,就可以制得甲壳素。目前甲壳素的生产工艺主要有酸碱法[3-4]、酶法[5]、发酵法[6]、EDTA法[7]等。酸碱法使用强酸强碱,对环境污染大,成本高,耗能大;酶法虽然污染小,且条件温和,但提取率较低;发酵法操作较为复杂,对生产条件要求严格,生产周期长;EDTA法成本低,耗时少,但工艺中使用的NaOH仍对环境有影响,且目前用EDTA法制备甲壳素的工艺还不够成熟。因此,研究出一种新的甲壳素提取方法尤为必要。
在反相微胶团中,表面活性剂的极性基团部分围成一个极性核心,称为“水池”。这个水池包括表面活性剂的极性基团内表面和其中的水分,以及溶解于水中的离子等。这个水池可以萃取蛋白质等水溶性大分子物质,从而实现蛋白的分离[8]。反相微胶团在天然成分提取中的应用越来越重视[9-10]。
目前,国内外主要采用传统的酸碱化学方法生产甲壳素,生产过程中会引起严重的环境污染,同时造成水资源的严重浪费[11]。而本研究采用柠檬酸和反相微胶团萃取技术结合的方法提取甲壳素,不仅减少了对环境的污染,用食品级的柠檬酸脱钙后的副产物柠檬酸钙还能作为食品添加剂添加于各种食品中,因此也实现了资源的回收,促进了原料的综合利用。
1 材料与仪器
1.1 材料与仪器
南美白对虾虾壳 茂名新洲海产有限公司;柠檬酸 食品级,天津市百世化工有限公司;CTAB(十六烷基三甲基溴化铵) 分析纯,天津市永大化学试剂有限公司;异辛烷 分析纯,天津市百世化工有限公司;硫酸、尿素、苯甲酸钠、碘化钾、HCl、HCl、氢氧化钠、硫酸铜、碘均为分析纯,过氧化氢溶液等。
SHZ-3循环水多用真空泵 郑州长城仪器有限公司;XO-1200超声波细胞粉碎机南京先欧仪器制造有限公司;DHG-9012A电热恒温鼓风干燥箱 上海申光仪器仪表有限公司;DG120半斤装中药粉碎机 浙江省瑞安市春海药材器械厂;HH-6数显恒温水浴锅 常州博远实验分析仪器厂;HZ-9212S数显水浴恒温震荡器 金坛市杰瑞尔电器有限公司;TD5B台式大容量离心机 长沙英泰仪器有限公司。
1.2 实验方法
1.2.1 预处理 挑选新鲜虾壳作为制备甲壳素的原料,用清水将虾壳内外表面的异物去除干净,于60 ℃烘箱中烘干后用粉碎机粉碎,备用。
1.2.2 超声波辅助柠檬酸脱除无机盐 根据彭元怀[12]等人的实验,脱除虾壳中无机盐的最佳条件为:室温、功率180 W、柠檬酸浓度为14 %、液料比为12∶1 (mL/g)、反应时间22 min。
1.2.3 反相微胶团技术脱除蛋白质 取适量CTAB溶解于尿素∶异辛烷为1 g∶4 mL的混合溶液中,构成透明澄清的反胶团溶液[13]。
1.2.4 实验内容
1.2.4.1 原料加入量的单因素实验 分别量取20 mL异辛烷于5个250 mL的锥形瓶中,各加入5 g尿素、0.8 g CTAB、10 mL C6H8O7-Na2HPO4缓冲溶液、10 mL 0.1 mol/L KCl溶液,摇匀,构成反胶团溶液。再分别加入0.40、0.60、0.80、1.00、1.20 g经柠檬酸脱盐后的虾壳,调反胶团体系的pH至9.0,在45 ℃,180 r/min的条件下震荡120 min。震荡完毕后,取出置于离心机中以3000 r/min离心5 min,去除上层物质,抽滤,干燥,称重。
1.2.4.2 KCl浓度的单因素实验 分别量取20 mL异辛烷于5个250 mL的锥形瓶中,各加入5 g尿素、0.8 g CTAB、10 mL C6H8O7-Na2HPO4缓冲溶液、分别加入10 mL 0.02、0.06、0.10、0.14、0.18 mol/L KCl溶液,摇匀,构成反胶团溶液。再分别加入0.60 g经柠檬酸脱盐后的虾壳,调反胶团体系的pH至9.0,在45 ℃,180 r/min的条件下震荡120 min。震荡完毕后,取出置于离心机中以3000 r/min离心5 min,去除上层物质,抽滤,干燥,称重。
1.2.4.3 萃取时间的单因素实验 分别量取20 mL异辛烷于5个250 mL的锥形瓶中,各加入5 g尿素、0.8 g CTAB、10 mL C6H8O7-Na2HPO4缓冲溶液、10 mL 0.1 mol/L KCl溶液,摇匀,构成反胶团溶液。再分别加入0.60 g经柠檬酸脱盐后的虾壳,调反胶团体系的pH至9.0,分别在45 ℃,180 r/min的条件下震荡60、80、100、120、140 min。震荡完毕后,取出置于离心机中以3000 r/min离心5 min,去除上层物质,抽滤,干燥,称重。
1.2.4.4 响应面实验 在单因素实验的基础上进行响应面实验,来确定影响虾壳中甲壳素产率的最佳因素水平,以原料添加量、萃取时间、KCl浓度为实验因素,实验数据的处理分析均采用Dseign Expert 6.5.0软件进行。因素水平表见表1。
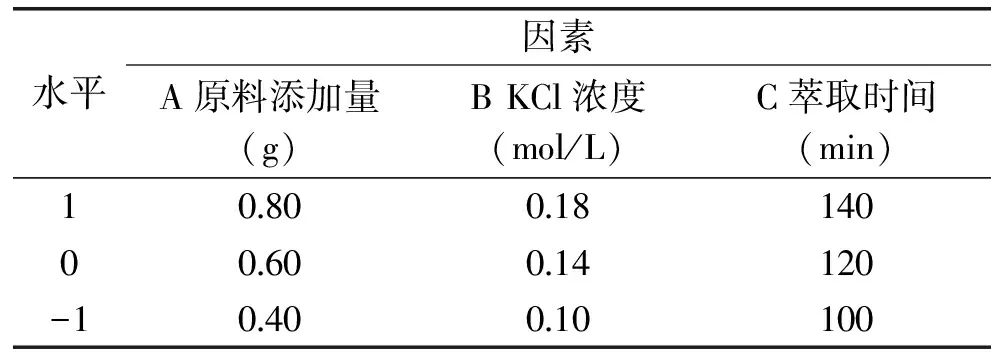
表1 响应面设计因素水平表
1.2.5 H2O2溶液脱色 将脱钙、脱蛋白质后的虾壳,浸于质量分数30%的过氧化氢中浸泡2 h(反应过程中低速搅拌,便于排除气体,并加速反应的进行),虾壳颜色渐变浅黄,逐步完全脱色,经水洗,干燥得到甲壳素产品。
1.2.6 甲壳素的定性分析 在提取出的甲壳素中加入1滴0.03%的碘-碘化钾溶液和1滴质量分数为1%的H2SO4溶液,在白瓷点滴试样板上显示紫褐色,再加数滴质量分数为75%的H2SO4溶液,观察颜色反应,若紫色逐渐消失,说明该测试产品为甲壳素[14]。
1.2.7 甲壳素产率的计算 甲壳素的产率包括柠檬酸脱除无机盐后甲壳素的产率、反相微胶团技术脱除蛋白质后甲壳素的产率以及最终甲壳素的产率,其计算公式如下:
柠檬酸脱除无机盐后甲壳素的产率(%)=柠檬酸脱除无机盐后虾壳的重量(g)/样本中虾壳的重量(g)×100
反相微胶团脱除蛋白质后甲壳素产率(%)=反相微胶团脱除蛋白质后虾壳的重量(g)/柠檬酸脱除无机盐后虾壳的重量(g)×100
最终甲壳素的产率(%)=经柠檬酸脱除无机盐和反相微胶团脱除蛋白质后虾壳的重量(g)/样本中虾壳的重量(g)×100
1.2.8 与成熟工艺对比实验
1.2.8.1 酸碱法 挑选新鲜虾壳作为制备甲壳素的原料,用清水将虾壳内外表面的异物去除干净,于60 ℃烘箱中烘干后用粉碎机粉碎。称取3份1.00 g虾壳,于100 mL 5% HCl中浸泡4 h至无气泡冒出,再补加50 mL 5 % HCl,浸泡2 h,除去虾壳中的钙质和无机盐,抽滤用蒸馏水洗至中性,加100 mL 10 % NaOH于50 ℃水浴中加热2 h,除去蛋白,过滤,用蒸馏水洗至中性,然后用0.1% HCl浸泡0.5 h,再用质量分数30%的过氧化氢溶液100 mL浸泡2 h,水洗至中性,抽滤,烘干后得白色粉末状甲壳素,分别计算甲壳素产率,取平均值[15]。

表2 原料添加量对甲壳素产率的影响
注:不同小写字母表示在0.05水平上的显著,大写字母表示在0.01水平上的显著,表3、表4、表7同。

表3 KCl浓度对甲壳素产率的影响

表4 萃取时间对甲壳素产率的影响
1.2.8.2 酶法 挑选新鲜虾壳作为制备甲壳素的原料,用清水将虾壳内外表面的异物去除干净,于60 ℃烘箱中烘干后用粉碎机粉碎。称取3份1.00 g虾壳,分别于100 mL 5% HCl中浸泡4 h至无气泡冒出,再补加50 mL 5% HCl,浸泡2 h,除去虾壳中的钙质和无机盐,抽滤用蒸馏水洗至中性,干燥。底物浓度为10%(重量百分比),pH8.0,沸水浴15 min,加入蛋白酶0.25%~1%(占反应液中蛋白量的百分比),温度55 ℃,时间24~48 h,再用沸水浴加热15 min,冷却,抽滤,烘干后得白色粉末状甲壳素,分别计算甲壳素产率,取平均值[16]。
2 结果与分析
2.1 单因素实验结果
2.1.1 原料添加量对甲壳素产率影响的单因素实验 结果如表2所示。
由表2单因素实验结果可知,随着原料添加量的增加,甲壳素产率先增加后减少,在0.60 g时达到最大值,为41.56%,极显著高于除0.80 g以外的添加量(p<0.01)。
2.1.2 KCl浓度对甲壳素产率影响的单因素实验 由表3可知,在一定范围内,甲壳素的产率随着KCl浓度的增加而增加,在0.14 mol/L时达到最大值,为49.67%,继续增加KCl浓度时,甲壳素产率反而下降,因此选择0.14 mol/L为KCl的最佳浓度。当KCl浓度为0.14 mol/L时的实验结果与其他浓度的实验结果有极显著性差异,(p<0.01)。
2.1.3 萃取时间对甲壳素产率影响的单因素实验 由表4可知:在一定的范围内,甲壳素产率随着萃取时间的增加而增加,在120 min时达到最大值,为49.67%,继续增加萃取时间时,甲壳素产率反而下降。因此选择120 min为最佳萃取时间。当萃取时间为120 min时,与其它实验结果存在极显著性差异,(p<0.01)。
2.2 响应面的实验结果
2.2.1 回归模型的建立及其显著性检验 运用Desingn-Expert 6.5.0软件对实验数据进行回归分析,并通过对数据进行逐步的回归拟合,可以得到原料添加量、KCl浓度和萃取时间与甲壳素产率之间的二次多项回归方程:
Y(%)=49.67-1.59A+0.22B+2.75C-4.24A2-4.63B2-4.21C2-1.49AB-0.27AC+2.89BC

表5 Box-Behnken设计方案及实验结果
回归模型方差分析的结果表明,该模型显著(p<0.005),失拟项不显著,由此可见,该方程可以比较准确地描述各因素与响应值之间的真实关系,可以利用该回归方程确定最佳配方组成。

表6 回归模型的方差分析
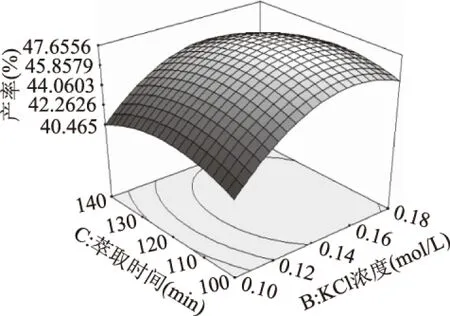
2.2.2 原料添加量与KCl浓度的交互作用对虾壳中甲壳素产率的影响 响应面图形的等高线(图1)表明,当萃取时间为120 min时,原料的添加量与KCl浓度没有明显的交互作用。当KCl浓度一定时,虾壳中甲壳素的产率随着原料添加量在0.40~0.60 g范围内的增大而增加,当原料添加量大于0.60 g时,虾壳中甲壳素的产率随着原料添加量的增大而降低。当原料添加量一定时,虾壳中甲壳素的产率随着KCl浓度在0.10~0.14 mol/L范围内的增大而增加,KCl浓度大于0.14 mol/L时,虾壳中甲壳素的产率又随着KCl浓度的增大而降低。 图1 原料添加量与KCl浓度的 交互作用对甲壳素产率的影响Fig.1 Effect of raw material content and concentration of KCl interactions on the extraction ratio of chitin 2.2.3 原料添加量与萃取时间的交互作用对虾壳中甲壳素产率的影响 响应面图形的等高线(图2)表明,当KCl浓度为0.14 mol/L时,原料添加量与萃取时间没有明显的交互作用。当原料添加量一定,萃取时间在100~120 min范围内时,虾壳中甲壳素的产率随着萃取时间的增加而增加;当萃取时间大于120 min时,虾壳中甲壳素的产率随着萃取时间的增加而降低。当萃取时间一定,原料添加量在0.40~0.60 g的范围内时,虾壳中甲壳素的产率随着原料添加量的增加而增加;当原料添加量大于0.60 g时,虾壳中甲壳素的产率随着原料添加量的增加而降低。 图2 原料添加量与萃取时间的 交互作用对甲壳素产率的影响Fig.2 Effect of raw material content and extraction time interactions on the extraction ratio of chitin 图3 KCl浓度与萃取时间的交互作用对甲壳素产率的影响Fig.3 Effect of concentration of KCl and extraction time interactions on the extraction ratio of chitin 2.2.4 KCl浓度与萃取时间的交互作用对虾壳中甲壳素产率的影响 响应面图形的等高线(图3)表明,当原料添加量0.60 g时,KCl浓度与萃取时间有明显的交互作用。当KCl浓度一定,萃取时间在100~120 min范围内时,虾壳中甲壳素的产率随着萃取时间的增加而增大;萃取时间大于120 min时,虾壳中甲壳素的产率随着萃取时间的增大而降低。当萃取时间一定,KCl浓度在0.10~0.14 mol/L的范围内时,虾壳中甲壳素的产率随着KCl浓度的增大而增大;当KCl浓度大于0.14 mol/L时,虾壳中甲壳素的产率随着KCl浓度的增大而降低。 通过分析与研究,得到柠檬酸反相微胶团法提取虾壳中甲壳素的最优条件是:原料添加量为0.62 g、KCl浓度为0.15 mol/L、萃取时间为116.25 min,产率为 47.69%。 实际进行实验过程中,采用原料添加量为0.62 g、KCl浓度为0.15 mol/L、萃取时间为116 min,产率为47.32%。 2.3 与成熟工艺的对比 柠檬酸反相微胶团法、酸碱法和酶法提取虾壳中甲壳素产率的对比如表7。 表7 甲壳素产率的对比 由表7可知,柠檬酸反相微胶团法甲壳素产率显著低于传统的酸碱法,存在极显著性差异,但柠檬酸反相微胶团法甲壳素产率明显高于酶法,也存在着极显著性差异。 由单因素实验总结可知,柠檬酸反相微胶团法在pH9.0提取虾壳中甲壳素的最佳条件是:原料添加量为0.60 g、KCl浓度为0.14 mol/L、萃取时间为120 min。通过响应面优化后,得到柠檬酸反相微胶团法提取虾壳中甲壳素的最优条件是:原料添加量为0.62 g、KCl浓度为0.15 mol/L、萃取时间为116 min。而本实验方法与酸碱法对比,产率明显低于传统的酸碱法,但该方法反应条件温和,用食品级柠檬酸代替盐酸,不但减小了对环境的污染,而且还实现了资源的充分利用;而与酶法相比,柠檬酸反相微胶团法的产率极显著高于酶法,而且还大大节省了时间,因此此法是可行的。 [1]陈天忠,姚歆和,文利新. 虾头、虾壳资源利综合用研究进展[J]. 湖南饲料,2006(4):35-36. [2]李鹏程,宋金明. 甲壳质/壳聚糖及其衍生物的应用化学[J]. 海洋科学,1998,5:25-29. [3]张雪,王雪涛. 虾壳制备甲壳素工艺研究[J]. 粮油食品科技,2007,15(4):36-37,48. [4]陈利梅,戴桂芝,李德茂. 南美白对虾甲壳素提取工艺的优化[J]. 中国调味品,2009,34(2):83-85. [5]段元斐,何忠诚,庄桂东,等. 甲壳素提取新工艺的研究[J]. 食品工业,2007,28(3):7-8. [6]周湘池,刘必谦,郭春苹,等. 生物技术清洁生产替代高污染化学法制备甲壳素的研究与应用[J]. 海洋与湖沼,2008,39(5):517-522. [7]何兰珍,杨丹,刘毅,等. 制备甲壳素过程中EDTA脱钙法的研究[J]. 食品与生物技术学报,2008,27(4):49-52. [8]王立峰,朱均旺,袁建,等. 超声波辅助反胶束提取菜籽蛋白工艺优化[J]. 中国粮油学报,2010,25(5):45-48. [9]刘东梅.双水相萃取法提取L-精氨酸的研究[D].厦门:华侨大学,2013 [10]孙晨,刘文举,刘宁宁. 聚乙二醇/盐双水相萃取L-苯丙氨酸的研究[J].食品工业科技,2012,33(6):324-327 [11]许庆陵,曾庆祝. 虾壳甲壳素及壳聚糖提取工艺的研究[J]. 中国食品添加剂,2013(6):104-109. [12]彭元怀,黄川,赵泽洁. 超声波辅助提取虾壳甲壳素的工艺研究[J]. 食品工业科技,2012,33(9):304-308. [13]布冠好,刘海远,陈复生,等. 三种反胶束体系后萃取大豆蛋白的研究[J]. 食品工业,2013,34(3):58-61. [14]陈长琨.昆虫生理生化实验[M].北京:中国农业出版社,1991:4-6. [15]谢宇,胡金刚,魏娅,等. 基尾虾虾壳中提取甲壳素工艺研究[J]. 河南工业大学学报(自然科学版),2009,30(1):37-40 [16]胡晓冰.生物法制备甲壳素与壳聚糖探讨[J]. 黄河水利职业技术学院学报,2013,25(4):39-41. Study on the extraction of chitin from shrimp shell by citric acid-reverse micelles method ZHANG Zhong,GAO Jia-xin (Guangdong University of Petrochemical Technology,Maoming 525000,China) A novel method of preparing chitin by reverse micelles and citric acid was studied. Chitin was made by means of citric acid and ultrasonic assisted extraction technology to remove inorganic salt and reverse micelles extraction technology to remove protein in the shrimp shell,and 30% hydrogen peroxide for bleaching. Based on the single factor experiment result,through the response surface design,the optimum conditions of extracting chitin by citric acid-reverse micelles method was studied. The results showed that the optimal conditions by citric acid-reverse micelle method were raw material content of 0.62 g,concentration of KCl 0.15 mol/L,extraction time of 116.25 min,and the rate of extraction was 47.32%. The yield of chitin was significantly lower than that of the traditional acid base method,but it was significantly higher than that of the enzyme method. The method is feasible,and it can provide theoretical basis for the improvement of the production process of chitin. hrimp shell;citric acid;reverse micelle;chitin 2016-08-19 张钟(1962-),男,本科,教授,研究方向:农产品贮藏与加工,E-mail:47108887@qq.com。 广东省科技计划2015B020230001。 TS254.9 B 1002-0306(2017)05-0269-05 10.13386/j.issn1002-0306.2017.05.042
注:“**”为差异极显著(p<0.01);“*”为差异显著(0.01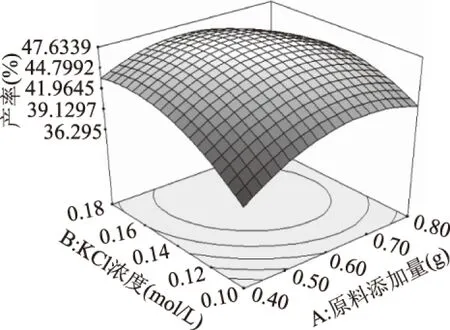


3 结论
