大孔树脂分离纯化菠萝蜜果皮黄酮工艺及其抗氧化活性研究
2017-06-01邓梦琴林晓瑛宋贤良
邓梦琴,林晓瑛,张 明,宋贤良,黄 苇
(华南农业大学食品学院,广东广州 510642)
大孔树脂分离纯化菠萝蜜果皮黄酮工艺及其抗氧化活性研究
邓梦琴,林晓瑛,张 明,宋贤良*,黄 苇
(华南农业大学食品学院,广东广州 510642)
本实验以菠萝蜜果皮的黄酮粗提液为供试液,通过静态吸附解析从6种极性不同的大孔树脂中筛选出NKA树脂作为最佳分离纯化树脂,并对NKA柱层析的动态吸附解析条件进行探索,得到最佳上样浓度为0.90 mg/mL、上样体积为200 mL、洗脱剂用量为120 mL;通过柱层析的单因素和正交实验,得到最佳纯化工艺为:上样流速和洗脱流速4 mL/min,上样pH5,以70%乙醇洗脱,此条件下,黄酮回收率高达96.02%;过柱后样品的黄酮纯度由原来的16.74%提高到84.42%,提高了4.04倍,表明NKA树脂对菠萝蜜果皮黄酮的富集纯化效果显著。对比纯化前后黄酮的体外抗氧化活性,结果表明,经NKA柱层析后,随着黄酮纯度提高,样品的体外抗氧化活性也显著提高。
菠萝蜜果皮,黄酮,分离纯化,体外抗氧化活性
菠萝蜜(Jackfruit),是一种高产值热带水果,果实硕大,又名“牛肚子果”、“蜜冬瓜”、“木菠萝”,原产于印度,属于桑科(Moraceae)桂木属常绿乔木[1],是我国典型的热带果品。菠萝蜜素有“热带珍果”之称[2],除了香甜可口的果肉可食用外,其他部位比如种子、果皮、树干乃至树叶等都具有各自不同的效用,种子可作为良好的抗性淀粉原料及添加剂[3-4],同时富含凝集素,具有一定的医用疗效[5-6],菠萝蜜叶可用作药膏[7],树根提取物可防治腹泻、哮喘、急性扁桃体炎等疾病[8],树皮则可用作镇静药[9]。由于菠萝蜜果实硕大,皮重占整果重量的几乎1/2,直接丢弃造成大量的资源浪费,因此菠萝蜜果皮的开发和利用对提高菠萝蜜果品综合利用率十分重要。目前菠萝蜜果皮中的果胶和膳食纤维的提取及利用是主要研究热点[10-12],而对于其中的天然活性产物的研究较少。菠萝蜜果皮中富含多酚、黄酮等天然活性物质,这些物质具有抗氧化、抗菌消炎、抗肿瘤等功效[13-16],是目前应用较为广泛的天然活性产物。国内已有的对于菠萝蜜果皮中多酚、黄酮物质的提取[17-18]研究还有待深入,其分离纯化研究更是处于初级阶段。本研究利用大孔树脂分离纯化菠萝蜜果皮黄酮提取液,得到纯度更高,体外抗氧化活性更好的黄酮纯化物,旨在进一步深入和完善菠萝蜜果皮中天然活性产物的研究,使果皮变废为宝,提高菠萝蜜的资源综合利用率,以期进一步完善菠萝蜜副产物的生产加工利用,为菠萝蜜果皮中的天然抗氧化剂的开发提供参考依据和技术支持。
1 材料与方法
1.1 材料与仪器
菠萝蜜果皮 广州市天平架水果批发市场;芦丁标准品 上海源叶生物科技有限公司;NKA、D101、AB-8、D4020、NKA9、H103树脂 天津南开大学化工厂;氢氧化钠、氯化钠、氯化铝、亚硝酸钠、丙酮、乙醇、DPPH等试剂均为分析纯。
三频式超声波处理机KQ-500DE 昆山市超声仪器有限公司;恒温水浴锅 HH-4型 常州澳华仪器有限公司;紫外可见分光光度计 752型 上海精密科学仪器有限公司;旋转蒸发仪IKA HB10 德国艾卡仪器设备有限公司;冷冻干燥机FPU-1200 上海爱朗仪器有限公司;数字pH计PHS-2F 上海精密科学仪器有限公司;恒温水浴摇床ZD-85 常州市金坛科兴仪器厂;高效液相色谱仪LC-15C 日本岛津公司;台式高速离心机H/T16MM 湖南赫西仪器装备有限公司。
1.2 实验方法
1.2.1 黄酮供试液制备 以料液比为1∶25 的61%丙酮,于45 ℃下超声提取24 min,设超声功率为300 W。将所得提取液离心,上清液经旋转蒸发浓缩至无丙酮味,再用乙酸乙酯-水等体积液液萃取,将萃取后的水相冷冻干燥为粉末,然后用一定量的蒸馏水溶解即为黄酮供试液。
1.2.2 黄酮含量测定 分别吸取0.00,0.20,0.40,0.60,0.80,1.00 mL的0.98 mg/mL芦丁标准液于6支10 mL具塞比色管中,按照亚硝酸钠-硝酸铝-氢氧化钠比色法测定黄酮含量[19],并以芦丁标准液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,其回归方程为y=1.0116x-0.008,相关系数R2=0.9995,线性范围为0~1.0 mg/mL,吸取1mL样品作样品黄酮含量测定。
1.2.3 大孔树脂的静态吸附与解析
1.2.3.1 树脂筛选 树脂经预处理后,分别准确称取AB-8、D101、D4020、H103、NKA、NKA-9等6种不同极性的大孔树脂各2.0 g于锥形瓶中,加入0.90 mg/mL的黄酮供试液20 mL,置于摇床上以25 ℃,120 r/min的条件充分吸附24 h,取上清液测定平衡时黄酮含量;滤出提取液,用蒸馏水清洗树脂表面,再将树脂转移至100 mL三角瓶,加入20mL 95%乙醇,于相同条件下洗脱24 h,充分解吸后取上清液测定黄酮浓度。参照以下公式计算吸附量(Q0)、吸附率(Q1)及解析率(Q2),并以吸附率、解析率为指标选择最佳纯化大孔树脂类型。
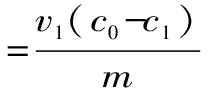
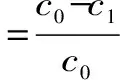
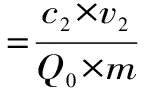
其中:c0:供试液浓度(mg/mL);c1:吸附平衡后浓度(mg/mL);c2:解析液浓度;v1:吸附滤液体积(mL);v2:解析液体积;m:树脂质量(g)。
1.2.3.2 静态饱和吸附动力学实验 按1.2.2.1中条件进行静态吸附,在振荡期间,每隔一段时间(0.5、1、2、4、6、8、12、20、24 h)测定三角瓶上清液中黄酮浓度,计算树脂的吸附量,绘制该树脂的静态吸附动力曲线。按1.2.2.1中条件进行静态解析,然后在振荡期间,每隔一段时间(0.5、1、2、4、6、8、12、20、24 h)测定三角瓶上清液中总黄酮浓度,计算树脂的解析率,绘制静态解析动力学曲线。
1.2.3.3 上样浓度的确定 测定冻干粉末中的黄酮含量,并取粉末配制成黄酮含量分别为0.101、0.307、0.500、0.702、0.904、1.101 mg/mL的上样液,按1.2.2.1中条件进行静态吸附和解析,每个浓度做3次平行。
1.2.4 大孔树脂的动态吸附解析
1.2.4.1 动态吸附上样量确定(渗透曲线) 取25.0 g预处理树脂,湿法装柱。上样液浓度为0.904 mg/mL,上样速率2 mL/min。每15 min测定一次流出液的黄酮浓度,当流出液黄酮浓度为上样液的10%时,认为达到树脂的渗透点,此时所用上样液的总体积为树脂动态吸附平衡所需的上样量。
1.2.4.2 洗脱液用量的确定(洗脱曲线) 吸附完全后,用蒸馏水淋洗柱子至流出液用1% NaOH检测无黄酮后再用70%乙醇进行洗脱,洗脱流速为2 mL/min,每15 min测定一次流出液的黄酮浓度,直至洗脱液流出液黄酮含量为0,用1% NaOH检测至无黄酮流出时停止洗脱。
1.2.4.3 NKA树脂动态吸附与解析单因素实验 以NKA为纯化树脂,0.904 mg/mL黄酮粗提液为上样浓度,设定动态吸附解析各单因素及水平如下:
上样流速:分别以2、3、4、5、6 mL/min流速上样;上样液 pH:分别用0.1%HCl和0.1%NaOH 调节pH至3、4、5、6、7上样;洗脱剂浓度:分别以10%、30%、50%、70%、95%的乙醇进行洗脱;洗脱流速:分别以2、3、4、5、6 mL/min的流速进行洗脱。
1.2.4.4 纯化工艺正交优化实验 通过NKA树脂动态吸附-解析进行纯化工艺优化,选择洗脱流速、上样液pH、洗脱液浓度为因素,以黄酮回收率为指标做正交优化实验,各因素及水平见表1。
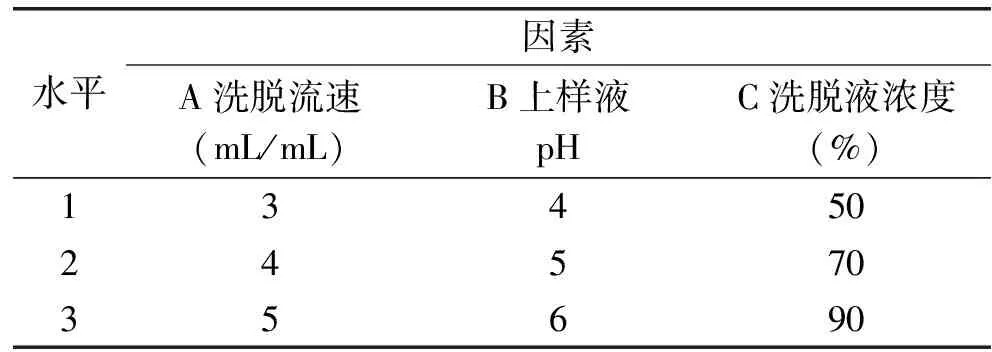
表1 正交实验因素及水平表
1.2.5 NKA大孔树脂纯化效果评价 黄酮纯度对比:取上柱前的水相液和经树脂洗脱后的洗脱液分别旋转蒸发并冷冻干燥,取等质量冻干样品分别测黄酮纯度。按以下公式计算黄酮纯度:
黄酮纯度(%)=(m1/m2)×100
式中,m1:洗脱液冻干物中黄酮类化合物含量mg;m2:洗脱液冷冻干燥后冻干物质量mg;
高效液相色谱分析对比:取等量上柱前后的样品溶于甲醇,采用岛津HPLC-15C系统,SPD-15C检测器;色谱柱Aglient,Zorbax XDB-C18(4.6 mm×250 mm,5-Micron)。色谱条件:进样量10 μL流速1.0 mL/min,柱温30 ℃,检测波长280 nm。采用二元高压梯度洗脱,流动相A:0.25%甲酸水溶液,流动相B:甲醇。洗脱程序:0~20 min,15%~56% B;20~30 min,56%~100% B;30~35 min,100%~15% B。
1.2.6 抗氧化活性测定
1.2.6.1 DPPH自由基清除率 参考陈海光等[10]方法测定。按以下公式进行计算DPPH自由基清除率:
式中:A0(对照):4.0 mL DPPH+0.5 mL无水乙醇;A1(反应):4.0 mL DPPH+样品溶液;A2(空白):4.0mL无水乙醇+样品溶液。
1.2.6.2 ·OH清除率 采用邻二氮菲-Fe2+氧化法,参考赵艳红等[11]方法测定。按照以下公式计算·OH清除率:
式中:A0:加入H2O2而不加样品时测得的吸光值;A1:未加样品及H2O2时测得的吸光值;A2:加入样品及H2O2时测得的吸光值。
1.2.6.3 还原能力测定 采用普鲁士兰法,参考陈洪璋等[12]方法测定。吸光值越大,还原能力越强。
1.3 数据处理
使用Origin 8.5作图,SPSS 19.0对数据进行统计分析。
2 结果与分析
2.1 大孔树脂的静态吸附与解析
2.1.1 树脂筛选 大孔树脂的吸附率和解析率能直接反映树脂对目标物的亲和力。由图1可知,6种树脂对黄酮吸附率大小顺序是:AB-8>D101>NKA>D4020>NKA9>H103,其中AB-8、D101、NKA三种树脂吸附率相差不显著,比较三者的解析率可以看出,AB-8对于菠萝蜜果皮黄酮的解析率明显低于D101和NKA,其中NKA树脂对黄酮的解析率高达98.42%,而D4020树脂虽然解析率高,但吸附效果明显弱于NKA。因此选用NKA和D101两种树脂为菠萝蜜黄酮初步纯化的树脂作为进一步筛选对象。
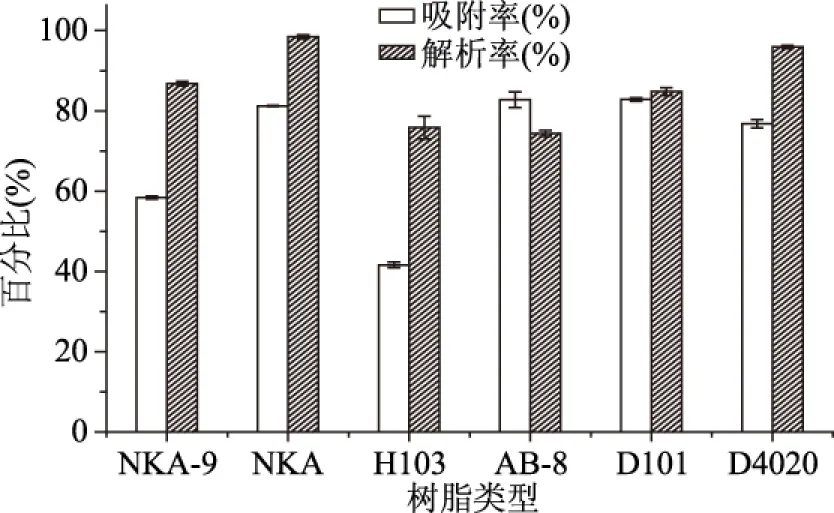
图1 6种大孔树脂的静态吸附和解吸性能Fig.1 Static adsorption/desorption properties of 6 kinds of macroporous resin
2.1.2 静态饱和吸附动力学实验 仅用树脂吸附率和解析率来评价其吸附性能并不全面,性能优良的树脂不仅要具有较好的吸附率和解析率,同时还应具有较快的吸附速率和解析速率。由图2和图3可知,这两种树脂均属于快速平衡型树脂,比较可知,NKA树脂达到吸附平衡的速度更快,且吸附率也较高;D101树脂虽然解析平衡时间与NKA几乎相同,但其解析率远低于NKA,综合考虑,选择NKA大孔吸附树脂为菠萝蜜果皮黄酮最佳分离纯化树脂。
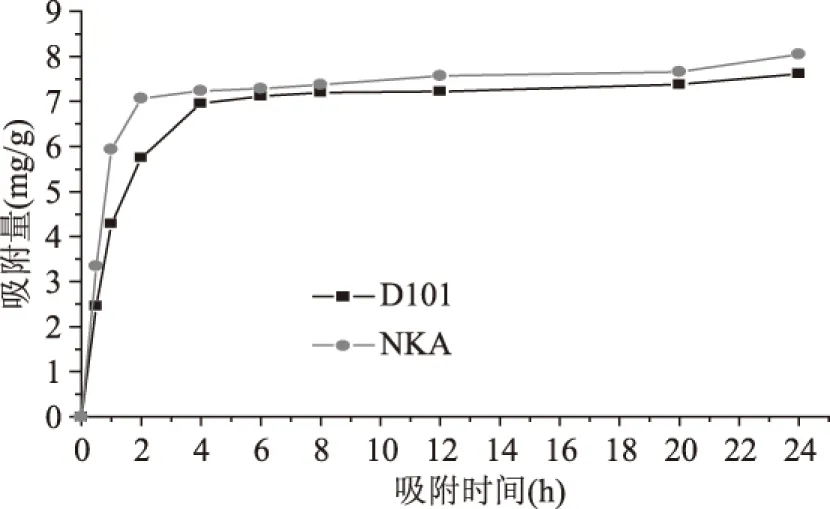
图2 NKA和D101静态吸附动力学曲线Fig.2 Adsorption kinetics curve of NKA and D101
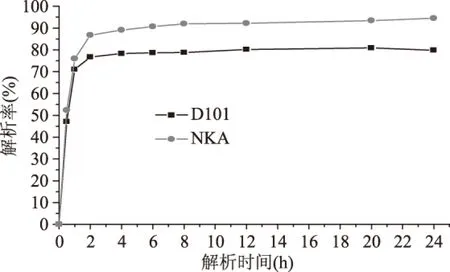
图3 NKA和D101静态解析动力学曲线Fig.3 Desorption kinetic curves of NKA and D101
2.1.3 上样浓度的确定 由图4可知,随着样品黄酮浓度的增大,吸附率和解析率均呈现先上升后下降的基本趋势,且当黄酮浓度为0.90 mg/mL时,吸附率和解析率最高。这是因为低浓度下,随黄酮浓度增大增加与树脂的接触率,提高吸附率,同时低浓度下解析也更充分;但持续增大浓度,黄酮吸附量逐渐饱和,吸附率反而下降,且与黄酮竞争吸附的杂质也越多,高浓度下解析,由于吸附孔隙填塞密集,会阻碍黄酮分子在解析过程中的反向扩散,导致树脂解析率下降。故0.90 mg/mL为最佳上样浓度。
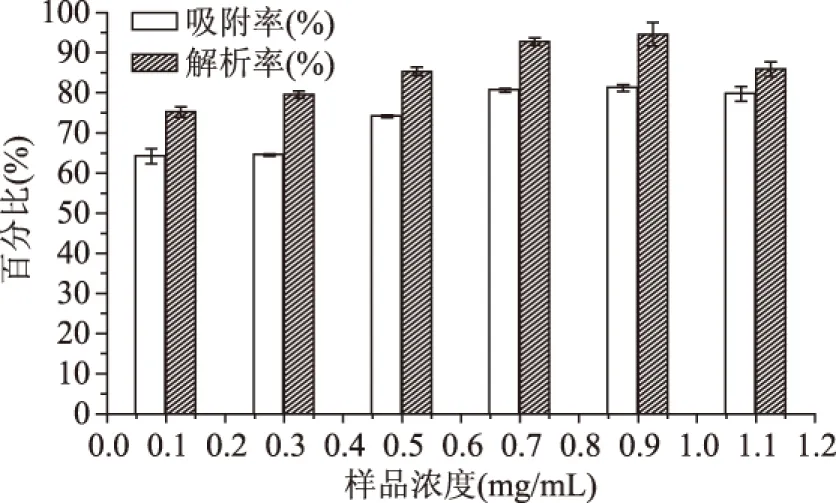
图4 样品浓度对树脂吸附率和解析率的影响Fig.4 Effect of sample concentrations on the static adsorption/desorption properties of resin
2.2 大孔树脂的动态吸附解析
2.2.1 动态吸附渗透曲线的绘制 由图5可以看出,菠萝蜜果皮水相黄酮的动态吸附渗透曲线为理想的S形曲线。随着上样体积的增加,其流出液的黄酮含量由最初的缓慢增大到迅速增大,说明当上样体积到达100 mL以后,大孔树脂的的吸附能力逐渐开始趋于饱和;当上样体积增至200 mL时,渗透曲线基本平缓,黄酮吸附量达到饱和,且当上样体积为200 mL时,流出液黄酮浓度大于上样液的10%,认为已达到树脂的渗透点,因此可以确定200 mL为树脂动态吸附平衡所需的上样量。
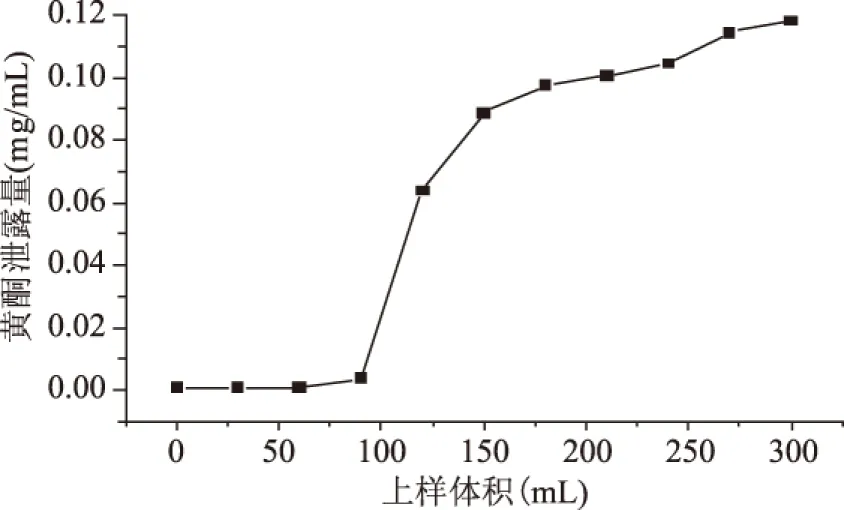
图5 NKA树脂的动态吸附渗透曲线Fig.5 Leakage curve of dynamic adsorption by NKA macroporous resin
2.2.2 动态吸附洗脱曲线的绘制 由图6可以看出,NKA树脂的洗脱曲线峰形较好,无明显拖尾现象,树脂的洗脱效果显著,样品基本不挂柱不残留。随着洗脱剂用量的增加,洗脱液中黄酮含量呈现先增大后减少的趋势,在洗脱剂用量增至60 mL时,洗脱液中黄酮含量已经很低,表明绝大多数黄酮在前60 mL洗脱液中被洗脱,当洗脱剂用量达到120 mL时,黄酮含量趋近于零,可以认为柱中黄酮物质已基本洗脱完全,可以停止洗脱。

图6 NKA树脂的动态洗脱曲线Fig.6 Dynam eluent curve of NKA macroporous resin
2.2.3 NKA树脂动态吸附与解析单因素实验 由图7和图8可知,上样流速对树脂吸附率的影响不显著,而随着上样pH的增大,树脂吸附率先升高后降低,且当样品pH为5时吸附率最高;黄酮回收率整体随上样流速和样品pH的增大呈现先升高后降低的趋势。这可能是由于NKA树脂为快速平衡型树脂,能迅速达到吸附平衡,故上样流速对吸附率的影响较少,但随着流速的增大,部分样品不能稳定地吸附于树脂内部,洗脱时黄酮损失增大,使回收率降低;pH变化可以影响黄酮在溶液中的存在形式,碱性条件下酚羟基会离子化,一般降低pH有利于样品吸附,但pH过低又会使样品在强酸条件下变性成盐。
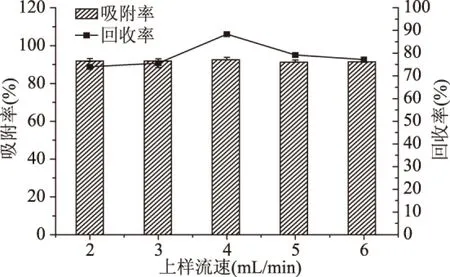
图7 上样流速对菠萝蜜果皮黄酮纯化效果的影响Fig.7 Effect of sample flow rate of the purification of jackfruit peel flavonoids
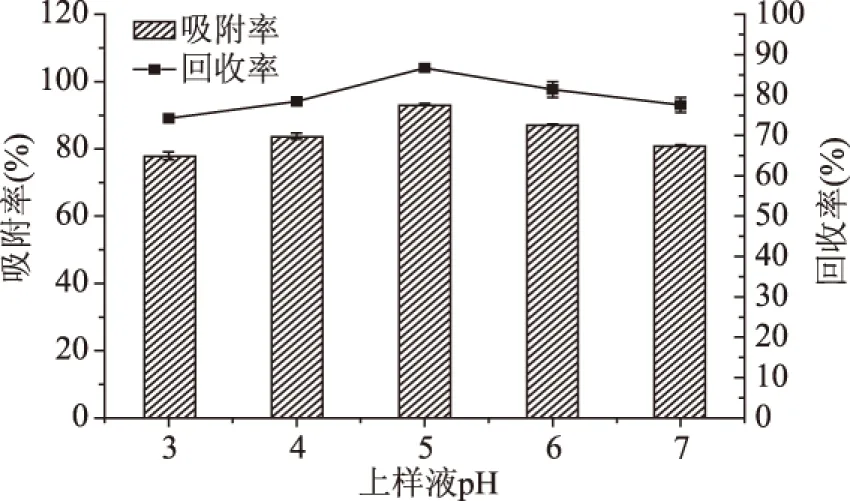
图8 上样pH菠萝蜜果皮黄酮纯化效果的影响Fig.8 Effect of sample pH values of the purification of jackfruit peel flavonoids
由图9和图10可知,随洗脱流速和乙醇浓度的增大,树脂解析率和黄酮回收率先增大后减少,当洗脱流速为4 mL/min,70%的乙醇浓度时,解析率和回收率达到最大值。由于洗脱流速过低,不能充分洗脱吸附在树脂内部的黄酮,而当洗脱流速过大时会导致部分黄酮未能及时被洗脱下来从而降低解析率和回收率;洗脱剂极性不同,与目标物的亲和力也不同,由图10可以看出,菠萝蜜果皮黄酮与70%乙醇有较好的亲和性。
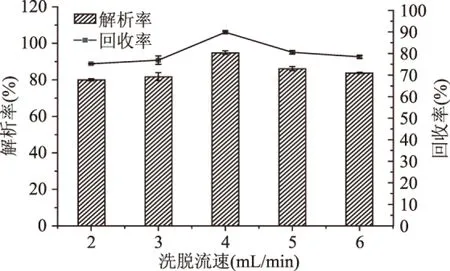
图9 洗脱流速对树脂解析率和黄酮回收率的影响Fig.9 Effect of elution flow rate of the purification of jackfruit peel flavonoids
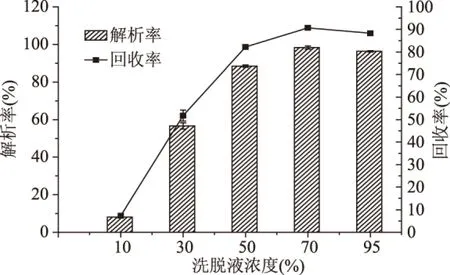
图10 乙醇浓度对树脂解析率和黄酮回收率的影响Fig.10 Effect of ethanol concentration of the purification of jackfruit peel flavonoids
2.2.4 纯化工艺正交优化实验 如表2所示,比较极差R可知,影响菠萝蜜果皮总黄酮回收率的各因素主次顺序为:C>B>A,即洗脱剂浓度>上样液pH>洗脱流速,NKA树脂对菠萝蜜果皮黄酮的最佳纯化工艺组合为A2B2C2,即洗脱流速为4 mL/min,上样pH为5,洗脱剂浓度为70%,在此条件下验证菠萝蜜果皮总黄酮回收率高达96.72%,纯化效果最好。

表3 大孔树脂NKA纯化菠萝蜜果皮黄酮的纯度对比
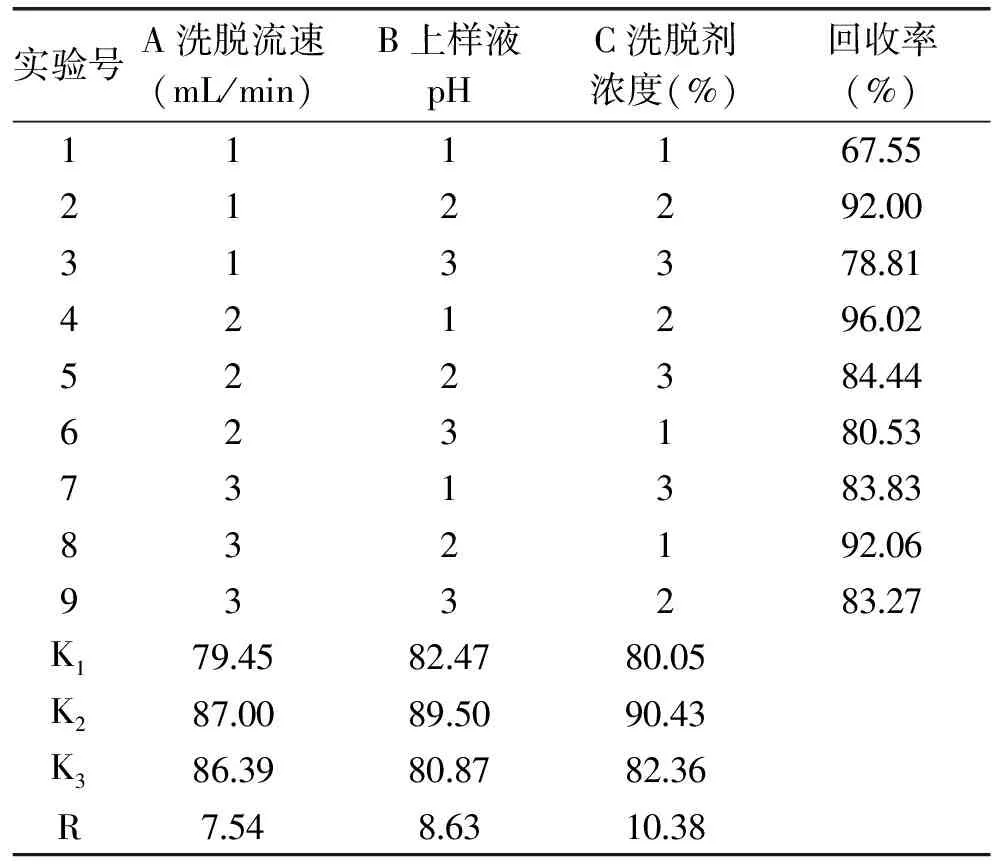
表2 正交实验分析结果
2.2.5 NKA大孔树脂纯化效果评价 纯度对比:由表3可知,经NKA树脂过柱纯化后,菠萝蜜果皮黄酮的纯度由原来的16.74%提高到84.42%,提高了4.04倍,且黄酮回收率高达96.41%,RSD%值不超过3%,表明实验精密度较好,工艺条件稳定便于控制,因此利用NKA树脂对菠萝蜜果皮黄酮进行富集纯化具有显著的效果。
高效液相色谱分析对比:由图11和图12可以看出过柱后样品杂质峰大为减少,样品纯度得到有效提高。图11中除两个明显尖锐的物质峰之外还有许多响应值低、分离度不好的杂质峰堆积,从图12中可看出这些杂质经过NKA树脂过柱纯化后被基本除去,仅剩保留时间为2.593 min的黄酮物质峰,且峰型尖锐、对称性良好,基本无其他杂质;而保留时间为10.679 min的物质峰也经NKA树脂过柱除去,可能是因为该物质的极性与70%乙醇洗脱剂极性相差甚远而未被洗脱出来。
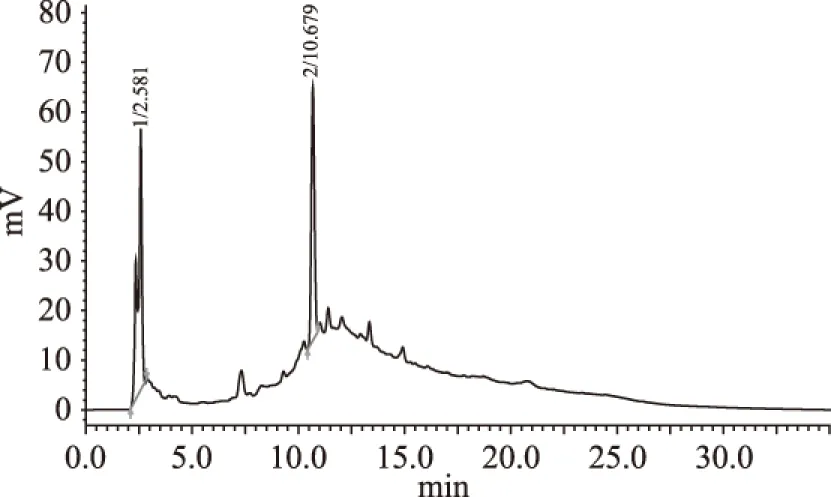
图11 过柱前菠萝蜜果皮水相粗提液液HPLC分析Fig.11 The results of HPLC analysis over the front pillar jackfruit peel flavonoids extract
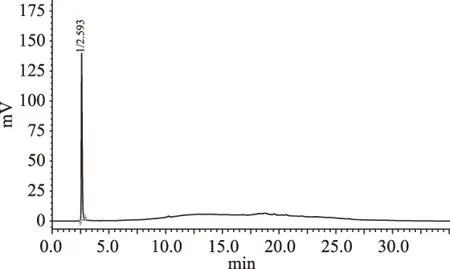
图12 过柱后70%乙醇洗脱液HPLC分析Fig.12 The results of HPLC analysis of 70% ethanol eluent jackfruit peel flavonoids
2.3 体外抗氧化活性比较
2.3.1 纯化前后黄酮自由基清除能力对比 取经NKA树脂纯化的样品洗脱液和上柱前的水相粗提液,分别测定它们在不同浓度条件下对DPPH·和·OH的清除率,并分别以同浓度下的VC和BHT溶液为对照。由图13和图14可知,在等浓度条件下,纯化后的洗脱液其DPPH·和·OH清除率远高于上柱前水相粗提液和对照溶液;当样品浓度较低时,水相粗提液DPPH自由基清除力略低于VC溶液,但随样品浓度的增大,自由基清除能力迅速提高,并逐渐超越VC溶液,而纯化后的洗脱液对·OH清除能力始终高于过柱前水相粗提液和BHT溶液,由此可知NKA树脂纯化对于菠萝蜜果皮中黄酮的DPPH自由基清除能力有显著提高的作用。
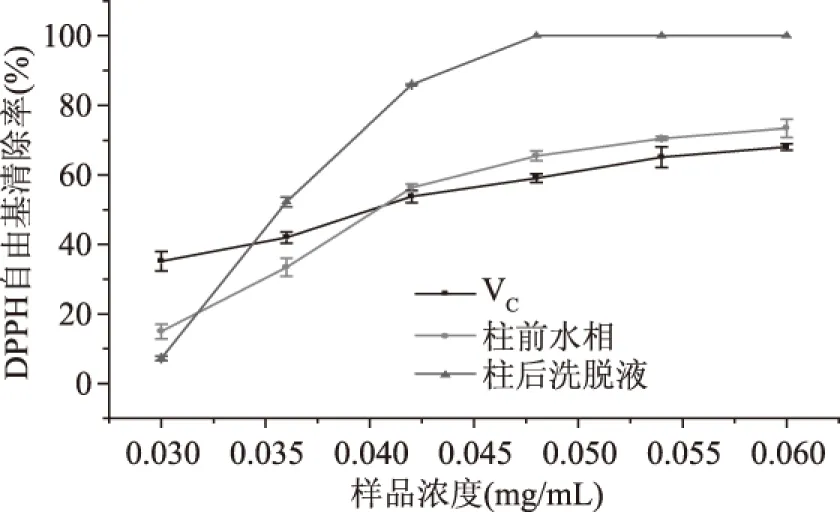
图13 纯化前后样品DPPH自由基清除能力对比Fig.13 DPPH radical scavenging ability of purified samples before and after

图14 纯化前后样品·OH清除能力Fig.14 ·OH radical scavenging ability of purified samples before and after
2.3.2 纯化前后黄酮还原能力对比 取经NKA树脂纯化的样品洗脱液和上柱前的水相粗提液,分别测定它们在不同浓度条件下的还原能力,并以同浓度的VC溶液为对照。由图15可知,等浓度下还原能力的大小顺序为:柱后洗脱液>柱前水相>VC溶液,且随着样品浓度的增大其还原能力随之提高,低浓度下二者有较好的线性关系,表明经NKA纯化可以有效提高菠萝蜜果皮黄酮样品的还原能力。
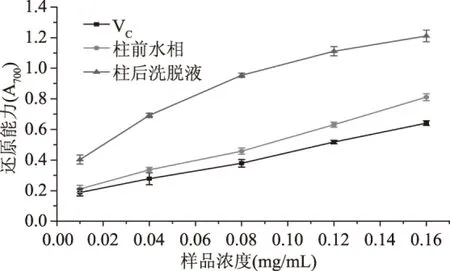
图15 纯化前后样品还原能力对比Fig.15 Comparative reducing ability of purified samples before and after
2.3.3 纯化前后自由基清除率IC50值比较 IC50值是指自由基清除率为50%时,抗氧化剂的浓度值,IC50值越小抗氧化能力越好。对比纯化前后样品的自由基清除率IC50值,由表4可知柱后洗脱液的DPPH·和·OH清除率IC50值均小于柱前水相,且与对照的VC溶液和BHT溶液相比,柱后洗脱液的自由基清除率IC50值远低于对照溶液,表明随着黄酮纯度的提高,样品的体外抗氧化活性也随之提高,且活性远优于对照溶液。

表4 纯化前后自由基清除率IC50值比较
3 结论
本实验从6种不同类型的大孔树脂中筛选出NKA树脂作为菠萝蜜果皮黄酮的分离纯化树脂,分别考察样品浓度、上样体积、洗脱体积等上柱条件,最终确定合适的上柱样品浓度为0.90 mg/mL、上样体积为200 mL、洗脱剂用量为120 mL。在此基础上,以上样流速、上样pH、洗脱流速、洗脱剂浓度为单因素并进行正交优化实验,得到最佳的纯化工艺为:上样流速和洗脱流速为4 mL/min,上样pH为5,洗脱剂浓度为70%乙醇。获得的菠萝蜜果皮总黄酮纯度由原来的16.74%提高到84.42%,提高了4.04倍,回收率高达96.41%,液相分析图峰形尖锐对称性好,杂质少,纯化效果显著;对纯化前后样品进行体外抗氧化活性进行对比,结果表明,随着黄酮纯度的提高,样品的体外抗氧化活性显著提高,具有优良的体外抗氧化活性。
[1]Manjeshwar Shrinath Baliga,Arnadi Ramachandrayya Shivashankara,Raghavendra Haniadka,et al.. Phytochemistry,nutritional and pharmacological properties of Artocarpus heterophyllus Lam(jackfruit):A review[J]. Food Research International,2011,44(3):1800-1811
[2]Ajayi I A. Comparative study of the chemical composition and mineral element content of Artocarpus heterophyllus and Treculia africana seeds and seed oils[J]. Bioresource Technology,2008,99(11):5125-5129.
[3]Kittipongpatana O S,Kittipongpatana N. Preparation and physicochemical properties of modified jackfruit starches[J]. LWT-Food Science and Technology,2011,44(8):1766-1773.
[4]Rengsutthi K,Charoenrein S. Physico-chemical properties of jackfruit seed starch(Artocarpusheterophyllus)and its application as a thickener and stabilizer in chilli sauce[J]. LWT-Food Science and Technology,2011,44(5):1309-1313.
[5]Nayak A K,Pal D. Blends of jackfruit seed starch-pectin in the development of mucoadhesive beads containing metformin HCl[J]. International Journal of Biological Macromolecules,2013,62:137-145.
[6]Kumar Nayak A,Pal D,Hasnain M. Development,Optimization andinvitro-invivoEvaluation of Pioglitazone-Loaded Jackfruit Seed Starch-Alginate Beads[J]. Current Drug Delivery,2013,10(5):608-619.
[7]Wang Y,Deng T,Lin L,et al.. Bioassay-guided isolation of antiatherosclerotic phytochemicals from Artocarpus altilis[J]. Phytotherapy Research,2006,20(12):1052-1055.
[8]郝倩. 菠萝蜜叶黄酮类化合物的提取及其浸膏的应用[D]. 北京:北京林业大学,2014.
[9]Joshee N,Bastola D R,Agrawal V P,et al.. Lakoocha:a multipurpose tree of warm climates[J]. Trends in New Crops and New Uses. ASHS Press,Alexandria,VA,2002:405-406
[10]台建祥,范鸿雁,薛慧,等. 菠萝蜜果皮果胶提取工艺的优化[J]. 食品科技,2014,39(1):236-239.
[11]宋贤良,张星启,蔡纯,等. 菠萝蜜皮果胶酸提醇沉工艺优化及其结构分[J]. 南方农业学报,2015,46(04):664-668.[12]Ooi Z X,Ismail H,Abu Bakar A,et al.. Effects of jackfruit waste flour on the properties of poly(vinyl alcohol)film[J]. Journal of Vinyl and Additive Technology,2011,17(3):198-208.
[13]沈楠,黄晓东,李治伟,等. 萱草花总黄酮改善CCl4致大鼠肝纤维化的作用[J]. 药学学报,2015,50(5):547-551.
[14]Kerubo L O,Midiwo J O,Derese S,et al.. Antiplasmodial activity of compounds from the surface exudates of Senecio roseiflorus[J]. Natural Product Communications,2013,8(2):175-176.
[15]Dórea J,Pereira L,Ferreira A L,et al.. Chemical composition and fermentation dynamics of jackfruit silage.[J]. Semina:Ciências Agrárias(Londrina),2013,34(4):1967-1975.
[16]钟良瑞,林霜,魏克民. 三叶青黄酮抗肺癌作用研究[J]. 中国药理学通报,2016,32(4):480-483.
[17]彭芍丹. 菠萝蜜果皮抗氧化活性成分的研究[D]. 海口:海南大学,2014.
[18]王佳珺. 菠萝蜜下脚料中多酚的分离与分析[D]. 广州:华南理工大学,2012.
[19]邓梦琴,宋贤良,林晓瑛,等. 超声辅助提取菠萝蜜果皮黄酮工艺优化及体外抗氧化活性研究[J/OL]. 食品工业科技,http://www. cnki. net/kcms/detail/11. 1759. TS.20160913. 1014.010.html.
Study on antioxidant activity of flavonoids extracted from jackfruit skin separated and purified by macroporous resin technology
DENG Meng-qin,LIN Xiao-ying,ZHANG Ming,SONG Xian-liang*,HUANG Wei
(Food College of South China Agricultural University,Guangzhou 510450,China)
Flavonoid crude extracts distilled from jackfruit skin were selected as test solution in this study. NKA resin was picked up as the best separation and purification resin from six kinds of macroporous resins with different polarity through static adsorption analysis,meanwhile,the analytical conditions of dynamic adsorption of NKA column chromatography were explored as well. The results showed the optimized parameters of analytical conditions were sample concentration of 0.90 mg/mL,the sample volume of 200 mL,and the elution dose of 120 mL. The best purification process was obtained by the single factor and orthogonal experiments which were 4 mL/min,pH5 and 70% ethanol concentration on sampling and elution flow rate,sampling pH value and ethanol concentration. The recovery rate of flavonoids was as high as 96.02% in this cases. The purity of flavonoids was increased from 16.74% to 84.42% and increased about 4.04 times after post-column,which indicated that NKA resin had a significant effect on the enrichment and purification of flavonoids from jackfruit skin. Results ofinvitroantioxidant activity showed that the purified flavone with NKA column chromatography exhibited significantly enhancement with increased purity of flavonoids compared with that unpurified.
jackfruit peel;separation and purification;antioxidant activityinvitro
2016-08-25
邓梦琴(1991-),女,硕士,研究方向:食品加工,E-mail:dmq503592509@163.com。
*通讯作者:宋贤良(1969-),男,博士,副教授,主要从事食品加工新技术的研究,E-mail:songxl2000@163.com。
公益性行业(农业)科研专项(201303077)。
TS209
B
1002-0306(2017)05-0246-07
10.13386/j.issn1002-0306.2017.05.038
