仿刺参精酶解工艺条件优化及体外抗氧化
2017-06-01刘少伟王共明赵云苹刘京熙井月欣
张 健,刘少伟,张 毅,王共明,赵云苹,刘京熙,井月欣,刘 芳
(1.华东理工大学,生物工程学院,生物反应器国家重点实验室,上海 200237;.中国科学院上海生命科学研究院,上海 200233;3.山东省海洋资源与环境研究院,山东烟台 264006)
仿刺参精酶解工艺条件优化及体外抗氧化
张 健1,2,3,刘少伟1,*,张 毅2,王共明3,赵云苹3,刘京熙3,井月欣3,刘 芳3
(1.华东理工大学,生物工程学院,生物反应器国家重点实验室,上海 200237;.中国科学院上海生命科学研究院,上海 200233;3.山东省海洋资源与环境研究院,山东烟台 264006)
本研究以仿刺参精(Apostichopusjaponicusspermary,ASJS)为材料,以水解度为指标优化了酶解工艺条件,并考察了酶解产物的体外抗氧化效果。实验选用木瓜蛋白酶(PAP)、复合蛋白酶(PRO)和风味蛋白酶(FLA)作为实验用酶,以双缩脲法结合三氯乙酸法测定水解度,通过单因素与正交实验,优化了单酶酶解工艺条件,并与双酶及三酶复配水解进行了比较实验,最后对不同的水解产物进行了体外抗氧化活性测定。结果表明:单酶最佳酶解工艺条件为PAP:酶添加量3.0%、温度70 ℃及反应时间4 h;PRO:酶添加量3.0%、温度45 ℃及反应时间4 h;FLA为:酶添加量2.0%、温度45 ℃及反应时间4 h。在最佳酶解工艺条件下PAP水解度为32.14%,PRO为31.09%,FLA为11.89%。双酶及三酶的复配水解工艺检测到的水解度均低于单PAP及单PRO。不同水解产物清除羟自由基和超氧阴离子自由基能力结果为,在样品浓度为5 mg/mL和10 mg/mL时,ASJS的PAP酶解产物好于PRO、FLA、双酶、三酶复配,同时也好于仿刺参卵及体壁PAP酶解产物。综上可知,ASJS的PAP水解产物显示出较好的体外抗氧化活性,可以进一步开发利用。
仿刺参精,酶解,正交优化,抗氧化
海参营养成分丰富,是高蛋白低脂肪的营养滋补品[1],含有胶原蛋白、多糖、多肽、皂苷、脂肪酸等多种活性成分,其中如海参多糖具有抗肿瘤、抗凝血及降血脂等活性[2-4],海参皂苷具有抗真菌、抗肿瘤及提高免疫等活性[5-6],海参肽具有抗疲劳、抗氧化及镇痛等活性[7-8]。
海参加工过程中通常产生大量的副产物,如海参肠道、海参卵和海参精等,已有研究表明,这些加工副产物同样含有丰富的营养成分[9-10],其中海参精是海参的雄性生殖腺组织,营养成分丰富,是高蛋白低脂肪的营养品,其蛋白质和氨基酸含量很高,不饱和脂肪酸及矿物元素含量也很丰富[11]。开展海参副产物的加工利用研究,将促进开发新的海参制品,节约资源,繁荣市场,企业增效。
仿刺参精作为海参加工过程的副产物,营养价值很高,但是开发利用程度较低,以此为原料的研究结果也较少,本实验以新鲜ASJS为研究对象,从几种常用中性蛋白酶中优化出最佳酶解工艺条件,并对多种水解产物的抗氧化活性进行了比较研究,为开发制备新型抗氧化活性物质提供了素材。
1 材料与方法
1.1 材料与仪器
鲜仿刺参生殖腺 烟台华康海洋食品有限公司;木瓜蛋白酶(PAP) 南宁庞博生物工程有限公司;风味蛋白酶(FLA)与复合蛋白酶(PRO) 丹麦诺维信公司;抗氧化(清除羟自由基及超氧阴离子)测定试剂盒 南京建成生物工程研究所;牛血清清蛋白标准溶液 生工生物工程上海股份有限公司;其他试剂 均为国产分析纯。
Kjeltec 2300型全自动凯氏定氮仪 丹麦Foss公司;AR1140电子天平 美国Ohaus公司;高速离心机 德国Eppendorf有限公司;TU-1810DASPC分光光度计 北京普析通用仪器有限公司;恒温水浴锅 常州中捷实验仪器制造有限公司;JMF-365胶体磨 烟台星火轻工机械设备有限公司。
1.2 实验方法
1.2.1 酶解工艺流程 新鲜仿刺参→显微鉴定分出ASJS→清洗沥干→匀浆→加蛋白酶酶解→灭酶→高速离心→取上清液待测
1.2.2 指标测定
1.2.2.1 总蛋白质含量测定 凯氏定氮法[12]。
1.2.2.2 可溶性蛋白的测定 使用双缩脲法,具体操作如下:配制0、2、4、6、8、10、12、14 mg/mL的牛血清清蛋白标准溶液,将标准溶液1 mL与双缩脲试剂4 mL混匀反应,在室温(20~25 ℃)下静置30 min,在540 nm下测定吸光度,绘制的标准曲线;样品中可溶性蛋白含量的测定参照上述步骤操作,通过回归方程计算求得样品中可溶性蛋白含量[13]。
1.2.2.3 水解度的测定 使用三氯乙酸(TCA)法。取酶解液5 mL与TCA(质量分数为10%)5 mL充分混匀,静置10 min,然后以10000 r/min离心10 min,以双缩脲法测定上清液中可溶性蛋白含量,以凯氏定氮法测ASJS中总蛋白含量[14]。按照下式计算水解度(%)。
式中:N1为反应后ASJS酶解液中可溶性蛋白含量(mg/mL);N2为反应前ASJS中可溶性蛋白含量(mg/mL);N0为ASJS中总蛋白含量(mg/mL)[15]。
1.2.3 单因素实验 选择PAP、PRO和FLA三种最适pH为中性范围的蛋白酶,分别对三种酶的温度、酶添加量和反应时间3个因素进行考察。根据文献并结合酶制剂说明书制定三种酶的单因素实验条件为:温度:40、50、60、70、80 ℃;酶添加量:0.5%、1%、2%、3%、5%;反应时间:1、3、5、7、9 h[16-17],不变的条件为PAP:温度70 ℃,PRO和FLA温度:50 ℃,酶添加量均为:3%,反应时间均为5 h。
1.2.4 正交实验设计 经过单因素实验后,继续考察温度、酶添加量和反应时间对水解度的影响,采用正交实验设计对工艺条件进行优化,得出三种蛋白酶各自最优的水解工艺。实验设计采用L9(34)正交表,PAP因素水平表如表1所示,PRO和FLA因素水平表如表2所示。
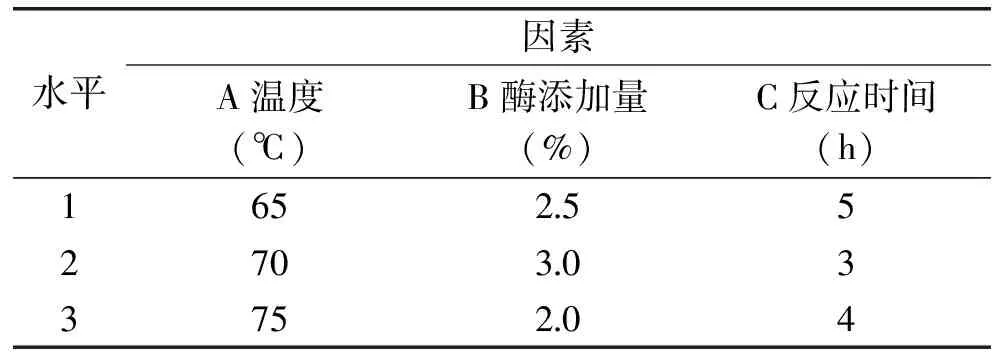
表1 正交因素水平表

表2 正交因素水平表
1.2.5 多酶复配的比较实验 通常蛋白酶因为酶切位点及作用方式的不同,具有不同的水解效果。参照前期的研究[18],对ASJS双酶及三酶复配进行实验。双酶复配实验采用PAP、PRO及FLA两两复配同时加入的方式进行。三酶水解方式为先用双酶(PAP与PRO)在温度70 ℃,酶添加量各1%条件下水解4 h,煮沸灭活后,间隔2 h再添加FLA继续水解,FLA水解条件为:温度45 ℃,酶添加量1%,反应时间1 h,酶灭活后测定其水解度。最后比较单酶、双酶及三酶复配的水解实验效果[18]。
1.2.6 体外抗氧化活性研究 经过ASJS酶解工艺条件优化后,使用一定的酶添加量,在各自最适宜温度下反应一定的时间,制备出多种ASJS水解产物。同时,采用与ASJS的PAP酶解相同步骤,对仿刺参卵和体壁进行水解,制备出仿刺参卵PAP水解产物和体壁PAP水解产物,制备采用的水解条件统一为酶添加量3%、时间5 h及各自最适温度,共制备出9种不同的水解产物。对这几种水解产物进行体外抗氧化(清除羟自由基和超氧阴离子)活性的测定。
1.2.6.1 清除羟自由基能力测定 使用羟自由基测定试剂盒,根据试剂盒操作说明测定不同水解产物清除羟自由基能力。
1.2.6.2 清除超氧阴离子自由基测定 使用清除超氧阴离子自由基测试盒,根据试剂盒操作说明测定不同水解产物清除超氧阴离子自由基能力。
1.2.7 数据处理与统计分析 采用Excel 2007软件整理数据,SPSS 22. 0软件进行正交实验设计及显著性分析。
2 结果与分析
2.1 可溶性蛋白标准曲线
按照双缩脲法标准曲线的制作步骤,绘制的标准曲线如图1所示。由图可以看出,经线性回归分析,双缩脲法测量牛血清清蛋白时,当蛋白质含量在0~12 mg/mL时,线性关系最好,标准曲线方程为y=0.0459x+0.0108(R2=0.9996)。
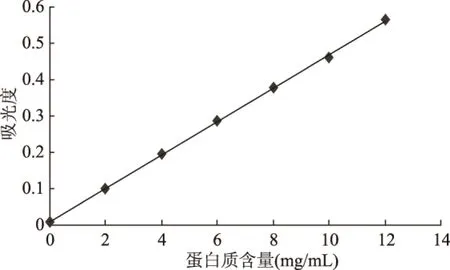
图1 双缩脲法标准曲线Fig.1 Standard curve of bovine serum albumin
2.2 ASJS酶解单因素实验结果
2.2.1 不同温度下ASJS水解度结果 由图2可知,随着温度由低到高,使用PAP组的水解度逐渐升高,当温度上升到70 ℃时,水解度达到30%左右。温度继续升高,水解度依然有所提高,推测原因在于PAP的适宜温度范围在10~85 ℃,在70~80 ℃仍存在一定的水解活力;另外推测,较高的反应温度可能激活了ASJS材料自身含有的自溶酶,进一步对精蛋白进行了水解,使得测定的水解度呈现出升高的现象,这与之前的相关研究结果类似[19]。综合考虑加热成本,水解度等因素后,确定进一步对PAP反应温度在70 ℃左右进行考察。
PRO是一种杆菌蛋白酶复合体,低添加量时也可以产生没有苦味的水解液,FLA是一种蛋白酶/肽酶复合物,在酶活力方面具有内切和外切两种作用;不同温度对PRO与FLA水解度的作用结果基本一致,均是随着温度逐渐提高,水解度出现先升高后下降结果,在80 ℃时出现回升情况,推测也是高温下自溶酶作用的结果[19]。根据实验结果,且参考各自最适温度范围,确定对PRO与FLA反应温度在50 ℃左右进一步优化。
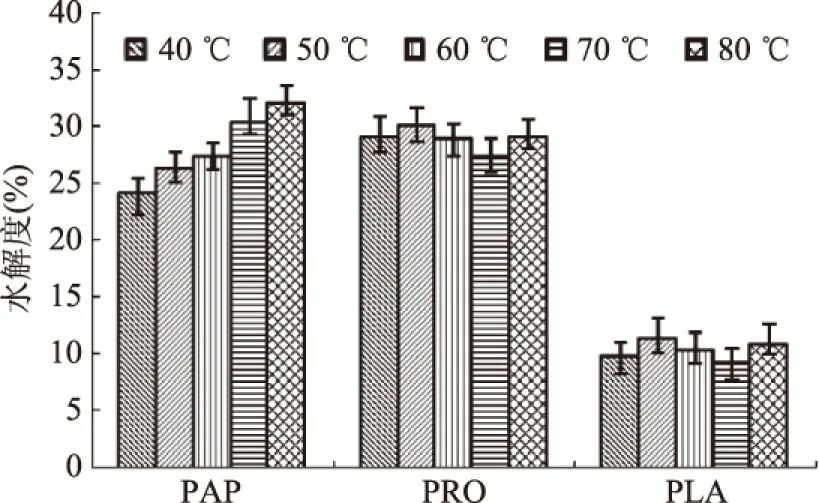
图2 不同温度下ASJS水解度结果Fig.2 Results of hydrolysis degrees of ASJS under different temperatures
2.2.2 不同酶添加量下ASJS水解度结果 由图3可以看出,当PAP酶添加量由0.5%增加到3%时,水解度随着酶添加量增加逐渐增加,当酶添加量由3%到5%时,水解度增加很小。考虑到较高的酶添加量会提高综合加工成本,故确定对PAP的酶添加量继续在3%左右进行考察。
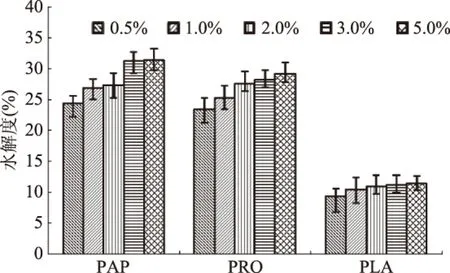
图3 不同酶添加量下ASJS水解度结果Fig.3 Results of hydrolysis degrees of ASJS by different enzyme dosages
PRO与FLA水解度均是随酶添加量增加而升高,而当酶添加量由3.0%到5.0%时,水解度增加变缓,综合考虑降低成本的需要,故选择PRO与FLA酶添加量均为3.0%左右进行进一步优化。
2.2.3 不同反应时间下ASJS水解度结果 由图4可知,在5 h内PAP水解度随着反应时间增加而逐渐升高,在5~9 h时,水解度升高趋势变的较缓慢,考虑到长时间水解会增加生产成本和造成微生物滋生,故选择对PAP的反应时间考察围绕5 h的时间点展开。
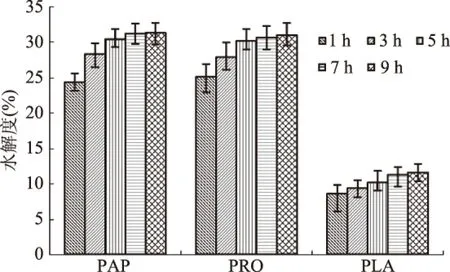
图4 不同反应时间下ASJS水解度结果Fig.4 Results of hydrolysis degrees of ASJS under different time
不同反应时间对PRO与FLA的水解度作用趋势基本相同,均是在5 h以内水解度随着反应时间增加而逐渐升高,而在5 h之后增加程度减缓,故确定PRO与FLA的反应时间也在5 h左右进行优化。
2.3 ASJS正交实验优化结果
2.3.1 PAP正交实验结果 在单因素实验结果之上,对温度、酶添加量和反应时间这3个因素进行进一步考察优化,实验结果和显著性分析结果如表3、表4所示。
由正交实验表直观分析可得出A3B2C1组合较好,对PAP水解度的影响三种因素主次顺序为:酶添加量>温度>反应时间,即酶添加量对实验的影响最大,温度次之,反应时间最小。由表4可得出酶添加量对水解度具有显著影响,温度和反应时间两个因素的影响均不显著。相关研究指出在正交实验中应严格控制具有显著影响的因素,而对于不显著因素,通常根据实际生产中操作性及经济成本等具体情况选择优水平[20]。经综合考虑后选择反应时间较短且水解度与A3B2C1相差很小的A2B2C3组合为最优组合,ASJS的PAP酶解优化工艺条件为:温度70 ℃、酶添加量3.0%、反应时间4 h。在此条件下进行实验,测得水解度为32.14%。
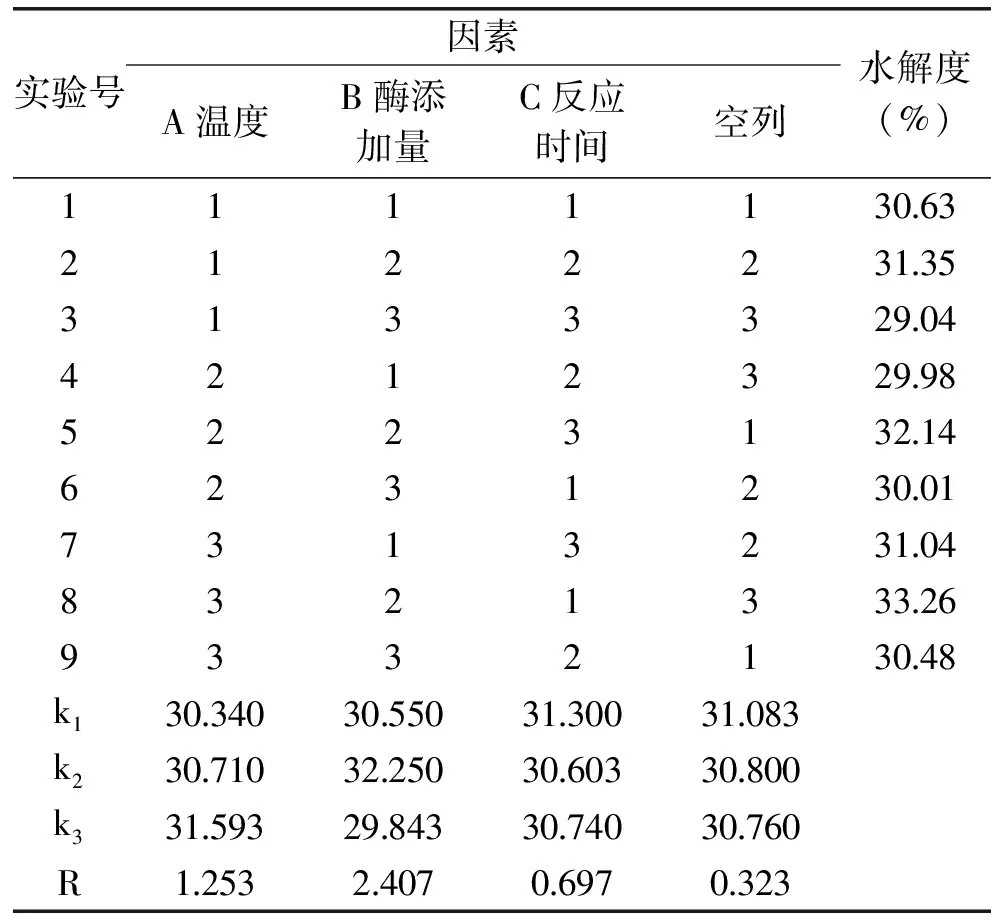
表3 PAP酶解正交实验
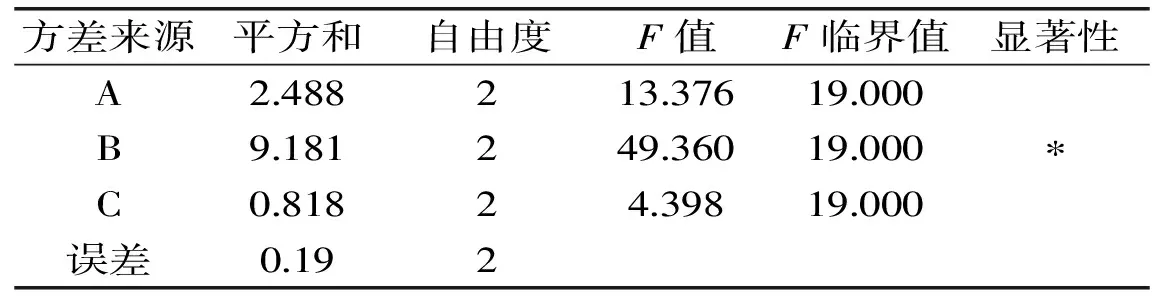
表4 PAP酶解显著性分析结果
注:显著性差异用*标注;置信水平为0.95,表6、表8同。2.3.2 PRO正交实验结果 在单因素实验结果之上,采用正交实验设计对温度、酶添加量和反应时间这3个因素进行进一步考察优化,实验结果和显著性分析如表5、表6所示。
由正交实验表直观分析可得出A1B2C1组合较好,对PRO水解度产生影响的三种因素主次顺序为酶添加量>温度>反应时间,即酶添加量对实验的影响最大,温度次之,反应时间最小。由表6可得出酶添加量和温度对水解度具有显著影响,而反应时间的影响不显著。经综合考虑后选择较短反应时间的A1B2C3组合为最优组合,ASJS的PRO最优酶解工艺条件为:温度45 ℃、酶添加量3.0%、反应时间4 h。在此条件下进行验证实验,实际测得水解度为31.09%。
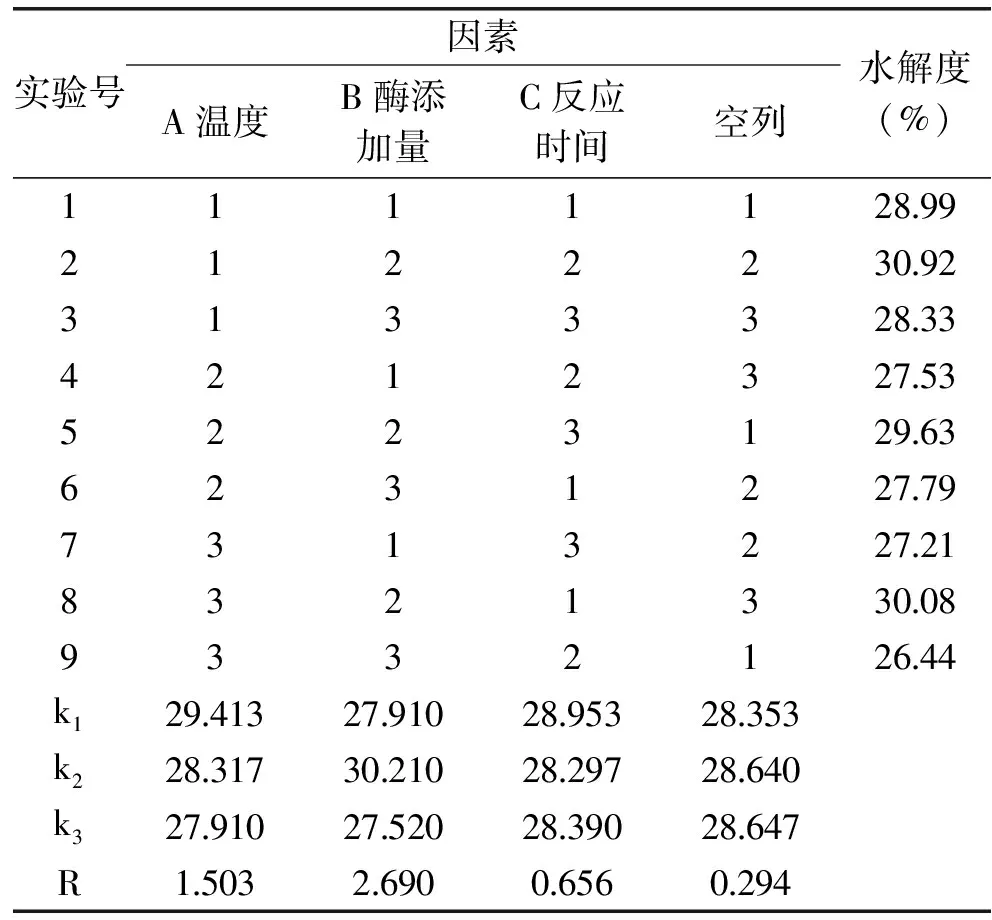
表5 PRO酶解正交实验

表6 PRO显著性分析表
2.3.3 FLA正交实验结果 在单因素实验结果基础上,进一步对温度、酶添加量和反应时间这3个因素进行优化,相关实验结果和显著性分析如表7、表8所示。
由正交实验表直观分析得出A1B2C1组合较好,对FLA水解度产生影响的三种因素的主次顺序为温度>反应时间>酶添加量,即温度对实验的影响最大,反应时间次之,酶添加量最小。由表8可得出温度对水解度具有显著影响,而酶添加量和反应时间的影响均不显著。经综合考虑后选择较少酶添加量和较短反应时间的A1B3C3组合为最优组合,ASJS的FLA酶解最优工艺条件为:温度45 ℃、酶添加量2.0%、反应时间4 h。在此条件下进行实验,测得水解度为11.89%。

表7 FLA正交实验设计
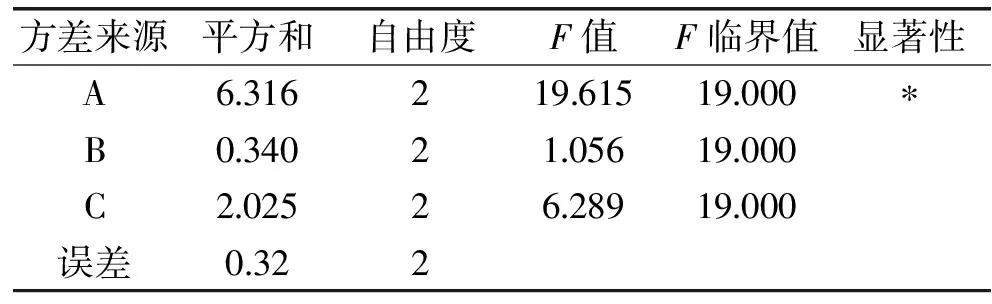
表8 FLA显著性分析表
2.4 多酶复配的比较实验结果
ASJS的双酶与三酶的水解比较实验结果如表9所示。三酶复配使用的水解度比双酶、单PAP及单PRO最佳条件下均低,说明多肽的得率降低了。推测在水解反应后期可能出现了过度水解现象,即水解液中蛋白质及多肽继续被分解成小分子肽及氨基酸,由于双缩脲法只能检测到蛋白质及多肽的原因从而出现这种现象[19]。
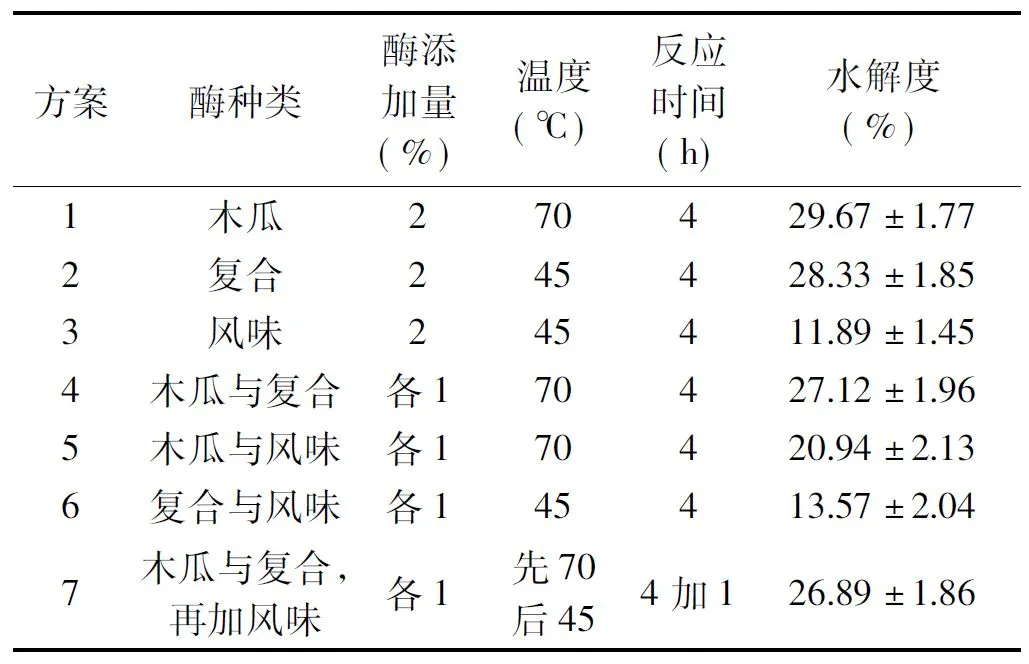
表9 多酶复配水解能力比较

图5 酶解液清除羟自由基作用Fig.5 Enzymolysis liquid scavenging hydroxyl free radicals注:图中蛋白酶分别为:1:PAP,2:PRO,3:FLA, 4:PAP与PRO,5:PAP与FLA,6:PRO与FLA, 7:PAP与PRO,再加FLA,8:卵PAP,9:体壁PAP,图6同。
2.5 清除羟自由基能力测定结果
由图5可以看出,各组分浓度在10 mg/mL时清除羟自由基能力均显著高于5 mg/mL(p<0.01)。在这两种样品浓度下,各组分间清除能力强弱趋势比较一致,在ASJS的三种单酶水解产物中,PAP好于PRO及FLA。双酶及三酶复配水解产物中,PAP与FLA复配水解产物好于另外三种复配方式,但显著低于PAP(p<0.05)。另外做为对照的刺参卵PAP水解产物和仿刺参体壁PAP水解产物均显著低于7种ASJS水解产物,且存在极显著差异(p<0.01)。综合比较,ASJS的PAP水解产物的清除羟自由基能力在9种不同的水解产物中最好。
2.6 清除超氧阴离子自由基测定结果

图6 酶解液清除超氧阴离子作用Fig.6 Enzymolysis liquid scavenging superoxide anion free radicals
由图6可以看出,各组分浓度在10 mg/mL时清除超氧阴离子能力均显著高于5 mg/mL(p<0.01)。在此两种样品浓度下,各组分间清除能力强弱比较趋势相同,在ASJS的三种单酶水解产物中,PAP好于PRO及FLA。双酶及三酶复配水解产物中,三酶水解产物好于另外三种双酶复配水解方式,略低于PAP,但无显著差异(p>0.05)。另外做为对照的刺参卵PAP水解产物和仿刺参体壁PAP水解产物均显著低于ASJS木瓜水解产物(p<0.01)。综合比较,ASJS的PAP水解产物清除超氧阴离子自由基能力在9种不同的水解产物中最好。
3 结论
本实验以双缩脲法结合三氯乙酸法测定水解度,通过单因素与正交实验,确定了三种蛋白酶的最佳酶解工艺条件,即PAP酶添加量3.0%、温度70 ℃及反应时间4 h;PRO酶添加量3.0%、温度45 ℃及反应时间4 h;FLA酶添加量2.0%、温度45 ℃及反应时间4 h。PAP与PRO表现出较强的水解能力,在优化后的条件下PAP水解度为32.14%,PRO为31.09%,FLA为11.89%。通过与双酶与三酶的水解实验比较得出,ASJS的单PAP及单PRO水解度较高。
体外抗氧化实验结果表明,各组在10 mg/mL时清除羟自由基和超氧阴离子自由基能力均显著高于5 mg/mL。ASJS的PAP产物好于PRO、FLA、三种双酶及三酶复配水解产物,同时好于仿刺参卵和体壁两种PAP水解产物。综合比较,ASJS的PAP水解产物的体外抗氧化活性在9种水解产物中最好,可以作为进一步制备抗氧化活性物质的材料。
[1]肖枫,曾名勇,董士远,等. 海参胶原蛋白的研究进展[J]. 水产科学,2005,24(6):39-41.
[2]李甜甜,王相海,林存智,等. 海参多糖抗肺癌活性及对T细胞免疫功能调节研究进展[J]. 中华临床医师杂志,2014(10):123-125.
[3]卢锋,吴明一,高娜,等. 黑乳海参硫酸化多糖的提取纯化、结构特征及其抗凝活性[J]. 大理学院学报,2013(6):12-16.
[4]Liu H H,Ko W C,Hu M L. Hypolipidemic effect of glycosaminoglycans from the sea cucumber Metriatyla scabra in rats fed a cholesterol-supplemented diet[J]. Journal of agricultural and food chemistry,2002,50(12):3602-3606.
[5]张佳佳,巫军. 黑乳海参皂苷nobilisideⅠ和nobilisideⅡ的体外抗真菌及抗肿瘤活性[J]. 中药材,2011,34(9):1420-1423.
[6]王静凤,傅佳,王玉明,等. 革皮氏海参皂苷对小鼠免疫功能的调节作用[J]. 中国海洋大学学报:自然科学版,2010,40(2):28-32.
[7]赵玲,殷邦忠,刘淇,等. 4种海参多肽抗氧化活性的比较研究[J]. 中国海洋药物,2012(2):19-24.
[8]童静静,章元炳,叶再镯,等. 海参多肽的研究进展[J]. 食品工业科技,2013(11):356-360.
[9]Sun W H,Leng K L,Lin H,et al. Analysis and evaluation of chief nutrient composition in different parts of Stichopus japonicus[J]. Chinese Journal of Animal Nutrition,2010,22(1):212-220.
[10]袁文鹏,刘昌衡,王小军,等. 防刺参不同部位营养成分的分析及综合评价[J]. 食品工业科技,2010(5):348-350.
[11]张健,王茂剑,马晶晶,等. 仿刺参生殖腺营养成分分析[J]. 食品科学,2013,34(14):232-236.
[12]宁正祥. 食品成分分析手册[M]. 北京:中国轻工业出版社,1997.
[13]毕葳,邢延一,李燕燕,等. 应用双缩脲反应测定鳖甲中总肽含量的方法学研究[J]. 中国实验方剂学杂志,2011,17(15):63-65.
[14]张彧,农绍庄,徐龙权,等. 海参蛋白酶解工艺条件的优化[J]. 大连轻工业学院报,2001,20(2):105-106.
[15]檀志芬,生庆海. 蛋白质水解度的测定方法[J]. 分析检测,2005,26(7):174-178.
[16]Mahmoud K A,Linder M,Fanni J,et al.Characterisation of the lipid fractions obtained by proteolytic and chemical extractions from rainbow trout(Oncorhynchus mykiss)roe[J]. Biochemestry,2008,43(4):376-383.
[17]陈晶,刘友明,熊善柏. 复合蛋白酶与风味蛋白酶分步水解鱼骨蛋白工艺的优化[J]. 华中农业大学学报,2007,26(5):704-708.
[18]王共明,张健,王茂剑,等. 仿刺参卵酶解工艺条件优化[J]. 食品科学,2012(23):193-198.
[19]王共明. 仿刺参卵多肽、多糖的制备及多肽活性研究[D]. 上海:上海海洋大学,2013.
[20]胡建军,周冀衡,柴家荣,等. 多指标正交实验数据的优化分析及应用[J]. 中国烟草学报,2008,14(2):9-14.
Optimization of enzymolysis technology ofApostichopusjaponicusspermary and antioxidant activitiesinvitroof hydrolysates
ZHANG Jian1,2,3,LIU Shao-wei1,*,ZHANG Yi2,WANG Gong-ming3,ZHAO Yun-ping3,LIU Jing-xi3,JING Yue-xin3,LIU Fang3
(1.College of Biotechnology,The State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China;2.Shanghai Institutes for Biological Sciences,Chinese Academy of Science,Shanghai 200233,China;3. Shandong Marine Resource and Environment Research Institute,Yantai 264006,China)
Apostichopusjaponicusspermary(ASJS)was used as material to optimize enzymolysis technology according to the degree of hydrolysis,and antioxidant activities of hydrolysates were also investigated. The hydrolysis enzymes included PAP,PRO and FLA. The biuret method combined with TCA was used to determine degree of hydrolysis. Through single factor test and orthogonal test,the optimized conditions of each enzyme were obtained. And at the same time,the enzymolysis test used sole enzyme compared with two enzymes and three enzymes was carried out. Finally,antioxidant activities of different hydrolysates were determinedinvitro. The results showed that the optimum conditions of enzymolysis technology with sole enzyme were as follows:PAP with the enzyme dosage 3.0%,temperature 70 ℃ and enzymolysis time 4 h,PRO with the enzyme dosage 3.0%,temperature 45 ℃ and enzymolysis time 4 h,FLA with the enzyme dosage 2.0%,temperature 45 ℃ and enzymolysis time 4 h. Under the optimum condition hydrolysis degrees of hydrolysis of PAP,PRO and FLA were 32.14%,31.09% and 11.89%,respectively. The enzymolysis degrees of double enzyme and three enzymes were lower than sole PAP and PRO. The results of scavenging abilities of hydroxyl radical and superoxide anion radicals displayed that with concentrations of 5 mg/mL and 10 mg/mL,the hydrolysate of ASJS hydrolyzed by PAP owned better ability than hydrolysates produced through PRO and FLA,double enzymes,three enzymes,and those from spawn and body wall hydrolyzed by PAP. In conclusion,PAP hydrolysate from ASJS exhibited good antioxidant activities,and it is promising to be utilized and exploited.
Apostichopusjaponicusspermary;enzymolysis;optimization;antioxidant activities
2016-08-17
张健(1980-),男,博士,副研究员,研究方向:生物化学与分子生物学,食品科学与工程,E-mail:zjsd408@163.com。
*通讯作者:刘少伟(1972-),男,博士,教授,研究方向:生物化学与分子生物学,食品科学与工程,E-mail:swliu@ecust.edu.cn。
山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT-22-07);烟台市科技发展计划项目(2014ZH081)。
TS254.1
B
1002-0306(2017)05-0232-06
10.13386/j.issn1002-0306.2017.05.036
