清热解毒扶正颗粒对内毒素大鼠肺肾组织NF—κBp65蛋白的影响
2017-06-01万启南韦衮政李黔云祁燕童晓
万启南++韦衮政 李黔云++祁燕++童晓云++陈维��

摘要:目的探討清热解毒扶正颗粒对内毒素大鼠肺肾组织NF-κBp65蛋白的影响。方法72只大鼠随机分为正常对照组、模型对照组、甲强龙组以及中药低、中、高剂量组,采用腹腔注射脂多糖法建立大鼠内毒素血症模型。正常组对照组、模型对照组予生理盐水1 mL/100 g灌胃,每天1次;甲强龙组给甲基强的松龙117 mg/100 g灌胃,每天1次;中药组给清热解毒扶正颗粒低、中、高剂量1 mL/100 g灌胃,每天1次;实验结束后,采用Western blotting法检测大鼠肺、肾组织NF-κBp65蛋白的表达。结果模型对照组NF-κBp65蛋白水平显著高于正常对照组,中药高剂量组与甲强龙组较好地降低内毒素大鼠肺、肾组织NF-κBp65蛋白水平,两组之间比较无统计学差异,中药低剂量组和中剂量组降低NF-κBp65蛋白水平的效果较差,与高剂量组和甲强龙组相比有统计学差异。结论清热解毒扶正颗粒能有抑制内毒素大鼠肺肾组织NF-κBp65蛋白表达的效果,降低内毒素血症的炎症反应,对内毒素有一定的治疗作用。
关键词:清热解毒扶正颗粒;内毒素血症;NF-κB p65蛋白
中图分类号:R2855文献标志码:A文章编号:1007-2349(2017)05-0016-05
[WT5HZ][JZ]Effects of Qingre Jiedu Fuzheng Granule on NF-κBp65 Protein in Lung-Kidney[JZ]Tissue of Endotoxin Rats
[WT5BZ][JZ]WAN Qi-nan, WEI Gen-heng, LI Qian-yun, QI Yan, TONG Xiao-yun, CHEN Wei
[WT5"BX][JZ](Yunnan Hospital, Kunming of Traditional Chinese Medicine, Kunming 650021, Yinnan)
[WT5HZ]【Abstract】[WTBZ]Objective: To study the effect of Qingre Jiedu Fuzheng Granule on NF-κBp65 protein in lung-kidney tissue of endotoxin rats. Methods: 72 rats were randomly divided into a normal control group, a model control group, a methylprednisolone group and low, medium and high dose groups of traditional Chinese medicine. Rat endotoxemia models were established by intraperitoneal injection of lipopolysaccharide method. The normal group and the model control group were given intragastric administration of 1 mL/100g of normal saline once daily. The methylprednisolone group was administrated 1.17 mg/100g of methylprednisolone once daily. The low, medium and high dose groups were administrated 1 mL/100 g of Qingre Jiedu Fuzheng Granule once daily. After the experiments were finished, the expression of NF-κBp65 protein in lung and kidney tissue of the rats was detected by Western blotting. Results: The level of NF-κBp65 protein in the model control group was significantly higher than that in the normal control group. The NF-κBp65 protein level in the lung and kidney of endotoxin rats of the high dose group and the methylprednisolone group decreased and there was no statistic difference between the two groups. The level of NF-κBp65 protein in the low dose group and the middle dose group decreased poorly, but compared with that of the high dose group and the methylprednisolone group, there was statistical difference. Conclusion: Qingre Jiedu Fuzheng Granule can inhibit the expression of NF-κBp65 protein in the lung and kidney of endotoxin rats, reduce the inflammatory reaction of endotoxemia and has certain curative effect on endotoxin.
[WTHZ]【Key words】[WTBZ]Qingrejiedu Fuzheng Granule, endotoxemia, NF-κB p65 protein
内毒素血症(ETM)是指循环血中出现可检出的内毒素的病症。内毒素血症发生原因主要是在严重创伤、感染等应激状态下全身的网状内皮系统功能障碍,免疫机能下降,诱导内毒素血症及全身免疫反应的发生,导致机体组织、细胞的损伤[1][2]。内毒素血症诱导的大量炎性介质失控性释放所致的全身炎性反应综合征(SIRS),以及进一步恶化发展成为的多脏器功能失常综合征(MODS)是严重感染患者走向死亡的主要途径,而该恶性进展的关键启动因子为内毒素及其诱导的失控性释放的大量炎性介质。脂多糖(LPS)是常用的诱导内毒素血症的毒素。在脂多糖诱导的炎症反应信号传导通路中,Toll样受体(Toll-like receptor,TLR)信号通路的激活与多种致炎介质释放密切相关[3]。NF-κB位于TLR下游信号通路的枢纽位置,它是一种普遍存在的转录因子,主要由P65和P50两个亚基组成,在常态下,NF-κB存在于细胞的胞质内,与其抑制因子IκB结合。作为多种信号转导途径的汇聚点,不仅参与介导了免疫应答、病毒复制、细胞凋亡和增殖的多种基因的表达调控,而且在调节炎症反应的基因中起关键作用[4-5]。当细胞受到内毒素、肿瘤坏死因子,白细胞介素等炎性分子刺激后,将信号转导入细胞内,最终引起NF-κB的活化,并诱导TNF-α、IL-1β、诱导型一氧化氮合酶(induced NO synthase,iNO)、趋化因子如IL-8、巨噬细胞趋化因子(MDF)及趋化因子受体等多种炎性分子的转录、表达,反馈激活NF-κB,加剧了组织的损伤[6-7]。
内毒素血症与中医学“热毒”、“温病”、“瘟疫”等病症相类似,中医药对此类病症有一定的疗效,名老中医临床经验方清热解毒扶正颗粒具有清热解毒、凉血化瘀、益气养阴的功效,对此类病症有一定的效果。研究表明,清热解毒扶正颗粒有明显抑制炎性肿胀作用;明显降低内毒素所致家兔的高热;降低内毒素致高热家兔的C-反应蛋白水平。临床研究表明,清热解毒扶正颗粒能明显降低老年肺炎患者升高的体液免疫指标;降低升高的血白细胞、血清降钙素原、C反应蛋白水平,有显著的抗感染作用。能降低慢性阻塞性肺疾病患者的二氧化碳分压,提高其氧分压,對外感高热、肺炎、慢性阻塞性肺疾病等具有较好的疗效[8-12]。现从TLR信号通路研究清热解毒扶正颗粒对NF-κB p65的影响,探讨如下。
1材料和方法
11材料
111实验动物选择合格清洁型Wistar大鼠(合格证号:SCXK{川}2013-24,001643)72只,体重(200±20)g。
112主要实验仪器及试剂脂多糖(LPS,Sigma公司,批号:L2630),兔抗大鼠NF-κBp65抗体(sigma公司,批号L2630),数码凝胶图象处理系统(GIS-2009型号);超低温冰箱(海尔立式BD370LT-86L-1型号);离心机(10R,美国Thermo公司);紫外分光光度计(UV-2450PC型号);恒温箱(3111,美国Thermo公司)。
113实验药品清热解毒扶正颗粒:由翼首草,荷叶顶,鱼腥草,柴胡,葛根,太子参,麦冬,丹皮,薏苡仁等十四味药组成。由云南中医学院第一附属医院中药房鉴定中药制剂室制备。1 g相当于原生药126 g。低剂量组含生药为05 g/ml,中剂量组含生药为1 g/ml,高剂量组含生药为2 g/ml,甲基强的松龙(国药集团容生制药有限公司,40 mg,国药准字H20030727)。
12方法
[KG(0.15mm]121模型制备72只大鼠进行编号,依随机数字表法分为中药低剂量组、中药中剂量组、中药高剂量组、正常组、模型对照组、西药组。除正常组外,其余大鼠根据文献[1]采用腹腔注射脂多糖致大鼠内毒素血症模型。具体操作方法是先每日测量大鼠体温(肛温)2次,连续2日,取2次体温的平均值记为基础体温。单次体温超过38℃或2次体温差超过05℃的大鼠剔除。实验前6 h禁食不禁水。然后腹腔注射LPS,诱导动物发热,注射LPS后每隔05 h测1次体温,连续测8 h。体温低于38℃的大鼠剔除。[KG)]
122药物治疗①正常组予生理盐水1 mL/100 g体重灌胃,每天1次;②模型对照组予生理盐水1 mL/100 g体重灌胃,每天1次;③西药组给甲基强的松龙117 mg/100 g体重灌胃,每天1次;④中药低、中、高剂量组分别给予清热解毒扶正颗粒低、中、高剂量1 mL/100 g体重灌胃,每天1次;各组连续灌胃28 d。
123实验标本处理4周后(28 d)麻醉大鼠,解剖打开大鼠腹腔,腹主动脉穿刺放血至大鼠死亡,剥离左肾脏外膜,切取左肾,解剖打开胸腔,分离肺组织器官,切取左上肺叶。肾、肺标本置无菌试管中-20℃保存在。
13Western blotting检测分别取各组肺、肾组织,用冷PBS液冲洗,在添加有蛋白酶抑制剂裂解液中匀浆,将匀浆液转至无菌聚丙烯离心管中,经超声震荡,离心提取总蛋白,分光光度计测定其浓度。分别取各样本总蛋白50 ug用聚丙烯酞胺凝胶电泳(SDS-PAGE)分离,然后电转移法至聚偏二氟乙烯(PVDF)膜。室温下将PVDF膜在含有5%脱脂奶粉的TBST缓冲液中封闭1h,然后加人兔抗大鼠NF-κBp65及内参对照GAPDH的抗体,4℃过夜。室温下TBST漂洗PVDF膜,加人用辣根过氧化物酶标记的羊抗兔二抗在室温下孵育1h。TBST再次漂洗PVDF膜,ECL试剂盒化学荧光法覆盖条带,全自动曝光机曝光,数码凝胶图象处理系统测定目的条带的光密度值,进行定量分析,严格按照试剂说明书操作。
14统计学方法计量资料均以均值±标准差(x[TX-*3/8]±s)表示,采用One-K-S检验进行方差齐性检验;样本方差齐性时,采用单因素方差分析进行组间比较;方差不齐者采用两个独立样本检验,数据使用SPSS190统计软件进行处理,以P<005为差异有统计学意义。
2结果
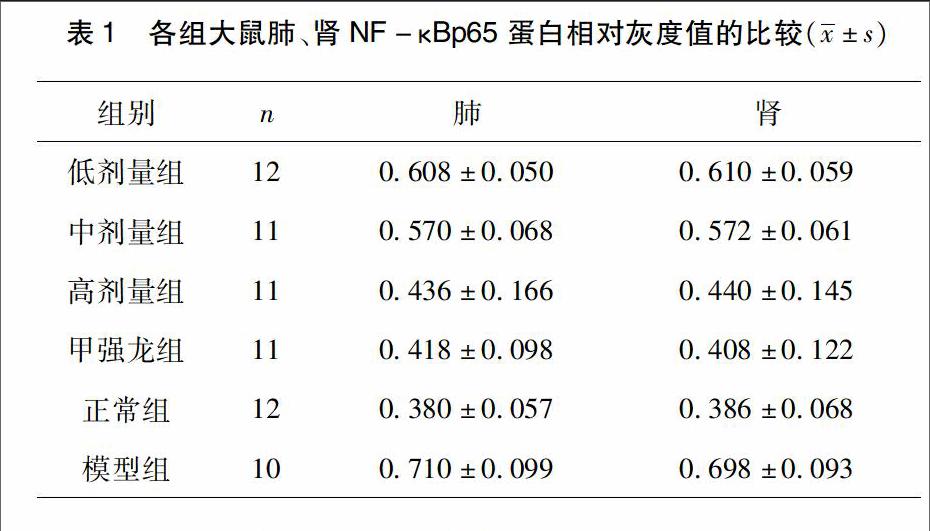
通过动物实验,结果显示,在肺、肾组织中,低剂量组与中剂量组比较,2组NF-κBp65蛋白水平无显著性差异(P>005);低剂量组与高剂量组比较,高剂量组NF-κBp65蛋白水平显著低于低剂量组(P<005);高剂量组更好地降低NF-κBp65蛋白水平;低剂量组与甲强龙组比较;甲强龙组NF-κBp65蛋白水平显著低于低剂量组(P<001),甲强龙组较好地降低NF-κBp65蛋白水平;低剂量组与正常组比较,低剂量组NF-κBp65蛋白水平显著高于正常组(P<001);低剂量组与模型组比较,两组NF-κBp65蛋白水平无显著性差异(P>005);中剂量组与高剂量组比较,中剂量组NF-κBp65蛋白水平明显高于高剂量组(P<005),中剂量组降低NF-κBp65蛋白水平明显低于高剂量组;中剂量组与甲强龙组比较,中剂量组NF-κBp65蛋白水平显著高于甲强龙组NF-κBp65蛋白水平(P<005);中剂量与正常组比较,中剂量组NF-κBp65蛋白水平显著高于正常组(P<005);中剂量与模型组比较,中剂量组NF-κBp65蛋白水平显著低于模型组(P<005)。高剂量组与甲强龙组比较,两组NF-κBp65蛋白水平无显著性差异(P>005),降低NF-κBp65蛋白水平效果相当;高剂量组与正常组比较,两组NF-κBp65蛋白水平无显著性差异(P>005);高剂量组与模型组比较,高剂量组NF-κBp65蛋白水平显著低于模型组(P<001),高剂量组降低NF-κBp65蛋白水平的效果显著;甲强龙组与正常组比较,两组NF-κBp65蛋白水平无显著性差异(P>005);甲强龙组与模型组比较,甲强龙组NF-κBp65蛋白水平显著低于模型组(P<001);正常组与模型组比较;模型组NF-κBp65蛋白水平显著高于正常组(P<001),造模后,NF-κBp65蛋白水平显著升高。肺、肾组织NF-κBp65灰度值见表1,肺组织NF-κBp65蛋白表达见图1,肾组织NF-κBp65蛋白表达见图2。
3讨论
在内毒素炎症反应中,LPS激活TLR4通路目前主要有两条公认的信号途径[13]:一条是髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖的信号通路;另一条是MyD88非依赖的信号通路。IL-1R受到IL-1刺激后,启动信号途径招募的第一个衔接分子就是MyD88[14]。MyD88激酶作为IL-1R的衔接蛋白,募集下游的蛋白激酶IRAK,导致IRAK自身磷酸化;磷酸化IRAK与TRAF6结合,TRAF6活化引起两条不同的信号转导通路,一条包括P38MAPK和JNK通路在内的MAPK信号通路,另一条是NF-κB通路,NF-κB作为一种普遍存在的转录因子,经激活后,转入细胞核中诱导特定基因的表达,并激活细胞因子IL-1、IL-6、IL-8、IL-12等促炎细胞因子的表达,从而产生大量的致炎因子如TNF-α、NO、COX-2等,引起组织炎症反应性损伤。TLR4/NF-κB通路是启动细胞内炎症信号传导的经典通路,NF-κB是细胞内生物信号传导中关键性炎症因子。阻断内毒素炎性反应信号通路的关键环节,抑制炎性因子的释放,促进炎性因子的阻斷将对内毒素炎性反应有重要的治疗作用。
[KG(0.15mm]中医药治疗内毒素血症既有直接的拮抗内毒素作用,更有其显著的增强机体免疫对内毒素的解毒功效[15]。本研究从TLR4信号通路中针对NF-κBp65炎症反应信号环节进行探讨,结果显示,脂多糖腹腔注射后,大鼠的肺肾组织NF-κBp65蛋白水平比正常组显著增高,清热解毒扶正颗粒低剂量组、中剂量组降低NF-κBp65蛋白水平较较弱,而高剂量组有效降低内毒素大鼠NF-κBp65蛋白水平,其效果与甲强龙相当,比低剂量组、中剂量组显著增强,存在量效关系。清热解毒扶正颗粒能够抑制炎症反应引起的NF-κBp65激活、转录,从而降低由于NF-κBp65激活导致的下游多种炎性因子如IL-1、IL-6、IL-8、IL-12、TNF-а、NO、COX-2、MDF等炎性介质激活、释放,进而降低炎症反应,减轻组织炎性损伤。复方中药疗效是多成分的效应,可多途径、多环节、多靶点地发挥作用。清热解毒扶正颗粒对内毒素血症的疗效途径包含了NF-κBp65信号通路,其效果与甲强龙相似,提示清热解毒扶正颗粒与甲强龙有类似的信号通路作用机制,至于其如何对NF-κBp65产生抑制作用,有待进一步研究。[KG)]
参考文献:
[1]Brunn CJ,Platt JLThe etiology of sepsis tumed inside out TrendsMolMed,2006,12(1):10-16[ZK)]
[2]Pinheiro da Silva F,Soriano FGNeutrophils recruitment during sepsis Critical points and crossroads Front Biosci,2009,14:4464-4476[ZK)]
[3]傅颖珺,谢勇内毒素血症与Toll受体[J].江西医学院学报,2006,46(5):178-180[ZK)]
[4]Goebeler M,Gillitzer R,Kilian K,et alMultiple signaling pathways regulate NF-kappaB dependent transcription of the monocyte chemoattractant protein-1 gene in primary endothelial cellsBlood,2001,97(1):46-55[ZK)]
[5]Yamamoto Y,Gaynor R BTherapeutic potential of inhibition of the NF-kappaB pathway in the treatment of inflammation and cancerJ Clin Invest,2001,107(2):135-142[ZK)]
[6]吕敏丽,张慧英Toll样受体与内毒素的作用[J].长治医学院学报,2009,23(3):236-240[ZK)]
[7]陈偲,杨敬平,银雪,等脓毒症患者血清中TLR-4、TREM-1、sCD14和IL-18的变化[J].临床肺科杂志,2014,(11):1956-1959[ZK)]
[8]万启南,曹东,叶勇,等清热解毒扶正颗粒抗炎、退热及对C-反应蛋白影响的实验研究[J].云南中医中药杂志,2011,32(3):47-49[ZK)]
[9]李黔云,万启南,段艳蕊自拟清热解毒扶正汤治疗慢性肺心病急性期临床观察[J].云南中医中药杂志,2014,35(12):35-36[ZK)]
[10]万启南,陈晓华清热解毒扶正颗粒治疗老年人肺炎59例疗效观察[J].光明中医,2007,22(7):59[ZK)]
[11]万启南,陈晓华,叶勇,等清热解毒扶正颗粒治疗外感高热症36例[J].中医研究,2007,20(7):20[ZK)]
[12]关昕璐,阎玉凝,魏太明,等翼首草的抗炎作用与急性毒性试验研究[J].北京中医药大学学报,2004,27(2):71-73[ZK)]
[13]MITSUHIRO F,MASASHI M,KENICHI TMolecular Mechanisms of Macrophage Activation and Deactivation by LPS:Role of the Receptor ComplexPharmacology and Therapeutics,2003,100:171-194[ZK)]
[14]Xiaoxia Li,Jinzhong QinModulation of Toll–interleukin 1 receptor mediated signalingJ Mol Med2005,83:258-266[ZK)]
[15]蒲晓东内毒素血症中医病机及治法探讨[J].中国中医急症,2005,14(12):1190-1192
