黑曲霉液态发酵韭籽粕提取韭籽多肽工艺
2017-06-01尹国友QiWang刘文霞李文建张现青
孙 婕,尹国友,Qi Wang,刘文霞,李文建,张现青
(1.河南城建学院生命科学与工程学院,河南平顶山 467036;2.加拿大农业与食品部圭尔夫研究与发展中心,安大略圭尔夫 N1G5C9)
黑曲霉液态发酵韭籽粕提取韭籽多肽工艺
孙 婕1,尹国友1,Qi Wang2,刘文霞1,李文建1,张现青1
(1.河南城建学院生命科学与工程学院,河南平顶山 467036;2.加拿大农业与食品部圭尔夫研究与发展中心,安大略圭尔夫 N1G5C9)
为充分利用提取韭菜籽油后的副产品韭籽粕,本文采用响应面分析法(RSM)优化黑曲霉液态发酵韭籽粕中韭籽多肽提取工艺,并测定了最优提取条件下韭籽多肽的抗氧化活性。结果表明:影响韭籽多肽提取工艺的因素主次顺序为发酵时间>韭籽粕浓度>初始pH,韭籽多肽提取的最佳工艺条件:韭籽粕浓度9.4%,初始pH3.0,发酵时间3 d,在此条件下,每毫升发酵液中韭籽多肽含量可达573.55 μg/mL。在最佳工艺条件下,测定黑曲霉液态发酵制备得到的韭籽多肽对DPPH·的清除能力以及总还原力,结果表明采用黑曲霉液态发酵制备得到的韭籽多肽具有抗氧化活性,随着韭籽多肽浓度的提高,抗氧化活性增强。
韭籽多肽,响应面法,液态发酵,抗氧化活性
韭菜籽,是葱属科植物韭菜的成熟干燥种子,是我国传统的中药材,最早记载于《名医别录》。韭菜籽的药用价值和营养价值都极高,2002年我国卫生部将其列为药食两用植物天然产物[1]。近年来国内外对于药食两用的韭菜籽研究主要集中在韭菜籽油的提取和成分分析等方面,而对韭菜籽油提取后的副产品——韭籽粕的进一步开发利用及研究等方面在国内外都鲜有报道[2-5]。韭籽中含有丰富的蛋白质和膳食纤维等成分,并且我国韭菜种质资源丰富,有必要对韭籽及其副产物韭菜籽粕进行进一步的开发利用。
近几年随着生命科学技术的飞速发展,人们在研究生物小分子的同时更加关注生物活性多肽物质的研究。科学家们已研究发现了具有抗氧化、降血脂和降血压等的功能性多肽,这就使得多肽类物质研究更为热门[6-8]。目前根据掌握的大量文献,除孙婕[9]、洪晶等[10]曾对韭菜籽蛋白的提取及抗氧化活性进行研究和陈涛涛[11]等人对韭菜籽中活性肽的抗菌和抗氧化研究以外,鲜有关于韭菜籽蛋白质、韭菜籽多肽的研究报道。响应面分析法(Response Surface Metod,RSM)是一种非常有效的常用统计学分析方法,通过实验数据可以建立数学模型来实现受多因素影响的最优组合条件的筛选;中心组合设计在食品工业中的应用较为广泛[12]。本实验以韭籽多肽得率为考察指标,采用响应面分析法研究黑曲霉液态发酵制备韭籽活性多肽得率的影响因素,利用Design-Expert软件中心组合设计,对三个主要工艺参数——韭籽粕浓度、初始pH、接种量进行优化设计实验,以获取最佳发酵条件,为今后在工业中充分利用发酵法提取韭菜籽中生物活性物质提供相应的工艺参数。
1 材料与方法
1.1 材料与仪器
黑曲霉 中国工业微生物菌种保藏管理中心(4097);斜面培养基:察氏培养基[13]。韭籽粕 平顶山市农业科学院提供;甘氨酸 天津市光复精细化工研究所;茚三酮 天津市科密欧化学试剂有限公司;三氯乙酸 天津市致远化学试剂有限公司;乙酸钠 天津市光复科技发展有限公司;乙酸氢氧化钠、盐酸、(均为分析纯) 洛阳市化学试剂厂;甘氨酸、DPPH· 上海索莱宝生物科技有限公司。
电子天平、pH计 梅特勒-托利多(上海)有限公司;高压蒸汽灭菌锅 上海科学有限公司;HZQ-X100E恒温震荡摇床 常州普天仪器制造有限公司;紫外可见光分光光度计 北京谱析通用仪器有限责任有限公司;超净工作台 苏州安泰空气技术有限公司;HWSZ8电热恒温水浴锅 上海一恒科技有限公司;FDC-1044高速离心机 科大创新股份有限公司中佳分公司。
1.2 实验方法
1.2.1 实验流程 制备黑曲霉孢子悬液、发酵培养基→培养基灭菌→菌悬液接种到发酵培养基中→液态发酵→离心取上清液→酶活测定
1.2.2 制备黑曲霉孢子悬液和发酵培养基 取黑曲霉斜面一支,用10 mL生理盐水分两次将菌苔洗下,充分震荡10 min后制成孢子悬液。用血球计数板在显微镜下直接计数[14]。用生理盐水调整孢子悬液浓度为107个/mL,取10 mL孢子悬液加入容量为150 mL装有90 mL的液体培养基的锥形瓶中,于30 ℃,200 r/min震荡培养36 h,待生成均一菌丝球时即为可用于发酵的种子液[15-16]。发酵培养基:韭籽粕溶液50 mL/瓶(锥形瓶容量150 mL),121 ℃灭菌 20 min 后冷却至室温,按照一定比例接入种子液,振荡培养。
1.2.3 甘氨酸标准曲线的制作 参考文献[17-18]的方法,分别取0、0.1、0.2、0.4、0.6、0.8、1.0 mL 20 μg/mL的标准甘氨酸溶液于试管中,用蒸馏水补足到1 mL。分别加入0.2 mol/L pH5.8的乙酸-乙酸钠缓冲液1 mL;再加入0.2%茚三酮显色液1 mL,充分混合后盖住试管口,在100 ℃水浴中加热15 min,冷却,放置5 min后,加入60%乙醇3 mL,充分摇匀,甘氨酸浓度为0的溶液为对照,在570 nm下测定 OD值。以甘氨酸的浓度(μg/mL)为横坐标,OD值为纵坐标绘制标准曲线。
1.2.4 发酵液中多肽含量的测定 取适量发酵液4000 r/min离心15 min,上清液3 mL于10 mL离心管中,加入3 mL 20%三氯乙酸,5000 r/min离心15 min。离心结束后,取适量上清液,稀释100倍,根据茚三酮法测定发酵液中多肽含量[19-20]。
1.3 单因素实验设计
影响黑曲霉发酵韭籽粕产韭籽多肽的主要因素有韭籽粕浓度、初始pH、接种量和发酵时间[21-22]。将韭籽粕粉碎并过60目筛,并将未通过筛孔的渣滓再次进行粉碎于过筛后的细粉混合作为发酵原料。
1.3.1 考察韭籽粕质量浓度对韭籽多肽含量的影响 分别按照3%、5%、7%、9%、11%(m/v)的比例称取韭籽粕,加入50 mL蒸馏水,pH调至6.0,121 ℃灭菌30 min,冷却至30 ℃以下,加10%(v/v)的种子液,混匀后30 ℃,200 r/min振荡培养3 d结束发酵,测定多肽浓度。
1.3.2 考察初始pH对黑曲霉发酵制备韭籽多肽的影响 按10%(m/v)的比例将韭籽粕加入到锥形瓶中,均加入50 mL蒸馏水,分别将pH调为3、4、5、6、7,21 ℃条件下灭菌30 min,冷却至30 ℃以下,接入10%(v/v)的种子液,混匀后30 ℃,200 r/min振荡培养3 d结束发酵,测定多肽含量。
1.3.3 考察接种量对黑曲霉发酵提取韭籽多肽的影响 按照10%(m/v)的比例称量预处理后的韭籽粕于各锥形瓶中,加入蒸馏水50 mL,pH均调至6.0。121 ℃条件下灭菌30 min,灭菌结束后冷却至30 ℃以下,然后按照6%、8%、10%、12%、14%(v/v)比例分别加种子液,混匀后30 ℃,200 r/min振荡培养3 d结束发酵,测定多肽含量。
1.3.4 考察发酵时间对黑曲霉发酵提取韭籽多肽的影响 按照10%(m/v)的比例称量预处理后的韭籽粕于各个锥形瓶中,均加入蒸馏水50 mL,pH均调至6.0。121 ℃条件下灭菌30 min,冷却至30 ℃以下,然后按照10%(v/v)比例加种子液,混匀后30 ℃,200 r/min分别振荡培养2、3、4、5、6 d结束发酵,测定多肽含量。
1.4 响应面实验设计
根据单因素实验的结果,根据中心组合设计,采用软件Design-Expert建立三因素三水平实验,确定微生物发酵韭籽粕提取韭籽多肽工艺。以韭籽多肽含量为考察指标,韭籽粕浓度(A)、初始pH(B)和发酵时间(C)为自变量,因素水平编码见表1。

表1 响应面分析法的因素与水平表
1.5 发酵液中多肽的提取
参考陈涛涛的提取方法[11]。
1.6 抗氧化效果测定
1.6.1 对DPPH·清除效果测定 参考孙婕等人的方法[9]。
1.6.2 总还原力测定 取0.2 mol/L pH6.6的磷酸缓冲液和质量分数为1%(m/V)的铁氰化钾溶液各2.5 mL,加入不同浓度的韭籽多肽溶液1 mL(用1.5中提取得到的多肽粉末配制不同浓度的多肽溶液),混匀后50 ℃水浴20 min,冷却后加入2.5 mL 10%三氯乙酸溶液,混匀,3000 r/min条件下离心10 min,取离心后的上清液2.5 mL,再加入2.5 mL双蒸水和2.5 mL 0.1%的氯化铁,混匀,室温下静置10 min,在700 nm处测定吸光度[23]。
1.7 数据统计分析
本实验数据统计及作图均采用Execl 2003软件,所有实验重复5次。
2 结果与分析
2.1 甘氨酸标准曲线
根据结果绘制标准曲线,如图1所示。

图1 甘氨酸标准曲线Fig.1 Standard curve of Glycine
通过茚三酮显色反应实验,确定甘氨酸浓度和吸光值之间的线性关系,即:Y=0.0687X-0.0425,R2=0.993。
2.2 单因素对发酵液中韭籽多肽含量的影响
2.2.1 韭籽粕浓度对黑曲霉发酵法制备韭籽多肽的影响 实验结果如图2所示。韭籽粕浓度对测定结果有较大影响,韭籽粕浓度从3%升到9%的过程中,多肽含量随之提高,增加趋势十分明显。但当浓度提高到11%时,多肽含量下降,分析其原因可能为浓度过大,发酵培养基粘度增高,基质水分含量减少,溶氧不足,不利于微生物的生长代谢以及微生物代谢产生的酶对蛋白质的水解作用[24]。因此,将发酵过程中的底物浓度即韭籽粕浓度定为9%。
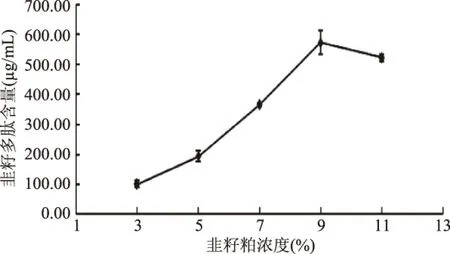
图2 韭籽粕质量浓度对韭籽多肽含量的影响 Fig.2 Effect of concentration of leek seed meal on Polypeptide content
2.2.2 初始pH对黑曲霉发酵制备韭籽多肽的影响 结果如图3所示。菌株所产蛋白酶对韭籽粕中蛋白的酶解效果与发酵初始pH有密切关系,同时,pH也会影响菌株的产酶量,进而影响多肽含量。从图3中可以看出,随着pH的增大,多肽含量迅速降低,其原因是所选发酵菌种为40970号黑曲霉,其主要产酸性蛋白酶,而酸性蛋白酶酶解时环境最适pH为2.5~3.5。当pH环境偏大或者偏小时,都不利于菌种的生长[25]。因此,在pH为3的条件下发酵效果较好。

图3 初始pH对韭籽多肽含量的影响Fig.3 Effect of initial pH on polypeptide content
2.2.3 接种量对黑曲霉发酵提取韭籽多肽的影响 结果如图4所示。接种量在6%~10%之间时,韭籽多肽含量先增后降,但是升高和下降的趋势均不明显。说明接种量在6%~10%之间时对发酵产多肽影响较小,但是随着接种量的增高,菌株大量消耗发酵培养基的水分,阻碍酶水解蛋白的过程,使得韭籽多肽含量显著下降[26]。因此根据测定结果,确定发酵接种量为8%。

图4 接种量对韭籽多肽含量的影响Fig.4 Effect of inoculation concentration on polypeptide content
2.2.4 发酵时间对黑曲霉发酵提取韭籽多肽的影响 结果如图5所示。发酵时间对微生物法提取多肽有较大的影响,发酵时间在2~3 d时,多肽含量显著增加,说明该时间段菌株大量产生次级代谢产物—酸性蛋白酶,蛋白酶作用于蛋白产生多肽。发酵进行3 d后,发酵液中营养基本大部分被消耗,菌株进入衰亡期,所产酶量减少[27],韭籽多肽含量随之下降。因此将3 d作为最佳发酵时间。

表3 回归方程的方差分析

图5 发酵时间对韭籽多肽含量的影响Fig.5 Effect of fermentation time on polypeptide content
注:p<0.001,代表极显著“***”;p<0.01,代表较显著“**”;p<0.05,代表显著“*”;p>0.05,代表不显著。
2.3 响应面法优化结果和分析
综合单因素实验结果,选取韭籽粕浓度、初始pH和发酵时间为考察因素,根据响应面分析法中心组合设计原理进行响应面实验,响应面实验设计及结果见表2。实验点共15个。可分为两类:一是12个析因点;二是区域的中心点-零点,零点实验重复3次,以估计误差。

表2 Box-Behnken 设计方案及响应值结果
运用Design-Expert分析软件进行数据处理,对实验数据进行多元回归拟合,得到韭籽粕浓度、初始pH、发酵时间的二元多次回归模型:R1=+593.68+54.46A+25.14B+122.94C+69.87AB+46.12AC+34.05BC-100.60A2-127.00B2-126.95C2
对回归方程进行方差分析,结果见表3。回归模型p值(p=0.0005)小于0.01,表明所得模型较显著。模型的相关系数R2达98.52%以上,失拟项p值为0.1333大于0.05,失拟不显著,说明该方程对实验拟合度较好,可靠性较高,可用此模型来分析和预测黑曲霉发酵法制备韭籽多肽的效果。从表3回归模型系数的显著性检验结果中可以看出,模型一次项A、C的p值小于0.01,说明韭籽粕浓度和发酵时间对韭籽多肽含量的影响极显著,B的p值大于0.05,说明初始pH对韭籽多肽含量的影响不显著;交互项AB的p值小于0.01对韭籽多肽含量影响极显著;交互项BC的p值大于0.05对韭籽多肽含量影响不显著;交互项AC的p值小于0.05对韭籽多肽含量影响显著;同时二次项A2、B2、C2的p值都小于0.01具有极高的显著性。由此可知,各影响因素对于多肽含量的影响不是简单的线性关系,曲面效应显著。各因素影响提取韭籽多肽含量的程度由大到小为:发酵时间>韭籽浓度>初始pH。
2.3.1 各因素对黑曲霉发酵韭籽粕制备得到韭籽多肽的影响分析 用各因素的F值可评价该因素对实验指标的影响,F值越大,表明该因素的影响越显著[28]。响应面曲面的坡度可反映该因素对黑曲霉发酵韭籽粕制备得到韭籽多肽含量影响的强弱程度[29]。响应曲面相对平缓,说明其可容忍处理条件的影响。等高线图的形状表明变量间的交互作用是否显著,椭圆等高线表明变量间的交互作用显著,圆形等高线表明交互作用不显著[30]。由图6~图8可以看出,各因素对韭籽多肽含量均有不同程度影响,韭籽多肽含量在实验区内可达到极值。此外,由等高线可知,发酵时间等高线变化趋势较韭籽粕浓度和初始pH陡峭。由此可推测发酵时间对所得多肽含量影响大于韭籽粕浓度和初始pH。由图7可看出,在韭籽粕浓度和初始pH交互作用等高线中,等高线沿韭籽粕浓度轴变化的趋势明显高于初始pH轴,说明韭籽粕浓度对黑曲霉发酵韭籽粕制备得到韭籽多肽含量影响较初始pH大。综上所述,各因素对韭菜籽蛋白提取率的影响主次顺序为发酵时间>韭籽粕浓度>初始pH。

图6 韭籽粕浓度和发酵时间对黑曲霉发酵韭籽粕 制备得到韭籽多肽影响的响应面和等高线Fig.6 Responsive surfaces and contour plot of the effect of concentration of Chinese leek seed meal and fermentation time on the concentration of leek polypeptide
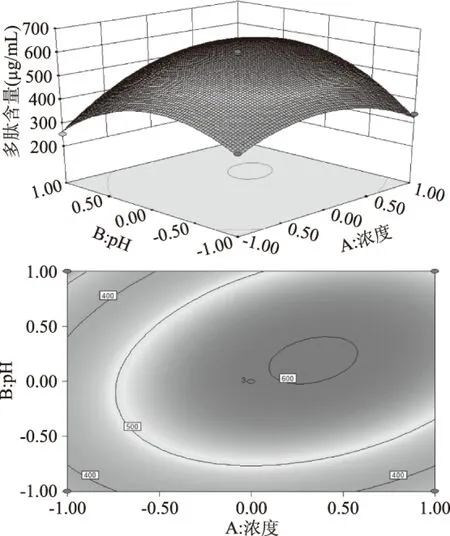
图7 韭籽粕浓度和初始pH对黑曲霉发酵韭籽粕 制备得到韭籽多肽影响的响应面和等高线Fig.7 Responsive surfaces and contour plot of the effect of concentration of Chinese leek seed meal and initial pH on the concentration of leek polypeptide

图8 初始pH和发酵时间对黑曲霉发酵韭籽粕 制备得到韭籽多肽影响的响应面和等高线Fig.8 Responsive surfaces and contour plot of the effect of concentration of initial pH and fermentation time on the concentration of leek polypeptide
2.3.2 最佳提取条件及验证 由Design-Expert软件分析三个因素最优实验点为:浓度9.40%,初始pH3.06,发酵时间3.04 d,在此点的韭籽多肽含量是593.34 μg/mL。按照实验操作的可行性,将最佳条件调整为韭籽粕浓度9.4%,初始pH3.0,发酵时间3.0 d,根据优化得到的参数进行验证实验,验证实验重复3次,发酵结果的平均韭籽多肽含量是573.55 μg/mL,与理论值相差3.45%(相对误差<5%),说明该方程与实际情况拟合很好,通过响应面法优化得到的模型回归方程及最佳条件可靠。
2.4 抗氧化性能检测
2.4.1 韭籽多肽和BHT对DPPH·的清除效果 由图9看出,以BHT为对照,随着韭籽多肽浓度的提高,清除能力逐渐增强,当浓度为2.0 mg/mL时,清除率达66.3%。

图9 韭籽多肽和BHT清除DPPH·的能力Fig.9 The scavenging of DPPH free radicals by leek polypeptide and BHT
2.4.2 韭籽多肽和BHT的总还原力 抗氧化剂通过自身的还原作用给出电子而清除自由基,还原力越强,抗氧化性越强。因此,可通过测定还原力来说明其抗氧化活性的大小[31]。由图10可知,随着韭菜籽浓度提高(0.1~2.0 mg/mL),还原力逐渐增强。

图10 韭籽多肽和BHT的总还原力Fig.10 The total reducing power of leek polypeptide and BHT
3 结论
根据单因素的实验结果,通过Box-Behnken中心组合实验设计及响应面分析,得到具有较好拟合度的回归方程模型,该模型具有统计学意义,从而确定优化条件。通过验证实验,优化后实际响应值与预测的最大响应值间拟合程度良好,表明中心组合设计和响应面分析在提取条件优化方面的应用具有实际指导作用。最终的优化条件为:韭菜籽粕浓度为9.4%,初始pH为3.0,发酵时间为3.0 d,在此条件下韭籽多肽含量是573.55 μg/mL。
对在最佳黑曲霉发酵工艺条件下制备得到韭籽多肽对DPPH·的清除能力以及总还原力进行测定,结果表明韭籽多肽具有抗氧化活性。
[1]胡国华,茅仁刚,张华,等. 韭菜籽提取物研究及应用(二)[J]. 中国食品添加剂,2008,(5):71-74.
[2]马志虎,侯喜林,汤兴利,等. 响应面法优化超临界CO2萃取韭菜籽油[J]. 中国油脂,2009,34(7):13-17.
[3]周玉新,于绪平,陈玮,等. 索氏法提取韭菜籽油的工艺研究[J]. 四川化工,2007,10(6):1-4.
[4]李超,王卫东,孙月娥. 响应曲面法优化韭菜籽油的微波提取工艺研究[J].食品工业科技,2010,(7):283-286.
[5]Pongsak Rattanachaikunsopon,Parichat Phumkhachorn. Potential of Chinese chive oil as a natural antimicrobial for controlling Flavor bacterium columnare infection in Nile tilapia Oreochromis niloticus[J].Fisheries Science,2009,75:1431-1437.
[6]赵延华,龚吉军,李振华,等.ACE抑制肽研究进展[J].粮食与油脂,2011(6):44-46.
[7]张晓梅,钟芳,麻建国.大豆降胆固醇活性肽的初步分离纯化[J].食品与机械,2006,22(2):33-36.
[8]王天明,苏意钢,马永军,等. 海地瓜多肽分离及抗氧化活性研究[J].现代食品科技,2014,30(5):75-81.
[9]孙婕,尹国友,丁蒙蒙,等.韭菜籽蛋白的提取及抗氧化活性研究初探[J]. 食品工业科技,2014,35(6):291-294.
[10]洪晶,陈涛涛,唐梦茹,等. 响应面法优化韭菜籽蛋白质提取工艺[J]. 中国食品学报,2013,13(12):90-96.
[11]陈涛涛.韭菜籽中活性生物分子的分离纯化及活性表征[D].福州:福州大学,2014.
[12]杨文雄,高彦祥. 响应面法及其在食品工业中的应用[J]. 中国食品添加剂,2005,6(2):68-71.
[13]杜鹏.乳品微生物学实验技术[M].北京:中国轻工业出版社,2008:228.
[14]李爱华,岳思群,马海滨. 真菌孢子三种技术方法相关性的探讨[J].微生物杂志,2006,26(2):107-110.
[5]周德庆.微生物学教程[M].北京:高等教育出版社.2002(2):152-166.
[16]武汉大学,复旦大学生物系微生物学教研室编.微生物学[M].北京:人民教育出版社,1990,448-449.
[17]Nakajima Y,Nakashima T,Inaba K,et al. Effects of nitric oxide on the redox status of liver microsomes-electron spin resonance monitor ringusing nitroxide probes[J]. Hepatol Res,2002,24(1):72-79.
[18]谢翠品,敬思群,刘帅,等.黑曲霉发酵核桃粕生产核桃多肽工艺优化[J].中国酿造,2013,32(2):53-56.
[19]管风波.大豆多肽液态发酵工艺优化[J].粮食与油脂,2008(6):14-16.
[20]柳杰,张晖,郭晓娜,等.液态发酵制备花生抗氧化肽的优化研究[J].中国油脂,2011,36(2):25-29.
[21]鞠兴荣,金晶,袁建,等.液态发酵法制备菜籽ACE抑制肽菌种的筛选[J].食品科学,2010,31(19):212-215.
[22]魏明,薛正莲,赵世光,等.米曲霉发酵米糠制取米糠多肽及其抗氧化活性研[J].食品工业科技,2014,35(19):114-118.
[23]吴丹.富硒香菇多糖和富硒平菇多糖体外抗氧化活性研究[J].安徽农业科学,2010,38(11):5841-5856.
[24]秦卫东,陈学红,马利华.黑曲霉发酵豆粕制备抗氧化肽研究[J].食品科学,2010,31(23):289-292.
[25]孙俊良.酶制剂生产技术[M].北京:科学出版社,2004,25-40.
[26]何荣海.枯草芽孢杆菌液态发酵菜籽粕制备抗氧化肽的研究[J].中国食品学报,2013,13(12):12-19.
[27]于研.微生物发酵法提取大豆油脂的研究[D].哈尔滨:东北林业大学,2012.
[28]王岸娜,孙玉丹,李龙安,等.响应面法优化猕猴桃糖蛋白提取工艺研究[J].河南农业科学,2012,41(8):121-127.
[29]岳喜庆,鲍宏宇,于娜,等.响应面法优化卵黄蛋白质提取工艺[J].食品研究与开发,2011,32(4):48-52.
[30]Rodríguez-González V. M.,Femenia A.,Minjares-Fuentes R.,et al.Functional properties of pasteurized samples of Aloe barbadensis Miller:Optimization using response surface methodology[J]. LWT-Food Science and Technology,2012,47(2):225-232.
[31]Yen Gow Chin,Duh Pin Der,Tsai Hui Ling. Antioxidant and pro-oxidant properties of ascorbic acid and gallic acid[J]. Food Chemistry,2002,79(3):307-313.
Optimization on the production of polypeptide from Chinese leek seed meal byAspergillusnigerliquid fermentation
SUN Jie1,YIN Guo-you1,Qi Wang2,LIU Wen-xia1,LI Wen-jian1,ZHANG Xian-qing1
(1.College of Life Science and Engineering,Henan University of Urban Construction,Pingdingshan 467036,China;2.Guelph Research and Development Centre,Agriculture and Agri-Food Canada,Guelph,Ontario,N1G5C9,Canada)
The optimum extraction conditions of bioactive peptides from Chinese leek seed meal by usingAspergillusnigerliquid fermentation were investigated using the response surface method(RSM)and the antioxidant activity of extract was obtained under optimum extraction conditions in order to make full use of the by-product of Chinese leek seed meal. The results indicated that the effect order of the three factors on the peptide extraction from Chinese leek seed meal was fermentation time>substrate concentration>initial pH,and the optimum extraction conditions were substrate concentration 9.4%,initial pH3.0,fermentation time 3 d. Under the optimal conditions,the extraction rate of peptide from Chinese leek seed meal was 573.55 μg/mL. Antioxidant activity of the leek polypeptide from Chinese leek seed meal,including the DPPH· and reducing power measure. The results showed that the leek polypeptide possessed antioxidant propertiesinvitro. And with the concentration of polypeptides increasing,its antioxidant activity gradually becomes stronger.
leek polypeptide;response surface method;liquid state fermentation;antioxidant activity
2016-08-04
孙婕(1976-),女,博士,副教授,研究方向:天然产物分离纯化及功能性质研究,E-mail:sunjie124@163.com。
河南省科技计划重点科技攻关项目(132102210192,152102210091);河南省产学研合作项目(152107000052); 河南省高等学校重点科研项目(17A550008)。
TS201.2
B
1002-0306(2017)05-0199-07
10.13386/j.issn1002-0306.2017.05.029
