南极磷虾中产抗菌活性物质菌株的筛选及系统发育分析
2017-06-01袁兰云王亚璐宁喜斌刘志东
袁兰云,王亚璐,宁喜斌,*,刘志东
(1.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306;.中国水产科学研究院东海水产研究所,上海 200090)
南极磷虾中产抗菌活性物质菌株的筛选及系统发育分析
袁兰云1,王亚璐1,宁喜斌1,*,刘志东2
(1.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306;.中国水产科学研究院东海水产研究所,上海 200090)
分别以金黄色葡萄球菌StaphylococcusaureusATCC 27661(Sa 27661)和大肠杆菌EscherichiacoliATCC 35218(Ec 35218)为指示菌,以南极磷虾中分离出的59株菌为测试菌,利用牛津杯法进行抗菌活性菌株的初筛及复筛,同时用比浊测定法和牛津杯法对活性菌株的部分特性包括生长曲线、抗菌曲线、最佳温度、最佳pH、最佳盐度进行了测定,以Mega 5邻接法对其16S r RNA基因序列及系统发育地位进行探究。结果发现,初筛获得13株菌对Sa 27661具有抗菌活性,6株菌对Ec 35218具有抗菌活性。复筛得到对Sa 27661和Ec 35218均具有明显抗菌活性的菌株3株,阳性率为5.08%,其编号分别为1A3、A4、1A5。且3株菌分别培养16、20、28 h进入生长对数期,培养36、48、60 h达到稳定期。分别培养56、64、72 h时抗菌活性达到最高,之后基本达到稳定。最佳温度分别为15、20、20 ℃,最佳pH分别为7、6、6,最佳盐度分别为1%、3%、2%。系统发育分析结果表明,菌株A4、1A5,均属于嗜冷杆菌属Psychrobacter,菌株1A5与已注册的菌株(Psychrobactersp. OK1)基因序列相似性可达100%。而菌株1A3与不可培养嗜冷杆菌属(UnculturedPsychrobacter)同源性为97%。三株菌均具有较好的耐酸性、耐碱性和耐盐性的能力,同时具有较好的抗菌活性。
南极磷虾,嗜冷杆菌属,抗菌活性,系统发育分析
极地微生物主要存在于极端的低温、高盐度及干燥的环境中,正是由于这样特殊的环境使其具有特殊的生物学特征及竞争优势[1-3]。为了适应特殊的环境条件,也必然具有其特殊的生理特点和适应机制,如嗜冷、耐冷特性、耐碱性、耐盐性及产活性物质等[2-6]。这些特性也使其有望成为开发新型活性物质的重要潜在来源之一[5]。与极地微生物相关的活性代谢产物方面的研发,在国际上已成为微生物学领域研究的热点之一[3-10]。从相关文献及报道可以发现,各国科学家们已从不同的样品(如南极海水、海冰、海洋沉积物等)中分离到了具有抗菌能力的细菌[3,5-6,12,22]。Giudice等从南极海水、海冰、海洋沉积物等样品分离的580株细菌中,以大肠杆菌(Escherichiacoli)、奇异变形杆菌(Proteusmirabilis)、藤黄微球菌(Micrococcusluteus)等为指示菌,共筛选出22株抗菌活性菌株,阳性率为3.8%[3,12]。李贺等从实验室保存的分离自南极的580株细菌中筛出4株抗菌活性菌株,阳性率为0.7%[3,5]。
南极磷虾,具有较高的科学价值及广泛的效用[13-18],也越来越受到人们的重视,对其研究也逐年增多,多集中于南极磷虾的脱氟工艺、南极磷虾粉及油的开发利用、虾青素的研究,但对其体内产抗菌活性物质菌株的研究未有太多报道,大多研究的产抗菌活性物质的极地微生物也多是从海泥、海冰中分离,而本实验室取部分南极磷虾虾砖,对其进行自然解冻,从南极磷虾虾肉中分离出了59株细菌,并以之为研究对象,对其进行了抗菌活性菌株的筛选,同时对活性菌株的部分特性,包括生长曲线、抗菌曲线、生长的最佳温度、耐碱性、耐盐性等进行研究,并对这些菌株构建了基于16S rRNA基因的系统发育树。以期从南极磷虾样品中分离到具有抗菌能力的菌株,并对菌株进行初步研究以了解其特性,使其有望成为新型活性物质的重要潜在来源之一,并有望应用到新型的食品生物防腐保鲜剂的开发中,从而为更好地研究南极磷虾及其体内的活性菌株打下良好的基础,对于深度利用开发南极磷虾资源具有一定的意义。
1 材料与方法
1.1 材料与仪器
南极磷虾 在南极打捞出迅速以原位海水冷冻,由雪龙号运回,实验中所用南极磷虾虾砖取自东海水产研究所;59株测试菌 由本实验室分离自南极磷虾虾肉并纯化保存;金黄色葡萄球菌(StaphylococcusaureusATCC 27661,Sa 27661)、大肠杆菌(EscherichiacoliATCC 35218,Ec 35218)为指示菌 由本实验室保藏;2216E固体培养基、2216E液体培养基 青岛海博生物技术有限公司并按要求进行配制;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司。
振荡培养箱ZQWY-200、水浴振荡培养箱ZHSY-50FT 上海知楚仪器有限公司;PCR扩增仪、凝胶成像系统(Gel DocTMXR+System) 美国BIO-RAD公司。
1.2 实验方法
1.2.1 抗菌活性物质产生菌的初筛 用无菌接种环分别取少量保存于斜面的59株分离自南极磷虾的测试菌,并接种于装有5 mL 2216E液体培养基的试管(15 mm×150 mm)中,于振荡培养箱ZQWY-200(15 ℃,120 r/min)中培养2 d,取1.5 mL发酵液于1.5 mL离心管中,在10000 r/min下离心10 min,留上清液测抗菌活性用。
以牛津杯法筛选抗菌活性菌株,将灭菌后的营养琼脂冷至约55 ℃,摇匀倒入已灭菌的培养皿(D=90 mm)中,每皿大约30 mL培养基,凝固后倒置于无菌操作台过夜。将过夜培养的指示菌Sa 27661和Ec 35218各取100 μL滴加在营养琼脂平板上,涂布使菌液均匀分布于培养基表面,正置约30 min使指示菌吸收彻底。用镊子将无菌牛津杯均匀放于培养基上,使牛津杯与培养基间无缝隙,每皿放置6~8个牛津杯。取上述发酵上清液加入牛津杯内,液面约与牛津杯平齐,静置1 h,然后置于37 ℃恒温培养箱培养24 h,观察牛津杯周围是否形成抑制圈[3,9,23]。
1.2.2 牛津杯加液量的测试 以初筛抗菌效果较好的菌株为测试对象(指示菌操作如1.2.1),分别取其50、100、150、200 μL的发酵上清液加入牛津杯中,置于37 ℃恒温培养箱培养24 h,观察不同加液量牛津杯周围抑制圈大小,并确定最佳加液量。
1.2.3 抗菌活性物质产生菌的复筛 活性菌株的培养及上清液的制备同1.2.1中初筛操作,以1.2.2中确定的最佳加液量将上清液加入牛津杯,37 ℃恒温培养24 h,测量各抑制圈直径,3次重复,计算平均值。同时比较抗菌活性菌株分别对指示菌Sa 27661和Ec 35218的抑菌效果,确定抗菌活性菌株抑制效果最好的指示菌。
1.2.4 抗菌活性菌株的部分特性研究
1.2.4.1 种子液的制备 分别挑取少量抗菌活性菌株接种于5 mL 2216E液体培养基中,于低温摇床15 ℃,140 r/min培养30 h,即种子液。
1.2.4.2 抗菌活性菌株的生长曲线及抗菌曲线 将活性菌株种子液以3%的比例,接种于100 mL 2216E液体培养基中(250 mL的三角瓶),于振荡培养箱ZQWY-200(15 ℃,120 r/min)中培养,从第12 h开始,每4 h于无菌操作台定时取样。测定其在600 nm下的OD值,绘出生长曲线[3-6]。同时每4 h于无菌操作台定时取1.5 mL发酵液,在10000 r/min下离心10 min,留上清液,以1.2.3中确定的抗菌活性菌株抑制效果最好的菌为指示菌。按照1.2.3中牛津杯法操作,测定抗菌活性菌株的抑菌圈直径,绘出抗菌曲线[3,5-6]。
1.2.4.3 温度对抗菌活性菌株生长的影响 分别取100 μL种子液,接种于5 mL2216E液体培养基中,分别于4、10、15、20、25、28、30、37 ℃摇床培养48 h。测定其在600 nm下的OD值,绘出温度对抗菌活性菌株生长的影响[3-6]。
1.2.4.4 pH对抗菌活性菌株生长的影响 配制2216E液体培养基,并调节其pH,分别为4、5、6、7、8、9、10,分装试管。分别取100 μL种子液,接种于不同pH的5 mL 2216E液体培养基中,于15 ℃,120 r/min培养48 h。测定其在600 nm下的OD值,绘出pH对抗菌活性菌株生长的影响[3-6]。
1.2.4.5 盐度对抗菌活性菌株生长的影响 配制改良2216E液体培养基,调节其盐度值,分别为0、0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%,分别取100 μL种子液,接种于不同盐度的5 mL改良2216E液体培养基中,于15 ℃,120 r/min培养48 h。测定其在600 nm下的OD值,绘出盐度对抗菌活性菌株生长的影响[3-6]。
1.2.5 抗菌活性菌株的菌体形态观察及部分生理生化指标鉴定 将保存于斜面的抗菌活性菌株重新在2216E平板上划线,15 ℃培养7 d观察菌落形态并挑取少量菌进行革兰氏染色观察菌体形态。同时参照《常见细菌系统鉴定手册》对其进行部分生理生化鉴定,包括运动性、需氧性、柠檬酸盐利用、接触酶、V-P实验、甲基红实验、淀粉水解、明胶水解、氧化酶实验[29]。
1.2.6 抗菌活性菌株的系统发育分析 将1.2.3中筛出的抗菌活性菌株,接种到2216E液体培养基中,并于15 ℃,120 r/min的条件下摇床培养40 h。按照细菌DNA提取试剂盒中方法,提取活性菌株DNA[3,6,9]。
16S r RNA基因的PCR扩增引物采用通用引物:
27F:5′-AGAGTTTGATCCTGGCTCAG-3′
1492R:5′-ACGGCTACCTTGTTACGACTT-3′
用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、引物1492R(5′-ACGGCTACCTTGTTACGACTT-3′)PCR扩增供试菌株16S rDNA近5′端的区域。25 μL反应体系:12.5 μL PCR Master Mix,1.0 μL模板DNA,上下游引物各1.0 μL,加ddH2O补充至25 μL。
PCR扩增条件:95 ℃,预变性5 min;94 ℃,变性1 min;55 ℃,退火1 min;72 ℃,延伸1.5 min;72 ℃,延伸10 min。按上述反应条件进行30个循环,4 ℃,保存[3,6,21]。取5 μL扩增产物进行1.5%琼脂糖凝胶电泳,电泳液为1×TAE,选取dl 2000 DNA Marker,凝胶成像系统观察条带,并将其余所得的PCR产物送上海生工进行测序[3,6]。
2 结果与分析
2.1 抗菌活性菌株的筛选
2.1.1 抗Sa 27661、Ec 35218的活性菌株的筛选 对本实验室保存的59株测试菌,进行抗菌活性菌株的初筛,获得对Sa 27661具有抗菌活性的菌株13株,阳性率为22.03%,对Ec 35218具有抗菌活性的菌株6株,阳性率为10.17%。
2.1.2 牛津杯加液量的测试 牛津杯加液量的测试如图1(以初筛抗菌效果较好的菌株1A3为测试对象)所示。从图1可以看出,加液量为50~150 μL时,随着加液量的增加,抑菌圈直径明显增加,但加液量为200 μL时抑菌圈直径比加液量为150 μL时更明显些,所以确定最佳加液量为200 μL,复筛加液量均为200 μL。

图1 牛津杯加液量的测试Fig.1 Liquid volume test of Oxford cup
2.1.3 抗Sa 27661和Ec 35218的活性菌株的筛选 以200 μL加液量对这些菌株进行复筛,发现有3株对Sa 27661和Ec 35218均具有抗菌活性,其编号分别为1A3、A4、1A5,抗菌活性菌株的阳性率为5.08%。而Giudice[12]等从南极海水、海冰、海洋沉积物以及海洋动物等样品分离的580株细菌中筛选出22株抗菌活性菌株,阳性率为3.8%。相比于其他文献报道[3-6,12],本研究筛选的抗菌活性菌株阳性率较高,说明南极磷虾体内的活性菌株比较多,究其原因可能是由于南极磷虾在生存过程中为抵抗恶劣环境以及其他不良因素,会在体内产生抗性菌株以抵抗外界不良因子从而维持自身的良好生长。菌株1A3、A4、1A5的抗菌圈直径结果记录如表1。
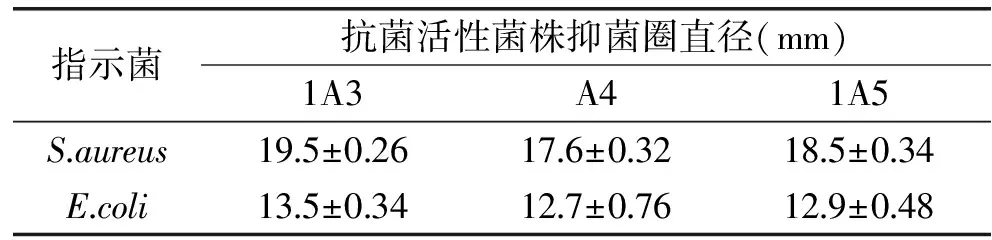
表1 抗菌活性菌株的抑菌圈直径
从表1可以看出,从抗菌圈直径来看,三株菌分别对Sa 27661和Ec 35218的抗菌效果没有太大差别,可能因为活性菌株本身为革兰氏阴性菌,所以总体对革兰氏阳性菌Sa 27661的抗菌活性相较于革兰氏阴性菌Ec 35218要好些。所以,后续实验对活性菌株抗菌曲线的测定以Sa 27661为指示菌。
2.2 抗菌活性菌株的部分特性研究
2.2.1 抗菌活性菌株的生长曲线及抗菌曲线 以菌株1A3、A4、1A5的生长时间为横坐标,以各时间点测定的OD600值为主纵坐标,以各时间点测定的抑菌圈直径为次纵坐标,绘出菌株1A3、A4、1A5生长曲线及抗菌曲线的双纵坐标图。结果如图2~图4。
从图2菌株1A3的生长曲线及抗菌曲线的双纵坐标图可以看出,菌株1A3在培养16 h进入生长对数期,36 h达到稳定期,56 h菌体开始衰亡。而菌株培养20 h开始出现抗菌活性,抗菌活性随着菌株进入对数期生长而增强,但菌株达到稳定期后抗菌活性仍在增加,直到菌株56 h进入衰亡期,抗菌活性达到最高并基本保持稳定,说明随着菌株的快速生长,菌体开始产生抗菌活性物质,但随着菌体衰亡自溶后,抗菌活性增加,随后稳定,即抗菌活性物质可能不仅存在于发酵上清液中,细胞内可能也含有抗菌活性物质。后期实验会对细胞进行破壁处理并对照上清液的抗菌活性,以验证细胞内是否也含有抗菌活性物质。
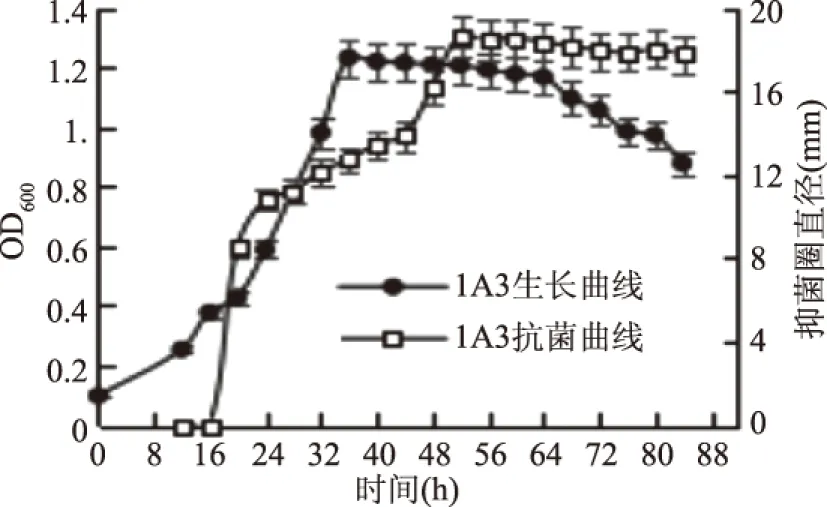
图2 菌株1A3的生长曲线及抗菌曲线Fig.2 The growth curve and antibacterial curve of strain 1A3
从图3菌株A4的生长曲线及抗菌曲线的双纵坐标图可以看出,菌株A4在培养20 h进入生长对数期,48 h达到稳定期,64 h菌体开始衰亡。而菌株培养24 h开始出现抗菌活性,抗菌活性随着菌株进入对数期生长而增强,但菌株达到稳定期后抗菌活性也基本达到最强并保持稳定,随着菌株进入衰亡期,抗菌活性也依然保持稳定趋势,说明随着菌株的快速生长,菌体开始产生抗菌活性物质,菌株生长达到稳定期后,抗菌活性也基本稳定,即抗菌活性物质可能只存在于发酵上清液中,随着细胞自溶并未释放出抗菌活性物质。后期实验会对细胞进行破壁处理并对照上清液的抗菌活性,以验证细胞内是否也含有抗菌活性物质。
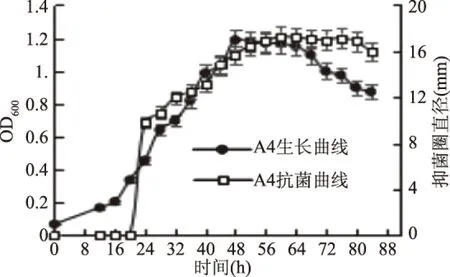
图3 菌株A4的生长曲线及抗菌曲线Fig.3 The growth curve and antibacterial curve of strain A4
从图4菌株1A5的生长曲线及抗菌曲线的双纵坐标图可以看出,菌株1A5在培养28 h进入生长对数期,60 h达到稳定期,72 h菌体开始衰亡。而菌株培养32 h开始出现抗菌活性,抗菌活性随着菌株进入对数期生长而增强,但菌株达到稳定期后抗菌活性也基本达到最强并保持稳定,抗菌活性物质的产生于菌株的生长曲线保持大体相同的趋势。即抗菌活性物质可能只存在于发酵上清液中,随着细胞自溶并未释放出抗菌活性物质。后期实验会对细胞进行破壁处理并对照上清液的抗菌活性,以验证细胞内是否也含有抗菌活性物质。
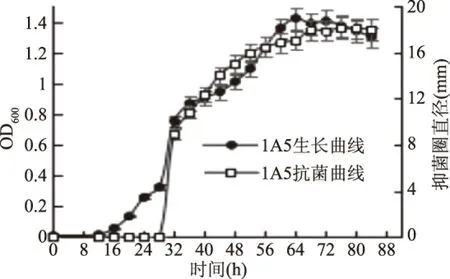
图4 菌株1A5的生长曲线及抗菌曲线Fig.4 The growth curve and antibacterial curve of strain 1A5
2.2.2 温度对抗菌活性菌株生长的影响 在不同的温度条件下,测定抗菌活性菌株1A3、A4、1A5的生长状况,结果如图5。
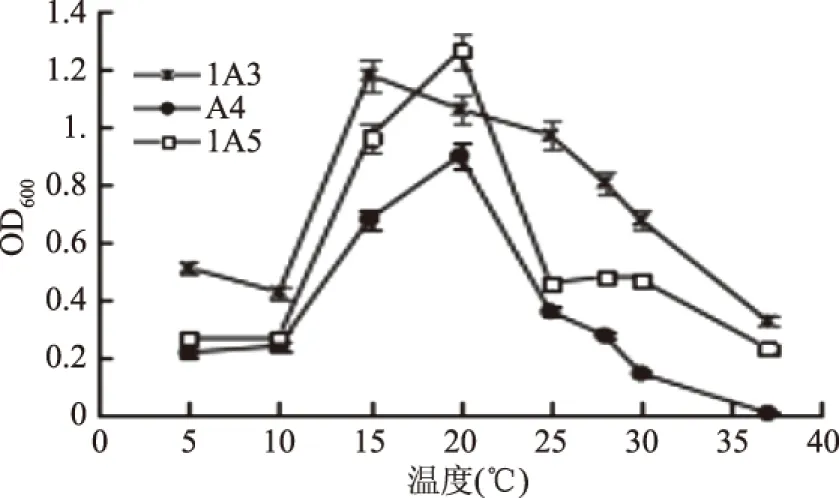
图5 活性菌株的最佳生长温度Fig.5 The optimum temperature of the antibacterial strains
从图5可以看出,活性菌株1A3、A4、1A5的最佳生长温度分别为15、20、20 ℃。对于菌株A4、1A5来说,低于10 ℃及高于25 ℃时,菌株生长受到抑制。而菌株1A3的最佳生长温度虽为15 ℃,但可耐受范围较大,为5~30 ℃。
2.2.3 pH对抗菌活性菌株生长的影响 不同的pH下,活性菌株1A3、A4、1A5的生长状况,如图6。
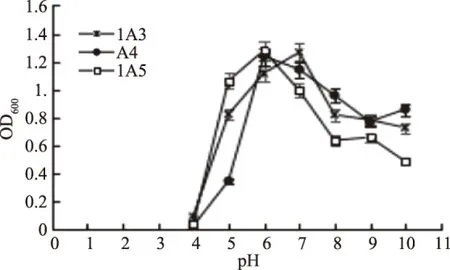
图6 活性菌株生长的最佳pHFig.6 The optimum pH of the antibacterial strains
从图6可以看出,菌株1A3生长的最佳pH为7,但在5~10的pH范围内均可生长,具有较好的耐酸性和耐碱性。相比于1A3来说,菌株A4生长的最佳pH为6,但pH低于6时,菌株生长受到抑制,在6~10范围内均生长良好,说明菌株A4耐碱性较好。菌株1A5生长的最佳pH为6,但pH为5时也生长良好,与pH为6时没有太大差别,可耐受的pH范围为5~9,但耐酸性比耐碱性好。三株活性菌株均具有耐酸性和耐碱性的能力。
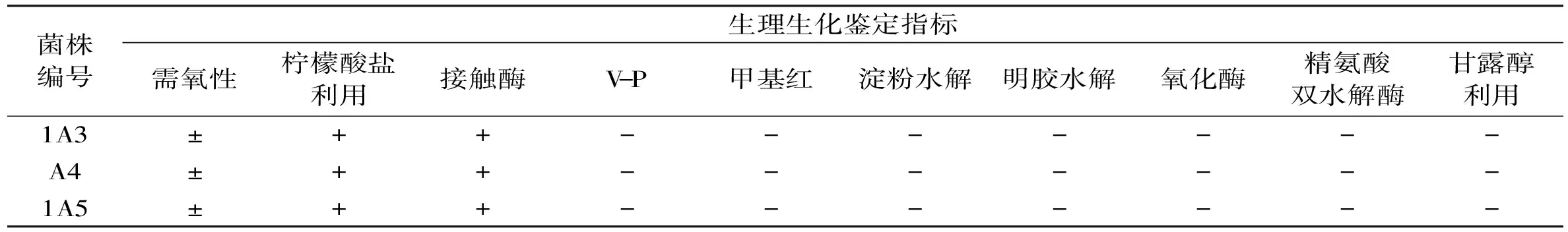
表2 抗菌活性菌株的生理生化鉴定结果
注:±:需氧及兼性厌氧;+:阳性;-:阴性。2.2.4 盐度对抗菌活性菌株生长的影响 在不同的盐度条件下,测定抗菌活性菌株1A3、A4、1A5的生长状况,结果如图7。
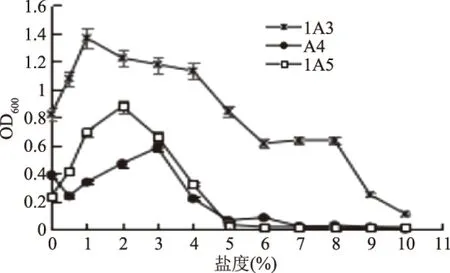
图7 活性菌株生长的最佳盐度Fig.7 The optimum salinity of the antibacterial strains
从图7可以看出,菌株1A3生长的最佳盐度为1%,可耐受的盐度范围为0~8%,即可在无盐条件下生长,又可耐受高盐度至8%。而菌株A4生长的最佳盐度为3%,且可耐受盐度范围较窄,约为0~3.5%,盐度大于3.5%时,菌株几乎不生长,从曲线可以看出,在无盐时,菌株生长,但盐度为0.5%时菌株反而生长缓慢,之后随着盐度增加,生长趋势变好,可能说明,出现盐后,菌株A4的生长可能受到了盐的诱导。菌株1A5生长的最佳盐度为2%,可耐受的盐度范围为0.5%~4%,盐度高于4%时,菌株几乎不生长,无盐时,菌株有轻微生长。
相比于菌株1A3来说,菌株A4、1A5生物量较低可能是因为培养温度为15 ℃,为1A3生长的最佳温度,而菌株A4、1A5生长的最佳温度为20 ℃。
2.3 抗菌活性菌株的菌体形态观察及部分生理生化指标鉴定
菌株1A3在2216E平板上单菌落为圆形,白色,光滑,不透明,边缘整齐,微凸,革兰氏染色阴性,短杆状。菌株A4在2216E平板上单菌落为圆形,米白色,光滑,不透明,边缘整齐,微凸,质地较软,革兰氏染色阴性,球杆状。菌株1A5在2216E平板上单菌落为圆形,米白色,光滑,不透明,边缘整齐,微凸,革兰氏染色阴性,球杆状。菌株1A3、A4、1A5的柠檬酸盐利用、接触酶均为阳性,V-P实验、甲基红实验、淀粉水解、明胶水解、氧化酶、精氨酸双水解酶、甘露醇利用均为阴性。活性菌株的部分生理生化鉴定结果如表2。
2.4 抗菌活性菌株的系统发育分析
活性菌株1A3、A4、1A5的16S rRNA基因的PCR扩增产物进行1.5%琼脂糖凝胶电泳后,电泳条带如图8所示,1.5 kb处条带清晰。
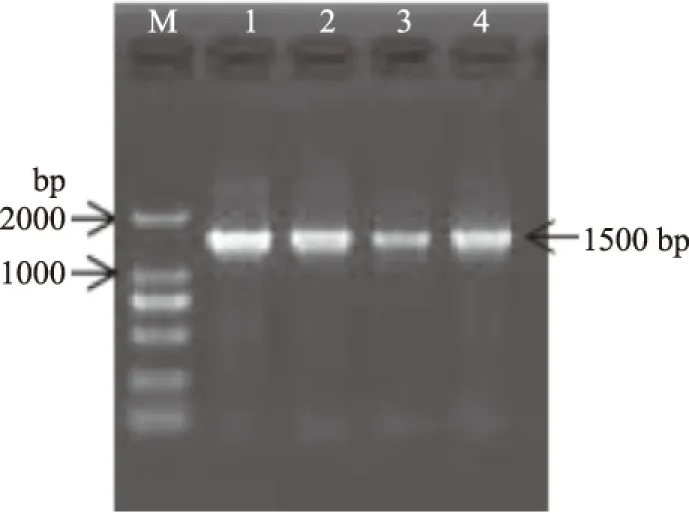
图8 活性菌株PCR产物电泳图Fig.8 PCR products electrophoretogram of active strains注:M为Marker(dl2000),1为菌株1A3, 2为菌株A4,3为菌株1A5,4为阳性对照。
将活性菌株的序列进行拼接,对于拼接后获得的16S rRNA基因序列,进行BLAST比对分析。与活性菌株1A3、A4、1A5的16S rRNA基因序列同源性最高的菌株及其同源性如表3所示。

表3 活性菌株的16S r RNA基因序列同源性
从表3可见,本研究中分离的活性菌株,与Gen Bank库中已有菌株相比,其16S rRNA基因序列相似性较高,均在97%及以上,并且菌株1A5与已注册的菌株Psychrobactersp. OK1基因序列相似性可达100%。

图9 三株抗菌活性菌株的16S rRNA基因序列系统发育树Fig.9 Phylogenetic tree of the three antimicrobial bacteria based on partial 16S rRNA gene sequences注:在树节上的数字代表1000取样的百分比,仅显示大于等于50%的情况。
对抗菌活性菌株1A3、A4、1A5及与其同源性较高的菌株的16S rRNA基因序列采用MEGA5进行序列比对并用邻接法构建了3株活性菌株的系统发育树,结果如图9所示。
参考图9并结合抗菌活性菌株的菌体形态观察及部分生理生化指标鉴定结果,可以得出,筛选出的三株抗菌活性菌株,其中A4和1A5属于嗜冷杆菌属(Psychrobacter),并且菌株Psychrobacter1A5即为已注册的菌株Psychrobactersp. OK1,而1A3与UnculturedPsychrobactersp. clone C5B01(与其同源性最高的菌株,不可培养嗜冷杆菌属)只有97%的相似性,可能为新种,但需进一步研究。
李贺[3,5]从580株极地细菌中筛选到的四株抗性菌株有两株为嗜冷杆菌属,抗菌活性较好,抗菌谱较广。而本研究从南极磷虾中筛选出的两株嗜冷杆菌属及一株不可培养嗜冷杆菌属,抗菌活性不如其他文献中报道,究其原因可能为:培养条件的限制,极地微生物的生长条件特殊,简单的实验室条件无法完全满足其生长,对其发酵产抗菌活性物质影响较大;对筛选出的菌株产抗菌活性物质抑菌圈的测定只是取发酵上清液,而在菌体细胞内可能也含有抗菌活性物质。后期实验会对抗菌活性菌株产抗菌活性物质发酵条件进行优化,以寻找最佳的发酵条件,并对抗菌活性菌株进行破壁处理,探究其胞内是否含有抗菌活性物质。
3 结论
本研究以本实验室从南极磷虾虾肉中分离出的59株细菌为研究对象,从中筛出三株对Sa 27661和Ec 35218均具有抗菌作用的菌株,其中A4、1A5均属于嗜冷杆菌属,而1A3与不可培养嗜冷杆菌属较接近,可能为新种。由于活性菌株本身为革兰氏阴性菌,所以对革兰氏阳性菌的抗菌效果较革兰氏阴性菌的效果更明显。且三株活性菌株均具有较好的耐酸性、耐碱性和耐盐性的能力,所以有望应用于饮料等食品工业以及洗手液等消毒产品中,后续可对其抗性机理进一步深入研究。
总之,南极磷虾体内抗性菌株较多,其有望成为新型活性物质的重要潜在来源之一,并有望开发为新型的食品生物防腐剂,从而为更好地开发利用南极磷虾及其体内的抗菌活性菌株打下了良好的基础,对于深度利用开发南极磷虾资源具有一定的意义。
[1]林学政,边际,何培青.极地微生物低温适应性的分子机制[J]. 极地研究,2003,15(1):75-82.
[2]曾胤新,陈波.南极低温微生物研究及其应用前景[J]. 极地研究,1999,11(2):66-75.
[3]李贺.极地微生物抗细菌活性菌株的筛选、鉴定及活性物质的初步研究[D].济南:山东轻工业学院,2011.
[4]Bowman J P,McCammon S A,Brown M V,et al. Diversity and association of psychrophilic bacteria in Antarctic sea ice.[J]. Applied and Environmental Microbiology,1997,63(8):3068-3078.
[5]李贺,林学政,刘同军.南极适冷菌Rheinheimerasp.97产抗菌活性物质发酵条件的优化[J].安徽农业科学,2011,39(17):10101-10103.
[6]王欣磊.南极细菌中抗低温致腐菌的筛选、鉴定及拮抗物质的研究[D].哈尔滨:哈尔滨工业大学,2013.
[7]曾胤新,陈波,邹扬,等.极地微生物——新天然药物的潜在来源[J].微生物学报,2008,5:695-700.
[8]De Pascale Donatella,De Santi Concetta,FuJuan.The microbial diversity of Polar environments is a fertile ground for bioprospecting.[J]. Marine Genomics,2012,8:15-22.
[9]N. Fong,M. Burgess,K. Barrow,et al. Carotenoid accumulation in the psychrotrophic bacterium Arthrobacter agilis in response to thermal and salt stress[J]. Applied Microbiology and Biotechnology,2001,56(5-6):750-756.
[10]谭仁祥.海洋微生物:新天然药物的重要源泉.中国天然药物(Chinese Journal of Natural Medicines),2006,4(1):2-4.
[11]张青松,王勇.中国南极考察28年来的进展[J].自然杂志,2008,5:252-258,309-310.
[12]Angelina Lo Giudice*,Vivia Bruni,Luigi Michaud. Characterization of Antarctic psychrotrophic bacteria with antibacterial activities against terrestrial microorganisms[J]. Journal of Basic Microbiology,2007,47(6):496-505.
[13]楼乔明,王玉明,刘小芳,等.南极磷虾脂肪酸组成及多不饱和脂肪酸质谱特征分析[J].中国水产科学,2011,4:929-935.
[14]崔秀明,汪之和,施文正.南极磷虾粗虾油提取工艺优化[J].食品科学,2011,24:126-129.
[15]刘丽,刘承初,赵勇,等.南极磷虾的营养保健功效以及食用安全性评价[J].食品科学,2010,17:443-447.
[16]袁玥,李学英,杨宪时,等.南极磷虾粉营养成分的分析与比较[J].海洋渔业,2012,4:457-463.
[17]常青,秦帮勇,孔繁华,等.南极磷虾在水产饲料中的应用[J].动物营养学报,2013,2:256-262.
[18]龚洋洋,黄艳青,陆建学,等.南极磷虾粉在水产饲料中的应用研究进展[J].海洋渔业,2013,2:236-242.
[19]Ricardo Cavicchioli,Khawar S Siddiqui,David Andrews,et al. Low-temperature extremophiles and their applications[J]. Current Opinion in Biotechnology,2002,13(3):253-261.
[20]J-C.Marx,T.Collins,S.D Amico,et al.Cold-Adapted Enzymes from Marine Antarctic Microorganisms[J]. Marine Biotechnology,2007,9(3):293-304.
[21]张燕娇. 深海和极地细菌的多相分类学研究及深海细菌RheinheimerananhaiensisE407-8的基因组学分析[D].山东大学,2012.
[22]苏聪. 南大西洋深海沉积物源可培养微生物的鉴定及抑真菌活性[D].哈尔滨:哈尔滨工业大学,2014.
[23]陈皓文,高爱国.中国极地微生物学调查研究进展[J].极地研究,2005,4:299-307.
[24]Zeng YX,Yu Y,Li HR,et al.Psychrobacterfjordensissp. nov.,a psychrotolerant bacterium isolated from an Arctic fjord in Svalbard.[J].Antonie Van Leeuwenhoek,2015,108(6):1283-1292.
[25]Shuai Che,Weizhi Song,Xuezheng Lin.Response of Heat-Shock Protein(HSP)Genes to Temperature and Salinity Stress in the Antarctic Psychrotrophic BacteriumPsychrobactersp. G[J]. Current Microbiology,2013,67(5):601-608.
[26]Yin-Xin Zeng,Ming Yan,Yong Yu,et al.Diversity of bacteria in surface ice of Austre Lovénbreen glacier,Svalbard. [J].Archives of Microbiology,2013,195(5):313-322.
[27]王全富,蔺一飞,苗苗,等.海冰微生物Pseudoalteromonassp. ANT319耐盐性初步研究[J].生物技术进展,2015,3:240-245.
[28]丁新彪,丛柏林,张扬,等.南极普里兹湾及邻近海域沉积物微生物多样性与生理生化研究[J].海洋科学进展,2014,2:209-218.
[29]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-384.
Screening and phylogenetic analysis of antibacterial strains isolated fromAntarcticKrill
YUAN Lan-yun1,WANG Ya-lu1,NING Xi-bin1,*,LIU Zhi-dong2
(1.Shanghai Engineering Research Center of Aquatic-Product Processing and Preservation,College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;2.East China Sea Fisheries Research Institute,Shanghai 200090,China)
StaphylococcusaureusATCC 27661 andEscherichiacoli35218 were used as indicator strains respectively. Screening of the antibacterial activity strains from the 59 strains isolated fromAntarcticKrillwas by the method of Oxford cup diffusion. The partial characteristics including growth curve,antibacterial curve,optimum temperature,optimum pH and optimum salinity of the antibacterial strains were also studied by the method of nephelometry and Oxford cup diffusion. And with the method of Mega 5 adjacency,the 16S rRNA gene sequence of the antibacteria strains were blasted and then the phylogenetic tree were constructed. The results showed that thirteen strains of Sa 27661 antibacteria activity and six strains of Ec 35218 antibacteria activity were screened in the preliminary screening. Also three antibacterial strains named as 1A3,A4,1A5 both of Sa 27661 and Ec 35218 antibacteria activities were screened in the dual-frequency screening. The positive rate was 5.08%. And they reach the logarithmic phase when they were cultured 16,20,28 hours and reach the stationary phase when they were cultured 36,48,60 hours respectively. They have the highest antibacterial activities when they were cultured 56,64,72 hours respectively. The optimum temperature of the antibacterial activity strains were 15 ℃,20 ℃,20 ℃,optimum pH values were 7,6,6 and optimum salinity were 1%,3%,2%respectively. Phylogenetic analysis indicated that strains of A4,1A5 belong to genera ofPsychrobacter. And the gene sequence similarity of strain 1A5 was up to 100% of the registeredPsychrobactersp. OK1(AB302184.1). But the homology of strain 1A3 was only 97% toUnculturedPsychrobacterwhich need further study. Three strains all have the ability of acid resistance,alkali resistance,salt tolerance,also the antibacteria activity which need further study.
Antarctickrill;Psychrobacter;antibacterial activity;phylogenetic analysis
2016-09-09
袁兰云(1989-),女,硕士研究生,研究方向:食品微生物,E-mail:15001956315@163.com。
*通讯作者:宁喜斌(1965-),男,博士,教授,研究方向:食品安全,微生物学,E-mail:xbning@shou.edu.cn。
上海市科委工程中心建设(11DZ2280300);上海海洋大学骆肇尧大学生科技创新基金(A1-0204-00-1015)。
TS201.3
A
1002-0306(2017)05-0179-07
10.13386/j.issn1002-0306.2017.05.025
