夹竹桃提取物对蚯蚓的毒害作用
2017-05-30宋文韬赵云
宋文韬 赵云


摘要 [目的]探究夹竹桃不同部位提取物对赤子爱胜蚯蚓的毒性效应。[方法]采用索式提取法制备夹竹桃乙醇提取物,配制不同浓度提取物溶液通过不同方式处理蚯蚓,进行蚯蚓中毒反应及死亡率研究。[结果]夹竹桃的茎皮和叶乙醇提取物对蚯蚓具有毒害作用,新鲜茎皮的毒力较叶强,干燥后毒力减弱。鲜茎皮乙醇提取物浓度≤2.0 mg/mL时,蚯蚓的死亡率较低,可正常生活。[结论]夹竹桃对蚯蚓的毒害作用主要集中在茎皮中,制作植物源农药时可以优先选用。茎皮提取物浓度为1.0~2.0 mg/mL可起到杀虫的效果。
关键词 夹竹桃;蚯蚓;植物源农药;乙醇提取物
中图分类号 X174 文献标识码 A 文章编号 0517-6611(2017)06-0043-05
The Toxicity Effects of Extracts of Nerium indicum Mill on Eisenia fetida
SONG Wen-tao1,ZHAO Yun2 (1.Sixth Middle School in Hefei,Hefei,Anhui 230000;2.School of Life Sciences,Hefei Normal University,Hefei,Anhui 230061)
Abstract [Objective]To study the toxicity effects of extracts of Nerium indicum Mill on earthworm Eisenia fetida. [Methods]Crude ethanol extract of different organs in Nerium indicum by the method of soxhlet extraction was used to study symptoms of poisoning and death situation for Eisenia fetida. [Result] Ethanol extracts of bark and leaves of Nerium indicum have toxic effects on Eisenia fetida. The toxity of fresh bark was stronger than that of leaves, with less toxity when it was dried. Chart draws that when concentration of the fresh barks ethanol extract was no higher than 2.0 mg/mL, death situation of Eisenia fetida was low and it can live a normal life. [Conclusion] The poisoning effects of Nerium indicum on Eisenia fetida mainly concentrates in the bark. So it was preferred in terms of the production of botanical pesticides. The extracts concentration of the bark which met the state requirements for production of pesticides was 1.0-2.0 mg/mL.
Key words Nerium indicum Mill;Eisenia fetida;Botanical pesticides;Ethanol extract
農药的大量使用必然会影响自然界的生物群落和生态体系。研究发现,使用农药会对土壤生物产生各种影响。随着蚯蚓人工养殖业的开展及其在饲料、食品、药物等行业的广泛应用,被国际经济与合作组织(OECD)选作环境监测的指示动物。蚯蚓毒理学是蚯蚓生态学的重要分支,主要是利用蚯蚓作为测试生物对可能造成土壤环境损害的污染物进行测试,并根据这些污染物质对蚯蚓的毒害程度,评价其可能对生态系统及其组分的危害程度。蚯蚓也是食物链中的重要环节,许多鸟类和哺乳动物以蚯蚓为食物,但土壤中的有些农药(如甲拌磷、克百威)可使蚯蚓大大减少,或者蚯蚓会富集农药使许多鸟类和哺乳动物中毒死亡[1-3]。
夹竹桃(Nerium indicum Mill)为夹竹桃科夹竹桃属植物,原产印度、伊朗和阿富汗,在我国栽培历史悠久,我国各省区均有栽培。夹竹桃茎皮纤维为优良混纺原料,又可提制强心剂;根及树皮含有强心甙和酞类结晶物质及少量精油;茎叶可制杀虫剂[4-8],其茎、叶、花朵均有毒,研究表明,全株或其根、茎、叶、花提取物对棉花害虫[棉铃虫(Helicoverpa armigera Hubner)]、水稻害虫[二化螟(Chilo suppressalis)、褐飞虱(Nilaparvata lugens)、白背飞虱(Sogatella furcifera)和灰飞虱(Laodelphax striatellus)]、蔬菜害虫(菜青虫、蚜虫)及储粮害虫[米象(Sitophilus oryzae Linne )、绿豆象(Callosobruchus chinensis)、四纹豆象(Callosobruchus maculatus)]等多种害虫具有胃毒、触杀、拒食、抑制生长发育的作用[4-8]。夹竹桃提取液还有抑菌、杀线虫和杀钉螺的作用[9-12]。夹竹桃叶乙醇提取物对福寿螺(Pomacea canaliculata)也有显著的毒杀作用[12-14]。然而,目前对土壤动物蚯蚓的毒性研究却鲜见报道。
由于蚯蚓能促进土壤有机质的分解,并对重金属具有富集作用,已广泛应用于有机废弃物处理及环境净化。然而,农药的广泛使用,必将对蚯蚓的生存、生长、繁殖产生不利影响[2]。因此,研究植物源农药对蚯蚓的毒性作用是评价农药对生态环境安全性的重要指标。为了更进一步了解夹竹桃毒物,笔者通过研究夹竹桃不同部位提取液的毒性来评价这些物质对环境安全的影响,旨在为准确评价夹竹桃对土壤动物的安全性及开发以夹竹桃为原料的杀虫剂提供科学依据。
1 材料与方法
1.1 试验材料
供试蚯蚓品种为0.32 g左右的健康具有环带的赤子爱胜蚯蚓,购于安徽省合肥市裕丰花市渔具市场。
夹竹桃采于合肥市环城公园,为夹竹桃科植物白花夹竹桃。70%乙醇为现配现用,化学试剂均为国产分析纯。
1.2 乙醇提取物的制备
称取夹竹桃鲜叶、鲜茎皮及干叶和干茎皮各50 g,加入质量分数为70%乙醇 250 mL,在25 ℃下采用索氏提取法提取8 h,得乙醇提取液。
将得到的不同部位提取物进一步用循环水式多用真空泵浓缩抽滤得到浓度更纯的乙醇提取物。再将该溶液用旋转蒸发仪蒸发出酒精得到提取物浸膏,放冰箱保存,需要时配制成供试药液的浓度。提取到黏稠的膏状物较难收集,提取率很低,仅2%~10%。试验时先配制成1.0、2.0、4.0 mg/mL,用于预测蚯蚓死亡率0~100%的浓度梯度。再配制成0.5、1.0、1.5、2.0、3.0、4.0 mg/mL用于试验。每次滴加1 mL 夹竹桃乙醇提取液观察现象,最终在0.5 h之内每瓶加入10 mL。
1.3 自然土壤法试验
(1)准备。在合肥师范学院校园内(樟树林)挖取适量适宜蚯蚓生活的自然土壤。
(2)处理。将0.5、1.0、1.5、2.0、3.0、4.0 mg/mL夹竹桃乙醇提取物与250 g自然土壤混匀,加入蒸馏水使土壤含水量为 35%左右。
将上述含不同浓度夹竹桃乙醇提取物的自然土壤放入 250 mL玻璃标准瓶中,再向玻璃标准瓶中放入 10 条在未经农药处理的人工土壤中驯养 1 d的蚯蚓。以蒸馏水培养为空白对照组。
(3)培养。用塑料薄膜封住玻璃标准瓶瓶口,再用解剖针把塑料薄膜扎孔后置于(20±2) ℃、湿度为(80±5)%的恒温箱中连续光照培养(光照强度为 800~1 000 lx,光暗交替(12 h∶12 h)。
(4)观察。试验第7天和第14天各计数1次,记录蚯蚓死亡率、体重变化及中毒症状,以蚯蚓前尾部对机械刺激(针刺)无反应视为死亡。
1.4 滤纸接触法试验
(1)清肠。取若干个烧杯,在底部铺 1 层滤纸,加入少量蒸馏水,以恰浸没滤纸为宜。挑选具有环带的健壮蚯蚓,放在滤纸上,用塑料薄膜封口,并用镊子扎孔,將烧杯置于温度为(20±2) ℃、湿度为80%的人工培养箱内,清肠1 d。
(2)处理。在直径 10 cm 的培养皿底铺衬滤纸,以恰好遮住器皿底为宜。取0.5、1.0、1.5、2.0、3.0、4.0 mg/mL的夹竹桃乙醇提取液倒入培养皿中,以恰好湿润浸没滤纸为宜。以蒸馏水培养为空白对照组。每处理3次重复。
(3)放入蚯蚓。将清肠后的蚯蚓冲洗干净,并用滤纸吸干蚯蚓体表水分,放入培养皿中。每处理放入同等生活条件的蚯蚓10 条。用塑料薄膜封口,并用镊子扎孔,使蚯蚓能正常呼吸。
(4)培养。将培养皿放入人工气候箱中培养,箱中为标准试验条件:温度为(20±2) ℃,湿度为(80 ± 5)%,光照强度为800~1 000 lx,光暗交替(12 h∶12 h)。
(5)观察。24、48 h 各计数 1 次,记录蚯蚓死亡率、体重变化及中毒症状,以蚯蚓前尾部对机械刺激(针刺)无反应为死亡,48 h 后结束试验。
2 结果与分析
2.1 夹竹桃鲜叶乙醇提取物对自然土壤法试验中蚯蚓生活的影响
由表1可知,随着夹竹桃鲜叶乙醇提取物浓度的增大,蚯蚓死亡率呈上升趋势。提取物浓度为0.5 mg/mL时,对蚯蚓几乎没有影响;浓度≥1.0 mg/mL有致死作用;浓度在1.0~2.0 mg/mL虽有毒害作用,但死亡率较低,均≤50%。
由表2可知,随着夹竹桃鲜叶乙醇提取物浓度的增大,蚯蚓的体重呈先增长后下降的趋势。这表明随着蚯蚓体内毒素的积累,蚯蚓出现消瘦状态。CK也表现出相同规律,表明在正常情况下也会出现体重先增后减,且与试验组相比体重变化不明显。
2.2 夹竹桃干叶乙醇提取物对自然土壤法试验中蚯蚓生活的影响
由表3可知,随着夹竹桃干叶乙醇提取物浓度的增大,蚯蚓死亡率呈上升趋势。夹竹桃干叶乙醇提取物浓度为0.5 mg/mL时,对蚯蚓几乎没有影响;浓度≥1.0 mg/mL有致死作用;浓度在1.0~3.0 mg/mL时,有毒害作用,但死亡率较低,均≤50%。
由表4可知,随着夹竹桃干叶乙醇提取物浓度的增大,蚯蚓体重减少明显,表现出负相关关系。在7 d内,提取物浓度在0.5~1.0 mg/mL对蚯蚓体重几乎没有影响,但浓度在1.5 mg/mL时表现出明显的中毒症状;到第14天时所有浓度夹竹桃乙醇提取物均对蚯蚓体重表现出明显的抑制性。
2.3 夹竹桃鲜茎皮乙醇提取物对自然土壤法试验中蚯蚓生活的影响
由表5可知,随着夹竹桃鲜茎皮乙醇提取物浓度的增大,蚯蚓死亡率呈上升趋势。提取物浓度为0.5 mg/mL时,随着时间的推移蚯蚓有死亡的现象,但是很少;浓度≥0.5 mg/mL有致死作用;浓度在0.5~1.5 mg/mL有毒害作用,但死亡率较低,均≤50%。
由表6可知,不同浓度的夹竹桃鲜茎皮乙醇提取物在不同时间的处理下,蚯蚓中毒反应存在差异。其规律是随着处理浓度的增大,蚯蚓的体重明显受到抑制。与CK相比,所有浓度夹竹桃鲜茎皮乙醇提取物均对蚯蚓的体重产生抑制,随着时间的增加,蚯蚓体重明显下降。
2.4 夹竹桃干茎皮乙醇提取物对自然土壤法试验中蚯蚓生活的影响
由表7可知,随着夹竹桃干茎皮乙醇提取物浓度的增大,蚯蚓死亡率呈上升趋势。浓度为0.5 mg/mL 时,对蚯蚓几乎没有影响;浓度≥1.0 mg/mL对蚯蚓有致死作用;浓度在 1.0~3.0 mg/mL 对蚯蚓有毒害作用但死亡率较低,均≤50%。
由表8可知,0~14 d,随着夹竹桃干茎皮乙醇提取物浓度的增大,蚯蚓的体重呈先增长后下降的趋势,且随着处理浓度的增大,表现越明显。这表明随着蚯蚓体内毒素的积累,蚯蚓出现消瘦状态。CK也表现出相同规律,表明在正常情况下也会出现体重先增后减,且与试验组相比,体重变化不明显。
2.5 夹竹桃鲜叶乙醇提取物对滤纸接触法试验中蚯蚓生活的影响
由表9可知,随着夹竹桃鲜叶乙醇提取物浓度的增大,蚯蚓死亡率呈上升趋势。该方法中蚯蚓死亡率普遍较高,明显比土壤培养的毒害作用大。浓度≥0.5 mg/mL就有致死作用,而浓度在0.5~1.0 mg/mL死亡率较低,均≤50%。
2.6 夹竹桃干叶乙醇取物对滤纸接触法试验中蚯蚓生活的影响
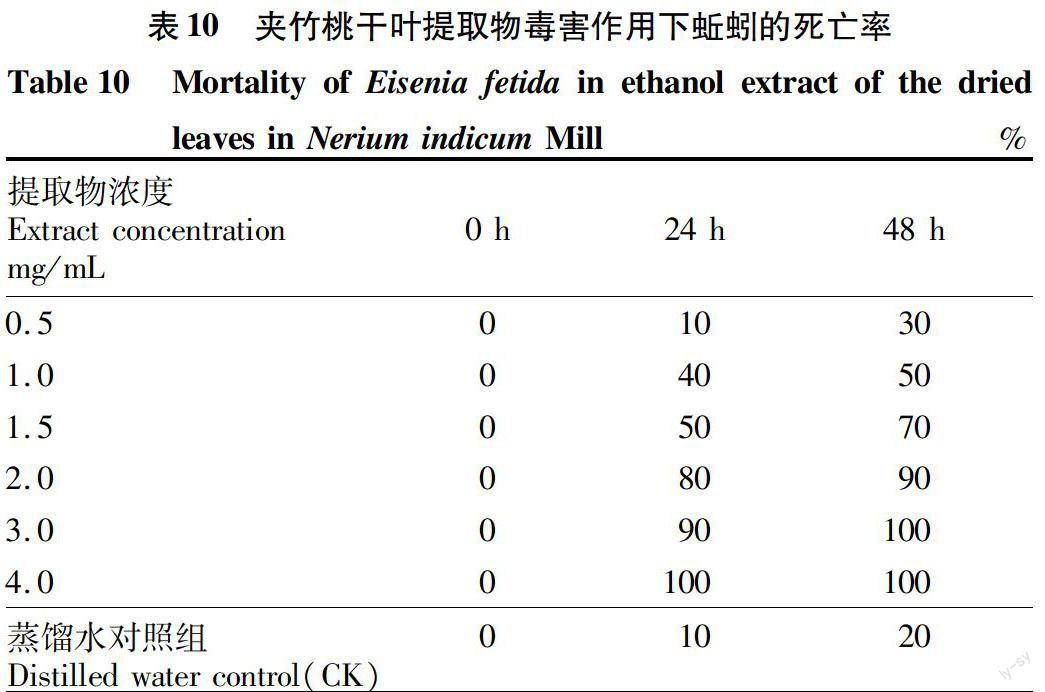
由表10可知,随着夹竹桃干叶乙醇提取物浓度的增大,蚯蚓死亡率呈上升趋势。该方法中蚯蚓死亡率普遍较高,明显比土壤培养的毒害作用大。浓度≥1.0 mg/mL,对蚯蚓致死作用比较明显;浓度在0.5~1.0 mg/mL死亡率较低,均≤50%。
2.7 夹竹桃鲜茎皮乙醇提取物对滤纸接触法试验中蚯蚓生活的影响
由表11可知,随着夹竹桃鲜茎皮乙醇提取物浓度的增大,蚯蚓死亡率呈上升趋势。该方法中蚯蚓死亡率普遍较高,明显比土壤培养的毒害作用大。浓度≥0.5 mg/mL时,对蚯蚓的致死作用较明显,且死亡率很高。
2.8 夹竹桃干茎皮乙醇提取物对滤纸接触法试验中蚯蚓生活的影响
由表12可知,随着夹竹桃干茎皮乙醇提取物浓
度的增大,蚯蚓死亡率呈上升趋势。该方法中蚯蚓死亡率普遍较高,明显比土壤培养的毒害作用大。浓度≥0.5 mg/mL时,对蚯蚓的致死作用较明显;浓度为0.5~1.0 mg/mL时,死亡率较低,均低于50%。
3 讨论
3.1 在自然土壤法中夹竹桃不同部位乙醇提取物对蚯蚓的毒害作用比较
3.1.1 夹竹桃鲜茎皮乙醇提取物对蚯蚓的毒害作用大于鲜叶乙醇提取物。
夹竹桃鲜茎皮乙醇提取物的浓度在0.5~1.5 mg/mL时对蚯蚓的毒害作用较小,在前7 d死亡率均低于50%,后7 d死亡率逐渐上升,且随着时间的推移和浓度的增加,浓度为4.0 mg/mL时全部死亡。随着浓度的增大和时间的延长,蚯蚓体内毒素的积累逐渐呈现出消瘦病态。与CK相比可知,在正常情況下蚯蚓会出现自然的体重变化,只是变化不明显。
夹竹桃鲜叶乙醇提取物浓度为0.5~2.0 mg/mL时,对蚯蚓的毒害作用较小,第7天死亡率均低于50%,在第14天死亡率有所增加,但是均低于100%。随着夹竹桃鲜叶乙醇提取物浓度的增大和时间的延长,蚯蚓的死亡率呈上升趋势。在浓度为4.0 mg/mL、第14天时,死亡率为90%。通过观察体重,得出的结论与鲜皮的作用效果相差不大,体重也出现了类似的变化,只是变化没有夹竹桃新鲜茎皮乙醇提取物明显。
通过观察蚯蚓的中毒症状可知,土壤培养过程中CK的蚯蚓生活状态良好。试验组表现有所不同,蚯蚓对鲜茎皮乙醇提取物的中毒症状较鲜叶乙醇提取物的明显,致死率高,在同等浓度和时间内,蚯蚓表现出强烈的反抗行为,急躁乱蹦,最终身体僵硬流出液体且针扎无反应死亡。
3.1.2 夹竹桃鲜叶乙醇提取物对蚯蚓的毒害作用大于干叶乙醇提取物。
夹竹桃鲜叶乙醇提取物浓度为0.5~2.0 mg/mL时,对蚯蚓的毒害作用较小,前7 d死亡率均低于50%,在第14天观察发现死亡率有所增加,但是均低于100%。在一定范围内,随着夹竹桃乙醇提取物浓度的增大和时间的延长,蚯蚓的死亡率呈上升趋势。通过观察体重可知,蚯蚓的生活状态在前7 d呈增长趋势。随着浓度的增大和时间的延长,体内毒素积累,蚯蚓逐渐呈现出消瘦病态。与CK对比可知,在正常情况下蚯蚓会出现自然的体重变化,只是变化不明显。
夹竹桃干叶乙醇提取物浓度为0.5~3.0 mg/mL时,对蚯蚓的毒害作用较小,在前7 d死亡率均低于50%,后7 d死亡率逐渐上升,随着时间的推延和浓度的增大,最终并没有全部死亡。在第14天浓度为4.0 mg/mL时,死亡率达到80%。通过观察体重可知,蚯蚓的生活状态在前7 d呈现增长趋势。通过观察体重可知,与鲜叶乙醇提取物的作用效果相差不大,体重也出现了类似的变化,只是变化没有鲜叶乙醇提取物明显。
通过观察蚯蚓的中毒症状,土壤培养时CK的蚯蚓生活状态良好,试验组表现有所不同,蚯蚓对夹竹桃鲜叶乙醇提取物表现出的中毒症状比干叶乙醇提取物明显,致死率高,在同等浓度和时间内,蚯蚓表现出强烈的反抗行为,急躁乱蹦,最终身体僵硬流出液体且针扎无反应死亡。
3.1.3 夹竹桃干叶乙醇提取物对蚯蚓的毒害作用大于干茎皮乙醇提取物。
夹竹桃干叶乙醇提取物浓度为0.5~3.0 mg/mL时,对蚯蚓的毒害作用较小,在前7 d死亡率均低于50%,后7 d死亡率逐渐上升,随着时间的推延和浓度的增大,最终并没有全部死亡。第14天浓度为4.0 mg/mL时,死亡率达到80%。通过观察体重,得出蚯蚓的生活状态在前7 d呈增长趋势。随着浓度的增大和时间的延长,体内毒素的积累,蚯蚓逐渐呈现出消瘦病态。与CK相比,得知在正常情况下蚯蚓会出现自然的体重变化,只是变化不是很明显。
夹竹桃干茎皮乙醇提取物浓度在0.5~3.0 mg/mL时,对蚯蚓的毒害作用较小,在前7 d死亡率均低于40%,后7 d死亡率逐渐上升,随着时间的推延和浓度的增大,死亡率变化不大,均≤50%。通过观察体重,得出的结论与夹竹桃干叶乙醇提取物的作用相差不大,体重呈现了类似的变化,只是变化没有干叶乙醇提取物明显。
通过观察蚯蚓的中毒症状,土壤培养时CK的蚯蚓生活状态良好,试验组表现有所不同,蚯蚓对夹竹桃干叶乙醇提取物表现的中毒症状比对干茎皮乙醇提取物的明显,致死率高,在同等浓度和时间内,蚯蚓表现出强烈的反抗行为,急躁乱蹦,最终身体僵硬流出液体用针扎无反应死亡。
3.2 在滤纸接触法中夹竹桃不同部位乙醇提取物对蚯蚓的毒害作用比较
3.2.1 夹竹桃鲜茎皮乙醇提取物对蚯蚓的毒害作用大于鲜叶乙醇提取物。
在濾纸接触处理方式下,对蚯蚓的毒害作用均较大。夹竹桃鲜茎皮乙醇提取物浓度为0.5 mg/mL以上时表现出剧烈的毒害致死作用。浓度为2.0 mg/mL时24 h死亡率达到90%,48 h死亡率达到100%。夹竹桃鲜叶乙醇提取物浓度为0.5~1.0 mg/mL时,24 h死亡率≤50%;浓度为2.0 mg/mL时,48 h死亡率90%;浓度为3.0 mg/mL时,24 h全部死亡。
3.2.2 夹竹桃鲜叶乙醇提取物对蚯蚓的毒害作用大于干叶乙醇提取物。
鲜叶乙醇提取物浓度为0.5~1.0 mg/mL时,24 h死亡率≤50%;浓度为3.0 mg/mL时,24 h全部死亡。
夹竹桃干叶乙醇提取物浓度为0.5~1.0 mg/mL时,死亡率≤50%;在1.0 mg/mL以上,毒害作用大;浓度为3.0 mg/mL时,24 h致死率达90%,48 h死亡率为100%。
3.2.3 夹竹桃干叶乙醇提取物对蚯蚓的毒害作用大于干茎皮乙醇提取物。
夹竹桃干叶乙醇提取物浓度在0.5~1.0 mg/mL时,蚯蚓死亡率≤ 50%;浓度在1.0 mg/mL以上毒害作用大;浓度为2.0 mg/mL时,24 h死亡率为80%,48 h死亡率为90%;在3.0 mg/mL时,48 h全部死亡。
夹竹桃干茎皮乙醇提取物浓度在0.5~1.0 mg/mL时,死亡率低于50%;浓度为2.0 mg/mL时,24 h死亡率为70%,48 h死亡率为80%;浓度为3.0 mg/mL时,48 h全部死亡。
4 结论
该研究结果表明,夹竹桃不同部位乙醇提取物对蚯蚓的毒害作用有差异。其中以夹竹桃鲜茎皮的毒性最强,在制作农药时应优先选用。当鲜茎皮乙醇提取物浓度≤2.0 mg/mL时,土壤动物蚯蚓的死亡率较低。作为植物源农药首先要求对蚯蚓的致死率≤50%,且以达到杀虫为目的。参考国家制作农药规定,应选用浓度为1.0~2.0 mg/mL夹竹桃鲜茎皮乙醇提取物作为植物源农药,该浓度下既达到了杀虫效果,又保证了蚯蚓的正常生活。
参考文献
[1] 张壬午,李治祥,白清云,等.应用标准方法测定农药对蚯蚓的毒性[J].环境科学学报,1985,5(3):327-333.
[2] 邱江平.蚯蚓与环境保护[J].贵州科学,2000,18(1/2):116-133.
[3] 张壬午,李治祥,白清云,等.化学农药对生态环境安全评价研究Ⅱ.化学农药对蚯蚓的毒性与评价[J].生态农村环境,1986(2):14-18.
[4] 毛永强,李娜.夹竹桃的开发利用[J].特种经济动植物,2005,8(3):36-37.
[5] 徐汉虹.杀虫植物与植物性杀虫剂[M].北京:中国农业出版社,2001.
[6] 操海群,岳永德,花日茂,等.植物源农药研究进展(综述)[J].安徽农业大学学报,2000,27(1):40-44.
[7] 郑许松,俞晓平,吕仲贤,等.夹竹桃叶提取物对茭白二化螟的生物活性[J].浙江农业学报,2003,15(3):167-171.
[8] 熊英年,张吉英,李德山.夹竹桃的杀虫作用[J].中兽医学杂志,1997(4):411.
[9] 李爱民,刘再明,李胜华.夹竹桃叶提取液的抑菌作用研究[J].时珍国医国药,2008,19(10):2485-2486.
[10] 谭宏亮,刘红卫,朱建新.夹竹桃叶提取物抑菌活性的初步研究[J].安徽农业科学,2007,35(35):11508,11513.
[11] 王猛,曹福祥,滕涛.夹竹桃提取物对松材线虫致死性的研究[J].湖南林业科技,2000,33(6):7-8.
[12] 杨毅,柯文山,王万贤,等.夹竹桃灭钉螺效果初报[J].应用生态学报,2000,11(6):959-960.
[13] 董道青,陈建明,俞晓平.夹竹桃植物的杀螺活性及其杀螺机理研究进展[J].湖北农业科学,2008,47(S1):57-60.
[14] 董道青,陈建明,俞晓平,等.夹竹桃不同溶剂提取物对福寿螺的毒杀作用评价[J].浙江农业学报,2009,21(2):154-158.
