梨树挥发物成分的鉴定及其对梨叶斑蛾的触角电位反应
2017-05-30张晓芳刘红敏张爱红方川张涛
张晓芳 刘红敏 张爱红 方川 张涛
摘要[目的]筛选梨叶斑蛾引诱物质。[方法]利用气相色谱-质谱联用仪(GC-MS)分析了梨树挥发物的主成分,并通过触角电位仪(EAG)测定了梨叶斑蛾对主要挥发物的电生理反应。[结果]梨叶中共鉴定出包含萜类、酯类、醛类及醇类在内的24种主要挥发物。梨叶斑蛾雌雄蛾对供试挥发物均可产生EAG反应,其中雌蛾对芳樟醇、月桂烯、反-β-罗勒烯的反应最明显;雄蛾对芳樟醇、反-β-罗勒烯、α-法尼烯的反应最强烈。剂量反应试验结果表明,梨叶斑蛾雌蛾对3种供试化合物的EAG活性与化合物的剂量之间呈正相关性。[结论]试验结果为制定基于植物源的梨叶斑蛾监测与防治策略提供了理论依据。
关键词梨叶斑蛾;梨叶挥发物;触角电位;气相色谱-质谱联用
中图分类号S436.612.2+3文献标识码A文章编号0517-6611(2017)09-0145-04
Pear Leaf Volatiles and Their Electroantennogram Responses to Illiberis pruni
ZHANG Xiaofang1, LIU Hongmin2, ZHANG Aihong1, ZHANG Tao1* et al
(1. Plant Protection Institute of Hebei Academy of Agriculture and Forestry Sciences, IPM Center of Hebei Province, Key Laboratory of Integrated Pest Management on Crops in Northern Region of North China, Ministry of Agriculture, P. R. China, Baoding, Hebei 071000;2. Xinyang College of Agriculture and Forestry, Xinyang, Hebei 464000)
Abstract[Objective] The aim was to screen attractants of I. pruni.[Method] The main volatiles, identified from pear leaf by using gas chromatographymass spectrometry (GCMS) were tested by electroantennogram (EAG).[Result] The 24 compounds were identified, including terpenoids, esters, aldehydes and alcohols. EAG tests showed that male and female moths had EAG response to all tested compounds, and the responses of male moths to linalool, myrcene and (E)βOcimene were the most significant, meanwhile, for female moths, linalool, (E)βOcimene and αfarnesene were the most EAGactive compounds. Further doseresponse experiments showed that the responses of female moths to the three compounds were obviously dosedependent.[Conclusion] The results provide the basis for developing plant volatilesbased strategy for monitoring and controlling of I. pruni.
Key wordsIlliberis pruni;Pear leaf volatile;Electroantennogram (EAG);Gas chromatographymass spectrometry (GCMS)
作者簡介张晓芳(1984—),女,山东聊城人,助理研究员,硕士,从事昆虫化学生态学研究。
*通讯作者,助理研究员,博士,从事昆虫化学生态学研究。
收稿日期2017-01-22
梨叶斑蛾(Illiberis pruni),幼虫别名梨星毛虫,又名梨狗子、饺子虫等,是鳞翅目斑蛾科翅叶斑蛾属的一种昆虫,广泛分布于河北、河南、山西、安徽等省,是梨、苹果、海棠、杏、樱桃等仁果类果树的主要食叶性害虫之一。梨叶斑蛾的幼虫主要取食花芽和叶片,对果树的品质和产量造成了很大影响[1],在管理粗放的果园危害尤為严重。梨叶斑蛾的幼虫有吐丝卷叶、潜伏叶苞为害的习性,因而影响了化学防治的效果[2]。而且,化学防治存在农药残留污染及容易产生抗药性等问题,因此,环境友好型措施防治该虫十分必要和迫切。
通常认为,植食性昆虫依靠寄主植物的特定挥发物来定位寄主,以获取适宜的取食、产卵、交配场所[3]。通过植物挥发物调节昆虫的行为是目前许多研究者正在探索的环境友好的害虫防治方法之一[4]。该方法通常是先鉴定害虫定位寄主的关键挥发物,进而将其用作引诱剂诱杀害虫,从而压低害虫密度达到防控的目的。而昆虫触角电位技术(Electroantennogram,EAG)能够从电生理角度反映出昆虫对挥发性气味物质的响应情况,从而甄别昆虫对哪些物质更感兴趣,快速完成害虫引诱物质的初步筛选[5-7]。
目前,国内关于梨叶斑蛾的引诱或趋避技术的研究鲜见报道。笔者以动态顶空吸附法收集梨叶挥发性气味物质,并使用气相色谱-质谱联用技术鉴定其主要组分,同时结合触角电位技术,测定了梨叶斑蛾的触角对供试化合物的电位响应及其浓度效应,初步明确了它们的相对活性,旨在为阐明梨叶斑蛾寄主选择机理以及筛选出对梨叶斑蛾具有生物活性的植物源引诱剂或趋避剂提供理论依据。
1材料与方法
1.1材料
1.1.1供试昆虫。梨叶斑蛾的蛹于河北保定清苑区温仁镇废弃果园采集获得,带回实验室后置于养虫笼内,每天观察蛹的羽化情况;羽化后按触角形状将雌、雄蛾分开,以体积浓度为5%的蜂蜜水饲养;并选择羽化后2~3日龄的健康成虫为供试昆虫。
1.1.2供试化合物。供试化合物的名称、纯度、来源见表1。
1.1.3
试剂与仪器。Porapak Q(80~100目),购自美国Waters公司。7890A-5975C气相色谱-质谱联用仪,为美国安捷伦公司产品;HP-5MS(30 m×0.25 mm×0.25 μm)毛细管柱,为美国安捷伦公司产品;触角电位仪和分析软件为荷兰Syntech公司产品。
1.2方法
1.2.1梨树挥发物的收集。试验用梨树叶采自河北保定清苑区南刘口村梨园,试验品种为黄冠。采用QC-1B型气体采样仪(北京市劳动保护科学研究所)和采样管(Φ 0.6 cm×16.0 cm)对梨树的挥发物进行动态顶空收集。每根采样管填充50 mg吸附剂Porapak Q。具体操作:采集新鲜完整的梨树叶50 g,用清水冲洗干净,擦干表面水分晾干后放入孟氏洗瓶中。洗瓶一端连接装有吸附剂的采样管,一端连接装有活性炭吸附剂的玻璃管。采樣管的另一端连接气体采样仪的进气口。所有连接处均用特氟龙管连接。采样气流为300 mL/min,采集时间为6 h。采集后的采样管用10 mL色谱纯正己烷洗脱至1.5 mL进样小瓶内,置于-24 ℃冰箱内待用。
1.2.2
梨树挥发物的测定。采用7890A-5975C气相色谱-质谱联用仪对“1.2.1”所得样品进行测定。色谱分析条件:HP-5MS毛细管柱,柱温箱初始40 ℃,保持1 min;以5 ℃/min升至180 ℃,保持2 min;再以10 ℃/min升至250 ℃,保持10 min。氦气(纯度>99.999%)做载气,流速1 mL/min。进样口温度250 ℃,不分流进样。
质谱分析条件:电离方式EI,质谱轰击电离能量70 eV,扫描质量50~400 m/z,四级杆温度为150 ℃,离子源温度为230 ℃,传输线温度为250 ℃。
经NIST14谱库检索,并结合标准品质谱图及保留时间对挥发物样品进行定性分析,相对含量采用峰面积法。
1.2.3
触角电位试验。采用触角电位仪和分析软件进行试验。参照Yang等[8]的方法进行EAG反应测定。测定前将较活跃的梨叶斑蛾雌雄蛾的整根触角自基部切下,切掉末梢,用昆虫针将触角两端连接在涂有导电胶的电极上,待基线稳定后进行电生理活性试验。
取24 μL待测样品溶液,均匀涂在滤纸条(2.0 cm×0.5 cm)上,待溶剂挥发后放入巴斯德管中,然后将巴斯德管连接在刺激气流上。调节连续气流流量为500 mL/min,刺激气流为40 mL/min,每次刺激时间为0.1 s,2次刺激间隔为30 s,以恢复触角的敏感性。每个样品雌、雄蛾各测试5个触角。以顺-3-己烯醇的反应值为参照,以正己烷为对照,测试样品前后均测试1次对照。
1.3数据处理
试验数据采用SPSS 19.0软件进行统计分析,并利用Duncan′s多重分析法比较梨叶斑蛾对供试化合物的触角电位反应差异。
梨叶斑蛾对化合物的触角电位响应用EAG反应相对值表示[9]。EAG反应相对值由以下公式算出:
Sr=Sc-CKmRm-CKm×100
式中,Sr为刺激样品的EAG反应相对值;Sc为刺激样品的EAG反应值;CKm为正己烷的EAG反应值;Rm为参照化合物顺-3-己烯醇的EAG反应值。
2结果与分析
2.1梨树挥发物组分的鉴定
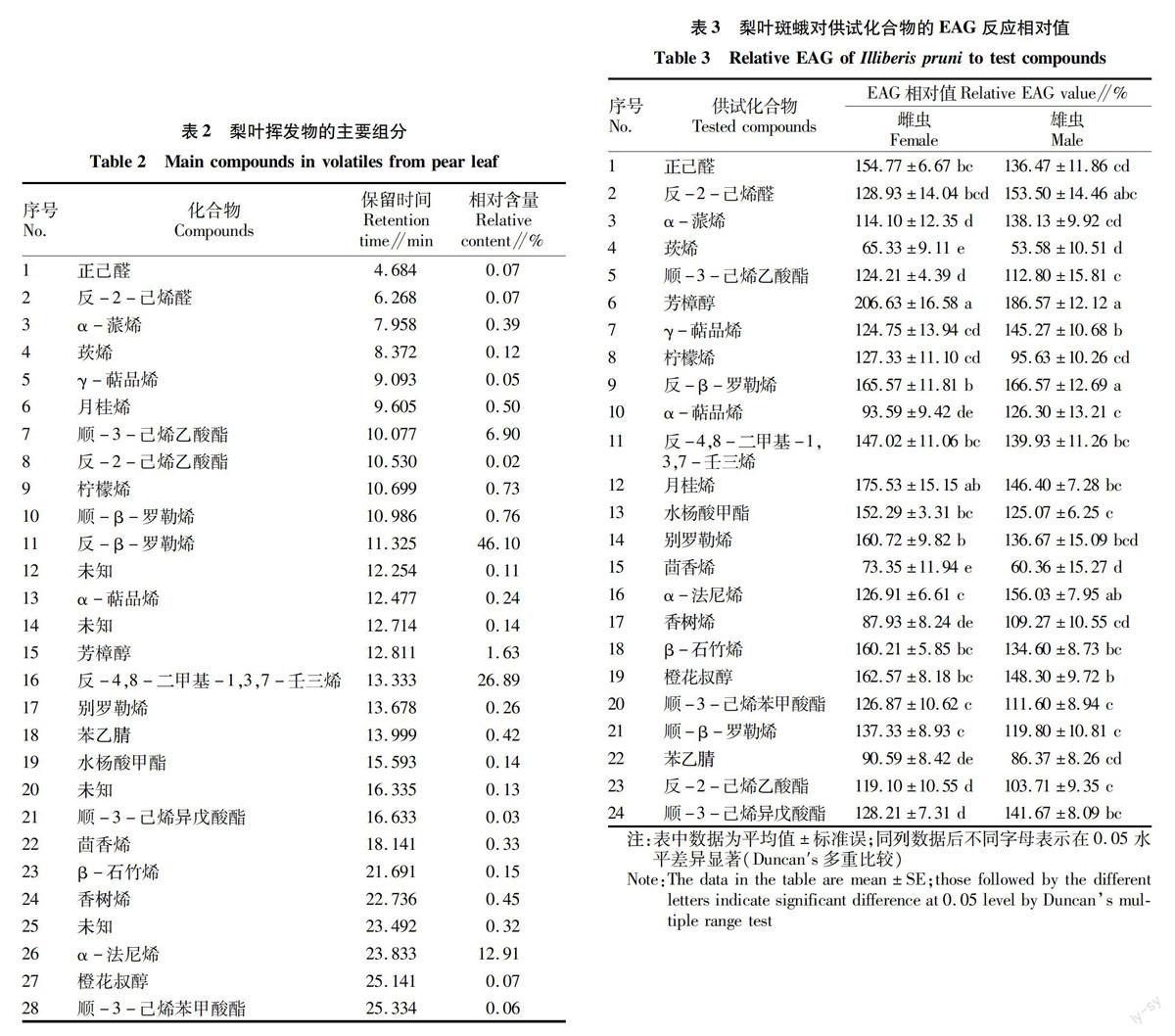
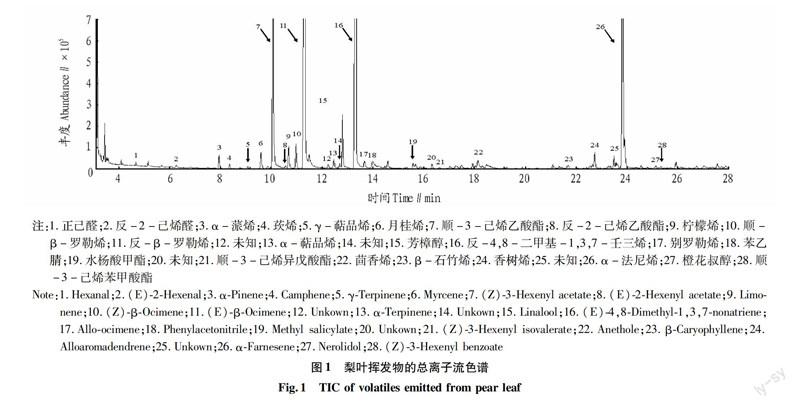
动态顶空收集的黄冠梨树叶挥发物样品经GC-MS分析,共检测出28种主要组分,经NIST14谱库检索并比对标准品保留时间鉴定出了其中24种化合物成分(图1、表2)。鉴定出的24种化合物均在其他植
物叶片中有所报道,为常见的绿叶挥发物质。梨树叶挥发物的种类主要包括萜类、酯类、醛类以及醇类,且以萜类化合物的相对含量最高,所占比例大于80%,显著高于其他类化合物。从单一物质含量来看,含量最高的3种化合物依次为反-β-罗勒烯、反-4,8-二甲基-1,3,7-壬三烯和α-法尼烯。
2.2梨叶斑蛾雌雄蛾对24种供试化合物的EAG反应
根据表2的结果,进行了梨叶斑蛾雌、雄蛾对鉴定出的24种化合物的EAG反应,结果见表3。所有供试化合物的浓度均为100.0 mg/L。表中EAG反应相对值小于100%表示该挥发物的EAG响应值低于参照化合物顺-3-己烯醇的EAG响应值。供试的24种化合物均能引起梨叶斑蛾的EAG反应,但反应强弱各异。从化合物的类型看,无环单萜类、倍半萜类、脂肪酸衍生物以及芳香族化合物的EAG反应较强,而单、双环单萜类化合物的EAG反应较弱。具体到化合物而言,引起梨叶斑蛾雌蛾较大EAG反应的是芳樟醇、月桂烯和反-β-罗勒烯,较小EAG反应的化合物为莰烯、茴香烯和香树烯;其他化合物居中;而引起梨叶斑蛾雄蛾较大EAG反应的是芳樟醇、罗勒烯及α-法尼烯,较小EAG反应的化合物为莰烯、茴香烯及柠檬烯。
将雌雄梨叶斑蛾对24种供试化合物的EAG反应进行比较,发现雌雄蛾的反应趋势基本一致,说明雌雄蛾可能都利用梨叶挥发物定位寄主。
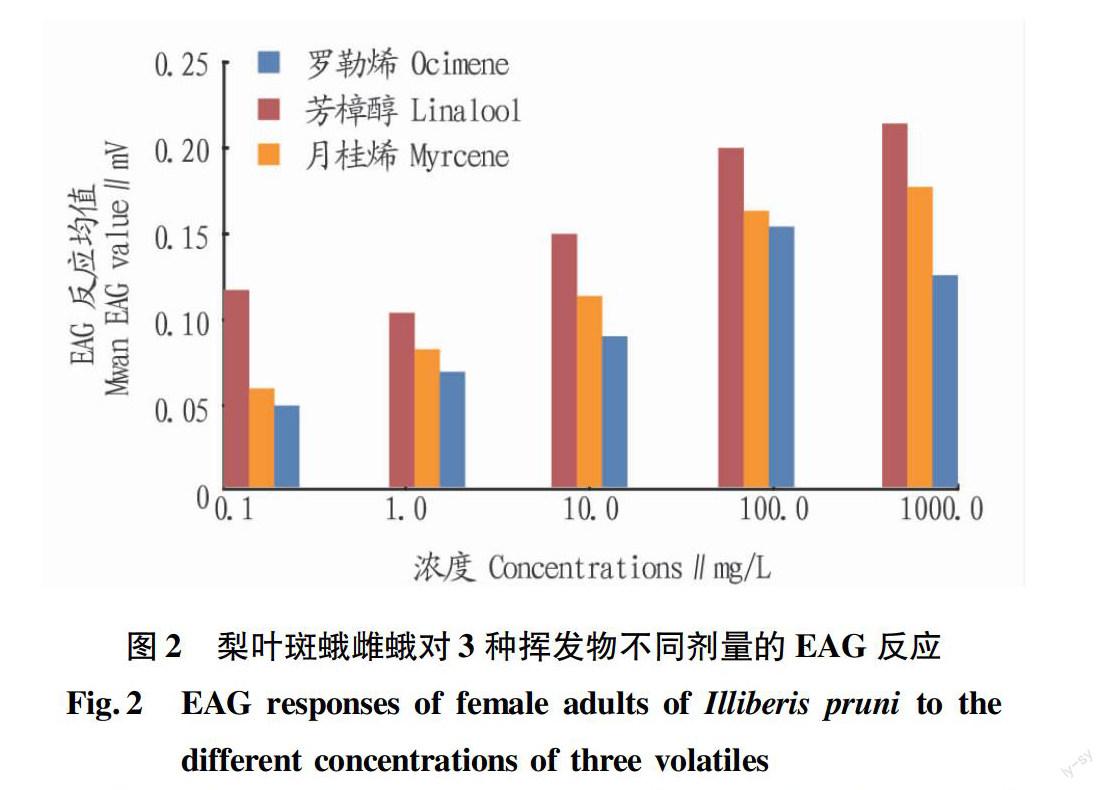
2.3梨叶斑蛾雌蛾对3种挥发物不同剂量的EAG反应
根据表3的结果,梨叶斑蛾雌蛾对芳樟醇、月桂烯和反-β-罗勒烯的EAG反应最强,所以测定了雌蛾对这3种物质不同剂量的EAG反应。由图2可知,梨叶斑蛾雌蛾对3种挥发物的EAG响应存在明显的浓度效应,总的趋势是EAG随着浓度的增大而增大,但是3种被测挥发物的响应趋势不尽相同。其中,在所测定的浓度范围内,梨叶斑蛾雌蛾对月桂烯的EAG反应值从0.1 mg/L到1 000.0 mg/L呈显著正相关;对芳樟醇的EAG反应值是先降低后上升,且到达一定的浓度(100.0 mg/L)后,EAG值增加平缓,说明该浓度可能已经超出雌蛾的感受閾值;对反-β-罗勒烯的EAG反应值是先升高后降低,最大值出现在100.0 mg/L处。
3结论与讨论
自然界中植食性昆虫和寄主植物之间存在协同进化关系,寄主植物为昆虫提供栖息场所和食物来源[10]。化学信号物质在昆虫和寄主植物之间起着重要作用,大量研究表明植物挥发物是昆虫定位寄主的关键因素[11]。
自然状态下,梨叶斑蛾经过选择寄主、聚集并最终定殖,完成其生活史。不同种的昆虫具有不同的寄主搜索行为,目前尚未明确梨叶斑蛾的定位机制。笔者在保定果园调查发现,梨叶斑蛾幼虫在梨树上大量发生,而不为害紧邻梨树的樱花等绿化树木。据此推断,梨树叶片挥发物中可能含有梨叶斑蛾用来寻找并定位寄主的关键物质。该研究发现,梨叶斑蛾对包括芳樟醇、月桂烯、罗勒烯、反-2-己烯醛等在内的多种被测化合物有较强的触角电位反应。有文献报道,上述化合物可引起华北大黑鳃金龟、绿盲蝽、橘小实蝇以及油橄榄果实蝇等昆虫产生较强的EAG反应[12-15]。与其他昆虫类似,梨叶斑蛾对寄主挥发物的EAG反应具有明显的剂量效应,当刺激物达到一定濃度后,EAG值趋于恒定或降低,说明该测试浓度达到其反应阈值。Contreras等[16]认为触角电位反应指示该刺激物对测试昆虫有引诱或趋避作用,该研究结果可为筛选对梨叶斑蛾具有引诱或趋避作用的活性物质提供依据。
有学者指出,寄主挥发物的混合组分对昆虫的引诱效果比单组分挥发物对昆虫的引诱效果更显著[17]。该研究测定了梨叶斑蛾对梨树挥发物单组分的触角电位效应,但各单组
分混合后對昆虫的作用效果可能不同,这种有效混合组分的
配比及其作用机制等尚需进一步研究。
参考文献
[1] 张洪喜,张江民.梨叶斑蛾(梨星毛虫)生活习性及防治[J].河北果树,1990(2):17-19.
[2] 李冬梅,李连昌,任自立,等.梨星毛虫性信息素的研究I:求偶与交配行为的观察[J].山西农业科学,1996,24(3):47-50.
[3] 杜家纬.植物-昆虫间的化学通讯及其行为控制[J].植物生理学报,2001,27(3):193-200.
[4] 蔡晓明,孙晓玲,董文霞,等.虫害诱导植物挥发物(HIPVs):从诱导到生态功能[J].生态学报,2008,28(8):3969-3980.
[5] NGUMBI E,CHEN L,FADAMIRO H Y.Comparative GCEAD Responses of a specialist(Microplitis croceipes)and a generalist(Cotesia marginiventris)parasitoid to cotton volatiles induced by two caterpillar species[J].Journal of chemical ecology,2009,35(9):1009-1020.
[6] 邓思思,尹姣,曹雅忠,等.华北大黑鳃金龟对20种植物源挥发物的电生理和行为反应[J].植物保护,2011,37(5):62-66.
[7] BHOWMIK B,LAKARE S,SEN A,et al.Olfactory stimulation of Apis cerana indica towards different doses of volatile constituents:SEM and EAG approaches[J].Journal of AsiaPacific entomology,2016,19(3):847-859.
[8] YANG M W,DONG S L,CHEN L.Electrophysiological and behavioral responses of female beet armyworm Spodoptera exigua(Hübner)to the conspecific female sex pheromone[J].Journal of insect behavior,2009,22(2):153-164.
[9] 王明,伍德明,阎云花,等.新疆棉铃虫性信息素的电生理研究[J].华中农业大学学报,1999,18(4):311-316.
[10] 李典谟,周立阳.协同进化:昆虫与植物的关系[J].昆虫知识,1997,34(1):45-49.
[11] BRUCE T J A,WADHAMS L J,WOODCOCK C M.Insect host location:A volatile situation[J].Trends in plant science,2005,10(6):269-274.
[12] 隋学良,许志春,田呈明.杏树挥发物成分的鉴定及其对杏树皱小蠹的触角电位的测定[J].应用昆虫学报,2012,49(4):980-985.
[13] 张国娜,王进军.桔小实蝇对几种寄主挥发物的触角电位反应[J].环境昆虫学报,2016,38(1):126-131.
[14] 张俊宇,林克剑,黄欣蒸,等.绿盲蝽对七种锦葵科植物挥发物的EAG和趋向行为反应[J].中国生物防治学报,2016,32(2):135-141.
[15] MALHEIRO R,ORTIZ A,CASAL S,et al.Electrophysiological response of Bactrocera oleae(Rossi)(Diptera:Tephritidae)adults to olive leaves essential oils from different cultivars and olive tree volatiles[J].Industrial crops and prodults,2015,77 :81-88.
[16] CONTRERAS M L,PEREZ D,ROZAS R.Empirical correlations between electroantennograms and bioassays for Periplaneta americana[J].Journal of chemical ecology,1989,15(11):2539-2548.
[17] WEBSTER B,BRUCE T,PICKETT J,et al.Volatiles functioning as host cues in a blend become nonhost cues when presented alone to the black bean aphid[J].Animal behaviour,2010,79(2):451-457.
