8—羧基喹唑啉酮衍生物的合成
2017-05-30徐玉玲何汀陈晶晶罗珊珊
徐玉玲 何汀 陈晶晶 罗珊珊

摘要以2-氨基-3-甲基苯甲酸为起始原料,经醋酸酐乙酰化、氧化、关环、取代等反应,设计合成了一系列8-羧基-2-甲基-3-芳基(脂肪基)-4(3H)-喹唑啉酮衍生物,所有目標化合物均测定了熔点并通过了1H NMR和质谱结构表征。通过单晶结构测试,发现该类化合物存在很强的氢键,很难进一步酯化或合成酰胺。
关键词喹唑啉酮;氧化;衍生物
中图分类号O626文献标识码A文章编号0517-6611(2017)08-0001-03
Synthesis of 8Carboxyquinazolinone Derivatives
XU Yuling, HE Ting, CHEN Jingjing et al
(School of Chemical & Environmental Engineering, Wuhan Polytechnic University, Wuhan, Hubei 430023)
AbstractThe synthesize route of 2methyl4oxo3phenyl3,4dihydroquinazoline8carboxylic acid derivatives undergoed acetylation, oxidation, cyclization and substitution reactions from the starting material of 2amino3methylbenzoic acid. All of the target compounds were confirmed by 1HNMR, MS and melting point. According to the result of Xray diffraction analysis, this series compounds existed strong hydrogen bond that was very difficult for further reaction of esterification or amidation.
Key wordsQuinazolinone;Oxidation;Derivatives
喹唑啉酮类化合物因其结构的可变性和广泛的生物活性,且合成方法多种多样,是杂环衍生物中重要的一类化合物,在农药和医药领域有着广泛应用[1-4]。在农药领域,喹唑啉酮的功效主要表现在杀虫、杀菌、抗病毒等方面;在医药领域,喹唑啉酮的功效主要表现在抗菌、抗肿瘤、抗癌、抗HIV-l和抗结核等方面,而且还具有退热、抗炎、催眠、抗惊厥、抗帕金森综合征、调节心血管和调节细胞及酶的活性功能。近年来,喹唑啉酮类化合物是有机合成、医药、农药和其他精细化工领域研究开发的热点课题之一[5-8]。
喹唑啉酮类化合物具有分子量小、结构简单、活性谱广等优点。设计合成的喹唑啉酮衍生物,不少都保留了喹唑啉酮的优点,活性也有很大的提高。因此,以喹唑啉酮为先导化合物,设计、合成结构新颖的化合物,并对其进行生物活性研究,具有很高的药物开发价值[9-10]。鉴于此,笔者以2-氨基-3-甲基苯甲酸为原料,经过乙酰化、氧化、关环、取代等反应,设计合成了一系列8-羧基喹唑啉酮衍生物,以期筛
选出具有进一步修饰潜力的医药先导化合物。
1材料与方法
1.1材料
1H NMR和13C NMR谱采用Mercury Plus 400 MHz核磁共振仪或者Varian VNMR 600 MHz(TMS为内标,DMSO-D6为溶剂);质谱ESI-MS由API2000质谱仪测定;元素分析数据由VarioELⅢ CHNSO型元素分析仪测定;单晶衍射用Bruker Smart Apex CCD型X-ray单晶衍射仪;熔点由BüCHI B-545数字熔点仪(温度计未经校正)测定。德国Heidolph MR3001型恒温加热磁力搅拌器,瑞士BüCHI R-200型旋转蒸发仪、德国Sartoruis电子天平、ZF-20D暗箱式紫外分析仪、DLSB低温冷却循环泵、SHZ-D(Ⅲ)循环水式真空泵、70-1型远红外线干燥箱、点样硅胶板等仪器。试剂和溶剂如无特殊说明,均为分析纯或化学纯。
1.2方法
1.2.1化合物1~3的合成。
以简单易得的2-氨基-3-甲基苯甲酸为起始原料,经醋酸酐乙酰化、氧化、关环、取代等反应,设计合成了一系列8-羧基-喹唑啉酮衍生物,具体合成路线见图1。
1.2.1.1 化合物1的合成。
15.100 g (100 mmol)2-氨基-3-甲基苯甲酸与40 mL乙酸酐于100 mL圆底烧瓶中,回流4.5 h至反应完全,停止加热,立即将热溶液(褐色)倒入350 mL冰水中,溶液中出现白色絮状沉淀,继续搅拌10 h后,过滤,干燥,得白色固体16.500 g,收率为86%。
1.2.1.2化合物2的合成。
将9.660 g (50 mmol)化合物1溶于200 mL水中,升温至80 ℃,分批缓慢加入31.600 g KMnO4,待紫色消失后继续搅拌6 h,反应结束后溶液呈灰褐色,趁热过滤,上层滤渣用热水洗2次,得浅黄色滤液,冷却后,滤液用浓盐酸酸化,析出白色沉淀,过滤,干燥得白色固体7.700 g,产率为70%。
1.2.1.3化合物3的合成[9]。
将8.927 g (40 mmol)化合物2与40 mL乙酸酐置于100 mL圆底烧瓶中,加热搅拌回流4 h至反应完全,减压蒸馏除去乙酸酐。加入正己烷重结晶,得黄色固体,过滤,用石油醚洗2次,正己烷洗2次,干燥得淡黄色固体(化合物3)6.800 g,收率为83%。熔点为211~212 ℃。
1.2.2目标化合物4的合成[9]。
1.2.2.1化合物4a~4h的合成。
在50 mL圆底烧瓶中加入2.050 g (10 mmol)化合物3和10 mmol取代苯胺化合物,室溫下搅拌3 h左右,加入50 mL 10%NaOH溶液,继续搅拌4 h,然后用浓盐酸酸化至溶液pH为1~2,静置,过滤,上层固体用水洗3次,石油醚洗1次,干燥得粗产品,用无水乙醇重结晶,干燥得目标产物4a~4h。
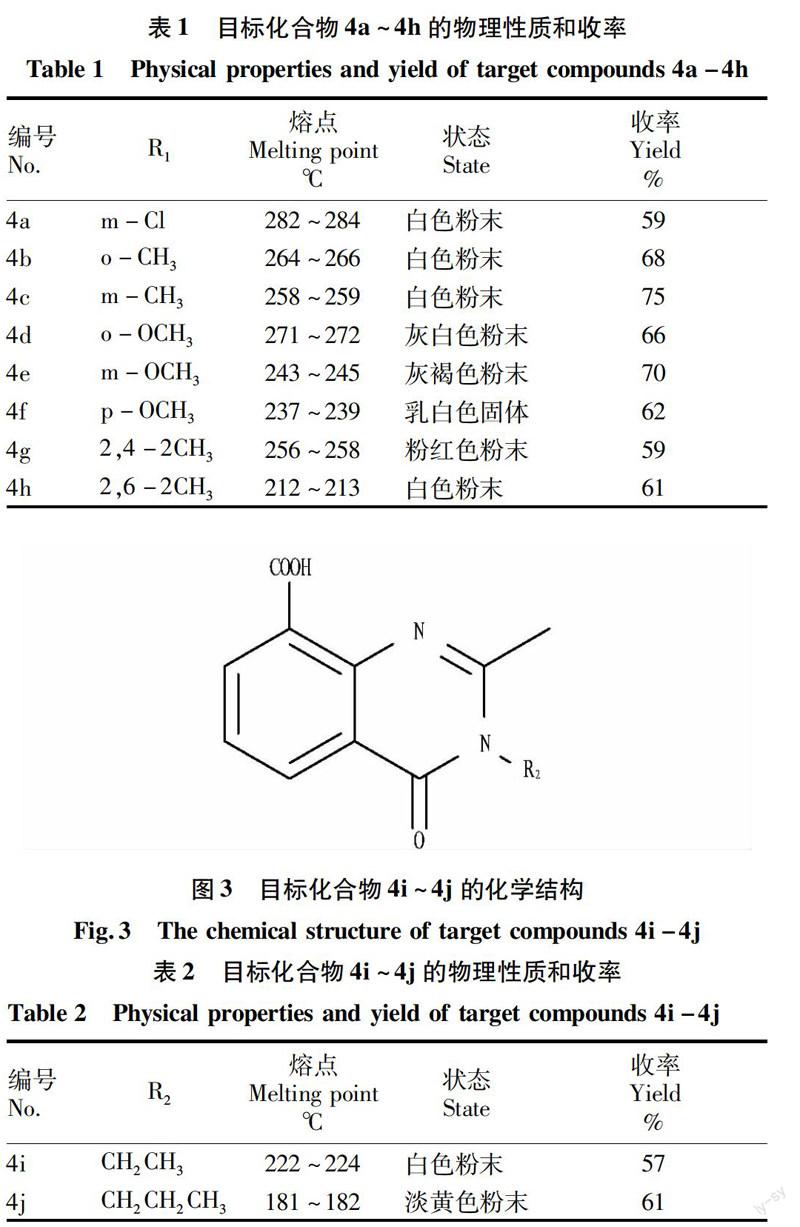
1.2.2.2化合物4i~4j的合成。
在50 mL圆底烧瓶中加入0.620 g (3 mmol)化合物3和3 mmol脂肪胺类化合物,加热回流24 h后,加入20 mL水,然后用浓盐酸酸化至溶液pH为1~2,有沉淀析出,静置,过滤,上层固体用水洗2次,石油醚洗1次,干燥得粗产品,用无水乙醇重结晶,干燥得目标产物4i~4j。
2结果与分析
2.1目标化合物的性质
芳胺取代喹唑啉酮化合物见图2和表1,脂肪胺取代喹唑啉酮化合物见图3和表2。所有化合物收率均为中等,这是因为得到目标化合物后,采用乙醇进行重结晶,损失一部分产品。在相同的后处理条件下,当苯环上的取代基为吸电子基团如氯原子时,产物收率偏低,当取代基为双取代时如4g和4h,收率也偏低。这可能是因为苯环上为吸电子基或者双取代基时反应较难进行,所以收率略微偏低。当R取代基为烷基如乙基或者丙基时,合成方法与苯环取代基完全不同,需要改为加热回流状态,且酸化时改为盐酸,使未反应的烷基胺形成铵盐,便于去除。
2.2目标化合物的进一步衍生
为了解目标化合物4的衍生能力及作为医药中间体的前景,该研究将化合物4进行进一步的衍生(以4b为例),使用酰化试剂将其转变为酰氯,以便下一步合成酯或者酰胺,并进行了二氯亚砜、草酰氯、三氯氧磷、三氯化磷、五氯化磷等与4b反应,均未成功得到相应的酰氯。合成酰胺或者酯的另一种方法是使用缩合剂,根据文献[11-12]报道,该研究使用的缩合剂有DCC/DMAP、EDCI/DMAP、DIC/DMAP、HOBT/EDCI、NHS/EDCI、HOOBT/EDCI等,使用这些缩合剂反应3 d后仍然未检测到新点。
所尝试的酰氯法、缩合法及微波法均未得到目标酯或者酰胺,分析无法得到目标物的原因可能有以下几个方面:①生成酯的位阻比较大,用一般的方法无法完成。②酸的羟基和邻位上的氮形成很强的氢键,使得酰氯难以形成从而难以合成相应的酯。③苯环上有吸电子取代基时,酰氯反应较难进行。因此,继续对化合物4b的结构进行研究。
2.3化合物4b的单晶衍射分析
X-ray单晶衍射试验在Bruker Smart Apex CCD型X-ray单晶衍射仪上进行,采用经石墨单色化的Mo-Kα射线为入射光,波长为0.710 73 。衍射试验是在T=298 K下进行的。选择尺寸合适的单晶进行衍射试验。结构用直接法结合Fourier合成解出。所有原子坐标均由理论加氢确定,修正采用“骑”母原子模式精修。
根据IUPAC给出的氢键准则:分子内氢键必须具备形成氢键的必要条件,还要具有特定的条件,例如:形成平面环,环的大小以五或六元环最稳定,形成的环中没有任何的扭曲。O—H……N之间的二面角是直线或接近180°。氢键越强,H……N距离越短。由图4可知,化合物4b的单晶衍射显示分子内形成很强的氢键,N1与O1上氢原子间距离仅为1.77 。N1和O1上氢原子几乎形成一条直线,由N1、CI、C2、C7、O1及其氢原子等形成稳定的平面五元环结构,所以整个分子具有很强的分子内氢键,这也是这一类化合物难以进行酯化或者酰化反应的一个重要原因。
e of compound 4b
氢键在成键方向的最优选择影响晶体的结构堆积模式。为化合物4b的结构堆积模式,可见整个喹唑啉酮结构为一个平面,由氮原子连接的邻甲基苯环与这个平面形成一个夹角为77°的二面角。因此,分子的堆积模式为平面层状结构。
3结论
以简单易得的2-氨基-3-甲基苯甲酸为起始原料设计合成了一系列8-羧基-2-甲基-3-芳基(脂肪基)-4(3H)-喹唑啉酮衍生物,所有目标化合物均测定了熔点并通过了1H NMR和质谱结构表征。
通过单晶结构测试,发现该类化合物存在很强的分子内氢键,所以很难进一步合成酯或酰胺。
参考文献
[1] ELBAYOUKI K A H M,BASYOUNI W M,MOHAMED Y A F,et al.Novel 4(3H)quinazolinones containing biologically active thiazole,pyridinone and chromene of expected antitumor and antifungal activities[J].Euro J Chem,2011,2(4):455-462.
[2] XU Y L,LIN H Y,CAO R J,et al.Pyrazolonequinazolone hybrids:A novel class of human 4hydroxyphenylpyruvate dioxygenase inhibitors[J].Bioorg Med Chem,2014,22(19):5194-5211.
[3] AVALLONE A,DIGENNARO E,SILVESTRO L,et al.Targeting thymidylate synthase in colorectal cancer:Critical reevaluation and emerging therapeutic role of raltitrexed[J].Expert Opin Drug Saf,2014,13(1):113-129.
[4] RIVERO I A,ESPINOZA K,SOMANATHAN R.Syntheses of quinazoline
2,4dione alkaloids and analogues from Mexican Zanthoxylum species[J].Molecules,2004,9(7):609-616.
[5] BOYLES D C,CURRAN T T,PARLETT R V.Electrophilic Namination of two quinazoline2,4diones using substituted(nitrophenyl)hydroxylamines[J].Org Process Res Dev,2002,6(3):230-233.
[6] LI J R,CHEN X,SHI D X,et al.A new and facile synthesis of quinazoline2,4(1H,3H)diones[J].Org Lett,2009,11(6):1193-1196.
[7] LI Y X,LUO Y P,XI Z,et al.Design and syntheses of novel phthalazin1(2H)one derivatives as acetohydroxyacid synthase inhibitors[J].J Agric Food Chem, 2006,54(24):9135-9139.
[8] ZAYED M F,HASSAN M H.Synthesis and biological evaluation studies of novel quinazolinone derivatives as antibacterial and antiinflammatory agents[J].Saudi Pharm J,2014,22(2):157-162.
[9] 羅铁军,李正名,赵卫光,等.2-甲基-3-芳基-7-(5,5-二甲基-3-酮-1-环己烯-1-基)甲酸酯-4(3H)-喹唑啉酮的合成[J].有机化学,2002,22(10):741-745.
[10] TRIPATHY,PRADEEP K.Microwave irradiated one flask synthesisof 2,3disubstituted quinazolin4ones[J].Journal of the institution of chemists,2003,75(6):179-180.
[11] MALHOTRA S,KOUL S K,SHARMA R L,et al.Studies on some biologically active azepinoquinazolines:Part I.An approach to potent bronchodilatory compounds[J].Organic chemistry including medicinal chemistry,1988,27(10):937-940.
[12] ELFAHAM A,ALBERICIO F.Peptide coupling reagents,more than a letter soup[J].Chem Rev,2011,111(11):6557-6602.
