非小细胞肺癌组织中Slitrk5的表达及意义
2017-05-25孙金鹏田涛陈玲刘燕春孔继昌
孙金鹏,田涛,陈玲,刘燕春,孔继昌
(1沧州中西医结合医院,河北沧州061000;2华北石油管理局总医院;3沧州市医学高等专科学校)
非小细胞肺癌组织中Slitrk5的表达及意义
孙金鹏1,田涛2,陈玲3,刘燕春2,孔继昌2
(1沧州中西医结合医院,河北沧州061000;2华北石油管理局总医院;3沧州市医学高等专科学校)
目的 观察非小细胞肺癌(NSCLC)组织中Slitrk5的表达情况,探讨其与患者临床病理特征的关系。方法 收集69例NSCLC患者手术切除的癌组织及癌旁组织,采用qRT-PCR法检测Slitrk5 mRNA表达,免疫组化染色法观察Slitrk5蛋白表达情况,Western blot法检测Slitrk5蛋白表达量,并分析Slitrk5蛋白高表达与NSCLC患者临床病理特征的关系。结果 癌组织中Slitrk5 mRNA及蛋白表达均显著高于癌旁组织(P均<0.05)。Slitrk5蛋白高表达在NSCLC患者不同性别、年龄、肿瘤直径、TNM分期、病理分型及有无淋巴结转移间比较差异均无统计学意义(P均>0.05)。结论 Slitrk5在NSCLC肺癌组织中高表达,可能与NSCLC的发生相关。
非小细胞肺癌;神经跨膜蛋白;Slitrk5;肿瘤分化程度
Slitrk蛋白家族是一类调节神经细胞突起生长的因子,能够控制轴突生长、调节神经元生长发育,在神经元细胞中过表达时,会导致轴突生长受到抑制。近年研究发现,Slitrk蛋白家族与肿瘤的发生发展有关。Slitrk3和Slitrk4在脑肿瘤中高度表达,尤其是在恶性程度高的肿瘤中,Slitrk4高表达更为明显[1];Slitrk3在淋巴瘤组织中表达上调[2],在胃肠道间质瘤中的表达上调,且与胃肠道间质瘤的分级和预后相关[3];Slitrk6在膀胱癌、肺原发癌和转移性癌、乳腺癌和胶质母细胞瘤中呈阳性表达[4],可作为晚期胃肠肿瘤一个潜在的治疗靶点[5],同时也是尿路上皮癌生物标志物ASG-15ME的靶基因[6]。然而有关Slitrk5在实体瘤中作用的研究较少。非小细胞肺癌(NSCLC)是肺癌的主要病理类型,患者一经确诊多为晚期,预后极差[7]。分子靶向治疗对NSCLC的诊疗具有重要意义。本研究观察了Slitrk5在NSCLC组织中的表达,并探讨其与NSCLC临床病理特征的关系,旨在为NSCLC的分子靶向治疗提供依据。
1 资料与方法
1.1 临床资料 选取2013年1月~2016年1月沧州中西医结合医院住院手术的69例NSCLC患者,男45例、女24例,年龄35~81岁、中位年龄60岁。均经术后病理检查确诊,术前未进行化放疗。根据2004版WHO肺肿瘤分类标准,鳞癌30例、腺癌30例、腺鳞癌6例、大细胞肺癌3例;伴周围淋巴结转移52例,无周围淋巴结转移17例;TNM分期Ⅰ期7例,Ⅱ~Ⅲ期62例。取手术切除的癌组织和相应的癌旁正常组织(距癌组织边缘≥2 cm),4%甲醛中性缓冲液固定,常规石蜡包埋,4 μm连续切片。
1.2 Slitrk5 mRNA检测 采用荧光定量PCR(qRT-PCR)方法。取组织标本,用TRIzol试剂提取总RNA,反转录合成cDNA。以各组cDNA为模板,进行qRT-PCR反应。Slitrk5上游引物:5′-TATTTACACACCACCCCGGC-3′,下游引物:5′-TGGGACACTCCAAAGGCAC-3′;内参GAPDH上游引物:5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游引物:5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。反应体系:模板2 μL,2×SYBR Premix Ex TaqTMⅡ 10 μL,上下游引物各0.5 μL,ddH2O 7 μL。反应条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火延伸30 s,72 ℃后延伸7 min,共40个循环。使用2-ΔΔCt分析法进行数据分析。以目的基因与内参基因表达比值表示目的基因表达量,实验重复3次。
1.3 Slitrk5蛋白定性检测 石蜡标本60 ℃烘烤2 h,采用EnVision二步法进行免疫组化染色。双氧水阻断内源性过氧化物酶,加入0.01 mol/L枸橼酸缓冲液中,90 ℃微波抗原修复8 min;5%二抗正常血清室温孵育封闭2 h;Slitrk5鼠抗人一抗(1∶200)室温孵育1 h后4 ℃过夜;聚合物增强剂室温孵育20 min,酶标抗鼠聚合物室温孵育25 min,常规DAB显色。以PBS代替一抗作为阴性对照,已知阳性片作阳性对照。以细胞膜呈棕色染色为阳性细胞。在光学显微镜×400视野下,每个样本选取5个视野,观察阳性细胞所占比例,无阳性细胞计0分,1%~10%计1分,11%~50%计2分,51%~80%计3分,>80%计4分。以≥3分为高表达,<3分为低表达。
1.4 Slitrk5蛋白定量检测 采用Western blot法。取新鲜冰冻肺癌组织和癌旁组织,用RIPA裂解液提取蛋白,BCA法测定浓度,取50 μg蛋白进行电泳,SDS-PAGE电泳后电转至PVDF膜,5%脱脂奶粉封闭1 h,加一抗鼠抗人Slitrk5抗体/鼠抗人β-Tubulin抗体(1∶1 000)4 ℃孵育过夜,加二抗HRP标记的抗兔IgG抗体(1∶5 000)孵育1 h,ECL化学发光法显色。采用Image J分析图像,以Slitrk5/β-Tubulin灰度比值表示Slitrk5蛋白的相对表达量。

2 结果
2.1 Slitrk5 mRNA在癌组织和癌旁组织中的表达比较 Slitrk5 mRNA在癌组织和癌旁组织中的相对表达量分别为5.32±0.57、1.26±0.37,二者比较P<0.05。其中55例(79.7%)癌组织中Slitrk5 mRNA表达高于癌旁组织。
2.2 Slitrk5蛋白在癌组织和癌旁组织中的表达情况比较 Slitrk5蛋白在癌组织中的高表达率为72.5%(50/69),在癌旁组织中的高表达率为15.9%(11/69),二者比较P<0.05。
2.3 Slitrk5蛋白在癌组织和癌旁组织中的表达量比较 Slitrk5蛋白在癌组织和癌旁组织中的相对表达量分别为0.768 3±0.265 0、0.218 9±0.072 2,二者比较P<0.05。
2.4 Slitrk5蛋白高表达与患者临床病理参数的关系 Slitrk5蛋白高表达与患者性别、年龄、肿瘤直径、TNM分期、病理分型及有无淋巴结转移均无关(P均>0.05)。见表1。
3 讨论
Slitrk蛋白家族在氨基酸链末端的跨膜结构域有2个富含亮氨酸的重复序列结构,并与轴突导向因子Slit高度同源,其C末端结构与神经营养受体原肌球蛋白受体激酶(Trk)具有高度同源性[8,9],Slitrk蛋白可以介导类似于Trk受体的一些生物功能,如神经突向外生长和树突细化,突出形成和神经元存活[10,11]。人类Slitrk5蛋白是一种Ⅰ型跨膜蛋白,包含958个氨基酸,定位于中枢神经系统突触,介导突触的形成[12,13]。Slitrk5主要在神经组织表达,具有调节神经突活动的作用。前人对Slitrk5的研究主要集中在精神疾病领域[14]。新近研究发现,Slitrk5作为TrkB信号共受体,可以通过调控TrkB的内吞后回收,从而促进脑源性神经营养因子(BDNF)依赖的信号转导[15]。BDNF/TrkB信号转导途径及其下游信号通路(PI3K/Akt、MAPK和PLC)与肿瘤细胞的增殖、浸润及转移密切相关[16]。Slitrk5的同源蛋白Slitrk3、Slitrk5、Slitrk6均已证明在肿瘤组织中表达异常,与肿瘤的发生发展相关,但目前尚无有关Slitrk5在实体瘤中表达情况的报道。
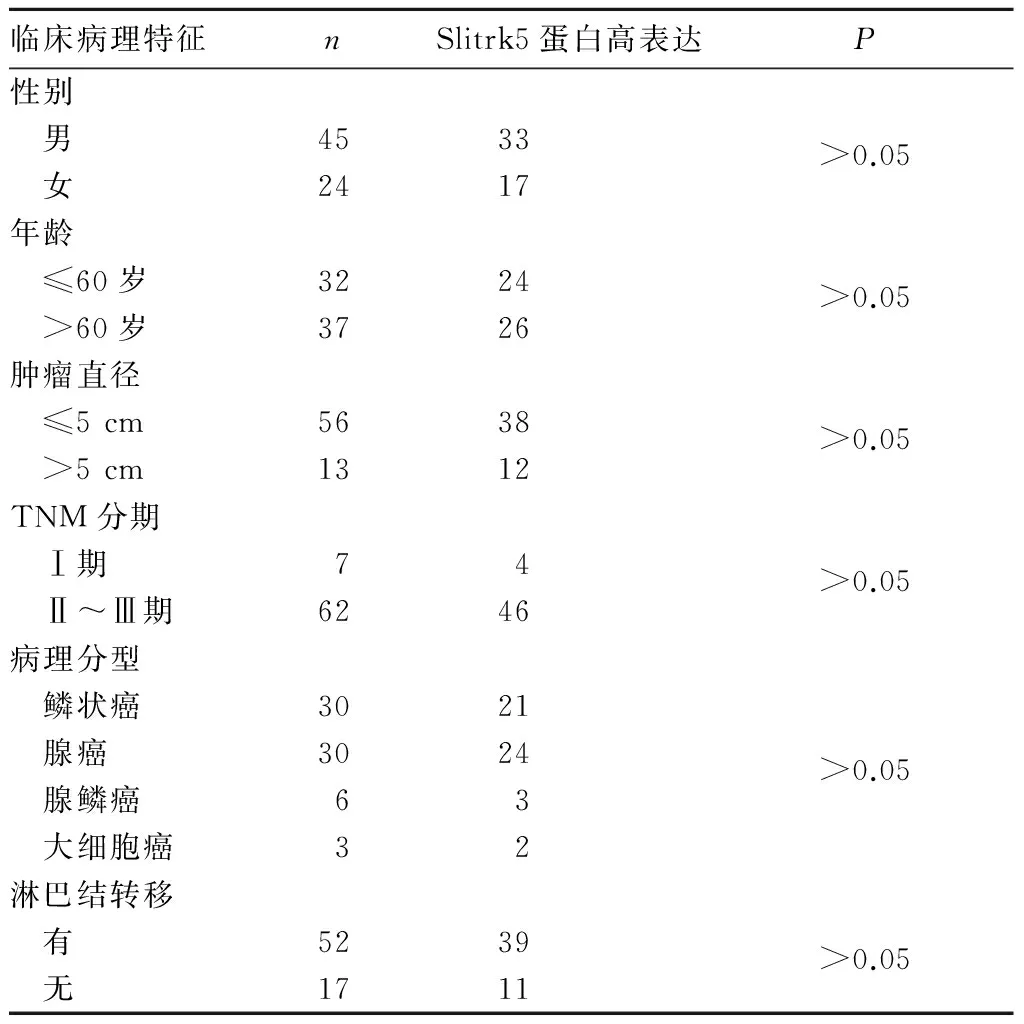
表1 Slitrk5蛋白高表达与患者临床病理特征的关系(例)
本研究显示,Slitrk5蛋白在NSCLC组织中的高表达率为72.5%,显著高于癌旁组织;qRT-PCR、免疫组化染色及Western blot检测发现,Slitrk5在癌组织中的mRNA及蛋白表达均高于癌旁组织,但Slitrk5蛋白高表达与患者性别、年龄、肿瘤直径、TNM分期、病理分型、淋巴结是否转移无关。表明Slitrk5在NSCLC组织中表达升高,Slitrk5蛋白高表达可能与NSCLC的发生相关,但与NSCLC的发展及转移无明显相关。这种不相关性可能与基础细胞的增殖、存活能力相关,但还需要进一步的研究来验证。除此之外,Slitrk5蛋白在NSCLC恶性过程的分子机制和功能还尚不清楚,还需要深入研究。
综上所述,NSCLC组织中Slitrk5高表达,可能与NSCLC的发生有关,Slitrk5可作为NSCLC的分子靶向治疗的相关靶点,在NSCLC基因治疗中具有一定的临床应用前景。
[1] 靳雁斌,范文红,范明.Slitrk基因家族的研究进展[J].国际病理科学与临床杂志,2006,26(2):159-161.
[2] Milde T, Shmelkov SV, Jensen KK, et al. A novel family of slitrk genes is expressed on hematopoietic stem cells and leukemias[J]. Leukemia, 2007,21:824-827.
[3] Wang CJ, Zhang ZZ, Jia X, et al. SLITRK3 expression correlation to gastrointestinal stromaltumor risk rating and prognosis[J]. World J Gastroenterol, 2015,21(27):8398-8407.
[4] Yang P, Coleman J, Li Y, et al. Abstract 1274: SLITRK6, the target of a novel antibody drug conjugate AGS15E, is expressed in bladder and other cancers[J]. Cancer Res, 2013,73(Suppl 8):1274-1274.
[5] Sanford T, Porten S, Meng MV. Molecular analysis of upper tract and bladder urothelial carcinoma: results from a microarray comparison[J]. PLoS One, 2015,10(8):1-10.
[6] Morrison K, Challita-Eid PM, Raitano A, et al. Development of ASG-15ME, a novel antibody drug conjugate targeting SLITRK6, a new urothelial cancer biomarker[J]. Mol Cancer Ther, 2016,15(6):1301-1310.
[7] Jemal A, Forman D, Bray F, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[8] Aruga J, Yokota N, Mikoshiba K. Human SLITRK family genes: genomic organization and expression profiling in normal brain and brain tumor tissue[J]. Gene, 2003,315:87-94.
[9] Aruga J, Mikoshiba K. Identification and characterization of Slitrk, a novel neuronal transmembrane protein family controlling neurite outgrowth[J]. J Bacteriol, 2003,24(1):117-129.
[10] Proenca CC, Gao KP, Shmelkov SV, et al. Slitrks as emerging candidate genes involved in neuropsychiatric disorders[J]. Trends Neurosci, 2011,34(3):143-153.
[11] Ko J. The leucine-rich repeat superfamily of synaptic adhesion molecules: LRRTMs and Slitrks[J]. Mol Cells, 2012,34(4):335-340.
[12] Yim YS, Kwon Y, Nam J, et al. Slitrks control excitatory and inhibitory synapse formation with LAR receptor protein tyrosine phosphatases[J]. Proc Natl Acad Sci USA,2013,110(10):4057-4062.
[13] Takahashi H, Katayama K, Sohya K, et al. Selective control of inhibitory synapse development by Slitrk3-PTPδ trans-synaptic interaction[J]. Nat Neurosci, 2012,15(3):389-398.
[14] Zhang K, Feng Y, Wigg KG, et al. Association study of the SLITRK5 gene and Tourette syndrome[J]. Psychiatr Genet, 2015,25(1):31-34.
[15] Song M, Giza J, Proenca C, et al. Slitrk5 Mediates BDNF-Dependent TrkB Receptor Trafficking and Signaling[J]. Dev Cell, 2015,33(6):690-702.
[16] 莫赛军,郑乃刚,曹文波,等.BDNF/TrkB信号途径与抗肿瘤治疗[J].癌变·畸变·突变,2014,26(6):476-478.
10.3969/j.issn.1002-266X.2017.06.014
R734.2
B
1002-266X(2017)06-0043-03
2016-06-28)
