深色果蔬维生素C检测方法的优化与比较
2017-05-25盖琼辉王春林
盖琼辉,王春林
(陇东学院,甘肃庆阳 745000)
深色果蔬维生素C检测方法的优化与比较
盖琼辉,王春林
(陇东学院,甘肃庆阳 745000)
目的:优化2,6-二氯靛酚钠滴定法和高效液相色谱法检测维生素C含量操作规范性及适用性。方法:对检测条件的设置、试剂及样液的保存时间、提取剂及浓度的选择、提取过程、脱色剂用量及2种检测方法的精密度、重复性和加标回收率等关键影响因素进行比较。结果:高效液相色谱法检测设置C18(5μm,4.6×250mm)色谱柱,0.1%草酸为流动相,流速1mL/min,柱温30℃,检测波长254nm,所得图谱保留时间适宜,峰形良好,维生素C标准液浓度在0.025~0.3mg/mL范围内线性关系良好,回归方程为:y=46 116x+173.26,R2为0.999 2;维生素C标准液在4~6℃保存下48h内可用、2,6-二氯靛酚钠溶液在4~6℃保存下应在12d内使用,待测液制备完成后应立即测定,若无法立即测定,可于4~6℃冰箱中保存1.5h;2%草酸为提取剂效果最佳,样品加提取液匀浆后迅速定容、过滤和检测,不可久置;使用2,6-二氯靛酚钠滴定法时需添加0.4g/30mL的活性炭进行脱色;精密度、重复性及加标回收率均符合测定要求。结论:2种检测方法都适用于深色果蔬维生素C含量检测,各有特点,可根据测定要求及实际条件选择适宜的方法。
深色果蔬;草莓;维生素C;高效液相色谱;2,6-二氯靛酚钠
维生素C是维持人体正常生命过程所必需的一类有机物[1],主要有提高免疫力、保护牙齿和牙龈、预防癌症、心脏病、中风等作用。维生素C主要以还原型形态存在于新鲜蔬果中,也有以氧化型及少量结合态存在,其含量是评定果蔬营养价值的重要指标。草莓为蔷薇科多年生草本植物[2],其果实颜色红艳,营养价值高,含有丰富的维生素C及色素,可作为深色果蔬的典型代表。
维生素C的测定方法有很多种,包括滴定法、分光光度法、荧光法、电极法、薄层色谱法及高效液相色谱法等,这些方法各有其特点和不足[3-4]。目前常用的检测方法主要为2,6-二氯靛酚钠滴定法和高效液相色谱法两种,但各种文献报道中[5-10]这两种检测方法所使用的提取剂、提取过程、脱色剂、试剂及待测液的保存温度和时间等具体操作条件并不一致,对检测结果可能造成影响。本文以深色果蔬草莓为材料对维生素C测定过程中涉及到的检测条件的设置、试剂及样液的保存时间、提取剂及浓度的选择、提取过程、脱色剂用量及两种检测方法的精密度、重复性和加标回收率等关键影响因素进行了比较研究,为2,6-二氯靛酚钠滴定法和高效液相色谱法检测维生素C含量的操作规范性及适用性提供依据。
1 材料与方法
1.1 材料、试剂和主要仪器
供试材料:2016年4月1日—5月1日期间市售草莓。
试剂:抗坏血酸(标准品)、2,6-二氯靛酚钠盐(分析纯)、碳酸氢钠(分析纯)、草酸(分析纯)、偏磷酸(分析纯)、醋酸(分析纯)、活性炭、甲醇(色谱纯)、超纯水等。
主要仪器:HZK-FA210型电子分析天平,成都欣宇实验设备有限公司;JJ-2型组织捣碎机,上海书俊仪器设备有限公司;JPS-30A型超声波清洗仪,郑州渤锐超声波设备有限公司;BILON-HL-205型恒温水浴锅,上海比朗仪器制造有限公司;JD-7200K型高速离心机,武汉晟睿明科学仪器有限公司;S-300型溶剂过滤装置,天津市领航实验设备有限公司;Ajilent 1100型高效液相色谱仪(配紫外检测器),美国安捷伦公司。
1.2 方法
1.2.1 2,6-二氯靛酚钠(2,6-DCIP)溶液的制备、标定及样品测定[11]称取52mg NaHCO3溶解于200mL沸水中,加入50mg 2,6-二氯靛酚,冷却后过滤、定容于250mL棕色容量瓶中,冰箱中冷藏保存,每次滴定前用1mg/mL维生素C标准液进行标定。即取1mL维生素C标准液,加入9mL 2%草酸,摇匀,用2,6-DCIP溶液滴定,以生成为红色持续15s不退为终点,记录2,6-DCIP溶液的消耗体积,计算每mL 2,6-DCIP溶液相当于维生素C的mg数,记为T值。样品测定时取待测样液10 mL,摇匀,用2,6-DCIP溶液滴定,以生成为红色持续15s不退为终点,记录2,6-DCIP溶液的消耗体积,另取10 mL 2%草酸作空白对照滴定,平行操作2次。样品中维生素C含量测定如式(1):
(1)
式(1)中:VA为样品滴定消耗2,6-DCIP溶液体积平均值(mL);VB为空白滴定消耗2,6-DCIP溶液体积平均值(mL);C为样品提取液定容体积(mL);T为每mL 2,6-DCIP溶液相当于维生素C的mg数(mg/mL);D为滴定时样液的体积(mL);W为被测样品的质量(g)。
1.2.2 高效液相色谱法(HPLC)检测条件及标准曲线的制备 HPLC检测条件[12]:C18(5μm,4.6×250mm)色谱柱、0.1%草酸为流动相、流速1mL/min、柱温30℃、检测波长254nm。用浓度为1mg/mL的维生素C标准液稀释成浓度分别为0.025、0.05、0.1、0.15、0.2、0.3mg/mL的维生素C标准使用液,用HPLC法进行检测,每次进样20μL,对所测得图谱的峰面积数据进行记录和分析,绘制出标准曲线,并计算出回归方程。
1.2.3 试剂存放时间试验 将维生素C标准液置于 4~6℃冰箱中,分别于0、3、6、24、48、72、96、118、142h时用HPLC法检测维生素C标准液中维生素C含量的变化,每处理重复3次;将2,6-DCIP溶液存放于4~6℃冰箱中,分别于0、2、4、6、8、10、12、14、16d时用维生素C标准液标定2,6-DCIP溶液,检测t值的变化。
1.2.4 待测液存放条件试验 将待测液避光分别存放于室温和4~6℃冰箱中,于0、0.5、1、1.5、2、2.5、3、8、16、24h时分别采用2,6-DCIP法和HPLC法检测维生素C含量。
1.2.5 提取剂选择试验 分别用1%、2%、3%的草酸溶液、偏磷酸溶液、醋酸溶液作为提取剂在同一条件下进行提取,对提取液分别用2,6-DCIP法和HPLC法检测维生素C含量。
1.2.6 提取方法优化试验 以2%草酸为提取剂与样品混合打成匀浆,取等量匀浆于7个100mL容量瓶中,用2%草酸定容,分别置于室温下震荡0、5、10、15min,及在超声波清洗仪中超声[13]5、10、15min,处理后立即过滤,滤液分别用2,6-DCIP法和HPLC法检测维生素C含量。
1.2.7 活性炭用量试验 以质量比1∶1称取草莓样品与2%草酸混合,迅速捣碎成浆,转移到250mL容量瓶中定容,摇匀后各取30mL置于7个离心管中,分别加入活性炭0、0.4、0.6、0.8、1.0、1.5、3.0g,摇匀后于10 000r/min离心机中低温离心15min,取上清液分别用2,6-DCIP法和HPLC法检测维生素C含量。
③点E与点C运动的路线有什么关系?(平行且相等)由此你发现了什么?(如图3,四边形AEE′C′是平行四边形)
1.2.8 精密度试验 HPLC法的精密度[14]试验用1mg/mL的维生素C标准液,重复检测6次(每次进样15μL),检测维生素C色谱峰保留时间和峰面积,计算RSD值。2,6-DCIP法[15]的精密度试验用2,6-DCIP溶液滴定0.02mg/mL的维生素C标准液,重复滴定6次(每次10mL),记录消耗2,6-DCIP溶液的体积并算出T值,计算RSD值。
1.2.9 重复性试验 采用同批次样品相同处理方法,分别用2,6-DCIP法和HPLC法检测维生素C含量,重复5次。
1.2.10 加标回收试验[16]在样品匀浆中,分别加入0.2mg/mL的维生素C标准液0、0.5、1mL,然后提取、脱色后分别用2,6-DCIP法和HPLC法进行检测,计算维生素C测定值和加标回收率。
2 结果与分析
2.1 HPLC检测条件及标准曲线
由图1可见,维生素C含量检测所得图谱保留时间适宜,峰形良好,说明检测条件设置得当。图2表明,维生素C标准液浓度在0.025~0.3mg/mL范围内线性关系良好,回归方程为:y=46 116x+173.26,R2为0.999 2。

图1 不同浓度维生素C标准液HPLC检测图谱
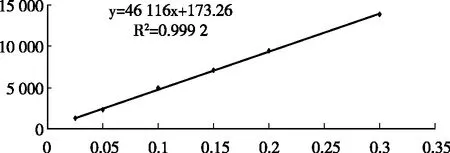
图2 HPLC法测定维生素C标准曲线
2.2 试剂存放时间对含量的影响
由图3、图4可见,存放于4~6℃冰箱中的维生素C标准液及2,6-DCIP溶液均随存放时间的增长含量降低。其中,维生素C标准液在0~48h之内变化不大,超过48h后维生素C含量急剧降低;2,6-DCIP溶液在0~12d内t值降低较小,超过12d后t值急剧下降。说明配制的维生素C标准液在4~6℃下可保存48h,超过48h不可作为标准液进行试验,配制的2,6-DCIP溶液在4~6℃保存下应在12d内使用。

图3 不同存放时间对维生素C标准液含量的影响

图4 不同存放时间对2,6-DCIP溶液的影响
2.3 待测液样存放条件对检测结果的影响
表1表明,待测液室温和低温存放,都随存放时间增长,维生素C含量降低,室温存放比低温存放降低幅度大。经多重比较得知,在室温下存放0.5h,待测液中维生素C含量即显著降低,低温存放1.5h内待测液中维生素C含量差异不显著。HPLC法检测所得维生素C含量均高于2,6-DCIP法检测结果。说明待测液制备完成后应立即测定,若无法立即测定,应置于低温保存,时间不超过1.5h。
图5显示,草酸及醋酸的浓度对维生素C的提取影响较大,2种酸均以2%提取效果最佳,偏磷酸的浓度对维生素C的提取影响较小。3%的草酸及醋酸使得2种检测方法的结果均出现较大差异,说明酸浓度过高不利于检测,2%草酸提取效果最佳。
2.5 提取方法优化
常温振荡提取和超声波提取都会随着提取时间的延长而使测定值下降(图6),其中超声波提取5min内,维生素C含量降低幅度较小,两种检测方法检测结果差异不大。说明样品加提取液匀浆后应迅速定容、过滤和检测。
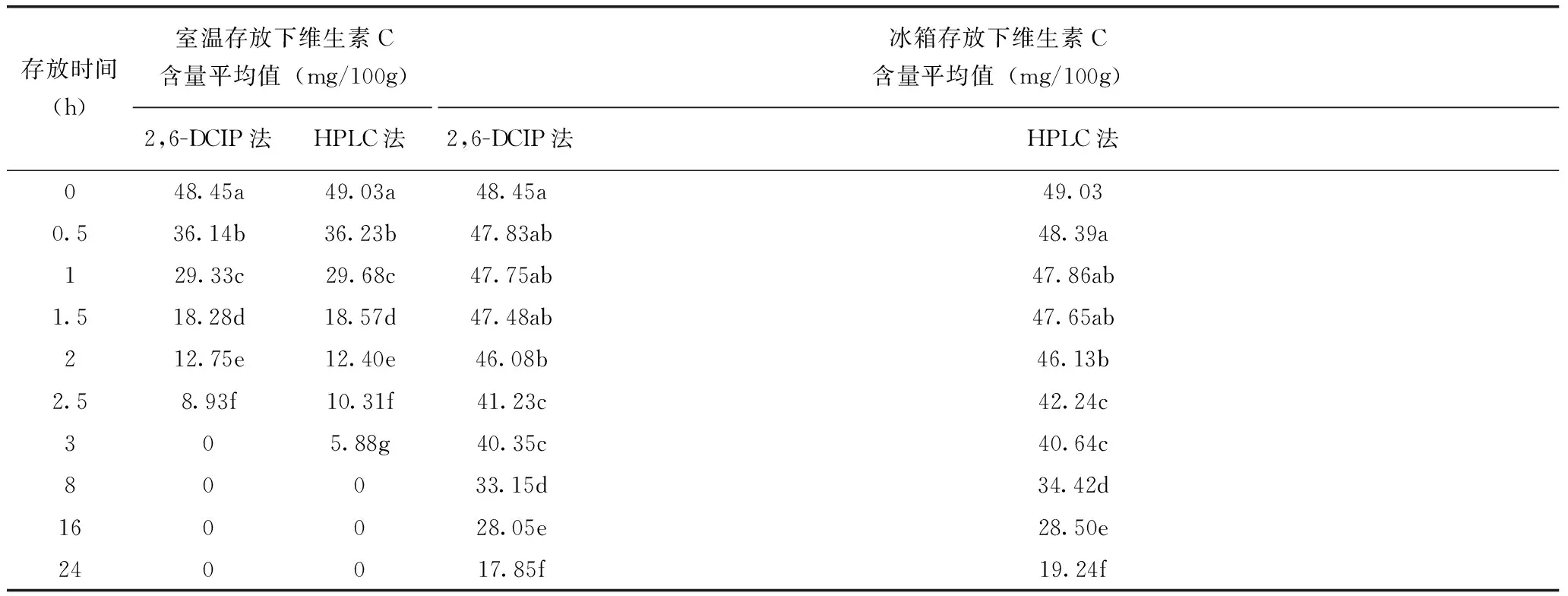
表1 不同存放条件下样品待测液维生素C含量 单位:mg/100g
注:表中字母是多重比较的字母标记法,采用最小显著性差异法(LSD)计算,显著性水平0.05。

图5 不同提取剂对测定结果的影响

图6 不同提取方法对维生素含量的影响
2.6 活性炭用量对检测结果的影响
由图7可见,样品中不添加活性炭时,2,6-DCIP法无法测出样品中维生素C含量,随着活性炭添加量的增加,测得的维生素C含量逐渐降低,添加量低于0.4g/30mL时对检测结果几乎无影响,超过则使检测结果大幅度降低,两种检测方法检测结果无显著差异。说明使用2,6-DCIP法检测样品中维生素C含量时必须使用低于0.4g/30mL的活性炭对样本进行脱色,使用HPLC法检测样品中维生素C含量时可不进行脱色处理。

图7 活性炭用量对检测结果的影响
2.7 检测方法精密度比较
由表2可见,HPLC检测维生素C标准液的保留时间RSD为0.13%,峰面积RSD为0.43%;2,6-DCIP法滴定维生素C标准液消耗2,6-DCIP溶液体积RSD为1.44%、t值RSD为1.43%,说明2种检测方法精密度均能够满足测定要求,HPLC法精密度高于2,6-DCIP法。

表2 2种检测方法精密度比较
2.8 检测方法重复性比较
由表3可见,采用2,6-DCIP法5次滴定相对标准偏差为2.68%、HPLC法5次检测相对标准偏差为2.56%,2种方法测定草莓维生素C含量的相对标准偏差均小于5%,方法重复性好,说明2种检测方法均适用于检测样品中维生素C含量。

表3 检测方法重复性比较
2.9 2种检测方法的加标回收率
表4表明,HPLC法的回收率在99%~104.1%之间、2,6-DCIP法的回收率在95.7%~100.2%之间,说明2种检测方法测定结果准确。

表4 2种检测方法加标回收率
3 结论与讨论
目前最常用的维生素C检测方法为2,6-二氯靛酚钠滴定法和高效液相色谱法,本文对这2种检测方法具体操作过程中涉及到的检测条件的设置、试剂及样液的保存时间、提取剂及浓度的选择、提取过程、脱色剂用量及2种检测方法的精密度、重复性和加标回收率等关键影响因素进行了比较,得出以下结论。
(1)HPLC检测设置C18(5μm,4.6×250mm)色谱柱,0.1%草酸为流动相,流速1mL/min,柱温30℃,检测波长254nm,所得图谱保留时间适宜,峰形良好,维生素C标准液浓度在0.025~0.3mg/mL范围内线性关系良好,回归方程为y=46 116x+173.26,R2为0.999 2,说明检测条件设置得当。(2)配制的维生素C标准液在4~6℃下可保存48h,超过48h不可作为标准液进行试验,配制的2,6-DCIP溶液在4~6℃保存下应在12d内使用。待测液制备完成后应立即测定,若无法立即测定,应置于低温保存,时间不超过1.5h。(3)提取剂浓度过高使得样品中维生素C含量测定值降低,通过比较得出2%草酸提取效果最佳。样品加提取液匀浆后应迅速定容、过滤和检测,不宜放置或进行震荡、超声提取。(4)活性炭可对样品提取液进行脱色,使用2,6-DCIP法检测样品中维生素C含量时需添加0.4g/30mL的活性炭对样本进行脱色,使用HPLC法检测样品中维生素C含量时可不进行脱色处理。(5)精密度、重复性及加标回收率试验均表明2种检测方法都适用于深色果蔬维生素C含量检测。其中HPLC法精密度高于2,6-DCIP法;2,6-DCIP法的回收率为95.7%~100.2%,平均回收率为97.95%,RSD为2.68%;HPLC法的回收率为99%~104.1%,平均回收率为101.55%,RSD为2.56%。HPLC法检测结果准确、稳定、操作简便、灵敏度高、重现性及选择性好,无需脱色,但试验前期准备和后期扫尾工作较为繁琐,如配制流动相、调试设备、做标准曲线、检测完成后冲洗色谱柱等,较为费时,且对样品的纯度要求比较高,所用仪器昂贵[16];2,6-DCIP法所需条件简单,操作简便、快速、测定结果准确,但滴定终点需人为判断,较为主观,不同的人检测可能造成较大的结果差异,且使用脱色剂吸附色素的同时,也吸附了一定数量的维生素C,造成样品中维生素C的损失。在实际操作过程中可根据测定要求及实际条件选择适宜的方法。◇
[1]庄萍.我国维生素C的发展前景及对策[J]. 惠州学院学报(自然科学版),2002,3:75-77.
[2]雷家军,代汉萍,谭昌华等.中国草莓属(Fragaria)植物的分类研究[J].园艺学报,2006(1):1-5.
[3]国增超.果蔬中维生素C含量检测方法的述评[J].农业与技术,2016(9):41-45.
[4]张昉,高蓉.维生素C检测方法研究进展[J].中国卫生检验杂志,2009,19(2):457-460.
[5]刘嘉祺,孙仁国.高效液相色谱法测定圣女果中维生素C的含量[J].中国食物与营养,2012,18(7):69-70.
[6]何优选,梁奇峰.高效液相色谱法测定梅县沙田柚果肉中维生素C的含量[J].光谱实验室,2010(4):1290-1293.
[7]单胜艳,单群,王春茹等.高效液相色谱法测定茶饮料中的维生素C[J].饮料工业,2013(8):29-31.
[8]赵晓梅,江英,吴玉鹏等.果蔬中维生素C含量测定方法的研究[J].食品科学,2006,27(3):197-199.
[9]杨晶晶,刘英,曲媛等.不同方法测定三七花、茎叶中维生素C含量[J].食品工业科技,2014,35(24):53-56.
[10]陈光,孙妍.2,6-二氯靛酚滴定法测定蜂胶中维生素C含量[J].理化检验(化学分册),2014,50(8):1404-1402.
[11]李润丰,赵希艳,高亚弟.2,6-二氯靛酚反滴定法测定红色果蔬中还原型VC[J].营养学报,2012,34(5):507-509.
[12]李会静,张建利,王亮.高效液相色谱法测定猕猴桃中维生素C的含量[J].煤炭与化工,2013(8):140-141.
[13]张丽丽,刘威生,等.高效液相色谱法测定5个杏品种的糖和酸.果树学报,2010,27(1):119-123.
[14]陈昌云,李小华,刘莉莉.高效液相色谱法测定蜜柚中维生素C的含量[J].化工时刊,2007,8:19-21
[15]苑乃香,宣亚文,谢东坡,等.2,6-二氯靛酚钠测定蔬菜中抗坏血酸的含量[J].安徽农业科学,2009(25):11853-11854.
[16]任成忠,毛丽芬.加标回收实验的实施及回收率计算的研究[J].工业安全与环保,2006(2):9-11.
[17]甘振威,武广恒,刘国良,等.自动电位滴定法和高效液相色谱法测定深颜色果蔬中维生素C浓度的比较[J].吉林大学学报(医学版),2014(2):441-445.
(责任编辑 李婷婷)
Optimization and Comparison of Detection Methods of Vitamin C in Dark Fruits and Vegetables
GAI Qiong-hui,WANG Chun-lin
(Longdong University,Qingyang 745000,China)

dark fruit and vegetable;strawberry;vitamin C;HPLC;2,6-DCIP
盖琼辉(1978— ),女,硕士,讲师,研究方向:农作物栽培、设施农业。
