棉蚜His-CYP6J1融合蛋白的分离纯化及多克隆抗体的制备
2017-05-19王亚美魏原杰艾新宇刘小宁
王亚美 魏原杰 艾新宇 刘小宁
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
棉蚜His-CYP6J1融合蛋白的分离纯化及多克隆抗体的制备
王亚美 魏原杰 艾新宇 刘小宁
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
通过亲和层析法纯化棉蚜His-CYP6J1融合蛋白,制备及鉴定其多克隆抗体。采用镍离子金属螯合亲和层析柱分离纯化棉蚜His-CYP6J1融合蛋白,SDS-PAGE检测纯化产物。用纯化得到的His-CYP6J1融合蛋白免疫小鼠,制备抗棉蚜P450 CYP6J1多克隆抗体;采用ELISA法检测抗体效价;免疫组化法检测抗血清特异性。结果表明,纯化的His-CYP6J1融合蛋白免疫小鼠后得到多抗血清,ELISA法检测抗血清效价达1∶200 000。免疫组化结果显示,此多克隆抗体能够与棉蚜P450 CYP6J1天然蛋白特异性结合,却在棉铃虫没有发现相应的结合反应。上述结果对研究棉蚜单一P450蛋白结构、功能及其在棉蚜抗药性形成过程的作用奠定基础。
P450 CYP6J1融合蛋白;蛋白纯化;多克隆抗体
细胞色素P450(CYP450)是一类血红素铁结合蛋白的超家族[1],它能够参与内源性物质以及包含药物、环境化合物在内的外源性物质的代谢[2]。该家族成员在生物、化学催化反应过程中具有的高度特异性使其在化工、环保及药物代谢等范围都具有极大的应用价值,从而成为生物及生化领域的研究热点。在细胞中,细胞色素P450主要分布在内质网和线粒体内膜上[3],在哺乳类动物中主要存在于微粒体和线粒体中。细胞色素P450酶系存在的范围很广泛,包括动物、植物、昆虫等[4]。但在昆虫中的中肠、脂肪体等器官中的细胞色素P450酶系的表达量较高[5]。据报道已经克隆到的昆虫P450家族的基因超过了1 000 个[6]。由于P450家族的多样性,这也决定了其功能的多样性,因此在提高昆虫对内外有毒物质代谢、寄主的适应性等方面都发挥着重要的作用[7]。
棉蚜(Aphis gossypii Glover)是一种世界性农业经济最重要的害虫之一。棉蚜,又称瓜蚜,属于半翅目蚜科蚜属,它是一种杂食性害虫,繁殖能力很高,寄主范围广泛,棉蚜有孤雌生殖和两性生殖两种方式。棉蚜是以韧皮部汁液为食的刺吸式昆虫,在取食的同时,它会传播某些植物病毒[8]而对农作物造成巨大的伤害[9]。目前,棉蚜的防治主要依赖于化学防治,随着各类杀虫剂的大量和不科学使用,导致棉蚜的抗药性发展较快,进而使其抗性机制复杂化[10],有文献报道称棉蚜可以通过改变自身的习性和行为逃避减少药剂的接触量[11],这对棉蚜的防治带来了巨大的困难。自1964年龚坤元等首次报道棉蚜对药物的抗性增加之后[12],陆续涌现对棉蚜抗药性机制的研究报道,其中参与棉蚜药物抗性的主要物质有乙酰胆碱酯酶[13-16]、羧酸酯酶等[17,18]。酯酶活性的增加或酯酶的敏感性降低都可以导致棉蚜对部分杀虫剂的抗性增加。但是,通过解毒酶细胞色素P450单加氧酶参与的抗性也是最常见的类型[19-22]。研究表明,棉蚜抗性品系的细胞色素 P450s的活性显著高于敏感品系,说明细胞色素P450s的活性升高,也会降低杀虫剂效果,从而引发棉蚜抗性的产生[23]。Peng等[24]检测出棉蚜抗性品系P450s的含量比敏感品系高,说明P450s表达量的增加有助于棉蚜解毒作用的增强。但是无论对其活性还是含量增加的评价,均是通过害虫体内P450超家族中所有成员的含量或活性测定来进行的,无法评价某个单一P450在应对外界刺激的变化情况,因此本实验对棉蚜 His-CYP6J1 蛋白进行纯化及其多克隆抗体的制备,为后期研究棉蚜单一P450蛋白结构、功能及其在棉蚜抗药性形成过程的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 棉蚜采自新疆安宁渠并于室内用棉苗长期饲养,饲养条件为:25℃,相对湿度为75%,光周期(L∶D)为16 h∶8 h。昆明白小鼠购买于新疆医科大第一附属医院。
1.1.2 实验试剂与仪器 蛋白Marker购于Thermo Scientific;Ni-NTA Agarose 购自Qiagen公司;辣根过氧化物酶标记的山羊抗鼠IgG和DAB显色试剂购自北京中杉金桥有限公司,其余所用的化学试剂(尿素、咪唑、无水乙醇、二甲苯等)均为国产分析纯试剂。加拿大Motic B5 professional series光学显微镜,美国紫外/可见分光光度计NanoDrop-1000。
1.2 方法
1.2.1 棉蚜 His-CYP6J1 融合蛋白的获得及纯化 将能表达出棉蚜 His-CYP6J1 融合蛋白的菌种接种到10 mL含卡纳抗生素(50 mg/mL)LB液体培养基中,37℃高速振荡(220 r/min)培养过夜;按 1∶100 的体积比转接到1 L含有卡纳抗生素(50 mg/mL)LB液体培养基中,37℃高速振荡(220 r/min)培养至OD600=0.6-0.8 时,取1 mL 不加IPTG的菌液为诱前作对照,然后加入IPTG(终浓度为0.5 mmol/L),培养4 h 后取1 mL 菌液作诱后蛋白,然后低温(4℃)离心收集菌液。先用PBS(pH7.2-7.4)缓冲液洗涤并悬浮沉淀,加入1 mmol/L 蛋白酶抑制剂PMSF,在冰上超声破碎菌体至相对透亮(间隔5 s,共30 min),4℃,12 000 r/min 离心10 min,将上清和沉淀分开处理,分别取1 mL 上清和沉淀用15%的SDS-PAGE进行分析,证实 His-CYP6J1 融合蛋白。
收集包涵体沉淀,并用PBS(pH7.2-7.4)缓冲液洗涤包涵体沉淀,然后加入8 mL 8 mol/L 尿素变性缓冲液(20 mmol/L Tris-HCl,0.5 mmol/L NaCl,1 mmol/L PMSF,2 mmol/L β-ME,8 mol/L 尿素,0.2% Tritonx-100,10 mmol/L咪唑)悬浮包涵体并室温过夜。将处理得到的总蛋白按照Ni-NTA His Tag Kit说明书依次用含不同浓度咪唑(40 mmol/L,3次;80 mmol/L,3次;100 mmol/L,3次;200 mmol/L,2次)进行洗脱,分别收集所有过程的流出液并进行标记。15%的SDS-PAGE检测,与预测大小一致、条带较粗且单一的样品所对应的流出液即是所需要纯化的His-CYP6J1 融合蛋白。收集纯化后的蛋白溶液放入透析袋,用不同浓度的透析液(4、2和0 mol/L尿素)透析,且每24 h更换透析液。
1.2.2 His-CYP6J1 融合蛋白含量的测定 以BSA为标准蛋白,按Bradford[25]的方法测定 His-CYP6J1融合蛋白的含量。
1.2.3 免疫小鼠制备抗棉蚜P450 CYP6J1多克隆抗体 以纯化的棉蚜His-CYP6J1融合蛋白为抗原,按照标准免疫程序[26]进行免疫。将等体积的His-CYP6J1 融合蛋白与完全弗氏佐剂充分乳化,采用背部多点皮下的免疫方法,以每只50 μg剂量免疫小鼠。于2周和4周后分别将棉蚜His-CYP6J1融合蛋白与不完全弗氏佐剂充分乳化,以相同的剂量和免疫途径免疫小鼠。每次免疫后对小鼠进行眼眶采血法收集血清[27]。
1.2.4 ELISA检测小鼠抗棉蚜P450 CYP6J1多克隆抗体效价 用浓度为20 μg/mL的His-CYP6J1融合蛋白包被ELISA板于4℃过夜,次日用PBST缓冲液洗涤3次,5%的脱脂奶粉37℃封闭2 h。再用PBST缓冲液洗涤3次后加入不同稀释浓度的小鼠血清,37℃孵育2 h。洗涤后以1∶3 000的稀释比例加入辣根过氧化物酶标记的山羊抗鼠IgG,37℃孵育1h。PBST洗3次后加TMB底物显色,避光显色20 min后,加入2 mol/L的硫酸终止反应,用酶标仪检测A450。未免疫前的血清为对照,其A450值为N;免疫后的A450值为P,以P/N>2.1判断为阳性。
1.2.5 免疫组化法检测抗棉蚜P450 CYP6J1多克隆抗体的特异性 选取棉蚜成虫和3龄棉铃虫幼虫进行免疫组化试验,检测抗棉蚜P450 CYP6J1多克隆抗体的特异性,具体方法参照文献[28]。因为棉蚜个体比棉铃虫个体小,因此免疫组化法有需要改进的步骤,具体方法如下:
(1)固定:将棉蚜放入4%的多聚甲醛缓冲溶液中,在4℃中固定24 h以上。
(2)脱水:棉蚜在浓度为30%、50%、70%、80%、95%和100%的乙醇溶液脱水处理20 min。
(3)透明:将棉蚜放入等体积无水乙醇、二甲苯混合溶液中处理1 h,再在二甲苯溶液中处理2次,分别处理40 min、30 min。最后将组织于38℃温箱中过夜。
(4)浸蜡:在56℃温箱中,待石蜡完全溶入二甲苯后处理1 h,反复两次,每次浸蜡1 h。
(5)包埋:将带有棉蚜组织的蜡液倒入牛皮纸叠好的槽中,使其凝固。
(6)切片:将棉蚜按照纵切的方式及棉铃虫横切的方式切成2 μm厚度的蜡片。
(7)烤片:载玻片平铺后,室温静置1 h,于56℃恒温培养箱中烘烤1 h。
(8)脱蜡:组织切片在二甲苯中脱蜡3次,每次20 min,再分别放入100%、90%、80%、75%的乙醇溶液中各3 min,蒸馏水洗涤3次,每次3 min。
(9)抗原修复:用柠檬酸盐缓冲液浸没组织切片,温度维持在92℃ 10 min左右。待缓冲液冷却至常温后,用PBS(pH7.4)溶液洗涤3次,每次3 min。蒸馏水洗涤3次,每次3 min。
(10)抗原封闭:PBST配置5%的脱脂奶粉,滴加在组织上,37℃孵育3 h。
(11)一抗孵育:用0.5%脱脂奶粉以1∶100比例稀释一抗后滴加在组织上,4℃孵育过夜,37℃孵育1 h。甩去一抗,用PBS溶液洗涤3次,每次3 min。蒸馏水洗涤3次,每次3 min。
(12)二抗孵育:用0.5%脱脂奶粉以1∶1 000稀释二抗,滴加在组织切片上,37℃放置3 h。甩去二抗后PBS洗涤3次,每次3 min。蒸馏水洗涤3次,每次3 min。
(13)DAB显色:将现配现用的DAB显色剂滴加在组织上,显色3 min,显色结束后立马用蒸馏水吸取DAB显色液。
(14)拍照:使用Nikon NIS-Elements D显微镜进行拍照。
2 结果
2.1 His-CYP6J1融合蛋白的诱导表达
15%的SDS-PAGE检测大量诱导的His-CYP6J1融合蛋白(图1),与诱导表达前相比,重组质粒pET28a-CYP6J1的菌种经IPTG诱导表达后和沉淀中有一条蛋白质增强条带,分子量约为57 kD,与预期的His-CYP6J1融合蛋白相对分子量相似,结果初步说明His-CYP6J1融合蛋白大量诱导表达成功,可进行His-CYP6J1 融合蛋白的纯化工作。
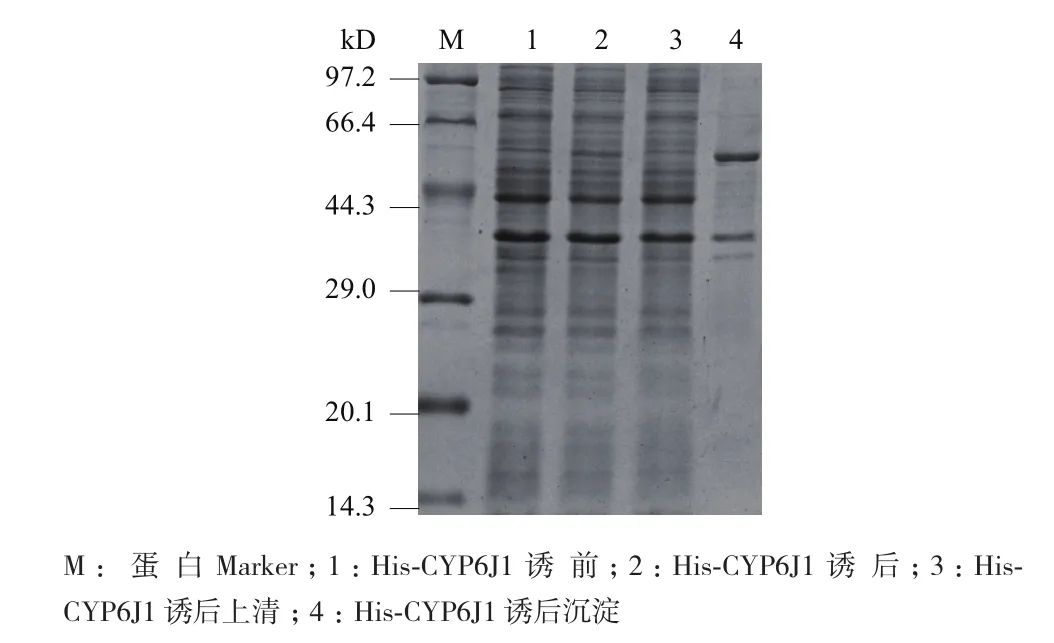
图1 SDS-PAGE检测His-CYP6J1融合蛋白的表达
2.2 His-CYP6J1融合蛋白纯化
因为His-CYP6J1融合蛋白的N端带有His标签,所以采用Ni-NTA-agarose亲和层析柱进行纯化。15%的SDS-PAGE检测显示(图2),用80 mmol/L和100 mmol/L咪唑洗脱的目的蛋白条带单一、清晰而且相对表达量较大,纯化后的蛋白与目的蛋白大小一致。利用Bradford法蛋白浓度定量经标准曲线计算后,His-CYP6J1 融合蛋白含量为0.8 mg/mL,说明His-CYP6J1 融合蛋白可满足小鼠免疫实验需要。
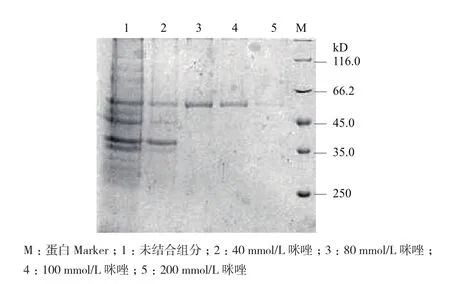
图2 His-CYP6J1融合蛋白的纯化
2.3 ELISA检测小鼠抗棉蚜P450 CYP6J1多克隆抗体效价
His-CYP6J1融合蛋白免疫小鼠3次后,ELISA检测小鼠的血清效价(图3)。小鼠抗血清ELISA检测的A450值与阴性对照相比大于2.1,3次His-CYP6J1 融合蛋白免疫小鼠后的血清效价达到1∶200 000,小鼠的抗体效价达到了预期目标,可进行免疫组化鉴定其特异性。
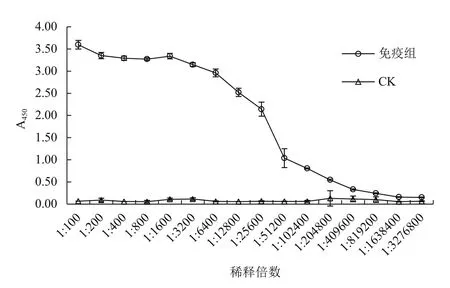
图3 ELISA检测His-CYP6J1蛋白免疫小鼠后的血清效价
2.4 免疫组化分析
取棉蚜成虫和3龄棉铃虫幼虫为实验材料,经过以小鼠抗棉蚜P450 CYP6J1多克隆抗体为一抗和以辣根过氧化物酶标记的山羊抗鼠IgG为二抗,进行抗棉蚜P450 CYP6J1多克隆抗体的免疫组化鉴定。结果表明,所制备抗棉蚜P450 CYP6J1多克隆抗体具有高特异性,用此抗体对棉蚜和棉铃虫组织进行了免疫组织化学分析。在显微镜下可以看到(图4),B(棉铃虫切片)和 D(棉蚜切片)经一抗孵育,A(棉铃虫切片)和 C(棉蚜切片)未加一抗孵育,最后DAB显色,A、B 和 C 未发现特异性结合,而相比对照组D可以看到棉蚜P450 CYP6J1多克隆抗血清和棉蚜P450 CYP6J1天然蛋白发生了特异性结合,结合部位是腹管和脂肪体(图4-D)。
3 讨论
本实验大量诱导了 His-CYP6J1 融合蛋白,诱导条件的不同对重组蛋白的表达量存在一定的影响,研究表明高浓度 IPTG 对蛋白表达量有抑制作用[29],而低浓度的 IPTG 会减少对细胞的损伤[30],所以,经摸索诱导表达条件,本实验将 IPTG 浓度确定为 0.5 mmol/L,结果表明,该浓度大量诱导 His-CYP6J1 融合蛋白是适合的。
实验通过亲和层析法成功分离纯化了 His-CYP6J1 融合蛋白,并以它为抗原制备了其相应的抗棉蚜P450 CYP6J1多克隆抗体,ELISA检测抗体效价约1∶200 000。细菌表达的融合蛋白可用于多方面的研究,如蛋白间的相互作用分析,蛋白激酶活性的研究,作为抗原用于多克隆抗体的制备及其它结构或功能的研究。蛋白是基因功能的主要表现形式,高效价的抗体是基因功能研究的一种重要工具,因此高效价抗体是抗原检测的关键[31]。本实验在制备抗血清的过程中,纯化棉蚜 His-CYP6J1 融合蛋白是最关键的步骤。pH、温度、时间都会影响蛋白的纯化效率,从图2中可以看出泳道1的流出液和泳道2的洗杂液中包含一定量的 His-CYP6J1 融合蛋白,可能的原因是诱导后的蛋白在与柱结合时已达到层析柱结合的饱和度或者与之结合的时间不够长,因此我们需要不断地优化纯化条件,从而获得量大又单一的目的蛋白。
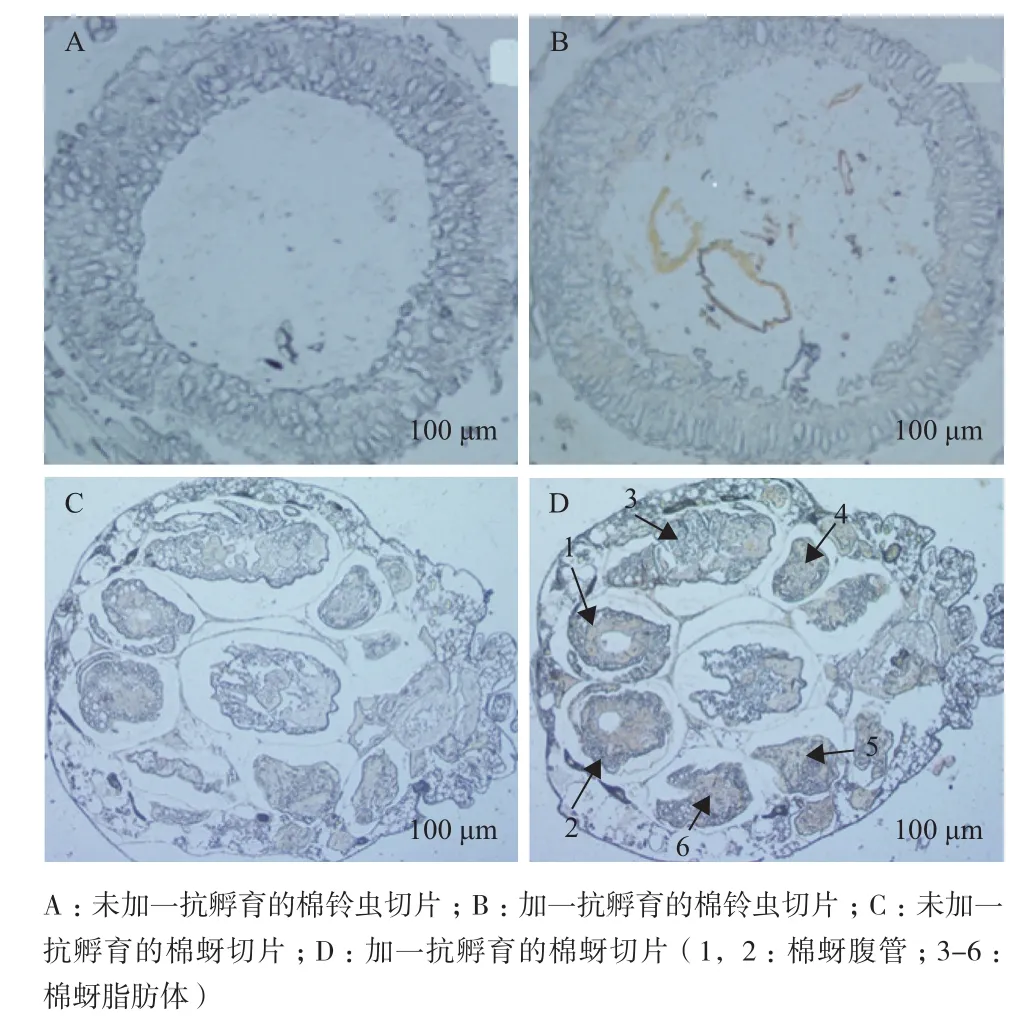
图4 免疫组化鉴定多克隆抗体的特异性
由于棉蚜个体比棉铃虫个体小,因此免疫组化实验的脱水和脱蜡过程需要相应的缩短时间,缩短时间到 20 min[28],以免切片后呈现不出完整的组织结构。免疫组化结果与对照组相比所制备的抗血清能够与棉蚜P450 CYP6J1天然蛋白特异性结合,结合部位发生在棉蚜的脂肪体,这与细胞色素P450酶系在棉铃虫中肠、脂肪体等器官中的的表达量较高相一致[5]。棉蚜的腹管中该蛋白的表达量也相对较高,这与棉蚜腹管的功能密切相关。棉蚜腹管具有分泌蜜露以及饲育幼蚜、排出代谢产物以及排蜡抵御天敌等功能[32],这些可能均需要P450s在棉蚜生命周期及繁殖力等方面发挥重要作用。但在棉铃虫没有发现特异性结合反应,说明作为棉花的两种重要害虫,虽然棉蚜P450 CYP6J1蛋白与棉铃虫的P450 CYP6B6蛋白均属于6家族,但两者基因序列的ORF相似性仅为43.05%。
4 结论
本研究在大肠杆菌中进行大量表达和纯化获得条带单一的His-CYP6J1融合蛋白,并利用纯化的融合蛋白免疫小鼠获得针对棉蚜P450 CYP6J1 特异性较高的多克隆抗体。
[1]Fire A, Xu SQ, Montgomeyr MK, et al. Potent and specific genetic interference by double-strnaded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391:806-811.
[2]Kennerdell JR, Carthew RW. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway[J]. Cell, 1998, 95(7):1017-1026.
[3]Timmons L, Fire A. Specific interference by ingested dsRNA[J]. Nature, 1998, 395(6705):854.
[4]Stegeman JJ, Livingstone DR. Forms and functions of cytochrome P450[J]. Comparative Biochemistry & Physiology Part C Pharmacology Toxicology & Endocrinology, 1998, 121(1-3):1-3.
[5]Brun A, Cuany A, Le Mouel TL, et al. Inducibility of the Drosophila melanogaster, cytochrome P450 gene, CYP6A2, by phenobarbital in insecticide susceptible or resistant strains[J]. Insect Biochemistry & Molecular Biology, 1996, 26(7):697-703.
[6]唐涛, 刘雪源, 邱立红, 等. RNA干扰及其对昆虫抗药性相关基因的沉默研究[J]. 棉花学报, 2010, 22(6):617-624.
[7]Bernhardt R. RNA interference and its application on silencing of insecticide-resistant genes in insects[J]. Journal of Biotechnology, 2006, 124(1):128-45.
[8]Blackman RL, Eastop VF. Aphids on the world’s crops trees:an identification and information guide[J]. Oriental Insects, 2000, 35(1):400-400.
[9]Thorpe P, Cock PJA, Bos J. Comparative transcriptomics andproteomics of three different aphid species identifies core and diverse effector sets[J]. BMC Genomics, 2016, 17(1):1-18.
[10]王荫长, 韩召军. 我国农业害虫抗药性发生概况[J]. 应用昆虫学报, 1991(2):120-121.
[11]Ahuja I, Rohloff J, Bones AM. Defence mechanisms of Brassicaceae:implications for plant-insect interactions and potential for integrated pest management. A review[J]. Agronomy for Sustainable Development, 2010, 30(2):311-348.
[12]龚坤元, 张桂林, 翟桂荣. 棉蚜对“1059”抗药性的测定[J].昆虫学报, 1964, 13(1):1-9.
[13]Liu N, Zhu F, Xu Q, et al. Behavioral change, physiological modification, and metabolic detoxification:mechanisms of insecticide resistance[J]. Acta Entomologica Sinica, 2006, 49:671-679.
[14]Delorme R, Augé D, Béthenod MT, et al. Insecticide resistance in a strain of Aphis gossypii from Southern France[J]. Pesticide Science, 1997, 49(1):90-96.
[15]Silver ARJ, Emden HFV, Battersby M. A biochemical mechanism of resistance to pirimicarb in two glasshouse clones of Aphis gossypii[J]. Pest Management Science, 1995, 43(1):21-29.
[16]Moores GD, Gao X, Denholm I, et al. Characterisation of insensitive acetylcholinesterase in insecticide-resistant Cotton Aphids, Aphis gossypii glover(Homoptera:Aphididae)[J]. Pesticide Biochemistry & Physiology, 1996, 56(2):102-110.
[17]Gong YH, Yu XR, Shang QL, et al. Oral delivery mediated RNA interference of a carboxylesterase gene results in reduced resistance to organophosphorus insecticides in the cotton Aphid, Aphis gossypii Glover[J]. PLoS One, 2014, 9(8):e102823.
[18]吕敏, 孙婳婳, 王丽红, 等. 植物次生物质对棉蚜谷胱甘肽S-转移酶和羧酸酯酶活性的诱导作用[J]. 中国农学通报, 2012, 28(3):253-256.
[19]Scott JG. Cytochromes P450 and insecticide resistance[J]. Insect Biochemistry & Molecular Biology, 1999, 29(9):757-777.
[20]Vontas J, Blass C, Koutsos AC, et al. Gene expression in insecticide resistant and susceptible Anopheles gambiae strains constitutively or after insecticide exposure[J]. Insect Molecular Biology, 2005, 14(5):509-521.
[21]Puinean AM, Foster SP, Oliphant L, et al. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphid Myzus persicae[J]. PLoS Genetics, 2010, 6(6):e1000999.
[22]Kalajdzic P, Markaki M, Oehler S, et al. Imidacloprid does not induce cyp genes involved in insecticide resistance of a mutant Drosophila melanogaster line[J]. Food & Chemical Toxicology, 2013, 60(10):355-359.
[23]郭天凤, 史雪岩, 高希武, 等. 棉蚜吡虫啉、啶虫脒不同品系解毒酶活性测定和增效剂作用的研究[J]. 环境昆虫学报, 2014, 36(3):388-394.
[24]Peng T, Pan Y, Yang C, et al. Over-expression of CYP6A2, is associated with spirotetramat resistance and cross-resistance in the resistant strain of Aphis gossypii, Glover[J]. Pesticide Biochemistry & Physiology, 2015, 126:64-69.
[25]Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 2015, 72(1-2):248-254.
[26]GRTB. Immunology—A short course(2nd edition):Editors. E Benjamini and S Leskowitz[M]. New York:Wiley-Liss, 1991:459pp.
[27]黄丽娜, 程婷婷, 王新绘, 等. 棉铃虫β-actin基因的克隆、表达及多克隆抗体制备[J]. 生物技术通报, 2015, 31(12):138-145.
[28]魏原杰, 张雷, 程婷婷, 等. 棉铃虫细胞色素P450 CYP6B6多克隆抗体的制备[J]. 生命科学研究, 2015(6):497-500.
[29]Chang GD, Li ZL, Qin JY, et al. Optimization of fermentation of recombinant human Endostatin(rh-Endostatin)expression in Escherichia coli[J]. Chinese Journal of Biotechnology, 2005, 21(4):662-666.
[30]李东江, 郑颖, 叶锋平, 等. 蛇毒类凝血酶基因大肠杆菌和酵母细胞表达条件的优化[J]. 西南国防医药, 2010, 20(6):670-672.
[31]于殿宇, 罗淑年, 王瑾, 等. 海藻酸钠-明胶固定化磷脂酶的研究[J]. 食品工业, 2008(3):9-11.
[32] 刘玉素. 棉蚜腹管的组织构造和几个关于腹管功能的试验[J].动物学报, 1956, 8(1):17-28.
(责任编辑 马鑫)
Isolation and Purification of His-CYP6J1 Fusion Protein from Aphis gossypii and Preparation of Its Polyclonal Antibody
WANG Ya-mei WEI Yuan-jie AI Xin-yu LIU Xiao-ning
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumuqi 830046)
This work aims to purify His-CYP6J1 fusion protein through affinity chromatography,and prepare and identify its polyclonal antibody. The fusion protein was purified by Ni-NTA chelating column,the purified product was detected by SDS-PAGE. Then the acquired fusion protein His-CYP6J1 was used to immune mice for preparing its polyclonal antibody against Aphis gossypii. Finally,ELISA was used to test antibody’s titer,and immunohistochemistry to identify its specificity. As results,antiserum titer was 1:200 000,the polyclonal antibody specifically bound to natural P450 CYP6J1 protein from A. gossypii,but not to the one from cotton bollworm. These results provide a foundation for studying the structure and function of a single P450 protein and its role in the insecticide- resistance of A. gossypii.
P450 CYP6J1 fusion protein;protein purification;polyclonal antibody
10.13560/j.cnki.biotech.bull.1985.2016-0920
2016-10-09
自治区青年科技创新人才培养工程项目(qn2015yx001),NSFC-新疆联合项目(U1603331)
王亚美,女,硕士研究生,研究方向:生化与分子生物学;E-mail:wangyamei0114@sina.com
刘小宁,女,博士,研究方向:农业昆虫与害虫防治;E-mail:liuxn0103@sina.com
