一氧化氮(NO)对镉胁迫下小麦幼苗氧化损伤的影响
2017-05-19马晓丽冀瑞萍田保华霍建新
马晓丽冀瑞萍田保华霍建新
(1. 晋中学院生物科学与技术学院,晋中 030600;2. 山西大学生命科学学院,太原 030006)
一氧化氮(NO)对镉胁迫下小麦幼苗氧化损伤的影响
马晓丽1冀瑞萍1田保华2霍建新1
(1. 晋中学院生物科学与技术学院,晋中 030600;2. 山西大学生命科学学院,太原 030006)
为探讨一氧化氮(NO)对重金属镉胁迫后小麦幼苗氧化损伤的影响。采用营养液水培法,以“晋麦8号”为材料,一氧化氮供体硝普钠(SNP),NO清除剂牛血红蛋白(Hb)及SNP类似物亚铁氰化钠(SF)分别处理小麦幼苗,研究NO在镉(Cd)胁迫下对小麦幼苗抗氧化系统的影响。结果显示,SNP处理可以缓解镉胁迫对幼苗生长抑制,显著增加可溶性蛋白、叶绿素和GSH含量,减少丙二醛(MDA)和过氧化氢(H2O2)的含量,并降低超氧阴离子(O2·-)产生速率、可溶性糖和脯氨酸的积累。而NO清除剂牛血红蛋白(Hb)处理使镉胁迫对小麦幼苗的毒害增强,SNP类似物亚铁氰化钠(SF)处理则没有缓解效应;进一步实验发现,SNP降低了镉胁迫下超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)等抗氧化相关酶的活性,减轻了镉胁迫的氧化损伤。NO可以通过调节抗氧化酶系统来缓解Cd对植物的毒害。
小麦幼苗;镉胁迫;一氧化氮;氧化损伤
重金属镉(Cadmium,Cd)是植物非必需元素,具有高的毒性和移动性。随着工业和农业生产,农田土壤受Cd污染越来越严重[1]。生长在Cd污染土壤中的作物,积累的Cd通过食物链进入人体,进而危害人类健康。镉可导致植物细胞中活性氧产生、扰乱抗氧化系统、破坏光合作用、影响营养元素的吸收和运输,最终致使作物品质和产量下降[2,3]。而植物本身可通过提高抗氧化系统酶活性、增加抗氧化剂产生、调节蛋白质水解、促进脯氨酸积累,提高色素含量,改善光合作用等途径[4],减轻镉胁迫的伤害。
一氧化氮(Nitric oxide,NO)是一种广泛分布于生物体内的小分子信号物质。近年来的研究发现NO参与植物生长发育[5]和响应非生物胁迫[6,7]等生理过程。用0.1 mmol/L硝普钠(Sodium nitroprusside,SNP)浸种能显著提高超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,降低由NaCl处理引起的小麦氧化损伤[8]。在干旱条件下NO对小麦幼苗叶片的Ps II功能具有调节作用[9]。邱宗波等[10]发现微波预处理可防护镉胁迫损伤小麦幼苗,其主要是通过NO起作用。在镉胁迫下,NO还可增强水稻(Oryza sativa L. cv.)、小麦(T. aestivum L.)、大麦(Hordeum vulgare L.)、苜蓿(Medicago truncatula)、大豆(Glycine max L.)等幼苗的耐受性,且不同作物的缓解机制存在较大差异[11,12]。本研究在实验条件下,以小麦幼苗为材料,采用NO外源供体SNP、SNP类似物亚铁氰化钠(Sodium Ferrocyanide,SF)、NO特异清除剂牛血红蛋白(Hemoglobin Bovine,Hb)处理镉胁迫下的小麦幼苗,研究NO对镉诱导的氧化损伤的缓解效应,以期探讨NO响应镉胁迫的生理机制。
1 材料与方法
1.1 材料
晋麦8号(Triticum aestivum,Jinmai 8),由山西省农科院小麦研究所提供。NO和Cd2+的供体及适宜浓度已由预备试验完成:CdCl2提供Cd2+;硝普钠([Na2Fe(CN)5]NO,SNP,Sigma公司)提供NO,4℃避光保存,现配200 μmol/L的母液,再按所需浓度稀释现用;牛血红蛋白(Hb,Sigma公司)为NO的清除剂。
1.2 方法
1.2.1 试验设计 试验在山西大学温室内进行。选取籽粒饱满,大小均匀的小麦种子,经0.1% HgCl2表面消毒后,培养于盛有湿滤纸的培养皿内,30粒/盘,25℃催芽。种子露白时,转移至光照培养室(生长条件光照16 h/d,光通量密度400 μmol/(m·s)),25℃培养,相对湿度60%,每3 d浇灌1次1/2 Hoagland营养液。生长20 d后,挑选长势基本一致的幼苗洗净转入装有1/2 Hoagland营养液的水培盆中预培养,预培养3 d后开始处理。试验设置7种处理:(1)CK(1/2 Hoagland营养液);(2)SNP(1/2 Hoagland营 养 液+100 μmol/L SNP);(3)Cd(1/2 Hoagland营养液+100 μmol/L CdCl2);(4)Cd+SNP(1/2 Hoagland营养液+100 μmol/L CdCl2+100 μmol/L SNP);(5)Cd+SF(1/2 Hoagland营养液+100 μmol/L CdCl2+100 μmol/L亚铁氰化钠);(6)Cd+Hb(1/2 Hoagland营养液+100 μmol/L-CdCl2+0.1% Hb);(7)Cd+Hb+SNP(1/2 Hoagland营 养 液 +100 μmol/L CdCl2+0.1% Hb+100 μmol/L SNP)。各处理重复3次,为保证处理浓度稳定,每隔2 d更换一次处理液,间歇通入空气。处理7 d后,取相同节位的叶片用于分析测定。
1.2.2 测定项目与方法
1.2.2.1 株高测定 取不同处理长势一致的20株小麦幼苗,用直尺测量小麦幼苗株高(cm)。
1.2.2.2 有机物质生理指标的测定 参考张志良等[13]的方法略作改进测定可溶性糖含量,采用紫外吸收法测定可溶性蛋白含量[14],脯氨酸含量和叶绿素含量的测定采用李合生等[15]的方法进行。
1.2.2.3 膜质过氧化产物含量和自由基含量的测定 硫代巴比妥酸法测定丙二醛(Malondialdehyde,MDA)含量[14],过氧化氢(Hydrogen peroxide,H2O2)含量测定采用Velikova等[16]的方法,超氧阴离子产生速率测定参考王爱国等[17]的方法。
1.2.2.4 抗氧化酶活性测定 提取小麦幼苗叶片的粗酶液,5 000 r/min离心3 min,取上清液测定超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)酶活参照Velikova等的方法[16];谷胱甘肽还原酶(Glutathione reductase,GR)活性测定参照Brennan等的方法[17]。还原型谷胱甘肽(Reduced glutathion,GSH)含量测定[18]。
1.2.3 数据处理 所有数据均采用3个生物学重复的平均值,差异显著性分析采用SPSS 13.0(IBM,New York,USA)软件进行t检验,然后用SigmaPlot10.0(Systat Software Inc.,London,UK)软件进行绘图。
2 结果
2.1 NO对镉胁迫下小麦幼苗株高的影响
图1显示,与CK相比,镉胁迫抑制小麦幼苗生长,株高降低41.0%(P<0.01);SNP+Cd处理缓解了镉胁迫对幼苗生长的抑制,株高只降低13.7%(P<0.05),Hb+Cd处理显著抑制了小麦幼苗的生长,株高降低45.7%(P<0.01)。与SNP+Cd相比,SNP+Hb+Cd处理的SNP缓解作用被Hb抑制,具有显著差异(P<0.05);而SF+Cd处理没有缓解作用。
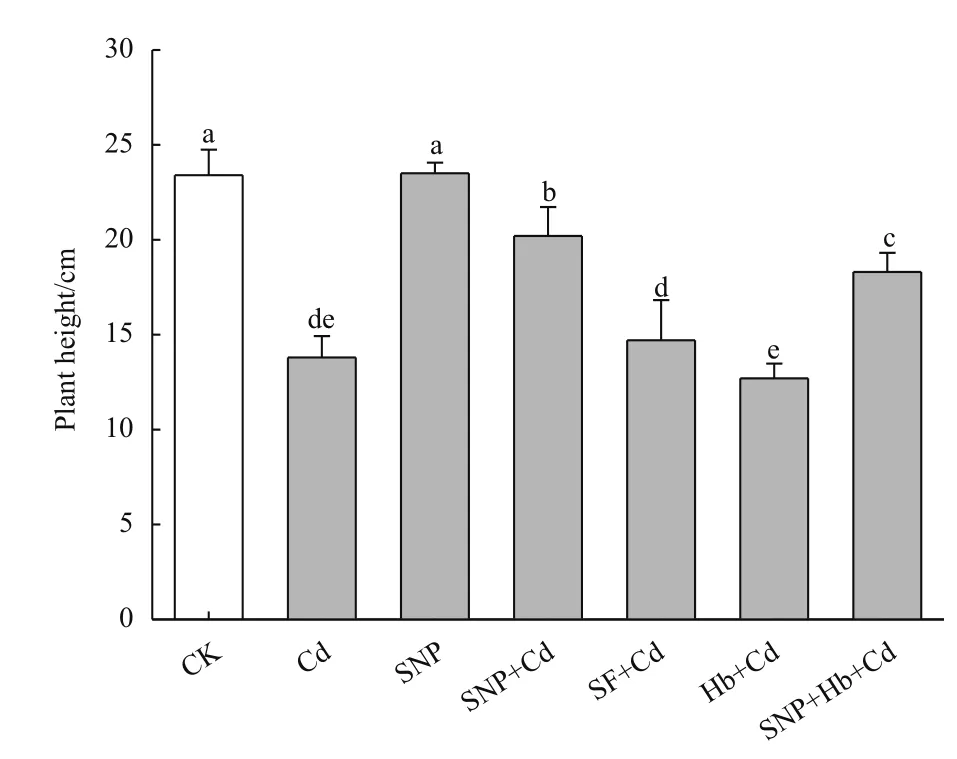
图1 NO对镉胁迫下小麦幼苗株高的影响
2.2 NO对镉胁迫下小麦幼苗有机物质含量的影响
镉胁迫下小麦幼苗脯氨酸和可溶性糖含量分别比CK增加1.6倍和38.8%,可溶性蛋白和叶绿素含量分别降低28.9%和17.3%。与Cd相比,SNP+Cd处理使可溶性蛋白和叶绿素含量升高,游离氨基酸和可溶性糖含量降低;Hb+Cd处理进一步显著提高脯氨酸和可溶性糖含量(P<0.05),降低了可溶性蛋白和叶绿素含量(P<0.05)。与SNP+Cd相比,SNP+Hb+Cd处理使脯氨酸增加17.5%,可溶性糖含量升高8.6%,可溶性蛋白减少5.4%,叶绿素含量降低7.8%,Hb抑制SNP的作用。而亚铁氰化钠处理使小麦幼苗中可溶性糖、可溶性蛋白、脯氨酸和叶绿素含量与镉处理无显著差异(P>0.05)(图2)。
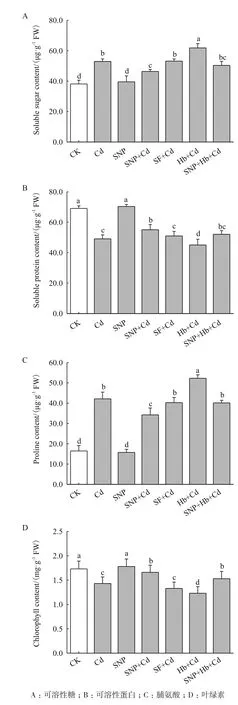
图2 NO对镉胁迫下小麦幼苗有机物质含量的影响
2.3 NO对镉胁迫下小麦幼苗膜质过氧化产物和自由基含量的影响
镉胁迫下小麦幼苗叶片中MDA和H2O2的含量及O2·-产生速率显著增加,叶片中MDA和H2O2含量及O2·-产生速率分别比CK增加65.7%、62.2%和31.2%,且差异显著(P<0.05)。与Cd相比,SNP+Cd处理降低了MDA和H2O2含量及O2·-产生速率(P<0.05)。镉胁迫下,添加NO清除剂Hb处理使MDA和H2O2含量和O2·-产生速率增加,Hb处理下添加SNP则减少了MDA和H2O2的含量及降低O2·-产生速率。与SNP+Cd处理相比,亚铁氰化钠+Cd处理的幼苗中MDA和H2O2含量和O2·-产生速率显著增加(P<0.05)(图3)。
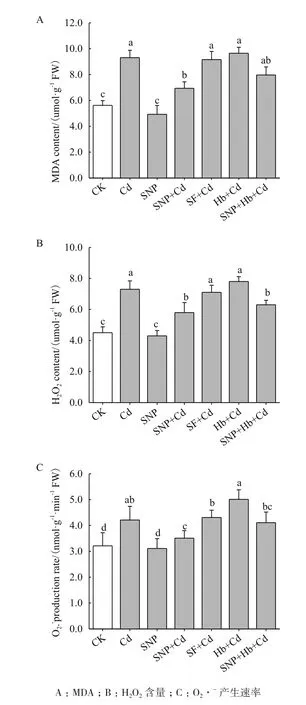
图3 NO对镉胁迫下小麦幼苗膜质过氧化产物和自由基含量的影响
2.4 NO对镉胁迫下小麦幼苗抗氧化系统的影响
与CK相比,镉胁迫处理降低了小麦幼苗叶片中CAT和APX活性,而SOD和GR活性显著提高,GSH含量显著增加。与Cd相比,SNP+Cd处理使CAT、APX和GR活性显著升高,分别升高26.1%、12.6%和97.3%,GSH含量提高1.43倍(P<0.05),而SOD活性降低30%。Hb+Cd处理的SOD、CAT和APX活性与Cd处理比无显著差异(P>0.05),而GR活性仅为Cd的83.8%(P<0.05),GSH含量降低3.1%。添加SNP可缓解了Hb+Cd处理对SOD、APX、GR活性的影响。亚铁氰化钠对镉胁迫下小麦幼苗叶片SOD、CAT、APX和GR活性与Cd处理无显著差异(P>0.05)(表1)。
3 讨论
在生理条件下,细胞间活性氧(ROS)水平和NO的产生是平衡的,它们可促进下游信号或翻译后修饰。在镉胁迫的植物的细胞水平上,氧化应激增加体内ROS积累,从而干扰了酶与非酶的抗氧化系统;同时也扰乱了NO合成的水平,进而导致ROS/NO的不平衡[19]。研究发现不同的NO供体可用来模拟植物体中内源NO的响应[20]。目前,NO供体包括SNP、S-亚硝基谷胱甘肽(Nitrosoglutathione,GSNO)、S-亚硝基-N-乙酰-D-青霉胺(S-nitroso-N-acetyl-D-penicillamine,SNAP)[20]和亚硝酰乙二胺四乙钌(II)(Nitrosyl ethylenediaminetetraacetate ruthenium(II),[Ru(NO)(Hedta)])[21]等。Floryszak-Wieczorek等[20]研 究 发 现SNP、GSNO和SNAP的半衰期分别为12、7和3 h,且SNP是最适的光敏感NO供体。Osti等用SNP和[Ru(NO)(Hedta)]分别处理巴西松(Araucaria angustifolia)胚胎悬浮细胞21 d后,细胞内源NO水平都升高且SNP处理的NO含量显著高于[Ru(NO)(Hedta)]处理[21]。同时,SNP广泛地当作NO供体来增强黑麦草[22]、小麦[8,9,23]和苜蓿[24]等植物对非生物胁迫的耐受性。本研究发现外源100 μmol·L-1SNP显著减少镉胁迫下幼苗体内H2O2含量和降低O2·-产生速率,同时增强CAT、GR和APX活性,降低SOD活性。与本研究结果类似,刘建新等[22]发现,外源150 μmol/L SNP显著促进镉胁迫下黑麦草幼苗根系和叶片中CAT活性,从而降低H2O2含量及O2·-产生速率。25和100 μmol/L SNP诱导Pb胁迫下小麦幼苗叶片中CAT的活性[23];100 μmol/L SNP显著增强紫花苜蓿幼苗SOD活性,增强叶和茎中GR活性,而显著降低根中GR活性[24]。
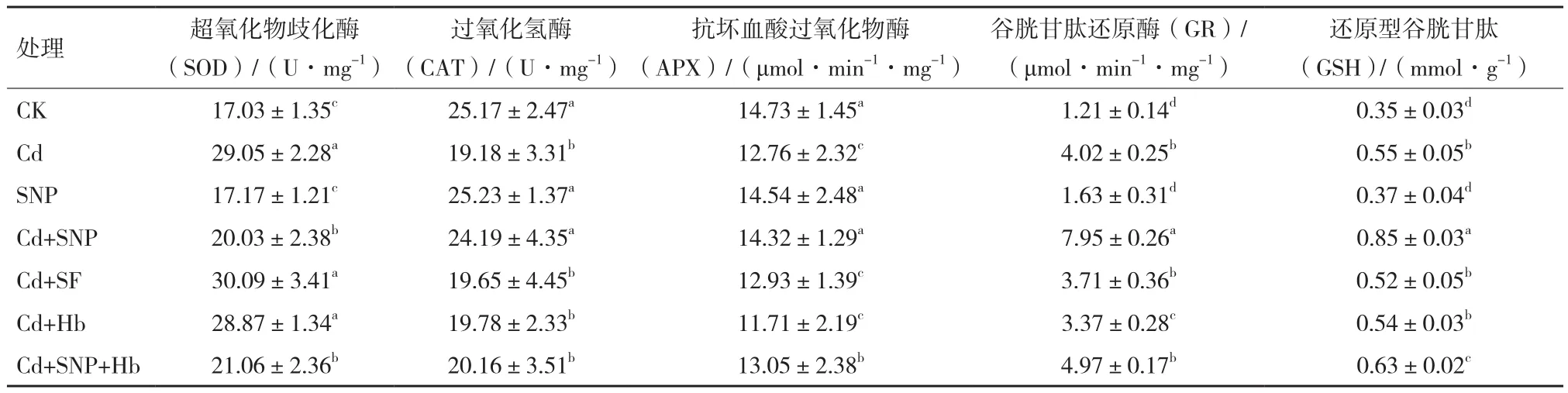
表1 NO对镉胁迫下小麦幼苗抗氧化系统活性的影响
在植物细胞中,Cd可以结合含硫残基的化合物,如GSH、MTs和PCs[4]。其中,GSH具有直接清除ROS的能力,本研究发现100 μmol/L SNP处理使镉胁迫下的小麦幼苗GR活性及GSH含量显著上升,减少MDA和H2O2含量及降低O2·-产生速率。陈银萍等也发现不同浓度SNP处理也能增强镉胁迫下紫花苜蓿(Medicogo sativa L.)幼苗GR活性[24]。NO还可以通过蛋白质的硝基化和巯基亚硝基化来发挥生理功能[25]。在拟南芥中,血红蛋白(Hb1)、S-腺苷甲硫氨酸合成酶(SAMS1)、半胱氨酸蛋白酶9(Mc9)、三磷酸甘油醛脱氢酶(GAPDH)、水杨酸结合蛋白3(SABP3)、甘氨酸脱羧酶复合物(GDC)和NADPH氧化酶等蛋白被证实NO可对其进行巯基亚硝基化修饰,进而抑制这些蛋白的活性[25]。蛋白硝基化研究显示在向日葵下胚轴[26]和水稻[27]中的GR蛋白分别为酪氨酸硝基化和巯基亚硝基化的靶点。然而,Begara-Morales研究发现ONOO-和GSNO可抑制豌豆的单脱水抗坏血酸还原酶(Monodehydroascorbate reductase,MDAR)的活性,而对叶绿体和胞质中的GR无影响,进而维持胞内还原型GSH的平衡[28]。Innocenti等[29]发现NO处理可以上调蒺藜苜蓿根(Medicago truncatula)中谷胱甘肽合成酶编码基因(gshs)的表达,表明NO忙于GSH合成相关基因表达的调控。由此可知,NO可以调控体内GSH水平的变化,来解毒重金属Cd的毒性,从而增强植株抵抗氧化胁迫。
SNP释放的NO作为信号分子,一方面能直接调节ROS代谢,但不同物种之间NO对抗氧化酶活性调节存在差异,这可能与NO在信号传导过程中不同的酶所在的位置有关。现已知NO可直接作用于抗氧化酶类中血红素铁结合来改变活性[24,30]。另一方面NO通过信号网络来调节响应机制,如其他信号分子H2S、H2O2、SA、JA等[19],一起协同作用来调节抗氧化酶类蛋白。
4 结论
NO增强小麦耐受镉胁迫,主要表现在可溶性蛋白、叶绿素和GSH含量的增加,MDA和H2O2含量的减少,O2·-产生速率的降低,可溶性糖和脯氨酸积累的减少。在镉胁迫下,NO可调节超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)等抗氧化酶类的活性,来缓解Cd对小麦的氧化损伤。
[1]曾希柏, 李莲芳, 梅旭荣. 中国蔬菜土壤重金属含量和来源分析[J]. 中国农业科学, 2007, 40(11):2507-2517.
[2] Smeets K, Cuypers A, Lambrechts A. Induction of oxidative stress andantioxidative mechanisms in Phaseolus vulgaris after Cd application[J]. Plant Physiol Biochemi, 2005, 43(5):437- 444.
[3]Zhang GP, et al. Influence of cadmium on mineral concentrations and yield components in wheat genotypes differing in Cd tolerance at seedling stage[J]. Field Crops Research, 2002, 77(2):93-98.
[4]Gill SS, Tuteja N. Cadmium stress tolerance in crop plants:probing the role of sulfur[J]. Plant Signal Behav, 2011, 6(2):215-222.
[5]Sirovfi J, et al. The role of nitric oxide in the germination of plant seeds and pollen[J]. Plant Sci, 2011, 181(5):560-572.
[6]Fancy NN, Bahlmann AK, Loake GJ. Nitric oxide function in plant abiotic stress[J]. Plant, Cell & Environ, 2016, 2(2):343-353.
[7]Shi HT, Li RJ, Cai W, et al. In vivo role of nitric oxide in plant response to abiotic and biotic stress[J]. Plant Signal Behav, 2012, 7(3):437-439.
[8]郑春芳, 姜东, 戴廷波, 等. 外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响[J]. 生态学报, 2010, 30(5):1174-1183.
[9] 邵瑞鑫, 信龙飞, 杨青华, 等. NO对干旱条件下小麦幼苗PSⅡ功能特性的调节效应[J]. 作物学报, 2012(9):1710-1715.
[10]邱宗波, 张曼曼, 等. 一氧化氮在微波预处理提高小麦幼苗抗镉胁迫中的作用[J]. 生态学杂志, 2013, 2(7):1794-1799 .
[11]Gill SS, Hasanuzzaman M, Nahar K, et al. Importance of nitric oxide in cadmium stress tolerance in crop plants[J]. Plant Physiol Biochem, 2013, 63:254-261.
[12]He H, He L, Gu M. The diversity of nitric oxide function in plant responses to metal stress[J]. Biometals, 2014, 2:219-228.
[13]张志良, 翟伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社, 2003:39-41.
[14]邹琦. 植物生理学实验指导[M]. 北京:中国农业出版社, 2006.
[15]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000:164-165.
[16]Velikova V, Yordanov I, Edreva A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants[J]. Plant Science, 2000, 151(1):59-66.
[17]Brennan T, Frenkel C. Involvement of hydrogen peroxide in the regulation of senescence in pear[J]. Plant Physiology, 1977, 59(3):411-416.
[18]Shen J, Xing T, Yuan H, et al. Hydrogen sulfide improves drought tolerance in Arabidopsis thaliana by microRNA expressions[J]. PLoS One, 2013, 8(10):e77047.
[19]Arasimowicz-Jelonek M, et al. The message of nitric oxide in cadmium challenged plants[J]. Plant Sci, 2011, 181(3):612-620.
[20]Floryszak-Wieczorek J, Milczarek G, Arasimowicz M, et al. Do nitric oxide donors mimic endogenous no-related response in plants?[J]. Planta, 2006, 224(6):1363-1372.
[21]Osti RZD, Andrade JBDR, Souza JPD, et al. Nitrosyl ethylenediaminetetraacetate ruthenium(ii)complex promotes cellular growth and could be used as nitric oxide donor in plants[J]. Plant Science, 2010, 178(5):448-453.
[22]刘建新, 胡浩斌, 王鑫. 外源一氧化氮供体对镉胁迫下黑麦草幼苗活性氧代谢、光合作用和叶黄素循环的影响[J]. 环境科学学报, 2009, 29(3):626-633.
[23]魏学玲, 等. 外源一氧化氮对Pb胁迫下小麦种子萌发及幼苗生理特性的影响[J]. 植物研究, 2011, 31(1):34-39.
[24]陈银萍, 蘧苗苗, 苏向楠, 等. 外源一氧化氮对镉胁迫下紫花苜蓿幼苗活性氧代谢和镉积累的影响[J]. 农业环境科学学报, 2015, 34(12):2261-2271.
[25]Kuruthukulangarakoola GT, Lindermayr C. Regulation and function of protein S-Nitrosylation in plant Stress[M]// Stress Signaling in Plants:Genomics and Proteomics Perspective, 2013, 1:123-148.
[26]Chaki M, Valderrama R, Fernández-Ocaña AM, et al. Protein targets of tyrosine nitration in sunflower(Helianthus annuus L.)hypocotyls[J]. J Exp Bot, 2009, 60(15):4221-4234.
[27]Lin AH, Wang YQ, Tang JY, et al. Nitric oxide and protein s-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice[J]. Plant Physiology, 2012, 158(1):451-64.
[28]Begara-Morales JC, et al. Differential molecular response of monodehydroascorbate reductase and glutathione reductase by nitration and s-nitrosylation[J]. J Exp Bot, 2015, 66(19):5983-5996.
[29]Innocenti G, Pucciariello C, Le Geuher M, et al. Glutathione synthesis is regulated by nitric oxide in Medicago truncatula roots[J]. Planta, 2007, 225(6):1597-1602.
[30]Correa-Aragunde N, Foresi N, Lamattina L. Nitric oxide is a ubiquitous signal for maintaining redox balance in plant cells:regulation of ascorbate peroxidase as a case study[J]. J Exp Bot, 2015, 66(10):2913-2921.
(责任编辑 马鑫)
Effects of Nitric Oxide on Oxidative Damage Metabolism in Wheat Seedling Under Cadmium Stress
MA Xiao-li1JI Rui-ping1TIAN Bao-hua2HUO Jian-xin1
(1. College of Life Science,Jinzhong University,Jinzhong 030600;2. College of Life Science,Shanxi University,Taiyuan 030006)
This study is to further study the response mechanism of nitric oxide gas signal on oxidative damage of wheat seedlings under cadmium(Cd)stress. Through nutrient solution cultivation,Triticum aestivum ‘Jinmai 8’ was selected as the plant material,and nitric oxide(NO)-donor sodium nitroprusside(SNP),NO-scavenger haemoglobin(Hb),and sodium ferrocyanide(SNP analogue)were used to investigate the effects of NO on oxidative damage metabolism in seedlings under Cd stress. The results showed that SNP alleviated the growth inhibition in wheat seedlings,significantly increased the contents of soluble protein,chlorophyll and glutathion,decreased the contents of malondiadehyde(MDA)and hydrogen peroxide(H2O2),as well as the production of O2·-,and the accumulations of soluble sugar and proline. However,the NO-scavenger hemoglobin treatment increased the toxicity of Cd stress to wheat seedlings,and the SNP analogue treatment presented no effect. Meanwhile,SNP decreased the activities of superoxide dismutase(SOD),catalase(CAT),glutathione reductase(GR)and ascorbate peroxidase(APX),which eliminated the oxidative damage under Cd stress. Conclusively,NO alleviates Cddamage by regulating the antioxidase system.
wheat seedlings;cadmium stress;nitric oxide;oxidative damage
10.13560/j.cnki.biotech.bull.1985.2017.05.015
2016-09-20
国家自然科学基金项目(31501772),山西省高等学校科技创新基金项目(20101129)
马晓丽,女,副教授,博士研究生,研究方向:细胞生物学;E-mail:mxl425@126.com
