利用放线菌酮提高黄素单氧化酶FMOGS-OX1亚细胞定位的准确性
2017-05-19夏洪宇孔稳稳徐蕊苍炜李晶
夏洪宇 孔稳稳 徐蕊 苍炜 李晶
(东北农业大学,哈尔滨 150030)
利用放线菌酮提高黄素单氧化酶FMO亚细胞定位的准确性
夏洪宇 孔稳稳 徐蕊 苍炜 李晶
(东北农业大学,哈尔滨 150030)
研究蛋白质亚细胞定位的常规方法是构建由35S启动子驱动目的基因与绿色荧光蛋白基因(GFP)融合的表达载体,在细胞中瞬时或稳定表达来确定该蛋白质在细胞中的定位。35S启动子的优势是能够获得较强的GFP信号,但同时也可能因为蛋白质合成量过大,导致部分蛋白滞留在运输途径中或出现在其真实定位以外的区域。为了解决这一问题,以模式植物拟南芥中黄素单氧化酶FMOGS-OX1为例,利用蛋白质抑制剂放线菌酮处理过量表达FMOGS-OX1-GFP融合蛋白的烟草叶片。结果表明:未经放线菌酮处理的烟草叶片表皮细胞,细胞质和内质网中均呈现了较强的荧光信号,放线菌酮处理后,内质网上的信号消失,而细胞质则呈现出稳定的信号,因此判断FMOGS-OX1合成后可能是经过内质网运输到细胞质中的。上述结果证明适当的放线菌酮处理,能够避免强启动子驱动报告基因造成的蛋白质合成过量的问题,可有效地提高蛋白质亚细胞定位的准确性。
GFP;FMOGS-OX1;亚细胞定位;放线菌酮;内质网
绿色荧光蛋白(Green fluorescent protein,GFP)是一种发现于水母、珊瑚等动物体内的生物发光蛋白。当绿色荧光蛋白与生物有机体蛋白相融合时,能够保持原有活性,其发光能力不受到影响,在荧光显微镜下可以清晰地观测到融合蛋白的定位、运动和活性等情况[1]。由于GFP自发的荧光较为稳定,观察具有容易操作、灵敏度高等优点,所以GFP作为报告基因已经被广泛地应用于基因表达的组织定位及蛋白质的亚细胞定位研究中。GFP能够在不破坏细胞和化学染色的情况下直接成像,也可用于活体实时定位和动态的研究[2,3],基于上述原因GFP逐渐成为分子生物学和细胞生物学研究中的一种重要技术工具[4-7]。尽管GFP荧光蛋白的检测有很多优点,但它并不能像酶一样能将底物无限加工而使荧光信号放大,GFP在转基因细胞中要有一定的转录本和转录后修饰才能产生成熟的GFP并适量积累才能观测到细胞中的荧光信号。如果使用基因的内源启动子可能出现荧光信号水平过低而难以检测的问题,因此通常采用强启动子来驱动GFP融合基因的强烈表达[8,9]。但由于GFP蛋白合成量过大,有时会导致部分蛋白滞留在运输途径中(如内质网或运输囊泡中)或超出内源蛋白质的真实定位范围,对蛋白质的准确定位造成混淆。
放线菌酮(Cycloheximide,CHX)是从灰色链霉菌中分离出来的一种化合物,对真核生物蛋白质的合成具有显著的抑制作用,它可作用于80S核糖体,能够干扰蛋白质合成过程中tRNA的移位因而阻碍翻译过程[10,11]。由于放线菌酮能够特异性地抑制新蛋白质的合成而不影响已经合成的蛋白在细胞内的运输,因此常作为蛋白质翻译过程的有效抑制剂,应用于蛋白的表达、细胞凋亡机制等代谢调控方面的研究,并在农学、医学、药学和分子生物学等研究领域中得到了广泛的应用[12,13]。
本研究以黄素单氧化酶(Flavin-containing monooxygenase,FMOGS-OX1)的亚细胞定位研究为例,用放线菌酮处理过量表达FMOGS-OX1基因的烟草表皮细胞,控制FMOGS-OX1的产量,从而获得了FMOGS-OX1的准确定位。芥子油苷是一种存在于十字花科植物中与植物生物胁迫抗性密切相关的次生代谢产物,FMOGS-OX1是芥子油苷合成途径中的重要侧链修饰酶,这种侧链结构的修饰对芥子油苷的生物活性有很大的影响[14,15]。本研究讨论了放线菌酮在植物蛋白质亚细胞定位研究中的应用,旨为提高蛋白质亚细胞定位的准确性提供技术方法上的参考数据。
1 材料与方法
1.1 材料
1.1.1 植物材料 以拟南芥(Arabidopsis thaliana)和烟草(Nicotiana benthamiana)作为实验材料。植物生长在温度为20℃,相对湿度为70%,光合通量为100 μ Ei的植物培养箱中,16 h/8 h光/暗周期条件下培养。
1.1.2 菌株及试剂 大肠杆菌DH5α、农杆菌LBA4404、pCAMBIA 2300-35S-C-GFP载体由本实验室提供、胶回收试剂盒、iScript cDNA合成试剂盒、DNA Marker DL2000、dNTP、Hotmaster Taq、DNA Ploymerase等购自TAKARA试剂公司。
1.2 方法
1.2.1 RNA提取与cDNA合成 选取拟南芥幼嫩的叶片提取总RNA,参照Trizol法提取,DNA酶Ⅰ处理后以备用。将提取好的RNA反转录成cDNA,cDNA合成具体方法参考 iScript cDNA合成试剂盒。
1.2.2 植物表达载体的构建 构建植物表达载体35S∶FMOGS-OX1-GFP,以上述获得的cDNA为模板进行PCR扩增,采用特异性引物5'-GGCTTA AUATGGCACCAACTCAAAACA-CAATC-3'和5'-GGTTTAAUT GATTC GAGGAAATA-AGA AG-3'克隆FMOGS-OX1基因的CDS序列。PCR反应体系参照Hotmaster Taq说明书。将FMOGS-OX1基因的编码区无终止密码子的片段,采用USER法[16]克隆到pCAMBIA 2300-35S-C-GFP载体上,构建过量表达FMOGS-OX1和GFP融合基因的植物表达载体35S∶FMO GS-OX1-GFP,将连接好的产物转入到大肠杆菌感受态细胞中,涂布于含有卡那霉素的LB培养基中筛选,挑取阳性单克隆菌落PCR鉴定并送去测序,将测序正确的质粒用于后续研究。
1.2.3 农杆菌法转化烟草叶片 采用CaCl2法制备农杆菌LBA4404 感受态细胞,取1 μL 35S∶FMOGSOX1-GFP质粒加入农杆菌感受态菌液中,冻融法进行转化。挑取农杆菌单菌落分别置于含有卡那霉素、链霉素和利福平的YEB液体培养基中筛选,于摇床中28℃ 200 r/min振荡培养过夜,当菌液OD600约为0.6时3 000 r/min 离心10 min,弃上清液收集菌体,重悬于农杆菌接种缓冲液(4.8 g MES,5 mL1 mol/LMgCl2,乙酰丁香酮120 μm/L,pH值5.6)中,28℃活化3 h后,采用注射器吸入菌液1 mL,将菌液注入待测烟草叶片背面,轻轻的渗入叶片直到看到液体扩散,再侵染下一个叶片,具体实验方法参考农杆菌渗入法[17]。
1.2.4 蛋白合成抑制剂放线菌酮处理 放线菌酮作为一种蛋白合成抑制剂能够抑制蛋白的从头合成,实验采用5%放线菌酮处理转基因35S∶FMOGSOX1-GFP烟草叶片1 h、3 h、5 h后对比未处理的35S∶FMOGS-OX1-GFP叶片进行亚细胞定位结果进行分析。
1.2.5 GFP检测 采用农杆菌渗入法转化烟草叶片,5 d后检测叶片表皮细胞中的荧光信号。图像采用LeicaSP2型激光共聚焦显微镜×20(NA0.7)或×60(NA1.2)倍镜观察,对材料进行照相采集。在488 nm波长下,光电子倍增调到525-565 nm范围内检测GFP。为降低非特异性不规则噪声的影响,显微镜应用xy模式。在364-488 nm的不同光通道内,通过扫描采集图像获取连续的图片。显微镜数据处理采用Image J。
2 结果
2.1 基因克隆与表达载体构建
选取拟南芥幼嫩的叶片提取RNA,以反转录所获得的cDNA为模板,扩增得到FMOGS-OX1基因的CDS全长(图1),电泳结果显示PCR产物条带位置与目的片段的大小一致,且测序结果正确。将PCR产物克隆到pCAMBIA 2300-35S-C-GFP载体上(图2),转入大肠杆菌中,检测结果正确,表明35S∶FMOGS-OX1-GFP载体构建成功。检测正确的菌液提取质粒,并将质粒转入到农杆菌中,挑取单菌落进行PCR鉴定。鉴定结果与克隆的目的条带一致(图3),保留正确菌液以备烟草转化用。
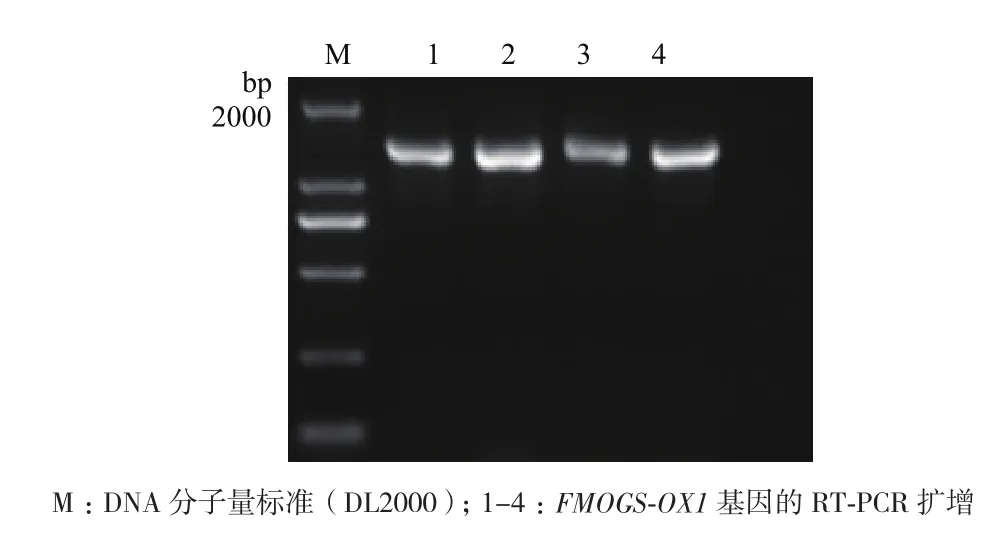
图1 FMOGS-OX1基因的扩增
2.2 FMOGS-OX1亚细胞定位的结果
采用农杆菌渗入法将菌液注入烟草叶片,5 d后取瞬时表达35S∶FMOGS-OX1-GFP 的烟草叶片,通过激光共聚焦显微镜进行表皮细胞的观察,发现荧光信号几乎充满了整个细胞,内质网的网状结构清晰可见(图4-B)。在这种情况下,由于荧光信号过于强烈,很难确定这些位置是否都是FMOGS-OX1行使功能的准确位置。为了降低荧光信号的强度,我们采用5%放线菌酮对转基因烟草叶片进行了不同长度时间(1 h、3 h和5 h)的处理。结果表明,经5%放线菌酮处理1 h后(图4-C),细胞内整体荧光信号显著减弱,内质网的结构仍然清晰可见,处理3 h 后(图4-D)荧光信号进一步减弱,内质网上的信号逐渐消失。由此我们推测内质网可能并不是FMOGS-OX1执行生理功能的最终位置,内质网可能只是负责FMOGS-OX1蛋白的修饰或运输。放线菌酮处理后,新蛋白质的合成受到了抑制,而滞留在内质网上的蛋白质经修饰被释放或运输到目的地,因而信号逐渐消失。当放线菌酮处理达到5 h时(图4-E),内质网上的荧光信号基本消失,而在细胞周边区域荧光信号显著加强,且随着处理时间的延长荧光信号强度和位置趋于稳定。
对放线菌酮处理5 h以上的35S∶FMOGS-OX1-GFP叶片表皮细胞进行高倍镜的观察发现(图4-F),荧光信号主要出现在细胞边缘位置,在细胞内部可以清晰观察到由于液泡的存在而形成的原生质索,因此这些荧光信号应该是来源于细胞质,在外围靠近细胞膜的区域荧光信号较强烈,可观察到一些颗粒状的信号中断(图4-G),很可能是悬浮于细胞质中的叶绿体等细胞器形成的。由于荧光信号没有呈现明显的细胞膜的轮廓,我们推断FMOGS-OX1应该特异性地存在于细胞质中,而且FMOGS-OX1在翻译以后很可能经过内质网的加工和修饰或是经由内质网运输释放到细胞质中行使生理功能。
3 讨论
在现代分子生物学研究中绿色荧光蛋白GFP已经成为一个非常重要的报告分子,能够作为活细胞探针用于亚细胞定位的研究。对转基因拟南芥、烟草等植物的研究表明,GFP对植物的生长发育不会产生毒害,因此采用GFP检测蛋白的表达可以适用于活体实时定位和动态研究[18-20]。一般通过构建目的基因与绿色荧光蛋白相融合的表达载体,对其进行过量表达,通过对GFP荧光信号的检测来分析该蛋白质在细胞内行使功能的位置[21]。为了研究FMOGS-OX1在细胞中行使功能的位置,我们构建了由CaMV35S启动子驱动FMOGS-OX1与GFP融合基因的植物表达载体35S∷FMOGS-OX1-GFP,在烟草(Nicotiana benthamiana)细胞中进行瞬时表达。对芥子油苷合成酶FMOGS-OX1进行亚细胞定位研究时发现,在整个细胞尤其是内质网及细胞质中检测到极强的GFP信号,我们推测很可能由于FMOGS-OX1被过量合成,导致部分蛋白滞留在合成、加工及转运的位置上,干扰了对FMOGS-OX1的准确定位。很难判断这些信号是否能代表FMOGS-OX1在细胞中执行功能的准确位置,为了获得FMOGS-OX1真实的定位信息,避免信号过强带来的困扰。我们采用放线菌酮对转35S∷FMOGS-OX1-GFP 的烟草叶片细胞进行了处理,研究结果表明,经放线菌酮的处理,发现适当浓度和时间的放线菌酮处理后,细胞中内质网上的GFP信号逐渐减弱并消失,最后只有细胞质中可持续检测到较强的GFP信号,证明FMOGS-OX1是在细胞质中行使功能的。我们推测FMOGS-OX1蛋白合成过程可能需要在内质网上进行修饰、浓缩等步骤,较强的GFP信号出现在内质网等亚细胞区域,可能是由于过量的蛋白质在运输到细胞质之前暂时滞留在内质网上,需要在内质网上进行运输,因此大量的荧光信号出现在内质网上。而经放线菌酮处理后,新蛋白质的合成受到了抑制,而内质网上的蛋白质被陆续运输至细胞质中,因而在细胞质中观察到了稳定的GFP信号。

图2 35S∶FMOGS-OX1-GFP植物表达载体构建示意图
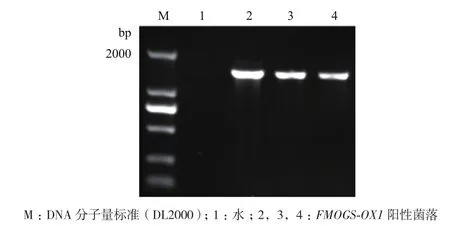
图3 35S∶FMOGS-OX1-GFP载体农杆菌菌落PCR鉴定
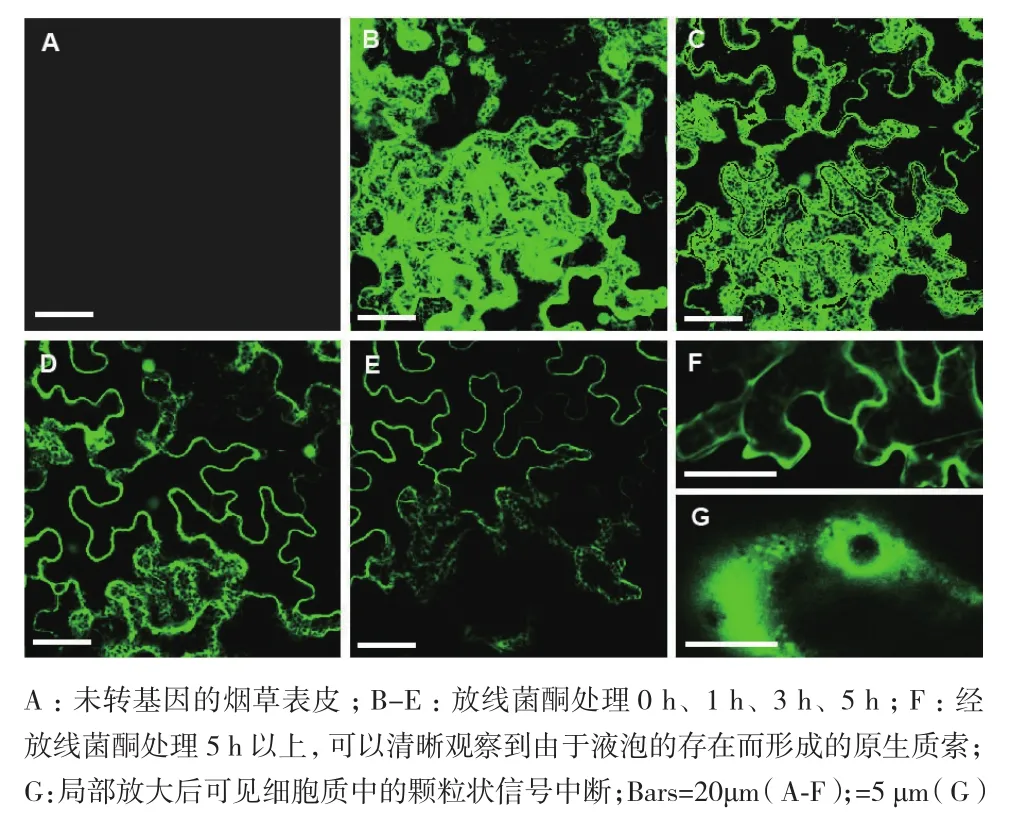
图4 放线菌酮处理对35S∶FMOGS-OX1-GFP转基因烟草表皮细胞中GFP荧光信号的影响
目前,在分子生物学中采用放线菌酮作为蛋白质合成抑制剂处理细胞来研究蛋白质定位及其他特性已经逐步被接受。Guirimand等[22]在研究长春花5-磷酸甲羟戊酸激酶,甲羟戊酸5-二磷酸脱羧酶和法尼基二磷酸合成酶的亚细胞定位时发现,组成型启动子驱动的GFP融合基因表达信号出现在过氧化物酶体和细胞质中,利用放线菌酮处理后,信号则特异性地呈现在过氧化物酶体中,细胞质中的信号来自于过量合成的无法及时转运到过氧化物酶体中的蛋白质。此外,他们的研究还发现,放线菌酮的浓度和处理时间在一定范围内对实验结果没有影响,不会改变蛋白质的亚细胞的定位。在本研究中发现,农杆菌介导的渗入法转化烟草叶片5 d后,用5%的放线菌酮处理5 h以上可以有效地抑制烟草叶片中GFP融合蛋白的过量累积,从而获得较为适中的荧光信号强度对目标蛋白进行准确的亚细胞定位。这些参数对其他植物蛋白质亚细胞定位中放线菌酮的应用提供了有益的参考。除了用于蛋白质亚细胞定位研究,放线菌酮作为蛋白质合成抑制剂还可应用于蛋白质稳定性的分析,Poutrain等[23]将小长春花中Aux/IAA 蛋白与YFP融合,用放线菌酮处理后观察生长素诱导该蛋白质的降解过程发现了该蛋白质的不稳定性。
综合本次的研究结果和其他学者对放线菌酮的不同应用,可以证明放线菌酮作为一种高效的蛋白质合成抑制剂,在有效阻止新蛋白合成的同时,对已有蛋白质的功能不产生明显的影响,因而可以在蛋白质研究中得到广泛的应用。
4 结论
本研究证明放线菌酮可以作为一种蛋白质抑制剂应用于蛋白亚细胞定位的研究中,在蛋白质过量表达的情况下,通过抑制蛋白质的合成,避免蛋白质定位出现假阳性信号,获得更为准确的定位信息。本研究发现,农杆菌介导的渗入法转化烟草叶片5 d后,用5%的放线菌酮处理5 h以上可以有效地抑制烟草叶片中GFP融合蛋白的过量累积,从而获得较为适中的荧光信号强度,对目标蛋白进行准确的亚细胞定位。这一结果为植物中其他蛋白质亚细胞定位的研究提供了参考数据。
[1]Inouye S, Tsuji FI, Inouye S, et al. Aequorea green fluorescent protein. Expression of the gene and fluorescence characteristics of the recombinant protein[J]. Febs Letters, 1994, 341(2-3):277-280.
[2]Chalfie M. Green fluorescent protein as a marker for gene expression[J]. Science, 1994, 263(5148):151.
[3]邢浩然, 刘丽娟, 刘国振. 植物蛋白质的亚细胞定位研究进展[J]. 华北农学报, 2006, 21(S2):1-6.
[4]Bisicchia P, Botella E, Devine KM. Suite of novel vectors for ectopic insertion of GFP, CFP and IYFP transcriptional fusions in single copy at the amyE, and bglS, loci in Bacillus subtilis[J]. Plasmid, 2010, 64(3):143-149.
[5]朱丹, 王希, 朱延明, 等. 植物亚细胞定位载体卡盒pCEG的构建及验证[J]. 东北农业大学学报, 2011, 42(4):83-88.
[6]宋传玲, 李丽珺, 文景芝. 大豆疫霉菌(Phytophthora sojae)增强型绿色荧光蛋白遗传转化载体的构建[J]. 东北农业大学学报, 2009, 40(01):9-12.
[7]Valdez BC, Perlaky L, Cai ZJ, et al. Green fluorescent protein tag for studies of drug-induced translocation of nucleolar protein RHII/Gu[J]. Biotechniques, 1998, 24(6):1032-1036.
[8]Yano K, Ueki N, Oda T, et al. Identification and characterization of human ZNF274 cDNA, which encodes a novel kruppel-type zincfinger protein having nucleolar targeting ability[J]. Genomics, 2000, 65(1):75-80.
[9]Tommerup N, Vissing H. Isolation and fine mapping of 16 novel human zinc finger-encoding cDNAs identify putative candidate genes for developmental and malignant disorders[J]. Genomics, 1995, 27(2):259-264.
[10]Degrave A, Moreau M, Launay A, et al. The bacterial effector DspA/E is toxic in Arabidopsis thaliana, and is required for multiplication and survival of fire blight pathogen[J]. Molecular Plant Pathology, 2013, 14(5):506-517.
[11]Schneider-Poetsch T, Ju J, Eyler DE, et al. Inhibition of eukaryotic translation elongation by cycloheximide and lactimidomycin[J]. Nature Chemical Biology, 2010, 6(3):209-217.
[12]Fischer-Posovszky P, Keuper M, Nagel S, et al. Downregulation of FLIP by cycloheximide sensitizes human fat cells to CD95-induced apoptosis[J]. Experimental Cell Research, 2011, 317(15):2200-2209.
[13]Doyle SM, Diamond M, Mccabe PF. Chloroplast and reactive oxygen species involvement in apoptotic-like programmed cell death in Arabidopsis suspension cultures[J]. Journal of Experimental Botany, 2009, 61(2):473-482.
[14]Hansen BG, Kliebenstein DJ, Halkier BA. Identification of a flavin-monooxygenase as the S -oxygenating enzyme in aliphatic glucosinolate biosynthesis in Arabidopsis[J]. Plant Journal, 2007, 50(5):902-910.
[15]Li J, Hansen BG, Ober JA, et al. Subclade of flavin-monooxygenases involved in aliphatic glucosinolate biosynthesis[J]. Plant Physiology, 2008, 148(3):1721-1733.
[16]Nour-Eldin HH, Hansen BG, Nørholm MHH, et al. Advancing uracil-excision based cloning towards an ideal technique for cloning PCR fragments[J]. Nucleic Acids Research, 2006, 34(18):e122.
[17]Sparkes IA, Runions J, Kearns A, et al. Rapid, transient expression of fluorescent fusion proteins in tobacco plants and generation of stably transformed plants[J]. Nature Protocols, 2006, 1(4):2019-2025.
[18]Stewart C. The utility of green fluorescent protein in transgenic plants[J]. Plant Cell Reports, 2001, 20(5):376-382.
[19]Leffel SM, Mabon SA, Stewart CNJ. Application of green fluorescent protein in plants[J]. Biotechniques, 1997, 23(5):912-908.
[20]Rouwendal GJA, Mendes O, Wolbert EJH, et al. Enhanced expression in tobacco of the gene encoding green fluorescent protein by modification of its codon usage[J]. Plant Molecular Biology, 1997, 33(6):989-999.
[21]Li J, Kristiansen KA, Hansen BG, et al. Cellular and subcellular localization of flavin-monooxygenases involved in glucosinolate biosynthesis[J]. Journal of Experimental Botany, 2010, 62(3):1337-1346.
[22]Guirimand G, Simkin AJ, Papon N, et al. Cycloheximide as a tool to investigate protein import in peroxisomes:A case study of the subcellular localization of isoprenoid biosynthetic enzymes[J]. Journal of Plant Physiology, 2012, 169(8):825-829.
[23]Poutrain P, Guirimand G, Glévarec G, et al. Molecular characterization of an Aux/IAA of Catharanthus roseus[J]. Journal of Plant Growth Regulation, 2011, 30(2):235-241.
(责任编辑 狄艳红)
Improving the Accuracy of FMOGS-OX1Subcellular Localization Using Cycloheximide
XIA Hong-yu KONG Wen-wen XU Rui CANG Wei LI Jing
(Northeast Agricultural University,Harbin 150030)
The conventional method of protein subcellular localization is to build the vector with the expression of fused target gene and green fluorescent protein gene(GFP)driven by 35S promoter. The subcellular localization of the target protein is then determined in the cells transiently expressing the fusion gene. Utilization of 35S promoter will lead to overexpression of the fusion gene and obtaining strong GFP signal. But sometimes the excessively synthesized protein will possibly remain in the transportation organelle or the areas exceeding the native protein location. The aim of this study is to solve this problem in the study of protein subcellular localization. To accurately determine the subcellular localization of Flavin-Containing Monooxygenase 1(FMOGS-OX1)in model plant Arabidopsis,a protein inhibitor,cycloheximide was applied to repress the over-expression of FMOGS-OX1-GFP fusion protein in tobacco epidermal cell. The results showed that before the treatment of cycloheximide,strong GFP signal was presented in both ER and cytosol. While after treated with cycloheximide,GFP signal disappeared in ER but remained in cytosol. This study demonstrated that proper treatment of cycloheximide may effectively avoid the excessive over-expression of the gene driven by 35S and thus is conducive to precisely determine the intercellular position where the protein facilitates its function.
GFP;FMOGS-OX1;subcellular localization;cycloheximide;endoplasmic reticulum
10.13560/j.cnki.biotech.bull.1985.2017.05.012
2016-10-28
国家自然科学基金基础科学人才培养基金项目(J1210069),黑龙江省教育厅科学技术研究项 目(12531003)
夏洪宇,女,硕士,研究生,研究方向:植物学;E-mail:xiahongyu0708@sina.com
李晶,女,博士,教授,研究方向:植物次生代谢;E-mail:lijing@neau.edu.cn
