聚乙二醇沉淀联用双水相萃取法纯化蛋清溶菌酶的研究
2017-05-19闻崇炜赵烨清石莉欧阳臻
闻崇炜 赵烨清 石莉 欧阳臻
(江苏大学药学院,镇江 212013)
聚乙二醇沉淀联用双水相萃取法纯化蛋清溶菌酶的研究
闻崇炜 赵烨清 石莉 欧阳臻
(江苏大学药学院,镇江 212013)
研究以聚乙二醇(Polyethylene Glycol,PEG)沉淀法联用PEG-硫酸铵双水相萃取体系纯化蛋清溶菌酶的工艺。结果表明,向预处理的鸡蛋清液中加PEG 4000至质量分数为16%时,可选择性沉淀除去蛋清中98.1%的杂蛋白,随后向上清液中加硫酸铵溶液至其质量分数为4.32%,可以构建PEG-硫酸铵双水相体系,分离上相即得高纯度溶菌酶。该法所得产物中96.34%为溶菌酶,其余为PEG 4000,不含有其它杂蛋白,溶菌酶总回收率达70.2%,比活为25 000 U/mg。该法简便易行,易于放大,每毫克精制溶菌酶中仅残留36.6 μg PEG 4000,生物安全性较高。
聚乙二醇4000;沉淀法;双水相法;溶菌酶
溶菌酶(Lysozyme)又称胞壁溶解酶,可以破坏微生物细胞壁的N-乙酰氨基葡萄糖胺和N-乙酰胞壁酸之间的β-1,4 糖苷键,具有良好的防腐杀菌作用。当前,溶菌酶可用于肉类、海鲜类及酒类的抗菌防腐,用于生产母乳化奶粉以提高婴幼儿的免疫力,还可用于抗菌、抗病毒、止血及消肿止痛[1]。
我国早已成为世界上的鸡蛋第一生产大国,鸡蛋清资源丰富。鸡蛋清中含有占蛋白总量0.3%-0.4%的溶菌酶,是生产商品化溶菌酶的最常用原料,常用工业化生产工艺有直接结晶法和离子交换法[2]。已有多个课题组研究了盐析法与离子交换法的优化以改进溶菌酶的制备工艺[3-5]。此外,还有课题组研究了用超滤法制备溶菌酶的工艺[6,7]。为进一步开发更简便易行的工艺,本研究以聚乙二醇(Polyethylene glycol,PEG)沉淀法结合PEG-硫酸铵双水相萃取技术(Aqueous two-phase extraction,ATPE)纯化制备蛋清溶菌酶的可行性。
1 材料与方法
1.1 材料
新鲜鸡蛋购自江苏大学恺源旅游超市;PEG 4000购自国药集团化学试剂有限公司;丙烯酰胺、N,N’-亚甲基双丙烯酰胺、三羟甲基氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、甘氨酸、过硫酸铵、硫酸铵、氢氧化钠、盐酸、氯化钠、丙酮均为分析纯,乙腈、甲醇均为色谱纯,均购自国药集团化学试剂有限公司;N,N,N’,N’-四甲基乙二胺(TEMED)购自AMRESCO公司;巯基乙醇购自Bio Basic Inc公司;溶菌酶标准品(15 000 U/mg)、溶壁微球菌均购自上海生工生物工程有限公司,蛋白分子量标准品购自TAKARA公司,含有14.3、20.1、29.0、44.3、66.4和97.2 kD 6条条带。
1.2 方法
1.2.1 蛋清液与PEG贮存液准备 鲜鸡蛋洗净并分离足量鸡蛋清,加两倍体积ddH2O稀释,低速搅拌均匀,随后在搅拌中调节至pH5.0左右即得蛋清液,置于-20℃保存备用。精密称取适量PEG 4000,加入等质量ddH2O,搅拌至PEG 4000充分溶解,即得质量分数50%的PEG贮存液,贮存液至少静置1 d后再用于PEG沉淀。
1.2.2 PEG沉淀法 取冻存蛋清液,化冻后以9 600×g离心20 min,称取适量澄清的上清液,100 r/min低速搅拌下滴加PEG 4000贮存液至预设质量分数,静置2 h,取适量样品以9 600×g离心20 min,分别收集上清与沉淀备用及后续检测。
1.2.3 PEG-硫酸铵双水相萃取法 称取按1.2. 2所述流程以16%的PEG4000处理所得上清多份,按5%、10%、15%、20%、25%、30%的质量比分别加入所需饱和硫酸铵溶液,于漩涡混匀器上充分混合后以9 600×g离心20 min分相,分别取上相和下相待后续检测。按下式计算相比(R)、萃取率(K):

其中,CT、CB分别为上相与下相溶菌酶浓度(mg/ mL),VT、VB分别为萃取后上相与下相溶液体积(mL)。
1.2.4 溶菌酶提取工艺 称取适量澄清蛋清液,搅拌中加PEG 4000贮存液至终质量分数为16%,静置2 h,9 600×g离心20 min,收集得上清;按上清质量比的1/10加入饱和硫酸铵溶液,混匀后静置1 h,9 600×g离心20 min,收集上相,透析,冷冻干燥即得溶菌酶。
1.2.5 蛋白质电泳(SDS-PAGE) 样品用适量ddH2O溶解,取少量加等体积2×上样缓冲液,沸水浴处理15 min得电泳样品。SDS-PAGE按Laemmli法[8]所述操作,分离胶浓度为12%,浓缩胶浓度为5%,70 V进行电泳,待溴酚蓝到达分离胶底部后终止电泳,剥下凝胶,考马斯亮蓝R250染色。
1.2.6 HPLC法测定溶菌酶纯度 采用安捷伦LC 1200液相色谱仪,色谱柱为Eclipse Plus C18(100 mm×4.6 mm ID),流动相A:0.1%甲酸水溶液,流动相B:含0.1%甲酸的乙腈溶液,溶菌酶样品及标准品用B液溶解,0.45 μm滤膜过滤后进样。流速:1.0 mL/min(0-10 min B液 10%;10-25 min B液从10%-60%;25 V 35 min B液 60%),柱温为30℃,进样量为20 μL,样品浓度为10 mg/mL,检测波长280 nm。
1.2.7 红外法测定溶菌酶吸收峰 采用美国Nicolet公司Avatar-370型傅立叶变换红外光谱仪,将冻干样品(约2 mg)与KBr(200 mg)充分混匀,压片,置于红外光谱仪的变温附件中于4 000-400 cm-1范围内扫描。
1.2.8 浊度法测定溶菌酶生物活性 称取适量溶菌酶,以0.05 mol/L(pH6.2)的PBS缓冲液溶解后稀释至50 μg/mL。取50 μL 溶菌酶溶液,加入酶标板中,再加入200 μL以0.05 mol/L(pH6.2)的PBS缓冲液稀释至0.3 mg/mL的溶壁微球菌悬液,混匀,置于酶标仪中以450 nm每隔30 s测定浊度的降低值,历时5 min。以50 μL PBS缓冲液与200 μL菌悬液的混合液为空白对照。以25℃下450 nm处每分钟使吸光度值降低0.001为1个酶活力单位(U),比活单位为U/mg。
1.2.9 数据处理 SDS-PAGE凝胶数据按以下流程处理:以Quantity One 软件(美国BIO-RAD公司)定量各条带灰度值,按如下公式计算各样品中溶菌酶沉淀率(PR)及纯度(PU)[9]。

其中,PGLYZ代表沉淀中溶菌酶灰度值,EGLYZ代表蛋清中溶菌酶灰度值,NP与NE分别代表沉淀及蛋清稀释倍数,SGLYZ代表样品中溶菌酶灰度值,SGALL代表沉淀中所有蛋白质灰度值。
HPLC数据按峰面积法进行定量。
2 结果
2.1 PEG用量对溶菌酶回收率及纯度的影响
对1.2.2所述获得的上清进行溶菌酶回收率及纯度的分析。结果如下:(1)上清中溶菌酶回收率随PEG用量的递增而逐步递减。当PEG 4000质量分数从2%递增到30%时,上清中溶菌酶回收率从95.4%逐步递减至42.4%;(2)上清中溶菌酶纯度随PEG用量的递增而逐步递增。当PEG 4000质量分数从2%递增到30%时,上清中溶菌酶纯度从12.6%逐步递增至100%(图1)。

图1 PEG4000用量对溶菌酶回收率及纯度的影响
2.2 硫酸铵用量对双水相体系及溶菌酶萃取的影响
按1.2.3所述加入饱和硫酸铵溶液至最终质量分数分别为2.16%、4.32%、6.48%、8.64%、10.8%、 12.96%,考察PEG-硫酸铵双水相体系的形成,分离上下相后精密称重及计算体积,由此计算相应相比(R)及溶菌酶的萃取率(K)。结果如下:(1)硫酸铵质量分数越高,双水相体系两相间差异越大,分相越快越清晰,同时上相体积越少,下相体积越大,即相比越低;(2)硫酸铵质量分数高于10.8%时,分相后在上下相间有蛋白质析出,会造成溶菌酶显著损失;(3)硫酸铵质量分数为4.32%时,双水相萃取效果最好,此时上下相分界清晰,上相易于分离,溶菌酶萃取率可达95.67%(表1)。

表1 硫酸铵用量对相比及萃取率的影响
2.3 溶菌酶的小试制备及质量分析
根据上述PEG 4000及硫酸铵的优化用量,处理300 mL蛋清液,共计得到样品245.4 mg。SDSPAGE分析(图2)表明样品为单一条带,迁移率与溶菌酶标准品完全一致。HPLC分析(图3)表明样品中主峰保留时间为17 min,也与溶菌酶标准品保留时间一致。因此,本工艺所得样品为高纯度溶菌酶,总回收率为70.2%。浊度法测定所得溶菌酶样品的比活为25 000 U/mg。此外,HPLC分析表明,次峰保留时间为30.9 min,为PEG峰,比例为3.66%。PEG 4000具有良好的生物安全性,不影响溶菌酶在食品及医药工业的应用。
目前认为1 600-1 700 cm-1之间是由蛋白多肽骨架的C=O伸缩振动引起的酰胺Ⅰ带的特征吸收峰,是蛋白质二级结构变化的敏感区域。图4为溶菌酶样品的红外吸收图谱,其中1 631、1 552、1 402 cm-1处的吸收峰与溶菌酶标准品的吸收峰吻合,此外1 461、1 298和1 137 cm-1处的吸收峰与PEG的吸收峰吻合,表明样品中既含有溶菌酶,同时尚有少量PEG。
3 讨论
PEG是含有多羟基结构的长链高分子聚合物,既可以缠绕沉淀蛋白质分子,同时还可使蛋白质分子脱水而形成沉淀。PEG沉淀法具有操作简便、易于放大、条件温和等优点,目前已被用于棉铃虫幼虫中肠及脂肪体微粒体蛋白、猪胰蛋白酶、牛轮状病毒及重组抗体的纯化[10-16]。双水相萃取技术也是一种高效而温和、易于放大操作的生物分离技术。本课题组在前期研究中已发现仅用PEG沉淀法制备蛋清溶菌酶,不仅需要较多PEG,而且溶菌酶得率较低,因此研究了PEG沉淀联用双水相萃取法以纯化溶菌酶的工艺。
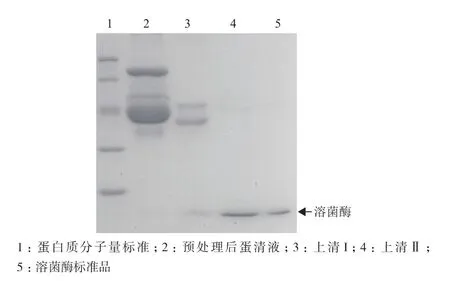
图2 溶菌酶样品的SDS-PAGE结果

图3 溶菌酶样品的HPLC结果

图4 溶菌酶样品的红外扫描结果
PEG沉淀结果表明,PEG 4000优先选择性沉淀蛋清中卵白蛋白及卵转铁蛋白为主的杂蛋白,溶菌酶保留在上清中,使其得到纯化,但是PEG 4000用量过高则会导致较多溶菌酶沉淀而降低上清中溶菌酶的回收率。进一步分析表明,当PEG 4000质量分数为16%时,可以沉淀除去98.1%的杂蛋白,上清中仍可回收到74.7%的溶菌酶,纯度可达58.2%;当PEG 4000质量分数为28%甚至更高时,虽然可以沉淀除去几乎所有其它杂蛋白,但溶菌酶回收率仅有42%左右。因此,为了兼顾溶菌酶回收率及纯度,PEG 4000沉淀时最终质量分数宜为16%。同时所得上清宜再加入硫酸铵至最终质量分数为4.32%以构建双水相萃取体系,此时上相中可以得到电泳纯的溶菌酶,且具有较高的生物活性。该工艺中PEG一物两用,首先作为杂蛋白的沉淀剂,随后作为双水相体系的成相物,操作极其简便。同时由于无毒及良好的生物相容性,PEG目前已被FDA批准为体内注射药用聚合物,因此,上述样品中虽有少量PEG 4000残留(每毫克精制溶菌酶中残留量为36.6 μg),但基本不影响溶菌酶在食品及药品等领域的应用。
4 结论
本研究建立两步法纯化蛋清溶菌酶的工艺:首先向蛋清液中加PEG 4000至其质量分数为16%,随后向上清液中加质量比为10%的饱和硫酸铵溶液,分离所得PEG-硫酸铵双水相体系的上相,即为高纯度溶菌酶,总回收率为70.2%,比活为25 000 U/mg。该法简便易行,易于放大,无需贵重复杂设备,所得溶菌酶具有较高的生物安全性。
[1] 赵龙飞, 徐亚军. 鸡蛋清中溶菌酶的应用性研究[J]. 食品工业, 2006, (3):19-20.
[2] 赵法利, 刘静波, 刘瑜, 等. 鸡蛋中功能成分的研究[J]. 食品科学, 2006, 27(12):798-802.
[3] 赵哲勋. 从鸡蛋壳中提取分离溶菌酶[J]. 食品科学, 1993, (1):45-46.
[4] 张文会, 王艳辉, 马润宇. 离子交换法提取鸡蛋清溶菌酶[J].食品工业科技, 2003, 24(6):57-59.
[5] 余海芬, 马美湖, 刘岩. 阳离子交换法提取蛋清溶菌酶的研究[J]. 中国家禽, 2008, 30(24):22-25.
[6] Wan YH, Lu JR, Cui ZF. Separation of lysozyme from chicken egg white using ultrafiltration[J]. Separation and Purification Technology, 2006, 48(2):133-142.
[7] Datta D, Bhattacharjee S, Nath A, et al. Separation of ovalbumin from chicken egg white using two-stage ultrafiltration technique[J]. Separation and PurificationTechnology, 2009, 66(2):353-361.
[8] Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227:680-685.
[9] 闻崇炜, 毛春友, 胡萍萍, 等. Tricine 蛋白质电泳定量检测溶菌酶方法的研究[J]. 江苏农业科学, 2012, 40(5):290-292.
[10] 郑明奇, 张文吉, 邱星辉, 等. 聚乙二醇8000对棉铃虫微粒体蛋白沉淀作用的研究[J]. 农药学学报, 2005, 7(1):81-84.
[11] 余英武, 赵金梅, 肖青虎, 等. 聚乙二醇沉淀猪胰蛋白酶的研究[J]. 西华大学学报, 2011, 30(5):96-99.
[12] Fontes LVQ, Campos GS, Beck PA, et al. Precipitation of bovine rotavirus by polyethylen glycol(PEG)and its application to produce polyclonal and monoclonal antibodies[J]. Journal of Virological Methods, 2005, 123(2):147-153.
[13] Giese G, Myrold A, Gorrell J, et al. Purification of antibodies by precipitating impurities using Polyethylene Glycol to enable a two chromatography step process[J]. Journal of Chromatography B, 2013, 938:14-21.
[14] Sommer R, Satzer P, Tscheliessnig A, et al. Combined polyethylene glycol and CaCl2precipitation for the capture and purification of recombinant antibodies[J]. Process Biochemistry, 2014, 49(11):2001-2009.
[15] Hu XT, Liu CM, Jin ZY, et al. Fractionation of dextrin by gradient polyethylene glycol precipitation[J]. Journal of Chromatography A, 2016, 1434:81-90.
[16] Hammerschmidt N, Hobiger S, Jungbauer A. Continuous polyethylene glycol precipitation of recombinant antibodies:Sequential precipitation and resolubilization[J]. Process Biochemistry, 2016, 51(2):325-332.
(责任编辑 李楠)
Purification of Lysozyme from Egg White by Combination of Polyethylene Glycol Precipitation and Aqueous Two-phase Extraction
WEN Chong-wei ZHAO Ye-qing SHI Li OUYANG Zhen
(School of Pharmacy,Jiangsu University,Zhenjiang 212013)
This work aims to establish a new technology of purifying lysozyme from egg white based on the combination of polyethylene glycol(PEG)precipitation and aqueous two-phase extraction. The results showed that 98.1% of non-lysozyme proteins were removed by the precipitation when PEG 4000 was added into pretreated egg white until its mass fraction reached 16%. Then,the supernatant of PEG precipitation was collected and mixed with saturated(NH4)2SO4solution until the mass fraction of this salt reached 4.32%. Therefore,the aqueous two-phase system of PEG/(NH4)2SO4was established and most of lysozyme could be transferred into the top phase. It was found that 96.34% of the freeze-dried top phase was lysozyme,and the rest was PEG 4000,no any other proteins existed. The recovery rate and the specific activity of lysozyme were 70.2% and 25 000 U/mg,respectively. In conclusion,this purification technology was simple,accurate,safe and reliable,and could be used for large-scale production of lysozyme.
polyethylene glycol 4000;precipitation;aqueous two-phase extraction;lysozyme
10.13560/j.cnki.biotech.bull.1985.2017.05.013
2016-12-19
国家自然科学基金项目(81573529),江苏大学高级人才启动基金(1281370001),江苏省普通高校研究生实践创新计划项目(SJLX15_0512)
闻崇炜,男,博士,副教授,研究方向:生物活性蛋白质分离及功能;E-mail:wenchw@ujs.edu.cn
