超声波辅助鱼皮胶原蛋白提取及其性质研究
2017-05-19王金梅包建强
王金梅,包建强
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
超声波辅助鱼皮胶原蛋白提取及其性质研究
王金梅,包建强
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
利用超声波辅助提取草鱼皮胶原蛋白,并通过SDS-PAGE、圆二色谱法对超声作用得到的草鱼皮胶原蛋白结构和变性温度等进行了研究。通过响应面试验得到最优工艺条件:超声功率310 W,超声时间10 min,酶解时间29 h,提取率达到68.67%。SDS-PAGE和CD显示:胶原蛋白为典型Ⅰ型,且纯度较高,变性温度为36℃,胶原蛋白的三螺旋结构完整,超声波对其结构无明显影响,且具有生物活性。
鱼皮;胶原蛋白;提取;超声波;凝胶电泳;圆二色谱;响应面分析
我国淡水产品年产量长期位居世界第一,2014年淡水鱼总产量达到2 770万t,占全国鱼类产量的73%[1]。为提高淡水鱼的经济效益,对淡水鱼进行深加工是目前面临的重要问题。2012年我国水品加工比例仅占36.15%[2],淡水产品加工比例更低仅为17%,淡水产品加工利用率低,低附加值的产品多,深加工的产品少的现象普遍存在,例如鱼糜加工业的采肉率仅为25%左右[2],其余60%—70%的鱼体部分成了加工副产品,大量副产品没有得到综合利用,还对环境造成污染。研究表明:鱼皮胶原蛋白含量丰富,郭文宇等[3]测得草鱼皮胶原蛋白量可达总蛋白含量80%以上,经加工处理可得到高品质的胶原蛋白。
胶原蛋白的提取方法主要有:水法提取、碱法提取、酸法提取和酶法提取。热水法提取的胶原蛋白由于超螺旋结构被破坏,因而不具备胶原蛋白的生理功能,这类胶原蛋白被称为明胶;碱法提取过程中会使胶原部分肽键水解,破坏其超螺旋结构,所以得到胶原蛋白分子量较小,且碱法水解过度会产生有毒的D型氨基酸旋光化合物,所以碱法提取胶原蛋白研究较少;酸法提取常与酶法结合使用,蛋白酶可以切除胶原蛋白末端的非胶原肽,使胶原蛋白溶解于酸或中性盐溶液中从而被提取出来。张双灵等[4]研究当酶剂量为1.2%、酶解时间80 min、酶解温度55℃、酶解pH=9时,虹鳟鱼皮胶原蛋白得率为26.1%。
近年来超声波在成分提取方面应用广泛,杨萌萌等[5]将超声波应用到提取牛蹄筋的酶溶性胶原蛋白中,研究了超声功率与超声时间及加酶量三个因素对提取率的影响,得到最优条件下提取率提高了1069%。本研究将超声波应用到草鱼皮胶原蛋白提取中,并通过响应面确定超声波的最优工作参数。由于水产品胶原蛋白不同于一般动物胶原蛋白,水产品胶原蛋白变性温度较低,有生物学功能的三螺旋结构容易在提取过程中被破坏,所以,采用圆二色谱法研究了胶原蛋白的热稳定性以及超声波对胶原蛋白结构的影响。
1 材料与方法
1.1 材料与仪器
实验室-50℃冻藏新鲜草鱼鱼皮,南浔新雅农产品(浙江)开发有限公司提供。胃蛋白酶酶活3 000 U/g和羟脯氨酸等药品,购自国药集团试剂有限公司。
UV-18OOPC型紫外可见分光光度计,上海美谱达仪器有限公司;XO-SM100超声波微波组合反应系统,先欧仪器(南京)制造有限公司;圆二色谱仪J-815,JASCO公司。
1.2 草鱼皮胶原蛋白提取工艺优化
1.2.1 胶原蛋白提取及纯化
鱼皮室温流水解冻,刮掉鱼皮表面残留鱼肉,剪碎称重,氢氧化钠浸泡除去杂蛋白,水洗至中性,正丁醇浸泡除脂,水洗,加乙酸,超声处理[4],加酶浸泡,离心取上清液,加Tris调节pH,加入氯化钠进行盐析,离心取沉淀,加乙酸复溶,低浓度乙酸中透析,冷冻干燥得胶原蛋白样品。
1.2.2 羟脯氨酸标准曲线绘制
胶原蛋白中含有的羟脯氨酸含量相对稳定,应用紫外分光光度计测定羟脯氨酸含量,乘以转换系数得到样品中胶原蛋白含量。通过Woessner比色法可得到有关羟脯氨酸标准曲线的回归方程,根据紫外分光光度计测定的吸光度值可计算羟脯氨酸含量[6],不同于一般动物的胶原羟脯氨酸含量(14.4%),鱼类胶原中含量略低,如Ikoma等[7]测得淡水鱼鳞胶原中羟脯氨酸的含量约为11%,本次研究取9.09[8]。
酶解液中胶原蛋白得率(W,%)和提取率(Y,%)换算公式如下所示:
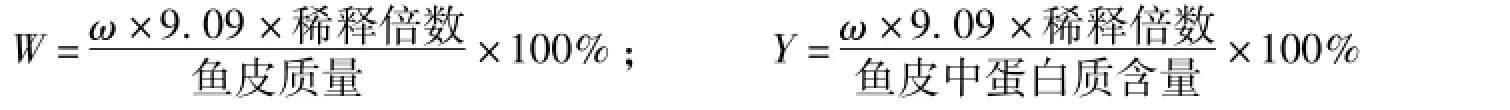
式中:ω为酶解液中羟脯氨酸的质量。
1.2.3 响应面设计试验
试验考察超声频率、超声时间和酶解时间三个因素对胶原蛋白提取率的影响,通过单因素预试验,确定响应面因素水平,应用Box-Behnken模型以A超声频率、B超声时间和C酶解时间为自变量,胶原蛋白得率Y为响应值设计试验,经预处理后的鱼皮提取条件为0.5 mol/L的乙酸以调节pH,料液比1∶15,进行超声波处理后加入胃蛋白酶量为4%。

表1 响应面因素水平表Table 1 Factors and levels of response surface
1.3 胶原蛋白聚丙稀酰胺凝胶电泳(SDS-PAGE)分析
SDS-PAGE参照Matmaroh等[9]的方法。胶原蛋白分离采用8%的SDS/聚丙烯酰胺凝胶、Tris-HCl/甘氨酸电泳缓冲系统。胶原蛋白溶于去离子水(1 mg/mL)后,与上样缓冲液(0.5 mol/L Tris-HCl,4%SDS,20%甘油,含或不含10%DTT,pH 6.8)以1∶1(V/V)混合,沸水浴5 min。样品冷却后,加入4%聚丙烯酰胺凝胶(浓缩胶)梳孔,冰浴电泳120 V。电泳结束后,凝胶用0.05%考马斯亮蓝R-250染色,用含15%甲醇和10%乙酸的脱色液脱去背景色。
1.4 热稳定性的圆二色谱测试
1.4.1 胶原蛋白结构鉴定
将冻干胶原蛋白溶解到0.1 mol/L的乙酸溶液,样品质量浓度为200μg/mL,取200μL注入1 mm比色皿中放入样品池。设置温度10℃,扫描速率10 nm/min,扫描波长范围190—250 nm,数据点间隔0.5 nm,圆二色谱仪记录椭圆率变化。
1.4.2 胶原蛋白热稳定性和不可逆性
设置波长220 nm,样品池温度从10℃升高到45℃,升温速度1℃/min,圆二色谱仪记录升温过程中数据变化。将胶原蛋白45℃处理后,降温到10℃保温20 min,10℃环境中记录190—250 nm波长范围的椭圆率变化。
1.4.3 温度对胶原蛋白结构影响
测试样品配制方法同1.4.1,试验设置5个不同的温度点,20℃、30℃、35℃、60℃、80℃,扫描波长范围190—250 nm,每个温度点扫描,记录数据,保温10 min后,再次扫描记录数据,扫描速率设置为100 nm/min。
1.4.4 超声波对胶原蛋白结构的影响
将配置好的胶原蛋白溶液放到超声清洗器处理,功率300W,分别超声处理5 min、10 min、15 min,记录椭圆率变化。
2 结果与分析
2.1 草鱼皮胶原蛋白提取的工艺优化
在单因素试验的基础上,以胶原蛋白提取率为响应值,利用Design Expert8.0.6设计试验,试验设计和结果如表2所示,表3为方差分析数据。其中回归模型系数的显著性P<0.01,回归模型显著,失拟项P=0.2745>0.05不显著,表明方程模拟比较好,可以进行数据分析。根据响应面回归模型:Y=66.87+1.13A+2.42B+4.31C+0.34AB-0.86AC-2.51BC-2.42A2-3.36B2-2.46C2,可知各因素对草鱼皮中胶原蛋白提取率影响的主次顺序为:C>B>A,即酶解时间>超声时间>超声功率,酶解时间对胶原蛋白提取率的影响最大,其次是超声时间。
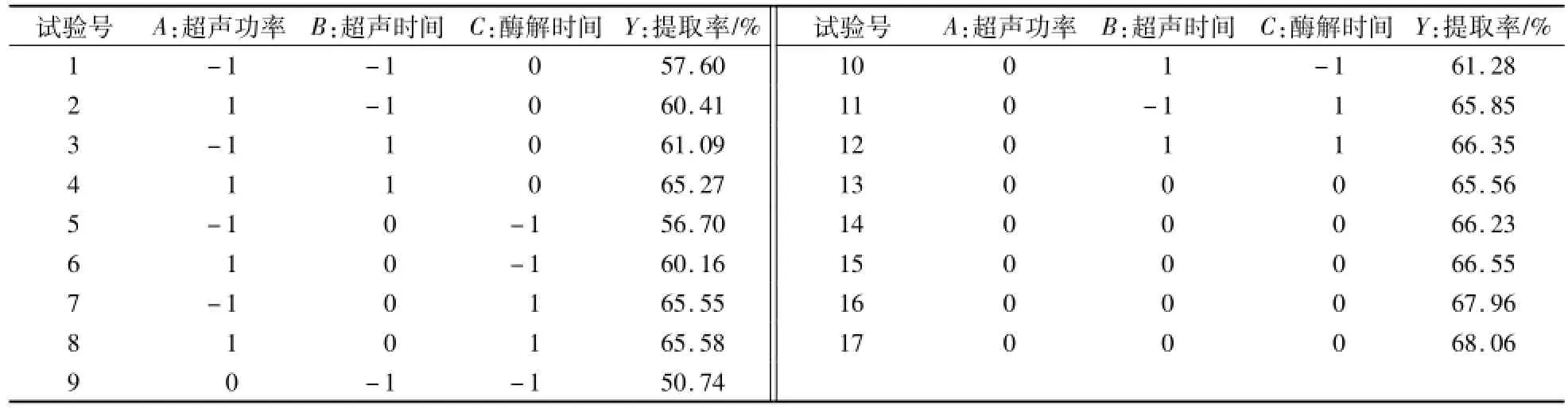
表2 试验方案的设计及结果Table 2 Experim ental design and results

表3 回归模型的方差分析及其系数的显著性检验Table 3 Variance analysis of regression m odel and significance test ofm odel coefficients
根据方差分析数据显示,酶解时间对提取率的影响极显著,超声功率和超声时间对提取率的影响显著;三因素两两交互作用分析,超声时间与酶解时间之间的交互作用对提取率的影响显著,超声功率和超声时间、酶解时间和超声功率响之间的交互作用影响不显著。
通过响应面法优化,酶法提取得到草皮胶原蛋白最优可操作的工艺条件为:超声功率312.97 W,超声时间10.29 min,酶解时间29.12 h,此时胶原蛋白提取率理论值为68.80%。考虑到实际生产中的需要,上述工艺条件进行略微调整,最终确定实际最优的提取工艺为:超声功率310W,超声时间10min,酶解时间29 h,并在此最优条件下对其进行3次验证试验,以考察模型的可靠性。结果表明:在实际的最优工艺条件下,超声波辅助提取下的胶原蛋白提取率达到68.67%,实际操作中的数值与试验设计中的理论数值(68.80%)相对误差仅为0.19%。
2.2 凝胶电泳
超声波辅助提取(UPSC)与未经超声波波处理所得的胶原蛋白(PSC)的电泳图谱如图1所示,所得胶原蛋白与标准Ⅰ型胶原蛋白条带基本一致,均存在两条不同的α链,是由α1和α2组成,其中从光密度来看α1和α2的比率为2∶1,因此胶原蛋白的组成应该为(α1)2α2这种结构符合真骨鱼胶原含有两条[10-11]或者三条[12]不同的链,根据与Maker对比,可以确定为Ⅰ型胶原蛋白,图1是另一条带为β,是两条肽链的二聚体,符合鱼皮Ⅰ型胶原结构,且图1中电泳条带清晰无杂带出现,说明超声波辅助酶法提取胶原蛋白纯度较高。图1中2和4对比,4和5对比发现,相同浓度的UPSC和PSC条带位置和条带密度均大致相同,表明超声波辅助提取没有破坏胶原蛋白的结构。
2.3 热稳定性的圆二色谱测试
2.3.1 胶原蛋白结构的圆二色谱测试
图2为圆二色谱仪扫描得到的胶原蛋白CD谱图。图2中10℃测定的CD谱图曲线,可以看到胶原蛋白在190—250 nm有正负两个吸收峰,最大负吸收峰在198 nm左右,最大正吸收峰在220 nm左右,并由正负峰强度比值可以表征胶原三螺旋结构完整程度[13],完全符合胶原蛋白三螺旋结构的吸收特征峰,说明提取得到胶原蛋白三股螺旋结构完整。图2中胶原蛋白溶液加温到45℃后降温到10℃并保温一段时间,圆二色谱仪记录190—250 nm波长范围的色谱图,图中没有明显的正负吸收峰,表明胶原蛋白在超过一定温度后已经变性解螺旋,降低温度后,三螺旋结构不能恢复,二级结构已被破坏。

图1 胶原蛋白SDS-PAGE图Fig.1 SDS-PAGE of grass carp skin’s collagen

图2 草鱼皮胶原蛋白圆二色谱扫描Fig.2 Circular dichroism spectra of grass carp skin’s collagen
2.3.2 胶原蛋白热稳定性和结构不可逆性测试
CD谱图上波长220 nm处的摩尔椭圆率表示胶原蛋白三螺旋结构的特征吸收光值谱,此波长处的CD值随温度的变化则可表征胶原蛋白三螺旋构象的变化过程[14]。对胶原蛋白溶液从10℃升高到45℃,记录椭圆率变化如图3(a),图3(a)中显示10—31℃,胶原蛋白CD值几乎没有变化,在31—34℃范围内CD值有略微减小,而在大于34℃到39℃范围内,CD值迅速减小。表示三股螺旋结构在34℃以前一直完整存在,之后三螺旋的α单链开始解旋,在温度大于39℃时,CD又变得稳定,表示三螺旋结构彻底破坏。对数据进行微积分处理得到图3(b),可以得到在36℃时,胶原蛋白的解螺旋速率最大[15],所以草鱼皮胶原蛋白的变性温度为36℃。

图3 草鱼皮胶原蛋白解螺旋过程Fig.3 Uncoiling of grass carp skin’s collagen
2.3.3 温度对胶原蛋白结构影响测试
图4是保温前后不同温度下胶原蛋白的CD曲线,设置五个温度点,对每个温度点的样品进行两次扫描,分别保温10 min。图4中(a)和(b)在接近变性温度的30℃,保温前后图谱并没有明显变化,说明在变性温度之前胶原蛋白结构稳定;温度点位35℃,正负峰比值RPN有略微变化,保温10 min后,其正负峰强度变化很大,RPN减小明显。温度点60℃时,保温10 min正峰强度几乎为零,负峰发生红移。由此得出结论,胶原蛋白在变性温度前,结构保持稳定,并且胶原蛋白解螺旋改变结构需要一段时间过程。

图4 不同温度点胶原蛋白圆二色谱Fig.4 Circular dichroism spectra of collagen at different temperatures
2.3.4 超声波对胶原蛋白圆二色性的影响
对胶原蛋白溶液进行一定时间的超声波处理后测得圆二色谱如图5,在功率300 W,作用不同超声时间的图谱与没有进行超声处理的胶原蛋白对比没有明显区别,说明超声波对胶原蛋白的三螺旋结构不会造成影响;并且CD图谱显示在220 nm和198 nm左右有两个吸收峰说明超声处理过的胶原蛋白仍具有生理活性。
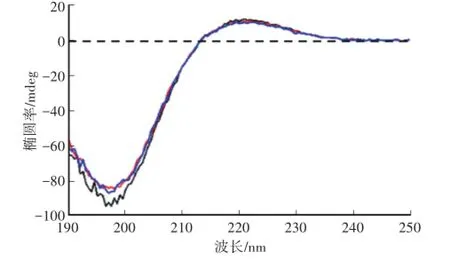
图5 不同超声时间的胶原蛋白圆二色谱Fig.5 Circular dichroism spectra of collagen at different ultrasonication times
3 结论
本研究将超声波作用到鱼皮胶原蛋白提取中,并通过响应面设计试验法获得最佳工艺参数:超声波功率310 W,超声波时间10 min,酶解时间29 h,此条件下胶原蛋白提取率为68.67%。超声波辅助法比未经超声处理的提取法得到胶原蛋白得率提高了13.38%。
SDS-PAGE显示胶原蛋白纯度较高,且结构符合标准Ⅰ型胶原蛋白;圆二色谱法测定胶原蛋白结构,判定其具有完整的三螺旋结构;测得鱼皮胶原蛋白变性温度为36℃,且其结构改变需要一定时间;对比温度对胶原三螺旋结构的影响,结论是超声波对胶原蛋白的结构影响不大,超声波辅助提取过程不足以对胶原蛋白的三螺旋结构造成影响,超声辅助提取得到的草鱼皮胶原蛋白仍然具有生物活性。
[1]农业部渔业局.中国渔业统计年鉴[M].中国农业出版社,2015.
[2]熊善柏.湖北省淡水鱼加工业现状、问题与发展方向[J].科学养鱼,2014(9):14-16.
[3]郭文宇,边清泉,刘家琴,等.木瓜蛋白酶提取草鱼皮胶原蛋白的工艺研究[J].皮革与化工,2009,26(1):34-36.
[4]张双灵,孙晓庆,王彩理,等.细菌海洋酶提取虹鳟鱼皮胶原蛋白的工艺研究[J].食品工业,2012(2):14-17.
[5]杨萌萌,郭兆斌,余群力,等.超声波辅助法提取胶原蛋白工艺研究[J].甘肃农业大学学报,2013,48(3):121-126.
[6]WOESSNER JF.The determination ofhydroxyproline in tissue and protein samples containing small proportions of this imino acid[J].Archives of Biochemistry and Biophysics,1961,97:440-447.
[7]IKOMA T,KOBAYASHIH,TANAKA J,et al.Physical properties of type Icollagen extracted from fish scales of Pagrusmajor and Oreochromis niloticas[J].International Journal of Biological Macromolecules,2003,32(3/4/5):199-204.
[8]顾杨娟,李杰,李富威,等.制备草鱼鱼鳞冻时鱼鳞前处理工艺的优化[J].江苏农业科学,2013,41(2):217-220.
[9]MATMAROH K,BENJAKUL S,PRODPRAN T,et al.Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish(Parupeneus heptacanthus)[J].Food Chemistry,2011,129(3):1179-1186.
[10]NAGAIT,ARAKIY,SUZUKIN.Collagen of the skin of ocellatepuffer fish(Takifugu rubripes)[J].Food Chemistry,2002,78(2):137-177.
[11]KIMURA S,OHNO Y,MIYAUCHI Y,et al.Fish skin type I collagen:wide distribution of anα3subunit in teleosts[J].Comparative Biochemistry and Physiology,1987,88(1):27-34.
[12]AOAC.Officialmethods of analysis of the association of official analytical chemists[M].15 th ed.Arlington,Washington DC,USA:Association of Official Analytical Chemists,1990.
[13]BROWN E M,FARRELL H M,WILDERMUTH JR J.Influence of neutral salts on the hydrothermal stability of acid-soluble collagen[J].Journal of Protein Chemistry,2000,19(2):85-92.
[14]MU C,LID,LINW,et al.Temperature induced denaturation of collagen in acidic solution[J].Biopolymers,2007,86(4):282-287.
[15]段蕊,叶超,邢芳芳.采用圆二色谱法研究冬夏鲢鱼鳞胶原蛋白的稳定性[J].食品与发酵工业,2010,36(1):73-75.
(责任编辑:程智强)
The ultrasonic-assisted solvent extraction and characterization of fishskin collagen
WANG Jin-mei,BAO Jian-qiang
(College of Food Science and Technology,Shanghai Ocean University,Shanghai201306,China)
The ultrasonic-assisted solventextraction of grass carp skin’s collagen was carried out,and the gained collagen’s structure and denaturing temperature were studied by SDS-PAGE and circular dichroism spectrocopy.The experiments by response surface methodology showed that the optimal processing conditions were 310-W ultrasonic power,10-min ultrasonication and 29-h enzymolysis,in which the extraction rate reached 68.67%.The research by SDS-PAGE and circular dichroism spectrocopy indicated that the collagen was of TypeⅠand had a comparatively high purity,its denaturing temperature was 36℃,and its triple-helix structure was intact and not influenced by ultrasonic wave,and also had a biological activity.
Fishskin;Collagen;Extraction;Ultrasonic wave;Gel electrophoresis;Circular dichroism spectrum;Response surface analysis
TS254
:A
1000-3924(2017)02-114-06
10.15955j.issn1000-3924.2017.02.21
2016-04-06
水产动物遗传育种中心上海市协同创新中心(ZF1206);上海市科委工程中心建设(11DZ2280300)
王金梅(1990—),女,硕士,研究方向:食品科学。Tel:15216835916,E-mail:wjmytu@163.com
,E-mail:baojq@shou.edu.cn
