杜鹃根际微生物的分离、鉴定及多样性分析
2017-05-19周田田蔡建超赵和文崔金腾
周田田,丁 榕,蔡建超,赵和文,2,3,崔金腾,2,3
(1北京农学院园林学院,北京 102206;2城乡生态环境北京实验室,北京 102206;3北京市乡村景观规划设计工程技术研究中心,北京 102206)
杜鹃根际微生物的分离、鉴定及多样性分析
周田田1,丁 榕1,蔡建超1,赵和文1,2,3,崔金腾1,2,3
(1北京农学院园林学院,北京 102206;2城乡生态环境北京实验室,北京 102206;3北京市乡村景观规划设计工程技术研究中心,北京 102206)
迎红杜鹃和照白杜鹃是北京仅有的两种野生杜鹃花,为了解海拔和种源对杜鹃根际菌落组成的影响,采样不同海拔、不同种源的杜鹃根际和非根际土壤,进行菌种纯化和分子鉴定,同时提取土壤DNA,进行第二代高通量测序;结合采样地自然条件,分析不同因素对根际菌落组成及丰度的影响。结果表明:分离杜鹃根际土壤得到了来源于5个属的11种细菌单菌落和来源于7个属的9种真菌单菌落;低海拔迎红杜鹃和高海拔迎红杜鹃的根际土壤中,分别具有5个和3个优势菌属;低海拔和高海拔的非根际土壤中,分别具有8个和9个优势菌属;杜鹃根际土壤中的菌种组成较非根际稳定,并且根际优势菌有一定的定向性;迎红杜鹃的根际细菌多样性大于照白杜鹃,但照白杜鹃根际优势菌属要多于迎红杜鹃;低海拔迎红杜鹃的根际细菌多样性和优势菌属都要大于高海拔迎红杜鹃。结论是海拔与种源对于杜鹃根际菌落组成与丰度有着显著的影响,杜鹃根际细菌的多样性与植物的物候期有关系,不同种源的杜鹃由于其根系分泌物的不同也导致了根际细菌多样性的差异。与高通量测序结果相比,本研究中分离得到的微生物种类明显较少,与前人的研究结果相一致。
杜鹃;根际微生物;鉴定;多样性
根际微生物是指存在于植物根系表面及其附近土壤中的微生物。植物根际具有极高的微生物多样性,是地球上最复杂的微生物群落之一。研究表明,植物根际定植的各种微生物细胞密度远大于植物体内细胞密度,同时根际微生物所拥有的基因数量也远远超过植物基因[1]。植物根际微生物与植物为互生关系,植物为微生物提供营养和能量物质,微生物为植物提供有效养分、维生素等,促进植物生长[2]。近年来,利用植物根际微生物来提高植物抗逆性的研究已经取得了一定的进展。杨培志研究表明,接种根瘤菌可大幅度提高紫花苜蓿的抗旱、耐盐、抗高温及根部机械损伤等非生物胁迫能力,苜蓿植株根瘤菌被激活的抗逆性远高于不激活的[3]。目前,已经有大量的有益菌种被筛选出来用于商业化生产,在提高作物抗逆性方面起到了重要的作用。
近年来,二代高通量测序技术不仅凭借其通量高,而且还能够同时分析上百份样品的优势,克服了传统变性梯度凝胶电泳(DGGE)、16SrRNA基因的末端限制性片段分析技术(T-RFLP)等技术检测限低、工作量大的缺点,成为解析复杂环境中微生物群落物种组成和相对丰度的首选工具[4]。细菌染色体上的16SrDNA是相对应的编码16SrRNA的DNA序列,具有丰富的遗传信息,其中的保守区可以反映物种间亲缘关系的远近,可变区可用来判定种间变异情况,非常适合用于进行种群分类和系统发育研究。通过高通量测序技术测序土壤微生物16SrDNA序列,来研究土壤微生物多样性,已在玉米、水稻、榨菜、欧美杨I-107等上有过报道[5-8]。Peiffer等[5]通过研究玉米根际微生物表明,利用16SV4区进行微生物多样性分析,可获得较好的微生物群落组成信息,不同种源对其根际微生物群落组成有影响的;根际与非根际微生物群落组成之间也存在较大差异,并且根际微生物的组成不受地理环境和栽培管理方式的影响。但是Edwards等[6]在水稻的根际微生物研究中发现,地理环境和栽培管理方式对水稻根际微生物的组成产生了一定影响。目前,通过二代高通量测序技术对植物根际微生物多样性研究已成为研究热点。
本试验通过对不同海拔和不同种源杜鹃根际微生物多样性进行研究,分析海拔和种源对杜鹃根际微生物群落组成的影响,并从杜鹃根际土壤中分离鉴定细菌和真菌,研究海拔、种源和根际微生物多样性之间的关系和得到利于杜鹃生长的根际菌种。
1 材料与方法
1.1 试验样品的采集
土壤材料取自北京市密云区西北部燕山山脉的云蒙山,东经为116°30′—116°50′,北纬为40°26′—40°38′,系燕山山脉的西南段,主峰海拔1 414 m,土壤为山地棕壤和淋溶褐土,土壤偏酸性[9]。土壤样品在2015年4月23日采集于云蒙山地区,在实地调查的基础上,选定了一处高海拔杜鹃居群和一处低海拔杜鹃居群,避开人为干扰因素,分别进行了采样。
在低海拔同一居群中取3株迎红杜鹃和3株照白杜鹃,在高海拔同一居群中取3株迎红杜鹃,采样地分布如表1所示。在每个居群采样地内,挖出杜鹃单株表层(10—20 cm)细根,采集直径0.2—0.5 cm的杜鹃细根,用抖落法获取细根上粘附的土壤作为根际土壤。采集对照组样品时,选择3处距离杜鹃居群根际较远的空地进行采样,采样深度为10—20 cm。土样采集完毕后装入已消毒的密封塑料袋中,并放入冰盒内运回实验室[10]。采集的样品置于-20℃保存,用于土壤总DNA的提取以及根际微生物的分离与鉴定。
1.2 试验方法
1.2.1 土壤总DNA的提取
将采集的15份样品,按类别各取1 g样品混匀(对应编号见表1),再从中取1 g样品进行土壤总DNA的提取,使用天根生化科技(北京)有限公司生产的土壤基因组DNA提取试剂盒(DP336),按操作说明对土壤总DNA进行提取和纯化。
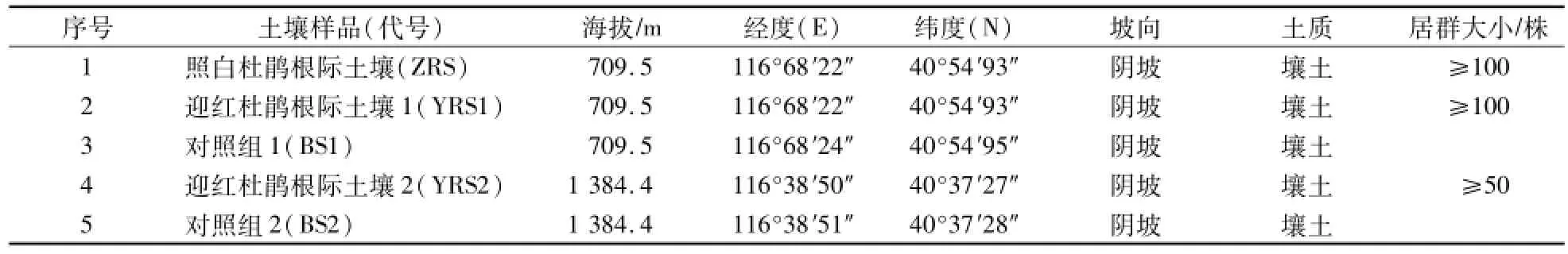
表1 采样地分布Table 1 Distribution of sam p le points
1.2.2 根际细菌16SrDNA V4区高通量测序
将提取的土壤总DNA委托北京诺禾致源生物信息科技有限公司进行二代测序。将经过PCR扩增检测合格的土壤样品的目的DNA利用16SrDNA V4区扩增,通过建库及Illumina公司升级后的HiSeq测序平台的PE250策略进行高通量双端测序,使用QIIME软件对测序数据拼接、过滤成Tags,根据Tags回归样品进行物种分类、细菌群落结构多样性分析以及多样品的比较分析。
1.2.3 杜鹃根际微生物的分离纯化
利用土壤稀释涂板法[11],将迎红杜鹃根际土壤稀释液分别涂布到牛肉膏蛋白胨培养基和马铃薯葡萄糖琼脂培养基(PDA)上,在室温下培养。待长出菌落后,挑取到新的培养基上,直到形成单一菌落。
1.2.4 杜鹃根际微生物的分子鉴定
提取各菌株基因组DNA,细菌采用引物515F/806R(515F:5’-CAGCMGCCGCGGTAA-3’;806R:5’-GACTACHVGGGTWTCTAAT-3’)扩增16SrRNA基因[5],真菌采用引物ITS4/ITS5(ITS4:5’-GGAAGTAAAAGTCGTAACAAGG-3’;ITS5:5’-TCCTCCGCTTATTGATATGC-3’)扩增ITS序列。PCR反应程序如下:94℃5 min;94℃40 s,54℃30 s,72℃40 s,37个循环;72℃10 min,4℃保存。扩增产物送至华大基因公司测序。
1.3 数据分析
二代测序结果使用QIIME软件对测序数据进行过滤,通过flash软件将reads进行拼接和过滤,得到高质量的Tags数据(Clean Tags),再去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)。利用Uparse软件对所有样品的全部Effective Tags进行聚类,将一致性(Identity)大于97%的序列聚为一个单位的OTU(Operational Taxonomic Unit)。用RDPClassifier方法与GreenGene数据库对OTUs序列进行物种注释分析,用R软件绘制土壤中菌群稀释曲线,并分别在各个分类水平统计各样本的群落组成。以样品中数据量最少的为标准,对各样品的数据进行均一化处理后用Qiime软件进行Alpha多样性分析,来评估各样品中微生物群落的物种丰富度和多样性。鉴定单菌落菌种时,将16SV4区序列在Green genes数据库进行比对,将ITS序列在Unit数据库进行比对。

图1 土壤样品总DNA的电泳结果Fig.1 Electrophoretic analysis of DNAs of soil sam p les
2 结果与分析
2.1 土壤样品总DNA的提取结果
利用1%琼脂糖凝胶电泳检测DNA的完整性,结果如图1。
从图1中可以看出,5种土壤样品中提取的总DNA条带清晰,说明提取到片段较完整,可以用于微生物多样性的后续分析。
2.2 杜鹃根际细菌群落结构多样性分析
2.2.1 测序质量
经过过滤后5个样品得到总拼接序列数(Raw tags)为209 040条,用于构建OTUs有效Tags数目(Effective Tags)为200 851条,达到96.08%。总检测到OTUs数为3 768个。由图2可知,各样品的稀释曲线均已趋于平坦,说明测序深度基本可以反映样品中绝大多数的微生物信息。相同杜鹃种间,低海拔迎红杜鹃的OTU数量高于高海拔迎红杜鹃。
2.2.2 根际与非根际土壤中细菌多样性比较
利用Uparse软件对5个样品的全部Effective Tags进行聚类,得到OTUs(Operational Taxonomic Units)。如图3所示,5个样品所共有的OTUs有1 121个,低海拔迎红杜鹃根际土壤特有140个OTUs,照白杜鹃根际土壤特有91个OTUs,高海拔迎红杜鹃根际土壤特有72个OTUs,低海拔非根际土壤特有229个OTUs,高海拔非根际土壤特有162个OUTs。低海拔和高海拔迎红杜鹃相比较时,其根际土壤的共有OTUs有1 629个,低海拔迎红杜鹃特有OTUs有999个,高海拔迎红杜鹃特有OTUs有390个。低海拔迎红杜鹃和照白杜鹃相比较时,其根际土壤的共有OTUs有 1 898个,迎红杜鹃特有OTUs有730个,照白杜鹃特有OTUs有429个。由此可见,低海拔迎红杜鹃根际土壤OTUs无论与同海拔的照白杜鹃相比,还是与高海拔迎红杜鹃相比,都有数量较高的OTUs。

图2 根际与非根际土壤中菌群稀释曲线Fig.2 Dilution curves of floras in rhizospheric and non-rhizospheric soils

图3 根际与非根际土壤微生物OTUs韦恩图Fig.3 Venn diagram of OTUs in rhizospheric and non-rhizospheric m icroorganism
根据物种注释结果,选取每个样品在门(Phylum)分类水平上最大丰度排名前10的菌门,生成菌种相对丰度图,如图4所示。5个样品在门分类水平上最大丰度排名前10的物种有变形菌门Proteobacteria(32.29%)、放线菌门Actinobacteria(17.19%)、酸杆菌门Acidoba cteria(16.45%)、疣微菌门Verrucomicrobia(696%)、WPS-2(5.63%)、芽单胞菌门Gemmatimonadetes(531%)、拟杆菌门Bacteroidetes(3.46%)、浮霉菌门Planctomycetes(3.45%)、绿弯菌门Chloroflexi(3.14%)和AD3(2.03%)。相对丰度大于10%的菌门为优势菌门,低海拔迎红杜鹃、照白杜鹃和高海拔迎红杜鹃根际土壤中共有的优势菌门有变形菌门Proteobacteria、酸杆菌门Acidobacteria和放线菌门Actinobacteria,其中高海拔迎红杜鹃根际土壤中WPS-2(12.40%)也为优势菌门。有研究结果表明变形菌门Proteobacteria、放线菌门Actinobacteria和酸杆菌门Acidobacteria在马铃薯等根际土壤中也为优势菌门[12]。
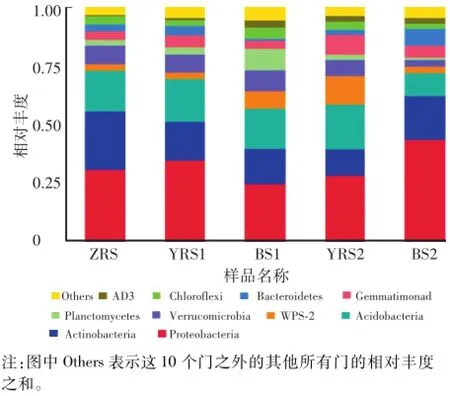
图4 5个样品在门分类水平上的相对丰度Fig.4 Relative abundances of phyla in 5 samp les
2.2.3 属水平的物种丰度热图分析
根据所有样品在属水平的物种注释及丰度信息,选取丰度排名前35的属,将每个属相对丰度经过标准化处理后得到Z值,据此绘制得到属水平的物种丰度热图,图中越偏向红色表示丰度越高,越偏向蓝色表示丰度越低,如图5所示。5份样品有相对较高的丰度差异。低海拔迎红杜鹃中Candi-datus-Solibacter等5个属、照白杜鹃中Granulicella等12个属、高海拔迎红杜鹃中Granulicella等3个属、低海拔对照中DA101等8个属、高海拔对照中Phaeobacter等9个属分别高于它们各自在5个样品中的平均含量。而且每个样品中丰度较高的菌属分别属于2—4个菌门,这表明每个样品的微生物多样性较高。
2.2.4 根际和非根际土壤细菌α多样性指数
利用Qiime软件对细菌OTUs进行分析得到5个样品细菌多样性指数(表2)。5个样品观测到的物种数在2 019—2 628种,低海拔迎红杜鹃观测物种数最大,高海拔迎红杜鹃观测物种数最小,两者相差609种。同样,5个样品Chao1丰度估值在2 247.821—2 887.327,低海拔迎红杜鹃Chao1丰度估值最大,高海拔迎红杜鹃Chao1丰度估值最小。观测物种和Chao1丰度估值两个参数的变化表明海拔对迎红杜鹃的根际微生物种类和丰度具有显著影响。5个样品香浓多样性指数均在8.8—9.8,表明所有样品的微生物多样性和丰度都较高,其中低海拔迎红杜鹃的指数最大,说明低海拔迎红杜鹃群落的多样性较高,物种分布最均匀。5个样品辛普森指数均在0993—0.997,都极其接近于1,这表明所有样品的微生物多样性和丰度都较好。

图5 属水平的物种丰度热图Fig.5 Species richness thermalm ap at genus level

表2 杜鹃根际和非根际土壤中细菌多样性指数Table 2 Bacterial diversity indexes in rhizospheric and non-rhizospheric soils
2.3 根际土壤微生物的分离与鉴定
2.3.1 根际细菌的分离与鉴定
使用牛肉膏蛋白胨培养基,涂布土壤菌液,不断地挑单菌培养,得到以下的细菌单培养菌株(图6)。
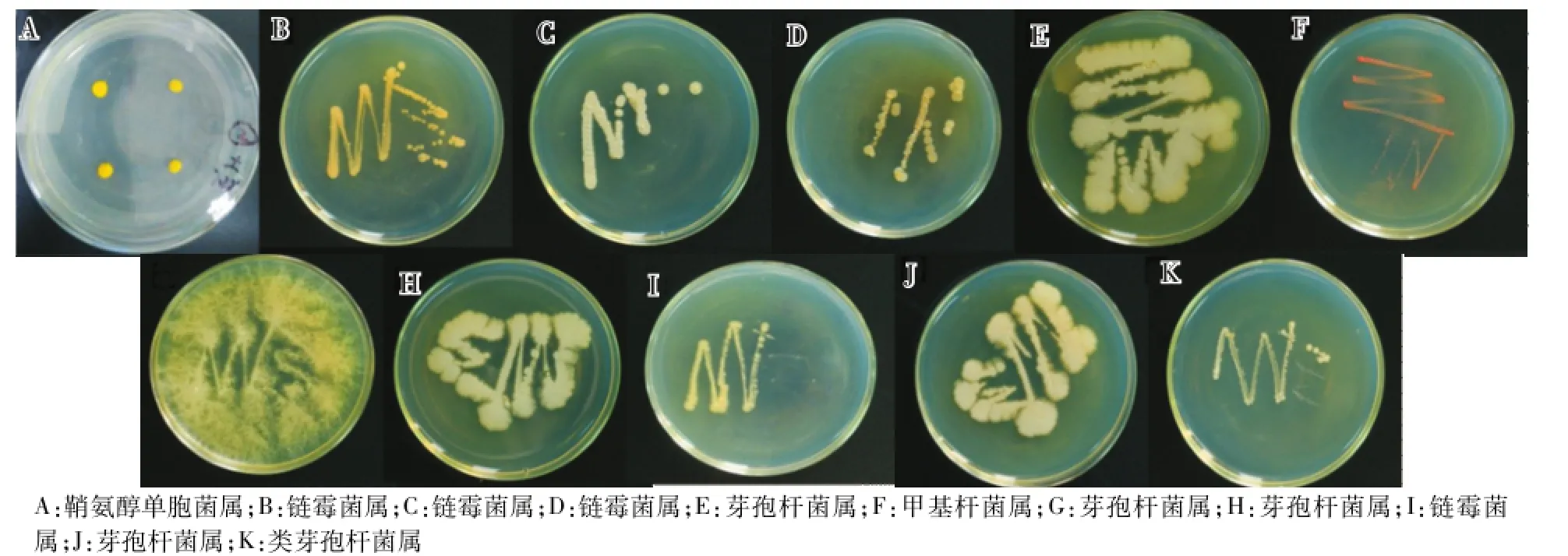
图6 细菌菌落Fig.6 Bacterial colonies
共分离得到11种细菌单菌落(表3),其中鞘氨醇单胞菌属、甲基杆菌属、类芽孢杆菌属各1种,链霉菌属、芽孢杆菌属各4种。所有的这些细菌菌属在高通量测序的结果中均被发现,鞘氨醇单胞菌属的相对丰度为0.33%,链霉菌属的相对丰度为0.24%,类芽孢杆菌属的相对丰度为0.05%,甲基杆菌属的相对丰度为0.05%,芽孢杆菌属的相对丰度为0.01%。其中一些细菌在其他植物根际土壤中也有发现,如在灰枣、水稻和草莓等根际土壤中均分离出芽孢杆菌属的细菌[11,13-14]。

表3 杜鹃根际微生物细菌测序结果Table 3 Sequencing results of bacteria in rhododendron rhizospheres
2.3.2 根际真菌的分离与鉴定
使用PDA培养基,涂布土壤菌液,不断地挑单菌培养,得到以下的真菌单培养菌株(图7)。
共分离得到9种真菌单菌落(表4),其中球腔菌属、格孢腔菌属、拟层孔菌属、被孢霉属、Ceratobasidium、毛霉属各1种,青霉属3种。其中有一些真菌在其他植物根际土壤中也有发现,如张海龙等[15]在银杏根际分离到毛霉属真菌,颜艳伟等[16]在花生的根际分离到青霉属真菌等。

图7 真菌菌落Fig.7 Fungal colonies

表4 杜鹃根际微生物真菌测序结果Table 4 Sequencing results of fungi in rhododendron rhizospheres
3 讨论与结论
3.1 讨论
云蒙山位于燕山山脉的西南段,主峰海拔1 414 m,土壤为山地棕壤和淋溶褐土,土壤偏酸性。该山的植物种类十分丰富,林木以原始次生林为主,有着91%以上的森林覆盖率。
根际细菌群落的构建尤其依赖于根系-微生物互作体系中信号分子的产生[17]。寄居在根际的细菌多数对植物是有益的,它们能够供给植物无机营养,增强植物对氮素的摄入,同时也能保护植物免受病原菌的侵袭[18-20]。因此,根系与微生物的互作效应使根际和非根际土壤细菌在组成和结构上产生了显著差异。本研究表明,杜鹃的根际与非根际土壤中优势菌的种类和数量均具有一定差异。低海拔迎红杜鹃和高海拔迎红杜鹃的根际土壤中,分别具有5个和3个优势菌属;低海拔迎红杜鹃和高海拔迎红杜鹃的非根际土壤中,分别具有8个和9个优势菌属。说明根际土壤中的菌种组成较非根际稳定,这也与其根际的特殊功能相适应,而非根际由于其不担负某一特殊功能,容易受到其他微生物或外来侵入体的干扰,其较高的异质性导致其优势菌的组成具有多样性。低海拔迎红杜鹃和高海拔迎红杜鹃的根际土壤中,优势菌属均来自于变形菌门Proteobacteria和酸杆菌门Acidobacteria,而其对照中还有若干优势菌属来自于其他菌门,这说明杜鹃根际的特殊环境决定了其优势菌的定向性。变形菌门类包括很多可以进行固氮的细菌,酸杆菌门有许多对植物残体降解起到重要作用的菌种,还参与土壤中的铁循环,这些特性都与根际微生物帮助寄主同化养分、增强抗逆性相一致[21-22]。
杜鹃根际土壤中的优势菌属中,已知其功能的有红游动菌属Rhodoplanes、诺卡氏菌属Nocardioides、分枝杆菌属Mycobacterium、伯克霍尔德氏菌Burkholderia、链霉菌属Streptomyces、鞘氨醇单胞菌属Sphingomonas和假单胞菌属Pseudomonas,它们主要属于变形菌门Proteobacteria、放线菌门Actinobacteria和酸杆菌门Acidobacteria。红游动菌Rhodoplanes是兼性厌氧光养菌,光照厌氧和黑暗好氧条件下均能很好生长,红游动菌的存在说明高海拔迎红杜鹃的根际土壤含氧量适中,通气性良好,适宜好氧菌的生长。诺卡氏菌Nocardioides主要以好气性腐生菌为主,少数为厌气性寄生菌,能够分解各种碳水化合物,有的能利用碳氢化合物、纤维素等,根际土壤中的诺卡氏菌同化土壤中的腐殖质,为杜鹃生长提供营养物质。分枝杆菌属Mycobacterium又称抗酸性杆菌属,这与杜鹃的根际酸性土壤环境是相一致的。链霉菌属Streptomyces、假单胞菌属Pseudomonas和鞘氨醇单胞菌属Sphingomonas有较强分解有机物的能力,可以将多种有机物作为能量来源,样地中的杜鹃根际土壤腐殖质较多,这为杜鹃根际有机物的分解与吸收提供了保证。同时,通过对迎红杜鹃根际土壤微生物的分离纯化及鉴定,得到了11个属的微生物,真菌7个属,细菌4个属,细菌的菌属数量远远少于通过高通量测序得到的菌属数量,原因是自然环境中99%以上的微生物不可用实验室纯培养的方法获得[23],其中芽孢杆菌属菌株,凭借其较强保湿性、较强的抑菌能力、较强有机质分解力产生丰富的代谢生成物等特点,已被广泛地用于菌剂的生产。试验中分离鉴定出的真菌大部分为腐生具有分解动植物体残躯形成有机酸的能力,如青霉属、拟层孔菌属、毛霉属,这有利于根际吸收营养物质,促进杜鹃生长。杜鹃非根际土壤中的优势菌属中,已知其功能的有乳杆菌属Lactobacillus、弧菌属Vibrio和脱硫叠球菌属Desulfosarcina。乳杆菌属Lactobacillus的分解产物是乳酸,弧菌Vibrio也能分解有机物产酸,它们的这一特性与云蒙山的土质偏酸性相一致。脱硫叠球菌属Desulfosarcina是一种厌氧的微生物,采样时观察到非根际土壤的疏松性较差,含氧量较少,它的存在也验证了这一点。
本研究中相同较低海拔高度的迎红杜鹃和照白杜鹃根际土壤的细菌多样性存在一定差异,由香浓多样性指数和Chao1丰度估计指数可知,迎红杜鹃的根际细菌多样性大于照白杜鹃,但照白杜鹃根际优势菌属要多于迎红杜鹃。在不同的植物根际土壤中,也有过类似的报导,陈林等研究发现,不同玉米品种根际微生物的活性和群落结构不同[24];Peiffer等[5]的研究发现玉米种源对于根际土壤细菌的α多样性有着重大影响。Bulgarelli等[25]提出的关于植物根系微生物区系形成的机理表明,宿主植物种源会主动调整根面和内生菌的生长过程,形成该植物所特有的根系核心微生物区系。这可能是由于杜鹃不同的种源决定了其根际根系分泌物的不同,而根系分泌物是介导根系-微生物互作关系的重要媒介,根系分泌物的不同决定了其根际细菌多样性的差异。本研究中迎红杜鹃根际土壤取自两个不同的海拔,通过由香浓多样性指数和Chao1丰度估计指数可知,低海拔迎红杜鹃的根际细菌多样性要大于高海拔迎红杜鹃,且低海拔迎红杜鹃根际优势菌属要多于高海拔迎红杜鹃。它们之间细菌多样性差异的产生可能主要是由于海拔的不同引起的,说明杜鹃根际细菌的多样性与植物的物候期有关系,采样时正值低海拔迎红杜鹃的花期,新陈代谢旺盛;高于高海拔迎红杜鹃还未萌发新芽,新陈代谢缓慢,这些直接影响到根系对营养物质的吸收。同样,也有研究表明土壤类型是根际微生物群落结构的决定性因素,而生长阶段和种源对根际有一定的调节作用[25-26]。
3.2 结论
北京云蒙山杜鹃根际土壤细菌以变形菌门Proteobacteria、放线菌门Actinobacteria和酸杆菌门Acidobacteria为主;迎红杜鹃根际与非根际的优势菌属不完全来自于相同的菌门;照白杜鹃的根际优势菌属多于迎红杜鹃,但迎红杜鹃根际细菌多样性大于照白杜鹃;低海拔迎红杜鹃根际细菌多样性和优势菌属都大于高海拔迎红杜鹃。本研究表明,杜鹃的根际与非根际的空间差异、种源差异、生长地的海拔差异都会影响土壤微生物多样性及其群落结构组成。
总之,杜鹃的根际与非根际的空间差异、种源差异、生长地的海拔差异都会影响土壤微生物多样性的组成,森林生态系统极其复杂,杜鹃根际土壤菌群分布受地形、植被、土壤营养与健康、人类干扰等多种因素影响,以及环境因素之间的相互影响作用,还有待于进一步的研究。
[1]MENDESR,GARBEVA P,RAAIJMAKERS JM.The rhizosphere microbiome:significance of p lant beneficial,plant pathogenic,and human pathogenicmicroorganisms[J].Fems Microbiology Reviews,2013,37(5):634-663.
[2]林辉锋.不同水分条件下化感水稻根际功能微生物研究[D].福州:福建农林大学,2010.
[3]杨培志.紫花苜蓿根瘤菌共生对干旱及盐胁迫的响应机制研究[D].杨凌:西北农林科技大学,2012.
[4]RINKE C,SCHWIENTEK P,SCZYRBA A,et al.Insights into the phylogeny and coding potential ofmicrobial dark matter[J].Nature,2013,499(7459):431-437.
[5]PEIFFER JA,SPOR A,KOREN O,et al.Diversity and heritability of themaize rhizospheremicrobiome under field conditions[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(16):6548-6553.
[6]EDWARDS J,JOHNSON C,SANTOSMEDELL/N C,et al.Structure,variation,and assembly of the root-associated microbiomes of rice[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(8):911-920.
[7]王殿东,谭永忠,田雪亮,等.茎瘤芥(榨菜)根肿病不同发病时期根际土壤真菌群落变化特征的高通量分析[J].中国蔬菜,2016(5):33-37.
[8]汪其同,朱婉芮,刘梦玲,等.基于高通量测序的杨树人工林根际和非根际细菌群落结构比较[J].应用与环境生物学报,2015,21(5):967-973.
[9]陈建梅,王钊宇,张立娜,等.基于ITS条形码技术分析北京云蒙山杜鹃花属遗传多样性[J].中国农学通报,2014,30(25):43-48.
[10]张矛宇,李强,张杰,等.中国新疆火焰山土壤环境及细菌群落结构[J].应用与环境生物学报,2015,21(1):155-163.
[11]赵娟,刘涛,潘磊,等.元阳梯田地方水稻品种根部内生菌及根际微生物的分离与鉴定[J].应用生态学报,2015,26(12):3737-3745.
[12]WEINERT N,PICENO Y,DING G C,et al.PhyloChip hybridization uncovered an enormous bacterial diversity in the rhizosphere of different potato cultivars:many common and few cultivar-dependent taxa[J].Fems Microbiology Ecology,2011,75(3):497-506. .
[13]孙林琦,郭艺鹏,王海儒,等.新疆枣园土壤解钾微生物菌株筛选及鉴定[J].经济林研究,2014,32(4):58-62.
[14]汪雪静,卜春亚,靳永胜,等.草莓根腐病菌拮抗细菌的分离与鉴定[J].园艺学报,2011,38(9):1657-1666.
[15]张海龙,李善春,卢维浩,等.银杏内生真菌多样性与产黄酮类物质真菌的分离和鉴定[J].土壤,2015,47(1):135-141.
[16]颜艳伟,张红,刘露,等.连作花生田根际土壤优势微生物的分离和鉴定[J].微生物学报,2011,51(6):835-842.
[17]PETRA M,DAVIDC,CHING HONGY.Developmentof specific rhizosphere bacterial communities in relation to plant species,nutrition and soil type[J].Plant Soil,2004,261:199-208.
[18]UROZ S,CALVARUSO C,TURPAULT M P,et al.Effect of the mycorrhizosphere on the genotypic and metabolic diversity of the bacterial communities involved in mineralweathering in a forest soil[J].Applied&Environmental Microbiology,2007,73(9):3019-3027.
[19]COCKING EC.Endophytic colonisation of p lant roots by nitrogen-fi xing bacteria[J].Plant Soil,2003,252:169-175.
[20]BERG G,ZACHOW C,LOTTMANN J,et al.Impact of plant species and site on rhizosphere-associated fungi antagonistic to Verticillium dahliae Kleb[J].Appl Environ Microbiol,2005,71:4203-4213.
[21]SPAIN A M,KRUMHOLZ L R,ELSHAHED M S.Abundance,composition,diversity and novelty of soil Proteobacteria[J].Isme Journal,2009,3(8):992-1000.
[22]LUGTENBERG B,KAMILOVA F.Plant-growth-promoting rhizobacteria[J].Ann Rev Microbiol,2009,63:541-556.
[23]KAMAGATA Y,TAMAKIH.Cultivation of Uncultured Fastidious Microbes[J].Microbes Environments,2005,20(2):85-91.
[24]陈林,张佳宝.玉米品种对根际微生物特性的影响[J].中国农学通报,2014,30(15):62-67.
[25]BULGARELLID,SCHLAEPPIK,SPAEPEN S,et al.Structure and functions of the bacterialmicrobiota of plants[J].Annual Review of Plant Biology,2013,64(1):807-838.
[26]LUNDBERG D S,LEBEISSL,PAREDESSH,etal.Defining the core Arabidopsis thaliana rootmicrobiome[J].Nature,2012,488(7409):86-90.
(责任编辑:程智强)
Isolation,identification and diversity analysis of rhododendron rhizospheric m icroorganism
ZHOU Tian-tian1,DING Rong1,CAI Jian-chao1,ZHAO He-wen1,2,3,CUI Jin-teng1,2,3
(1Faculty of Landscaping,Beijing Agricultural College,Beijing 102206,China;2Beijing Laboratory of Urban and Rural Ecological Environment,Beijing 102206,China;
3Beijing Engineering Research Center of Rural Landscape Planning and Design,Beijing 102206,China)
In order to find out the effects of altitude and provenance on rhododendron rhizospheric colony composition,both rhizospheric and non-rhizospheric soils of the only two species ofwild rhododendron in Beijing(Rhododendron mucronulatum and R.micranthum)were sampled at different altitudes,the bacterial and fungal purification and theirmolecular identification weremade,and the soil DNAswere extracted and sequenced by a second-generation high-throughput sequencing.Also the impacts of different factors on the colony composition and abundance were analyzed according to the sampling sites’natural conditions.The results showed that isolating the rhizospheric soils obtained 11 species of bacteria under 5 genera and 9 species of fungi under 7 genera;The R.mucronulatum rhizospheric soils at low and high altitudes had 5 and 3 dominantgenera respectively;The non-rhizospheric soils at low and high altitudes had 8 and 9 dominant genera respectively;The bacterial composition of rhododendron rhizospheric soilswasmore stable than thatof non-rhizospheric soils and the dominantgenera of rhizosphere had a certain directive property;The bacterial diversity of R.mucronulatum rhizosphere was greater than thatof R.micranthum rhizosphere,but the dominant genera of R.mucronulatum rhizosphere were less than those of R.micranthum rhizosphere;Both bacterial diversity and dominantgenera of R.mucronulatum rhizosphere at low altitude were greater than those at high altitude.It was concluded that both altitude and provenancesignificantly influenced the colony composition and abundance of rhododendron rhizosphere,and the bacterial diversity of rhododendron rhizosphere had a relationship with plantphenological phases and was differentbetween different-provenance rhododendrons due to their different root exudates.Compared with the high-throughput sequencing result,the microbial species obtained by isolation was obviously less,which was identical with previous studies.
Rhododendron;Rhizospheric microorganism;Identification;Diversity
S154.3;S685.21
:A
1000-3924(2017)02-063-08
10.15955j.issn1000-3924.2017.02.12
2016-08-08
北京市科技提升计划(TJSHG201310020020);北京市属高等学校创新团队建设项目(IDHT20150503)
周田田(1991—),女,在读硕士,森林培育专业。Tel:18811311366,E-mail:1058363745@qq.com
赵和文Tel:010-80799122,E-mail:zhaohewen6@sina.com;崔金腾Tel:010-80797210,E-mail:cuijinteng@163.com
