黔西南地区超广普β-内酰胺酶肺炎克雷伯菌耐药研究
2017-05-18王兴林文德学
王兴林,李 莹,文德学
(贵州省黔西南州人民医院检验科,贵州 黔西南 562400)
・临床交流・
黔西南地区超广普β-内酰胺酶肺炎克雷伯菌耐药研究
王兴林,李 莹,文德学
(贵州省黔西南州人民医院检验科,贵州 黔西南 562400)
目的研究本院肺炎克雷伯菌产超广普β-内酰胺酶(ESBLs)的流行情况及其基因类型和耐药情况,为临床上治疗肺炎克雷伯菌相关疾病提供合理用药方案。方法随机选取本院200株肺炎克雷伯菌,采用双纸片确证法确定产超广普β-内酰胺酶的流行情况,通过PCR基因扩增技术确定ESBLs的基因类型,通过自动微生物鉴定系统药敏实验观察ESBLs的耐药性。结果① 本院ESBLs的检出率为32.5%,在200株中65株被检出;②65株ESBLs中,37例(56.9%)为CTX-M基因型,6株(9.2%)为SHV基因型,7株(10.8%)为TEM型,两种基因型9株(13.8%),三种基因型共6株(9.2%);③产超广谱β-内酰胺酶组和非产超广谱β-内酰胺酶组中,耐药性分布是不同的,产超广谱β-内酰胺酶组对头孢唑林和头孢噻肟的耐药率为100%,而对哌拉西林/他唑巴坦、亚胺培南、美洛配能的耐药率最低。结论本院以CTX-M基因型ESBLs为主,此外也可以看到SHV基因型和TEM基因型,通过本研究ESBLs基因型的检测,可以更好的指导临床上治疗肺炎克雷伯菌的抗菌素的使用。
肺炎克雷伯菌,β-内酰胺酶,基因,耐药
肺炎克雷伯菌在临床上属于常见的菌属,产β-内酰胺酶是细菌对β-内酰胺类抗生素产生耐药性的主要原因之一[1],此外第三代头孢类药物在临床上的广泛使用,细菌逐渐能产生能水解第三代头孢类药物的超广谱β-内酰胺酶。目前对于产超广谱β-内酰胺酶的肺炎克雷伯菌的临床报告越来越多。因为在国内外均有由产超广谱β-内酰胺酶的肺炎克雷伯菌引发的全院内的爆发性感染[2]。因此此类菌种也被视为医院内重点监控菌种,此类菌种在临床上往往表现为多药耐药性,为了能有效的控制此类菌种在当地的传播,更加准确的指导临床上抗菌药的使用,准确检验此类菌种是十分必要的,本院是黔西南地区的三级医院,收入的患者来至黔西南地区不同区域,从而可以间接的反应黔西南地区的肺炎克雷伯菌的基因及耐药情况。对我院2013年1月到2014年5月我院分离出的200株肺炎克雷伯菌进行超广谱β-内酰胺酶进行检验,并且对肺炎克雷伯菌的基因型进行分析。
1 研究样本及方法
1.1 研究样本
本研究所有的分离200株肺炎克雷伯菌均来自本院2013年1月到2014年5月我院住院部的患者。
1.2 超广谱β-内酰胺酶的检验
本研究采用的是双纸片确证法,所用试剂如表一。对两个纸片在加了克拉维酸后,测量抑菌环的直径,如果直径大于5cm,便视为产超广谱β-内酰胺酶。

表1 标准纸片确证法药敏纸片
1.4 超广谱β-内酰胺酶基因检验
采用平板划分离分经标准纸片确证法检验为超广谱β-内酰胺酶肺炎克雷伯菌的所有菌种,然后进行培养,温度设定为35度,培养时间为16~20 h。将细菌加入100 uL的TE缓冲液中,在100℃下进行细菌裂解,裂解时间为10 min。在经20000rpm离心5分钟后,去上清液5 mL作为本研究的模版。100 mL反应体系中,含有dNTP200nM,模版5 mL,Taq聚合酶1U,Mg1.5nM。反应条件为:预变性温度设置为94摄氏度,反应时间为1分钟,变性温度设定为94℃,时间为1 min。退火45秒。25个循环,在72℃下延伸5 min。最后采用1%的琼脂糖凝胶电泳,并且在紫外灯下观察研究的结果。

表2 引物序列及退火温度
1.5 肺炎克雷伯菌药敏试验
本研究使用美国BD Phoenix100全自动微生物鉴定及药敏分析仪,其配套阴性药敏分析板条含氨苄西林、阿米卡星、氯素霉、环丙沙星、头孢唑林、庆大霉素、左旋氧氟沙星、哌拉西林、复方新诺明、哌拉西林/他唑巴坦、阿莫西林/克拦维酸、氨曲南、头孢他啶、头孢噻肟、头孢吡肟、亚胺培南、美洛配能、氨苄西林/舒巴坦、四环素,头孢哌酮/舒巴坦采用纸片法。药敏实验使用肺炎克雷伯菌ATCC10031作为质量控制菌株。
1.6 统计学方法
采用卡方检验比较产超广谱β-内酰胺酶组和非产超广谱β-内酰胺酶组耐药性分布的情况。效验值取0.05。
2 结 果
2.1 超广谱β-内酰胺酶的检验结果
200株肺炎克雷伯菌中检出超广谱β-内酰胺酶肺炎克雷伯菌65株(32.5%),产超广谱β-内酰胺酶菌种中,对头孢他啶耐药的有54株(83.1%),对头孢噻肟/头孢他啶耐药15株(23.1%)。非产超广谱β-内酰胺酶菌种中,对头孢他啶耐药的有6株(13.3%),对头孢噻肟/头孢他啶耐药7株(15.6%)。
2.2 基因型检验结果
本研究用5中基因引物65株超广谱β-内酰胺酶肺炎克雷伯菌进行基因检验,结果显示有37例(56.9%)为CTX-M基因型,6株(9.2%)为SHV基因型,7株(10.8%)为TEM型,两种基因型9株(13.8%),三种基因型共6株(9.2%)。在本研究中,未见PER,VEB基因型。详见表三、图1到3。

表3 65株超广谱β-内酰胺酶肺炎克雷伯菌基因型分布
2.3 药敏试验结果
200株肺炎克雷伯菌对肺炎克雷伯菌的耐药情况如表四。应用卡方检验比较产和非产超广谱β-内酰胺酶耐药情况显示,两组间的在耐药率上的分布是不一致的,有显著性差异(x2=41.473,P<0.05),其中产超广谱β-内酰胺酶组对头孢唑林和头孢噻肟的耐药率为100%,而对哌拉西林/他唑巴坦、亚胺培南、美洛配能的耐药率最低,产超广谱β-内酰胺酶组内可见三种基因型对哌拉西林/他唑巴坦、亚胺培南、美洛配能不产生耐药性,但检出CTX-M+TEM+SHV的菌种对哌拉西林/他唑巴坦、亚胺培南、美洛配能有耐药性,分别为37.5%、25%、25%。同时两种基因型对哌拉西林/他唑巴坦、亚胺培南、美洛配能也均产生耐药性。
3 讨 论
肺炎克雷伯菌从细胞壁结构上划分为革兰阴性杆菌,按照异化作用进行区分为兼性厌氧型。肺炎克雷伯菌因为毒力强,致死率高等特点,一直以来都是临床上重点观察的病原菌之一[3]。由于第三代头孢类药物的不合理使用,使得产超广谱β-内酰胺酶的肺炎克雷伯菌的检出率在逐年的增高,ESBLs能通过质粒介导能水解第三代头孢类药物药物,但是这样的质粒介导可通过克拉维酸进行抑制[4]。本研究纳入的黔西南地区200株菌种中ESBLs的检出率为32.5%,与贵州省ESBLs的检出率相近,贵州省的为30.26%[5],同时在全国范围内比较,本院ESBLs的检出率高于全国的ESBLs的检出率28.1%[6]。

图1 肺炎克雷伯菌SHV基因扩增产物电泳图
图2 肺炎克雷伯菌TEM基因扩增产物电泳图

图3 肺炎克雷伯菌CTX-M基因扩增产物电泳图
基因型分析
本研究结果显示,基因结果显示在本地区以CTX-M基因型为主,检出率为83.5%,其中单纯CTX-M基因型56.9%,CTX-M+SHV和有CTX-M+TEM总计13.3%,CTXM+TEM+SHV为9.2%。研究显示,CTX-M型是非TEM和SHV型,其来源上并非遗传,可能是通过一些肠杆菌科细菌染色体上的天然的β-内酰胺酶获得[7]。CTX-M基因型在我国为主要的类型,同时在广州也是以CTX-M型为主[8]。产超广谱β-内酰胺酶的肺炎克雷伯菌中SHV基因型检出率为29.2%,单纯SHV基因型为9.2%,而CTX-M+SHV为7.7%,CTX-M+TEM+SHV为9.2%。此外TEM基因型检出率为29.3%,单纯TEM基因型为10.8%,而CTX-M+TEM为 6.2%,CTX-M+TEM+SHV为9.2%。SHV基因型和TEM基因型,在我国并不是主要的肺炎克雷伯菌基因类型[9],相反在美国、法国等国家是主要的主要流行的基因型[10]。在国内不同区域也是不一致的,在山西则是以TEM基因型为主[11]。
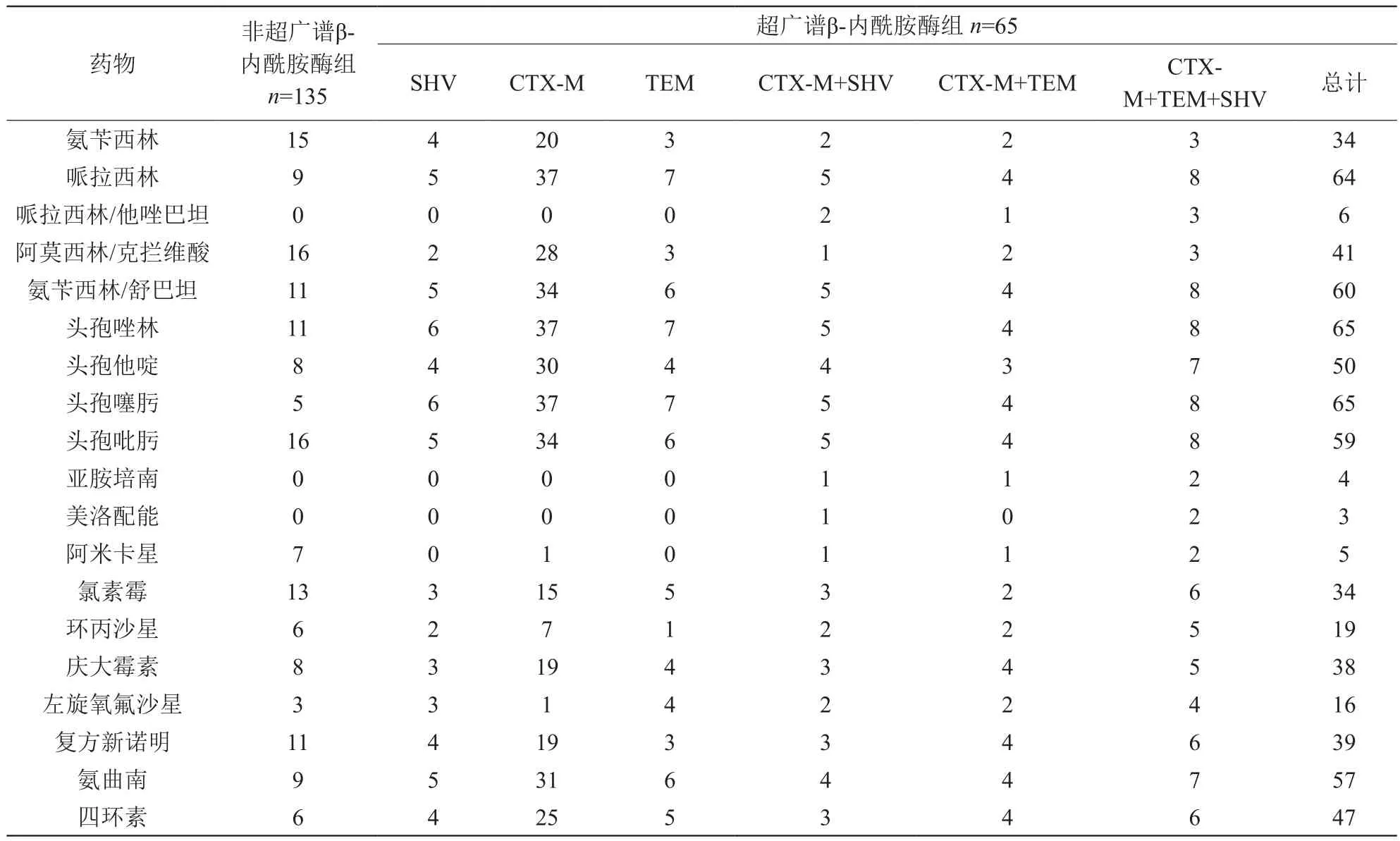
表4 200株肺炎克雷伯菌耐药情况
不同基因型耐药性分析
CTX-M基因型的肺炎克雷伯菌的水解底物为青霉素类的抗生素,包括了第一代和第二代青霉素类抗生素,有研究显示对于第三代青霉素类抗生素具有选择性,其对于头孢噻肟的选择性高于头孢吡肟,会优先水解头孢噻肟,有部分的CTX-M基因型的肺炎克雷伯菌可水解头孢吡肟,这可能是与CTX-M基因型的不同类型有关[12]。从本研究的中CTX-M基因型的药敏实验可以证实这个观点,37株CTX-M基因型中,全部菌株对头孢噻肟耐药,而头孢吡肟的耐药率为34株(91.9%)。但是从头孢吡肟药敏结果来看,头孢吡肟的耐药性较高,可能是CTX-M基因上的一些氨基酸位点发生改变导致对头孢吡肟的水解能力增强。同时在CTX-M基因还存在交叉耐药性,除青霉素类外,也具有耐药性,这可能是CTX-M基因肺炎克雷伯菌通过转化、接合和转导能方式,获得相关的耐药基因。此外药敏研究显示单纯CTX-M基因肺炎克雷伯对亚胺培南和美洛配能没有产生耐药性。
同时SHV基因型和TEM基因型在本研究中,对于头孢噻肟的耐药性是高于头孢吡肟,[13]。有研究显示SHV基因型对头孢噻肟的耐药性是高于头孢吡肟,本研究从侧面也反应这点[14]。对于TEM基因型有研究显示,其对于头孢他啶的水解能力要高与头孢噻肟,但是在本研究中头孢他啶的耐药性是低于头孢噻肟[15]。这可能是与本地区头孢他啶的使用相关。本研究中SHV基因型和TEM基因型的肺炎克雷伯菌对于亚胺培南和美洛配能显示出高的敏感性。
随着第三代头孢菌素类药物的使用,产超广谱β-内酰胺酶的肺炎克雷伯菌的的检出增加。对其流行状况、基因类型和耐药性进行监测,可切断产超广谱β-内酰胺酶的肺炎克雷伯菌的相关的耐药质粒传播途径,指导临床上抗肺炎克雷伯菌的使用,减少肺炎克雷伯菌在院内的感染。
[1] 陈 键.老年呼吸科患者感染产超广谱β-内酰胺酶肺炎克雷伯菌耐药分析[J]. 临床肺科杂志,2016(1):51-53.
[2] 黄文辉,陈媛.产超广谱β-内酰胺酶的检测及院内感染的分布[J].医学争鸣, 2009(22):2646-2646.
[3] 李艳萌.肺炎克雷伯分离株耐药性和毒力基因的相关性研究[D].苏州大学,2015.
[4] 史宝玉,谭晓武,姜 艳.产超广谱β-内酰胺酶大肠埃希菌和肺炎克雷伯菌的耐药性调查分析[J].中国实验诊断学,2015(5):765-769.
[5] 陈 敏,朱张国,高 奇,等.76株肺炎克雷伯菌感染及耐药性的分析[J]. 医学综述,2010,16(3):474-476.
[6] 李 耘,李家泰.ESBLs在大肠埃希菌、肺炎克雷伯菌和阴沟肠杆菌中的检出率及耐药情况比较[J].中国抗生素杂志,2005,30(3):151-158.
[7] 黄义山,蔡 燕,易成凤,等.四川北部地区肠杆菌科细菌产ESBLsCTX-M亚型研究[J].中国继续医学教育,2015(13):20-21.
[8] 肖庆忠,苏丹虹,江洁华,等.广州地区革兰阴性杆菌CTX-M和OXA型广谱β-内酰胺酶基因分型研究[J]. 中华医院感染学杂志,2005,15(12):1321-1326.
[9] 姚 杰,徐元宏,贾建安,等.产CTX-M酶肠杆菌科细菌耐药性及其相关耐药基因研究[J].中华医院感染学杂志,2011,21(14):2874-2877.
[10] 胡龙华,余方友,熊建球,等.肺炎克雷伯菌临床分离株产超广谱β-内酰胺酶的基因型研究[C]// 中华医学会第七次全国检验医学学术会议资料汇编.2008.
[11] 蔡朝民,程明刚,刘香萍,等.产ESBLs肺炎克雷伯杆菌SHV型β-内酰胺酶临床研究[J].中国热带医学,2013,13(12):1528-1529.
[12] 周 翼,魏 威.产超广谱β-内酰胺酶大肠杆菌耐药性分析及耐药基因检测[J].检验医学与临床,2015(13):1935-1937.
[13] 刘 丁,陈 萍,王 政,等.产超广谱β-内酰胺酶肺炎克雷伯菌耐药性和基因分型研究[J].中国病原生物学杂志,2008,3(11):810-811.
[14] 史伟峰,王玉月,李美忠,等.产超广谱β-内酰胺酶的肺炎克雷伯菌相关耐药基因研究[J].检验医学,2009,24(3):215-218.
[15] 王喜仁.大肠埃希菌和肺炎克雷伯菌对头孢菌素的耐药性与ESBLs基因分型研究[D].青岛大学,2013.
本文编辑:李 豆
R563.1
B
ISSN.2095-8242.2017.13.2395.04
课题名称:产超广谱β-内酰胺酶肺炎克雷伯菌耐药性分析(课题编号:2013-44)
