芦丁的光谱分析
2017-05-18韩宝来李元元张玲玲翟广玉
韩宝来,李元元,张玲玲,翟广玉
(1.河南应用技术职业学院 医药学院,河南 开封 475004;2.郑州工业应用技术学院 医学院,河南 郑州 450052;3.郑州工业应用技术学院 医学院,河南 郑州 450052)
芦丁的光谱分析
韩宝来1,李元元1,张玲玲2,翟广玉3*
(1.河南应用技术职业学院 医药学院,河南 开封 475004;2.郑州工业应用技术学院 医学院,河南 郑州 450052;3.郑州工业应用技术学院 医学院,河南 郑州 450052)
通过UV、IR、1H NMR、13CNMR、MS、TG、DSC等指纹图谱特征,对芦丁的结构、成分及特性进行了解析。结果表明,在255nm和375nm有两个最大紫外吸收峰;红外吸收峰分别是:羰基υC=O1655.03cm-1,苯环骨架振动频率υC=C1603.69cm-1,羟基υ-OH3423.42cm-1;1H NMR谱中主要氢原子的归属:δ12.48(5-OH)、10.77(7-OH)、9.35(4′-OH)、9.29(3′-OH);13C NMR归属δ 178.0(C-4),164.6(C-7),161.5(C-9),157.9(C-5),157.1(C-2);加热经过三次失重,样品结构发生完全分解;质谱提供了基本裂解途径。为芦丁及其衍生物的研究生产和质量控制提供可靠的指纹图谱数据。
黄酮;芦丁;热分析;指纹图谱;质量控制
前言
芦丁(槲皮素—3—芦丁糖苷,图1)广泛分布在多种植物中[1],如水果(橙子、葡萄柚、柠檬、大枣、杏等),中草药(槐米、芸香、荞麦、沙棘、山楂、桉树叶、毛冬青、连翘、银杏、柴胡、绞股蓝等)。其中以槐米、荞麦、桉树叶含量最高,可作为提取芦丁的原料。我国是芦丁生产消费大国,目前国内主要从槐米和荞麦中提取,年需求量达1000t左右。国际市场欧洲,法国、比利时是芦丁产品的消费大国,我国芦丁年出口量在500 t左右[2]。
芦丁具有多方面的生理活性。有助于保持及恢复毛细血管的正常弹性,调节毛细血管壁渗透性的作用,临床上用于治疗过敏性紫癜及各种因毛细血管脆性增加而引起的出血性疾病,如便血,尿血,吐血,子宫出血、视网膜出血等,也用于治疗高血压和老年气管炎等,此外它还有抗菌和抗放射作用。芦丁可以直接作为药品,也用于复配和作为药物的中间体,是芦丁片、复方芦丁片和合成维脑路通(羟乙芦丁)的主要原料[3]。
芦丁对人们的健康有重要作用,它具有清除自由基的功能[4],如清除羟基自由基、氧自由基、过氧化氢自由基等,这些自由基可导致人体多种疾病。芦丁还具有抗氧化[5]、抗炎[6]、抗癌[7~8],保护心脑血管的作用[9],还是有效的金属离子螯合剂[10]。螯合治疗是减缓重金属中毒的首选疗法[11],螯合剂能与引起中毒的重金属离子牢固地结合成螯合物,从体内排泄出去,达到解毒的目的。
目前,芦丁及其衍生物的研究是一个热点[12]。因为芦丁药理作用显著,使用安全。为建立中药提取生产质量管理规范,促进植物提取物质量标准化,发展多种快速、有效、操作简便、适于推广的质量控制检测方法十分必要。因此,制定芦丁的质量检测标准也迫在眉睫。作者结合本课题组多年来对芦丁的系列研究成果与经验,特撰写本文以供参考。通过UV、IR、1H NMR、13CNMR、MS、热分析等指纹图谱特征解析,探讨快速鉴别芦丁的方法。指纹图谱分析操作简便、灵敏度高、重现性好。一方面,为芦丁的生产及质量控制提供可靠的指纹图谱数据;另一方面,也为更好地研究和应用芦丁及其衍生物提供理论支持。
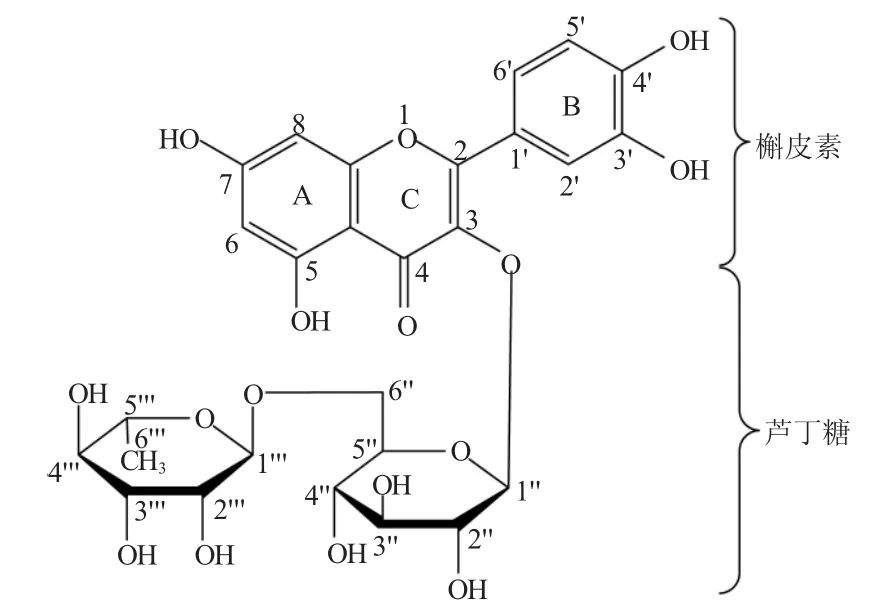
图1 芦丁的结构Fig.1 The structure of rutin
芦丁是黄色或微带绿色的固体粉末或细微结晶,化学式:C27H30O16,相对分子质量:610.51。
1 材料与方法
1.1 仪器与试药
芦丁(上海晶纯实业有限公司,纯度≥98.5%);甲醇为色谱级;溴化钾为光谱级;其余试剂为分析级。iS10 FT-IR型红外光谱仪(美国尼高力);德国耐驰(Netzsch)STA 409 PC/PG差热分析仪;UV-240型紫外可见分光光度计(日本岛津公司);400MHz核磁共振仪(Brucker);esquire3000质谱仪(Brucker)。
1.2 方法
紫外光谱实验条件:甲醇为溶剂,波长扫描范围从200~600nm;红外光谱实验条件:溴化钾压片;核磁共振谱实验条件:溶剂为DMSO-d6,400MHz;热分析实验条件:在静态空气气氛,以10℃·min-1升温速率从室温加热到800℃,差热量程为100V。质谱实验条件:ESI源鞘气为氮气,扫描范围m/z50~350。
2 结果与讨论
2.1 芦丁的紫外光谱
芦丁有两个吸收峰,359nm吸收带由肉桂酰生色团产生,为带Ⅰ,属于π→π*(B环)电子跃迁;257nm吸收带由苯甲酰生色团产生,为带Ⅱ,属于n→π*(A环)电子跃迁[13]。
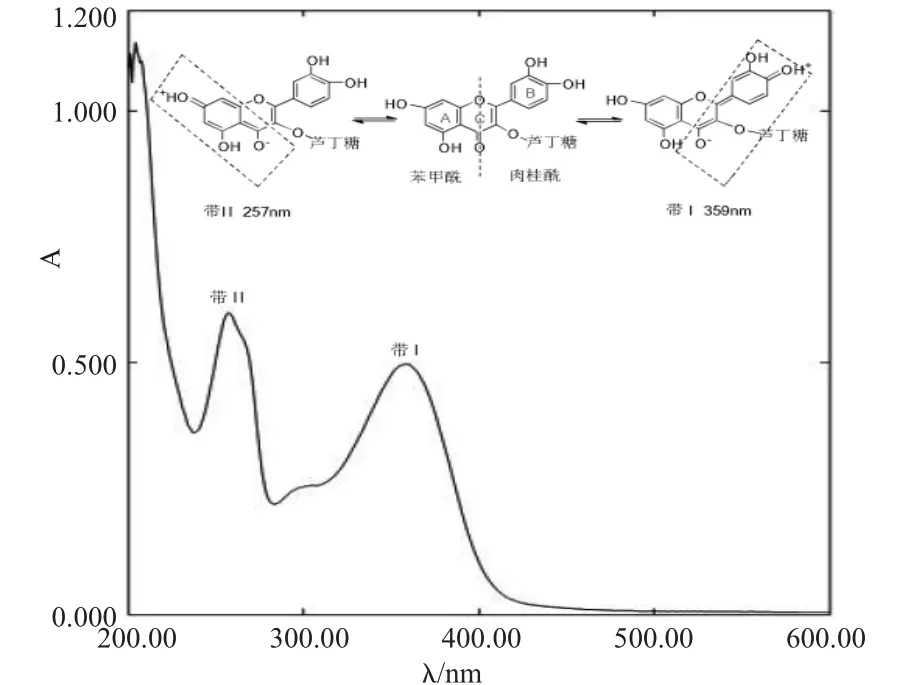
图2 芦丁的紫外光谱Fig.2 The UV spectrum of rutin

图3 芦丁的红外光谱Fig.3 The IR spectrum of rutin
2.2 红外光谱分析
芦丁分子主要官能团红外吸收峰分别是:羰基υC=O1655.03cm-1;苯环骨架振动频率υC=C1603.69cm-1,1504.96cm-1,1456.11cm-1;羟基υ-OH3423.42cm-1[14]。
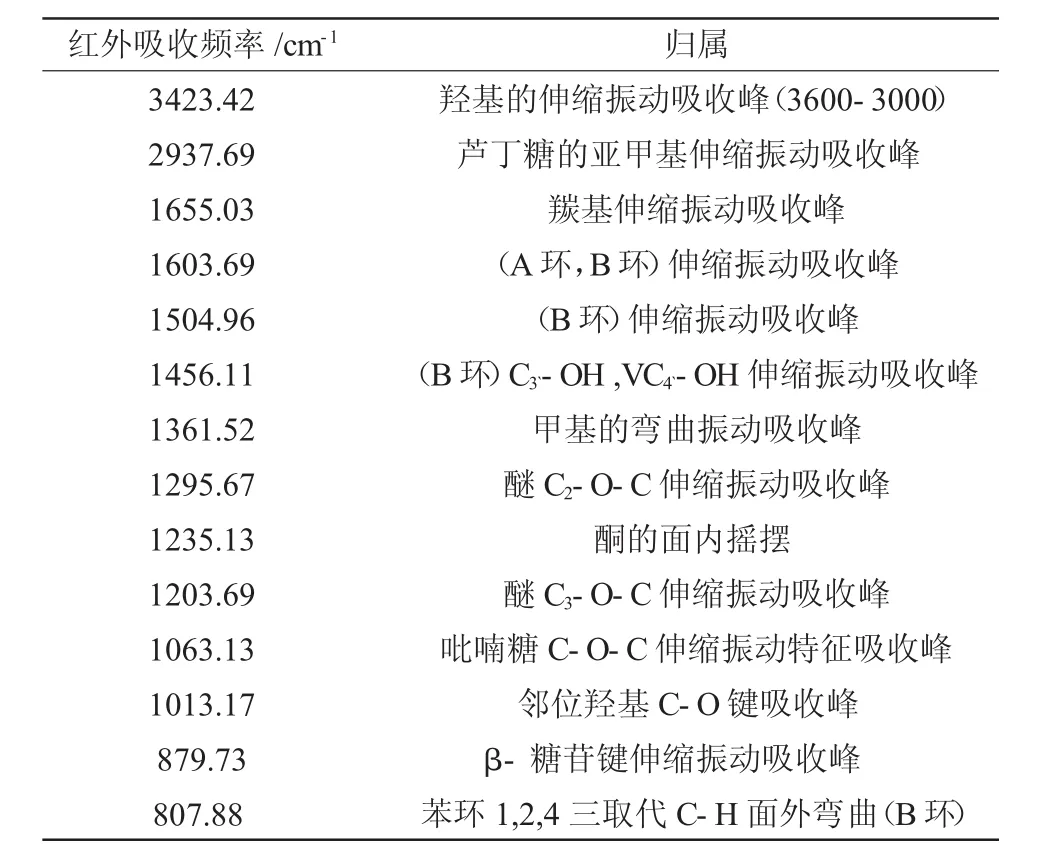
表1 芦丁主要官能团的红外吸收频率Table 1 The IR absorption frequency of major functional groups of rutin
2.3 芦丁的氢谱
1H-NMR谱是鉴定黄酮化合物的结构类型、确定取代基的位置和进行结构研究的有效方法。氢谱可以提供有关分子中不同种类氢原子的情况,如根据化学位移和偶合常数可以判断有关氢原子的化学环境,每种不同环境下氢原子的数目以及每个氢原子相邻的基团的结构等。
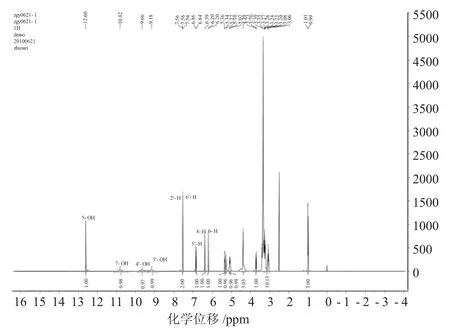
图4 芦丁的氢谱Fig.4 The1H NMR of rutin
芦丁1HNMR谱中主要氢原子的归属:δ12.48(s,1H,5-OH)、10.77(m,1H,7-OH)、9.35(m,1H,4′-OH)、9.29(m,1H,3′-OH)。7.66(s,1H,J=1.8Hz,2′-H)、7.53(dd,1H,J=1.8Hz,6′-H)、6.88(d,1H,J=8.5Hz,5′-H)、6.39(d,1H,J=1.4Hz,8-H)、6.17(d,1H,J=1.4Hz,6-H)。5.33(d,1H,J=7.0Hz,1’’-H),5.06(brs,1H,1’’’-H),3.04~3.72(m,sugarprotons),0.98(d,3H,J=6.0Hz,6’’’-H)[16]。
2.4 芦丁的碳谱

图5 芦丁的碳谱Fig.5 The13C NMR spectra of Rutin
有机化合物主要由碳原子构成基本结构,通过碳谱的测定,可以了解分子的基本骨架信息。碳谱的各条谱线都有它的唯一性,根据碳原子的化学位移,可以判断碳原子的类型,结构的完整性,进一步确定其结构[17]。图5标示出了芦丁分子中每个碳原子的化学位移。
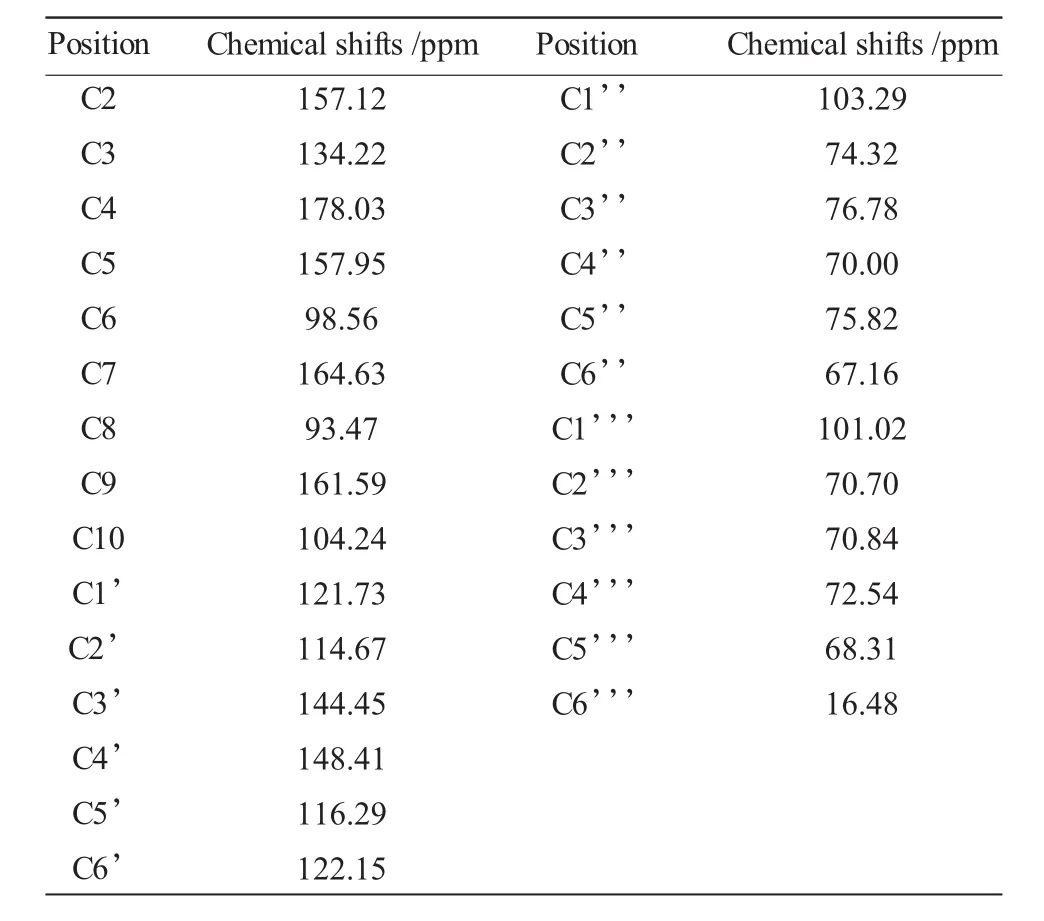
表2 芦丁的碳谱化学位移Table 2 The13C NMR(chemical shift)data of rutin
芦丁的碳谱归属13C NMR(101MHz,MeOD)δ178.03(C-4),164.63(C-7),161.59(C-9),157.95(C-5),157.12(C-2),148.41(C-4'),144.45(C-3'),134.22(C-3),122.15(C-6'),121.73(C-1'),116.29(C-5'),114.67(C-2'),104.24(C-10),103.29(Glc,C-1''),101.02(Rha,C1''),98.56(C-6),93.47(C-7),76.78(Glc,C-3''),75.82(Glc,C-5''),74.32(Glc,C-2''),72.54(Rha,C4''),70.84(Rha,C3''),70.70(Rha,C2''),70.00(Glc,C-4''),68.31(Rha,C5''),67.16(Glc,C-6''),16.48(Rha,C6'')。
2.5 芦丁的质谱
质谱是确定物质式量和结构式的常用方法。质谱图中不仅提供物质分子的分子式,而且利用碎片离子可获得一些有用的结构特征信息。
进样方式为直接进样,离子源为电喷雾电离源,阴离子检测模式:[M-H]-m/z 609,并对质量数m/z,609和301做二级质谱,分别得到:

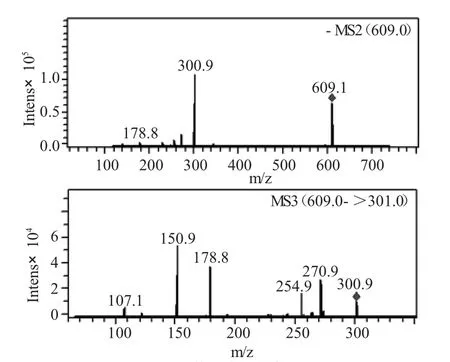
图6 芦丁的质谱Fig.6 The MS of rutin
芦丁的质谱碎裂机制及各个峰的归属如下:

图7 芦丁的质谱裂解Fig.7 The MS decomposition of rutin
芦丁的裂解途径可能是:
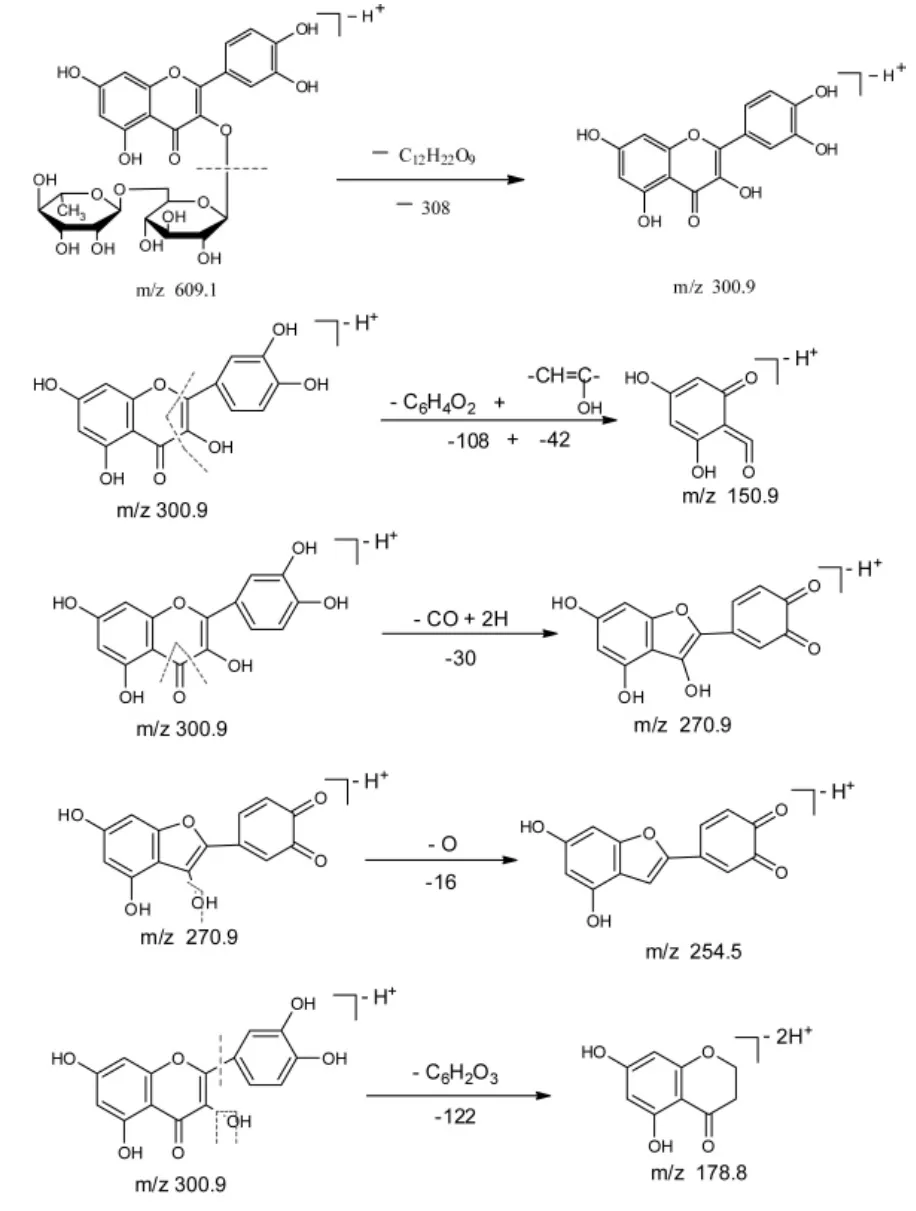
图8 芦丁的质谱裂解碎片分析Fig.8 The analysis of MS decomposition fragments of rutin
2.6 芦丁的热分析
通过加热化合物可引起其物理化学的变化,伴随放热和吸热的产生以及质量的变化。而通过热重分析,可以了解化合物的稳定性。近年来,热分析技术已经在药物分析领域里有了广泛的应用,如对传统中药活性成分的理化性质的研究,药物的质量控制等。并且为进一步研究一些药物的热力学特性提供一定的基础参数和理论指导[18]。
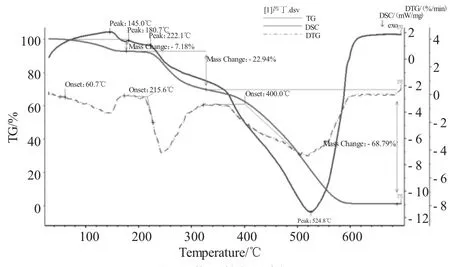
图9 芦丁的热分析Fig.9 The thermogravimetric analysis of rutin
2.6.1 TG/DTG曲线
TG曲线(见图9)上出现三个明显的失重台阶,这与DTG曲线(见图9)上的三个峰相对应。首先,在60.7~215.6℃,TG曲线有个小的失重台阶,失重率为7.18%(三个结晶水,理论值为7.29%),DTG曲线有个小峰。从215.6℃开始,TG曲线呈现出一个陡峭热分解失重台阶,对应于DTG曲线出现一个尖锐的峰,此阶段失重率为22.94%,推测为芦丁发生了部分分解;第三次失重从400.0℃开始,出现一个大的明显的失重平台,失重率为68.97%,推测为剩余芦丁发生了分解。随后,TG曲线平稳,无明显的失重平台。热分解的总失重率为98.91%,这时芦丁样品全面分解。
2.6.2 芦丁的DSC曲线
芦丁的DSC曲线(见图9)有一个吸热峰和三个放热峰。在145~222.1℃时,DSC显示有三个小吸热峰,应该是芦丁由固体受热变成液体,逐渐达到熔点所致。而DSC上位于524.8℃有个放热峰,TG曲线呈现出一个陡峭热分解失重台阶,说明此时芦丁受热分解。此后DSC曲线趋于平稳,说明600℃以后芦丁基本分解完全。
3 结 论
芦丁紫外光谱在375nm和255nm有两个最大吸收峰,其热分析图谱提供了化合物的热力学特性,经过三次失重,样品结构被全面破坏,发生完全分解。结合核磁共振谱、红外光谱对芦丁的特征官能团做了说明。质谱分析则提供了芦丁的基本裂解途径。本研究为芦丁及其衍生物的研究与代谢反应提供了有用的信息。
[1] RANCHMAT MAULUDIN,RAINER H MÜLLER,CORNELIA M KECK.Kinetic solubility and dissolution velocity of rutin nanocrystals[J].european journal of pharmaceutical sciences,2009,36:502~510.
[2] 张中朋,刘张林.芦丁出口现状及前景分析[J].中国现代中药,2008,10(1):37~38.
[3] HAO HUI-HUI,SHAO ZHU-MIN,TANG DAO-QUAN,et al. Preventive effects of rutin on the development of experimental diabetic nephropathy in rats[J].Life Sciences,2012,91(19-20):959~967.
[4] HENRYK ZIELINSKI.Antioxidant Properties and Rutin Content of High Pressure-Treated Raw and Roasted Buckwheat Groats[J].Food Bioprocess Technol,2013(6):92~100.
[5] MINA GHIASI,MAJID M HERAV.Quantum mechanical study of antioxidative ability and antioxidative mechanism of rutin(vitamin P)in solution[J].Carbohydrate Research,2011,346(6):739~744.
[6] IGOR B AFANAS’EV,ELENA A OSTRAKHOVITCH,ELENA V MIKHAL’CHIK.Enhancement of antioxidant and anti-inflammatory activities of bioflavonoid rutin by complexation with transition metals[J].Biochemical Pharmacology,2001,61:677~684.
[7] TIAN XUE,LI FENGJU,ZHU LU,et al.Study on the electrochemical behavior of anticancer herbal drug rutin and its interaction with DNA[J].Journal of Electroanalytical Chemistry,2008,621:1~6.
[8] LIN JING-PIN,YANG JAI-SING,LIN JEN-JYH,et al.Rutin Inhibits Human Leukemia Tumor Growth in a Murine Xenograft Model In Vivo[J].Environmental Toxicology,2012,27(8):480~484.
[9] MANACH C,MAZUR A,SCALBERT A.Polyphenols and prevention of cardiovascular diseases[J].Curr.Opin.Lipidol.,2005,16: 77~84.
[10] AFANAS’EV,DOROZHKO A,BRODSKI A,et al.Chelating and free radical scavenging mechanisms of inhibitory action of rutin and quercetin in lipid peroxidation[J].Biochemical Pharmacology,1989,38:1763~1769.
[11] GHOLAMREZA DEHGHAN,ZAHRA KHOSHKAM.Tin(II)-quercetin complex:Synthesis,spectral characterisation and antioxidant activity[J].Food Chemistry,2012,131:422~426.
[12] KELLY CAROLINA FRAUZINO ARAJOUJO,EULA MARIA DE MBCOSTA,FRANCINE PAZINI,et al.Bioconversion of quercetin and rutin and the cytotoxicity activities of the transformed products[J].Food and Chemical Toxicology,2013,51:93~96.
[13] MINA GHIASI,AFSANEH AZADNIA,MASOUD ARABIEH,et al.Protective effect of rutin(vitamin p)against heme oxidation: A quantum mechanical approach[J].Computational and Theoretical Chemistry,2012,996:28~36.
[14] SERGIO A PAYAN-GOMEZ,NORMA FLORES-HOLUIN,ANTONINO PEREZ HERNANDEZ.Computational molecular characterization of the flavonoid rutin[J].Chemistry Central Journal, 2010,4(12):2~8.
[15] Paolo Matteini,Andrea Goti,Giovanni Agati.Theoretical conformational analysis of rutin[J].Monatsh Chem,2010,141:793~800.
[16] ALEXANDER V PASTUKHOV,LIDIYA A LEVCHENKO,ANATOLI P SADKOV.Spectroscopic study on binding of rutin to human serum albumin[J].Journal of Molecular Structure,2007,842:60~66.
[17] MINA GHIASI,SALMAN TAHERI,MOHSEN TAFAZZOLI. Dynamic stereochemistry of rutin(vitamin P)in solution:theoretical approaches and experimental validation[J].Carbohydrate Research,2010,345:1760~1766.
[18] NADJA BUCHNER,ANGELIKA KRUMBEIN,SASCHA ROHN,et al.Effect of thermal processing on the flavonols rutin and quercetin[J].Rapid Commun.Mass Spectrom,2006,20:3229~3235.
[19] LATIFA CHEBIL,MOHAMED BOUROUKBA,CLAIRE GAIANI, et al.Elucidation of the Kinetic Behavior of Quercetin,Isoquercitrin,and Rutin Solubility by Physicochemical and Thermodynamic Investigations[J].Industrial&Engineering Chemistry Research(Ind.Eng.Chem.Res.),2013,52:1464~1470.
Spectrum Analysis of Rutin
HAN Bao-lai1,LI Yuan-yuan1,ZHANG Ling-ling2and ZHAI Guang-yu3
(1.College of Medicine,College of Applied Technology of Henan,Kaifeng 475004,China;2.College of Medicine,Zhengzhou University of Industrial Technology,Zhengzhou 451100,China;3.Department of Pharmacy,Zhengzhou University of Industrial Technology,Zhengzhou 451100,China)
The structure,composition and characteristics of rutin are analyzed by fingerprint spectrum,such as UV,IR,1H-NMR,13C-NMR,MS, TG and DSC etc.There are two maximum UV absorption peaks at 255 and 375nm respectively;the infrared absorption peaks are showed as follows: carbonyl υC=O1655.03cm-1,benzene ring skeleton vibration frequency υC=C1603.69cm-1and hydroxyl υ-OH3423.42cm-1.The attribution of major hydrogen atoms in1H NMR spectrum are showed as follows:δ12.48(5-OH),10.77(7-OH),9.35(4'-OH)and 9.29(3'-OH);and the attribution of13C NMR are showed as follows:δ178.0(C-4),164.6(C-7),161.5(C-9),157.9(C-5),157.1(C-2).After thermal weight loss for 3 times,the structure of sample decomposes completely and the mass spectrum provided a basic decomposing way.The analysis provides a reliable fingerprint spectrum data for the research,production and quality control of rutin and its derivatives.
Flavonoids;rutin;thermal analysis;fingerprint spectrum;quality control
O657.3
B
1001-0017(2017)01-0072-05
2016-09-01
韩宝来(1963-),河南开封尉氏人,副教授,研究方向为药物化学。
*通讯联系人:翟广玉(1954-),男,河南项城人,教授,硕士生导师。从事中草药有效成分的结构优化、药物化学合成及教学工作。
