可诱导性表达多种流感病毒HA蛋白稳定细胞系新型构建方法的研究
2017-05-18张艳晶韩连连郭丽钟辉王健伟
张艳晶 韩连连 郭丽 钟辉 王健伟
100730 北京协和医学院中国医学科学院病原生物学研究所
·技术方法·
可诱导性表达多种流感病毒HA蛋白稳定细胞系新型构建方法的研究
张艳晶 韩连连 郭丽 钟辉 王健伟
100730 北京协和医学院中国医学科学院病原生物学研究所
目的 建立一条创新性的技术路线快速构建可诱导性表达多种甲型流感病毒(IAV)HA蛋白的细胞系。方法 将多种IAV的HA蛋白基因连接到含有PiggyBac转座子位点的Cumate诱导表达系统中,与PiggyBac转座酶质粒共转染HEK293A细胞系,利用嘌呤霉素筛选阳性细胞,并用Cumate诱导相应病毒蛋白表达。 结果 流式细胞仪检测及Western blot检测结果均表明,加入诱导剂Cumate后,获取的细胞系中绝大部分细胞均开始表达相应的病毒蛋白。结论 利用PiggyBac转座子可以高效率的构建诱导性表达IVA HA蛋白的细胞系。
Fund programs: The Peking Union Medical College Youth Research Funds(3332016140)
流感病毒是流行性感冒(简称流感)的病原体,由于其抗原性易发生变异,并可导致传染性极强的呼吸系统疾病,流感病毒曾多次引起世界性大流行。近年来,禽流感病毒H5N1和H7N9引起了数百例人感染[1],相对于季节性流感,禽流感病毒患者死亡率明显增高(分别达60%和36%)[2-4]。因此,迫切需要对禽流感致病机理,特别是包括HA蛋白在内的病毒蛋白与致病性的关系[5],进行深入研究。
研究病毒蛋白与致病性的关系需要构建体外病毒蛋白质表达系统。相对于质粒瞬时转染表达系统,稳定表达细胞系具有结果稳定、可观察长时间作用的特点[6-7]。但经典的细胞系单克隆筛选技术效率低下,工作强度大且耗时长,因此迫切需要采用新的细胞系构建技术路线。已有研究表明,利用PiggyBac转座子可以显著提高外源性DNA整合效率[8],从而显著增加病毒蛋白表达细胞系的构建效率。因此,在本研究中,我们将采用PiggyBac转座子技术构建包括禽流感在内的多种流感病毒HA蛋白的稳定表达细胞系。
由于部分病毒蛋白具有细胞毒性,因此在本研究中将采用异丙基苯甲酸(4-isopropylbenzoic acid, Cumate) 诱导表达体系来表达病毒蛋白。由于四环素在畜牧业中广泛应用,常用的四环素诱导表达系统容易受到牛血清中残留的四环素影响,因此在四环素诱导培养体系中,需要筛选培养用的血清。而Cumate是一种无细胞毒性、常规细胞培养条件下缺如的化学物质,在培养基中加入Cumate即可诱导相应启动子表达其下游基因。因此相对于四环素诱导表达系统,Cumate诱导表达系统具有操作简便,结果稳定的特点。
在本研究中,我们利用PiggyBac转座子构建了一系列流感病毒HA蛋白可诱导表达细胞系,充分展示了该方法高效、快捷的特点。同时,本研究中构建的HA诱导表达细胞系也为研究流感病毒HA蛋白与流感病毒致病性之间的关系打下了坚实基础。
1 材料与方法
1.1 质粒和细胞 H3N2、H5N1、H7N7、H7N9和H9N2的HA基因合成于上海生工。293A细胞购自美国Atcc,培养基为添加有10%胎牛血清、2 mmol/L glutamine (美国Invitrogen公司)、100 U 青链霉素(Invitrogen公司)的DMEM培养基(Invitrogen公司)。细胞在37℃、5% CO2的条件下培养。Cumate诱导PiggyBac转座子表达系统(PB-Cuo-MCS-IRES-GFP-EF1-CymR-Puro Inducible cDNA Cloning and Expression Vector,货号PBQM812A-1,简称12A)以及PiggyBac转座酶表达质粒(Super PiggyBac Transposase expression vector)均购自Systembio公司,其中12A质粒通过IRES带有GFP表达框。克隆用菌株TOP10购自北京Tiangen公司。
1.2 试剂 PCR试剂盒、质粒提取试剂盒、胶回收试剂盒购自美国Qiagen公司。DNA Marker、蛋白质Marker、限制性内切酶和高保真酶均购自美国NEB公司。Cumate购自美国Sigma公司。
1.3 PCR引物设计和合成 以合成的各型流感病毒的HA基因序列设计引物,并在表达框羧基末端加入FLAG标签,以加上FLAG标签的各型HA为模板设计引物连接到12A质粒上。序列如下:5′-3′
H3N2-5:GAGCTAGCGAATTCGAATTTATGAAGACTATCATTGCTCTG
H3N2-3:AAATCGGATCCGCGGCCGTCACTTATCGTCGTCATCCT
H5N1-5:GAGCTAGCGAATTCGAATTTATGGAGAAAATTGTGCTGCTG
H5N1-3:AAATCGGATCCGCGGCCGTTACTTATCGTCGTCATCCT
H7N7-5:GAGCTAGCGAATTCGAATTTATGAACACTCAAATCCTGGTC
H7N7-3:AAATCGGATCCGCGGCCGTTACTTATCGTCGTCATCCT
H7N9-5:GAGCTAGCGAATTCGAATTTATGAATACGCAGATTTTGGTG
H7N9-3:AAATCGGATCCGCGGCCGCTACTTATCGTCGTCATCCTT
H9N2-5:GAGCTAGCGAATTCGAATTTATGGAAATTATTGCCCTGATC
H9N2-3:AAATCGGATCCGCGGCCGTTACTTATCGTCGTCATCCT
1.4 目的基因的PCR扩增 以上海生工合成的HA基因为模版,用高保真酶扩增目的基因。反应条件为:95℃预变性5 min;95℃变性1 min,52℃退火1 min,68℃延伸2 min,共30个循环;最后68℃延伸2 min,4℃保存。PCR产物1%琼脂糖凝胶电泳鉴定和回收。
1.5 重组表达载体的SLIC法构建及克隆 将12A质粒用SWAⅠ酶切2~3 h,与PCR扩增的目的基因以2:1的比例,加入T4 DNA聚合酶和T4 DNA聚合酶缓冲液,22℃连接25 min,取出后迅速加入连接体系体积1/10的dCTP(2 mmol/L),室温放置5 min。将连接产物转化感受态大肠埃希菌TOP10,在37℃孵育箱中,在1‰氨苄青霉素的LB培养基中培养过夜,挑取单菌落活化培养,小提质粒,以质粒为模板PCR,1%琼脂糖凝胶电泳鉴定,PCR鉴定正确质粒送北京睿博测序公司测序。测序正确的菌种进行扩大培养,Qiagen中提试剂盒提取质粒用于后续实验。
1.6 目的蛋白诱导表达细胞系的构建 将得到的重组表达质粒与Super Piggybac Transposase质粒以0.6:0.2的比例转染24孔板中的293A细胞。次日将24孔板中转染过的细胞传至6孔板中,待6孔板中细胞生长至底面积的30%左右,加入终浓度为2 μg/ml的嘌呤霉素。培养2~3 d后,可见大量细胞漂浮死亡。将存活细胞从6孔板中细胞传至T25细胞培养瓶中,并加入终浓度为1 μg/ml的嘌呤霉素,培养2~3 d后,传至T75细胞培养瓶后继续培养,长满后铺24孔板(1×105/孔)用于蛋白表达鉴定,其余细胞液氮冻存。
1.7 重组蛋白流式分析 将上述细胞系传代入24孔板后加入Cumate(1∶10000,起始浓度300 mg/ml),培养48 h,胰酶消化收获细胞,用含0.5%BSA和2 mmol/L EDTA的PBS洗涤细胞一次,0.2 ml PBS重悬细胞,流式检测GFP的表达。
1.8 重组蛋白Western blot分析 将上述细胞系传代入24孔板后加入Cumate(1∶10000),培养48 h,用PLB裂解细胞,收上清,100 μl样本加入20 μl的6×loading buffer,100℃10 min,制好的蛋白样本经12%SDS-PAGE后,在湿转膜仪上转移至NC膜上,用5%脱脂奶粉37℃封闭30 min或4℃过夜。PBST洗膜3次,加入封闭液稀释的抗Flag(购自美国Sigma公司,1∶4000),室温摇动2 h。PBST洗膜3次,加入封闭液稀释的兔抗鼠800(购自Invitrogen公司,1∶10 000),室温摇动反应30 min,PBST洗膜3次,流水冲洗3次,用Odyssey检测。
2 结果
2.1 重组表达质粒的鉴定 重组表达质粒经PCR扩增后,1%琼脂糖凝胶电泳鉴定,在约1700 bp处出现特异性条带,大小和预期相符。将目的基因送测序,结果表明插入片段与各型HA重合率为100%,无突变,插入序列方向正确。该结果提示利用SLIC连接技术可以可靠构建目的质粒。
2.2 重组HA蛋白荧光检测 将嘌呤霉素筛选过的可诱导表达HA蛋白细胞系以1×105/孔铺入24孔板。培养24 h后加入或不加入Cumate诱导剂,诱导培养48 h后用Nikon荧光显微镜观查荧光,结果显示绝大部分细胞均显示绿色荧光(图1),提示经嘌呤霉素筛选后,大部分存活的细胞均已整合了PiggyBac转座子内的表达系统。图1中展示了H7N9 HA细胞系加入Cumate与否对细胞绿色荧光的影响。

图1 Cumate诱导H7N9 HA细胞系绿色荧光表达Fig.1 Cumate inducea the EGFP expression in H7N9 HA cell line
2.3 重组HA蛋白表达细胞系流式细胞检测分析 为定量测定该技术路线嘌呤霉素筛选后细胞中阳性表达细胞的比例,将嘌呤霉素筛选过的可诱导表达HA蛋白细胞系以1×105/孔铺入24孔板。培养24 h后,分别加入或不加入Cumate诱导剂,继续诱导培养48 h后收获细胞,用流式细胞仪检测绿色荧光的表达。结果显示80%~90%以上的细胞均为GFP阳性,该结果再次提示该技术路线筛选到的细胞株具有很高的阳性表达率。见图2。
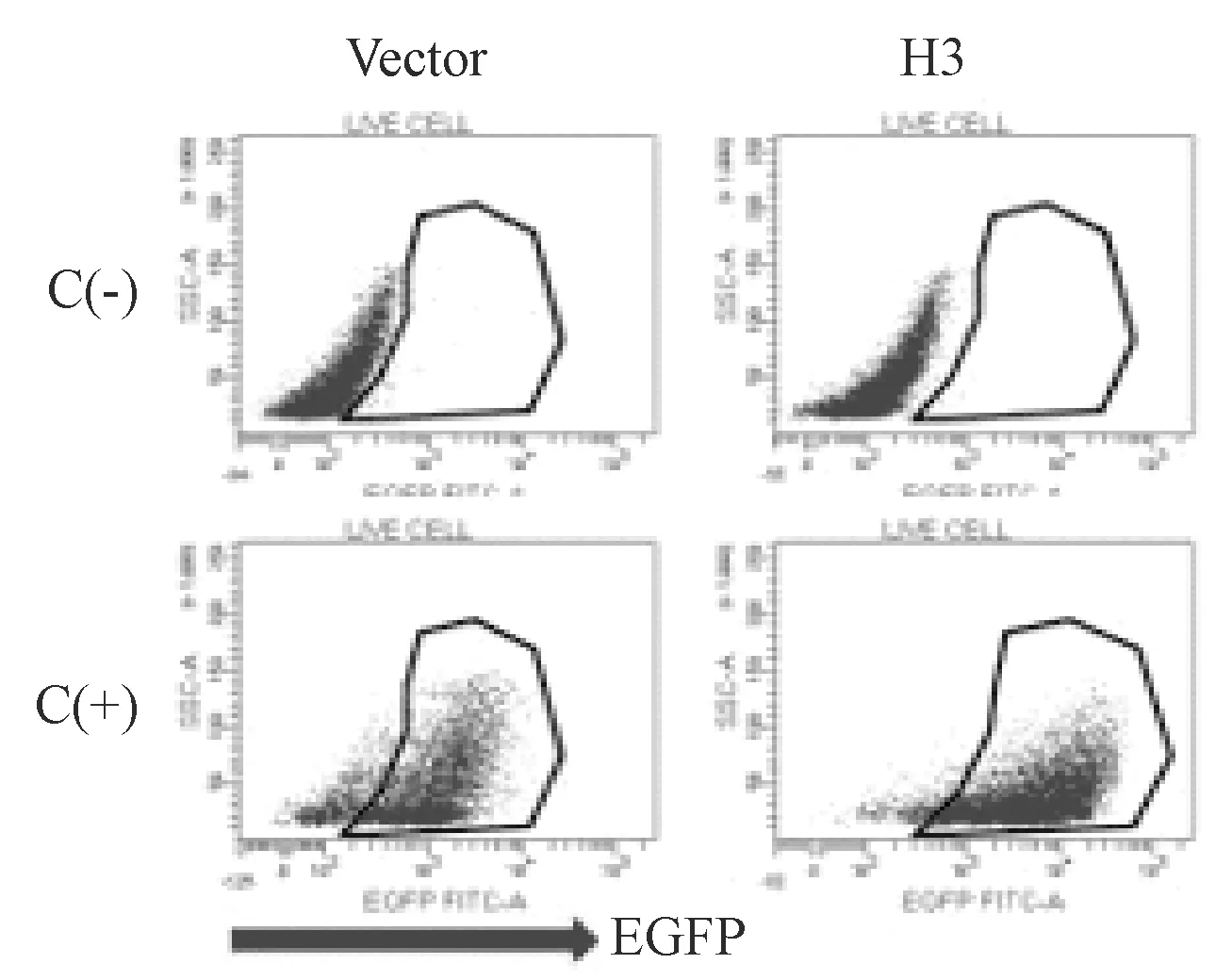
C(-):未加入Cumate;C(+):加入Cumate;Vector:12A空载体细胞系;H3:H3N2 HA蛋白表达细胞系图2 Cumate诱导所获细胞系中EGFP表达C(-):without Cumate;C(+):with Cumate;Vector:cell line with empty vector;H3: cell line with H3N2 HA proteinFig.2 Cumate blot induced EGFP expression in cell lines
2.4 重组HA蛋白表达细胞系Western blot分析 为最终确定目标蛋白质的表达,将嘌呤霉素筛选过的可诱导表达HA蛋白细胞系以1×105/孔铺入24孔板。培养24 h后,分别加入或不加入Cumate诱导剂,继续诱导培养48 h后收获细胞,加入100 μl PLB裂解细胞,按Western blot标准操作流程检测相应蛋白质的表达。Western blot结果显示,在加入Cumate诱导剂后,在H3N2、H7N7和H7N9的HA细胞系中均可观察到全长HA0的表达,而在H5N1、H9N2的HA细胞系中可观察到HA2的表达。而在未加入诱导剂的各细胞系中均未观察到相应蛋白质的表达。该实验结果证实,加入诱导剂可以诱导各细胞系表达相应的HA蛋白。见图3。

图3 重组HA蛋白表达细胞系Western Blot分析Fig.3 The Western identification of HA expression in cell lines
2.5 通过控制诱导剂Cumate的浓度可以调控细胞中HA蛋白的表达量 为观察不同浓度诱导剂对目标蛋白质表达量的影响,将H3N2和H7N7 HA蛋白细胞系以1×105/孔铺入24孔板.培养24 h后,分别加入不同浓度的Cumate诱导剂(稀释倍数分别:1/10 000,1/20 000,1/40 000,1/60 000,1/80 000,1/100 000;起始浓度300 mg/ml)。诱导培养48 h后收获细胞,按Western blot标准操作流程检测相应蛋白质的表达。Western Blot结果显示,随着诱导剂浓度的增高,目标蛋白的表达量也相应增加,两者存在着良好的相关性。该结果提示,通过控制诱导剂Cumate的浓度可以调控细胞中HA蛋白的表达量,为进一步的HA蛋白质功能比较提供了便利。见图4。
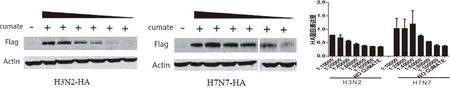
注:最右侧图为左侧两图条带灰度定量分析结果图4 不同浓度诱导剂诱导HA蛋白表达的Western blot分析Note: Two graphs on the right side are the quantitative analysis results in the gray scaleFig.4 The effect of different concentration Cumate on HA expression in cell lines
3 讨论
本研究利用PiggyBac转座子技术建立了多种流感病毒HA蛋白的可诱导表达细胞系。Western blot检测结果表明加入诱导剂Cumate后,HA蛋白可以在相应细胞系中持续表达,且其表达量与诱导剂的浓度直接相关。流式细胞检测结果表明,经嘌呤霉素抗性筛选后,80%~90%的存活细胞均可以诱导出目的蛋白表达,从而显示利用PiggyBac转座子可以高效率的构建外源病毒蛋白表达细胞系。
PiggyBac转座子发现于昆虫细胞,但作为一种高效的转基因技术目前已被应用于多种哺乳动物细胞中。研究表明其将目的基因整合入细胞基因组的效率是传统随机整合载体的8倍以上[9-11]。因其整合的高效率,绝大多数经过嘌呤霉素筛选过的细胞均可表达相应目的蛋白,因此经典技术路线中的单克隆筛选过程在PiggyBac技术路线中通常可以省略。相对于逆转录病毒及腺相关病毒系统,因为省略了病毒生产过程,PiggyBac转座子系统具有流程短、操作简便的特点。而相对于已有的Sleeping Beauty转座子系统,PiggyBac转座子系统在插入长基因片段时效率更高,而且没有Sleeping Beauty转座子系统的Overproduction inhibition效应(一种由于转座酶高表达反而导致转座效率低下的效应),因此是一种更为优异的转座子系统表达系统[12]。
在研究病毒蛋白活性的研究手段中,瞬时转染系统具有构建时间短,操作简单的特点。但是其效率与细胞转染效率等密切相关,难以应用于难转染细胞。而且转染和表达效率与细胞状态直接相关,因此其结果稳定性也相对较差。同时,瞬时转染的外源基因仅能持续表达很短的一段时间,因此难以用于观察目的蛋白的长时间作用。在本研究中,我们采用了诱导表达的稳定细胞系技术路线,目的蛋白在正常培养过程中不表达,因此不会干扰细胞的正常状态,从而避免了病毒细胞毒性蛋白对细胞系传代的影响。加入诱导剂后,目的蛋白开始表达,以未加诱导剂的相应细胞系为对照,即可观察相应目的蛋白的活性。而且,由于目的蛋白的表达量与诱导剂的浓度高度相关,因此可以通过调节诱导剂的浓度来观察目的蛋白表达量与其活性的关系,从而为进一步确认其生物活性提供依据。
此外,在本研究中我们还采用了的SLIC连接方法构建目标质粒。SLIC是一种非序列依赖及非DNA连接酶依赖的分子克隆方法[13]。与经典的限制内切酶切割/T4 DNA连接酶法相比,SLIC克隆技术不仅不受限制性内切酶序列的限制,而且可以更高效率的将大目的基因片段连接入大质粒片段。我们利用该方法有效的克服了研究初期遇到的目的质粒构建困难等问题。
在本研究中,我们通过PiggyBac转座子系统构建了可诱导性表达多种流感病毒HA蛋白的细胞系,该细胞系的建立为以后深入研究流感病毒HA蛋白的功能奠定了基础和创造了条件。
[1] 王志亮, 刘华雷, 赵永刚. 禽流感与人类健康 [J]. 中华实验和临床病毒学杂志,2006,20(1): 80-82. doi: 10.3760/cma.j.issn.1003-9279.2006.01.023.
[2] Neumann G, Chen H, Gao GF, et al.H5N1 influenza viruses: outbreaks and biological properties[J]. Cell Res,2010(1), 20: 51-61. doi: 10.1038/cr.2009.124. Epub 2009 Nov 3.
[3] To KK, Chan JF, Chen H, et al. The emergence of influenza A H7N9 in human beings 16 years after influenza A H5N1: a tale of two cities[J]. Lancet Infect Dis, 2013(9),13:809-821. doi: 10.1016/S1473-3099(13)70167-1.
[4] Jernigan DB, Cox NJ. H7N9: preparing for the unexpected in influenza[J]. Annu Rev Med,2015,66:361-371. doi: 10.1146/annurev-med-010714-112311.
[5] 董方圆, 王昕, 丁小满, 等. α-2,6唾液酸受体结合特异性的H7N9流感病毒的筛选 [J]. 中华实验和临床病毒学杂志,2016,30(2): 123-128. doi: 10.3760/cma.j.issn.1003-9279.2016.02.004.
[6] 王战会, 齐义鹏, 林裕龙, 等. 乙型肝炎病毒表面抗原突变体稳定表达细胞系的建立和抗原性鉴定 [J]. 中华实验和临床病毒学杂志,2004,18( 1 ): 47-50. doi: 10.3760/cma.j.issn.1003-9279.2004.01.012.
[7] 曹守春, 李玉华, 李加, 等. 稳定表达狂犬病病毒CTN-1V株糖蛋白细胞系的建立 [J]. 中华实验和临床病毒学杂志,2013,27(6): 483-485. doi: 10.3760/cma.j.issn.1003-9279.2013.06.029.
[8] 钱秋杰,车家倩,叶露鹏,等.piggyBac转座系统的功能改进及在哺乳动物中的应用[J]. 遗传, 2014, 36(10):965-973.
[9] Kim A, Pyykko I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool[J]. Mol Cell Biochem, 2011,354(1-2):301-309.doi: 10.1007/s11010-011-0832-3.
[10] Yusa K, Zhou L, Li MA, et al. A hyperactive piggyBac transposase for mammalian applications[J]. Proc Natl Acad Sci USA, 2011,108(4):1531-1536. doi: 10.1073/pnas.1008322108.
[11] Burnight ER, Staber JM, Korsakov P, et al. A hyperactive transposase promotes persistent gene transfer of a piggyBac DNA Transposon[J]. Mol Ther Nucleic Acids, 2012,1:e50.doi: 10.1038/mtna.2012.12.
[12] Wu SC, Meir YJ, Coates CJ, et al. piggyBac is a flexible and highly active transposon as compared to sleeping beauty, Tol2, and Mos1 in mammalian cells[J]. Proc Natl Acad Sci U S A, 2006,103(41):15008-15013.doi:10.1073/pnas.0606979103.
[13] Li MZ, Elledge SJ. Harnessing homologous recombination in vitro to generate recombinant DNA via SLIC[J]. Nat Methods,2007, 4(3): 251-256.doi: 10.1038/nmeth1010.
(本文编辑:陈培莉)
欢迎订阅 欢迎投稿 欢迎刊登广告
中华实验和临床病毒学杂志
http://zhsyhlcbdxzz.yiigle.com
邮发代号18-224 电话:010-63530971, 63540009, Email:bianjibu2005@sina.com
邮编:100052 地址:北京市西城区迎新街100号
Rapid construction of stable cell lines which inducible express HA proteins from various influenza virus strains
ZhangYanjing,HanLianlian,GuoLi,ZhongHui,WangJianwei
PekingUnionMedicalCollege&InstituteofPathogenBiologyChineseAcademyofMedicalSciences,Beijing100730,China
ZhongHui,Email:zhonghui_bj@126.com
Objective An innovative technique was established to rapidly construct various cell lines that could be induced to express multiple influenza A virus (IAV) proteins. Method The HA protein genes of multiple IAVs were cloned into the Cumate-induced expression system which was positioned between two PiggyBac transposon sites. These HA plasmids were transfected into the HEK293A cell line with the PiggyBac transposase plasmids. The transfected cells were screened with puromycin, and after that the corresponding virus proteins were induced with Cumate. Results The results of flow cytometry and Western blotting showed that the virus proteins were expressed in most of the cells in corresponding lines after the induction of Cumate. Conclusion Cell lines which were inducible to express IVA HA protein can be efficiently constructed by using the PiggyBac transposon system.
Influenza virus; PiggyBac transposon; Inducible expression; Cell line construction
钟辉,Email:zhonghui_bj@126.com
10.3760/cma.j.issn.1003-9279.2017.02.016
协和青年基金(3332016140)
流感病毒;PiggyBac转座子;诱导性表达; 细胞系构建
2017-02-01)
