一种双氧水氧化二硫醚合成硫代芳基砜的方法
2017-05-17李术艳柯炎平
李术艳,柯炎平
一种双氧水氧化二硫醚合成硫代芳基砜的方法
李术艳1,2,柯炎平3
(1.漳州职业技术学院食品与生物工程系,福建漳州363000;2.农产品深加工及安全福建省高校应用技术工程中心,福建漳州363000;3.华南农业大学材料与能源学院,广东广州510642)
以二芳基二硫醚(ArSSAr)为原料,以廉价环保的双氧水(H2O2)为氧化剂,在碘单质(I2)促进下,以乙醇或二甲亚砜(DMSO)为溶剂,60℃下简便合成了S-芳基硫代芳基砜并通过核磁共振氢谱1H NMR和红外IR对产物结构进行确证.该方法具有反应条件温和、原料易得和操作简单等优点.
二芳基二硫醚;双氧水;S-芳基硫代芳基砜;氧化
砜类化合物是合成天然产物和生物活性分子的重要中间体[1-4],因其广谱的生物特性而具有广泛的应用前景.同时作为重要的有机合成中间体被广泛用于C-C键的形成、分子重组等反应中.硫醚直接氧化制备砜类化合物是最简单和最常用的合成方法[5].在众多研究中,各种氧化剂被不断报道[6-7],如二氧化锰、过氧化酮、过氧酸等.虽然这些氧化剂能快速地氧化硫醚制备砜,但反应需要较高温度,反应过程又往往产生强酸强碱性溶液等,难以工业化.而双氧水具有含氧量高,经济环保等优点,作为清洁氧化剂备受国内外研究者关注[8-11].双氧水氧化硫醚制备砜的反应中,一般都是在过渡金属配合物催化下进行的[11-17].
硫醚氧化成砜的报道非常多,但二硫醚被氧化成硫代砜却鲜有报道.硫代砜的结构中既有C-S键(具有硫醚的特性)又有砜基,可能具有更强的生物活性,有望成为重要的有机合成和药物合成中间体.鉴于硫代芳基砜具有潜在生物活性的结构特点,尝试了芳基二硫醚氧化制备硫代芳基砜的探索研究.结合绿色环保的理念,追求原子经济反应、节能生产的效应,设计了非金属碘促进的双氧水氧化芳基二硫醚制备硫代砜的反应,合成系列化合物.实验采用乙醇做溶剂,在60℃下反应2~6 h即得到产物,无需加入金属盐等催化剂.化合物结构经红外光谱,核磁共振氢谱等手段进行确认,目标化合物的合成路线见图1.该方法具有操作简单、绿色安全等优点.
1实验部分

图1双氧水氧化二硫醚制备硫代砜的反应
1.1试剂及仪器
对苯二硫醚、4,4'-二甲基二苯二硫醚、4,4'-二硝基二苯二硫醚、4,4'-二甲氧基二苯二硫醚、4,4'-二氟二苯二硫醚、4,4'-二氨基二苯二硫醚、4,4'-二溴二苯二硫醚、4,4'-二氯二苯二硫醚、3,3',5,5’-四氯二苯二硫醚、3,3'-二硝基二苯二硫醚均为分析纯,购于百灵威科技有限公司;双氧水、纯乙醇、碘均为分析纯,购于安耐吉化学试剂有限公司;薄层层析硅胶板(2.5 cm×8 cm)购于烟台江友硅胶开发有限公司,TLC点板后,于紫外灯(254 nm)下显色.
AVANCE-600型核磁共振仪(1H NMR:TMS为内标,DMSO-d6为溶剂,Bruker公司),NICDLET 6700型傅立叶红外光谱分析仪(KBr压片),ZF-20D型暗箱式紫外分析仪(购自河南爱博特科技发展有限公司),DSB-2100型旋转蒸发仪(购自上海爱朗仪器有限公司),智能恒温磁力搅拌器(ZNCL-QS 130-60)(购自河南爱博特科技发展有限公司),TLE104E/02型电子天平(购自梅特勒-托利多仪器(上海)有限公司).
1.2合成和表征
1.2.1产物S-芳基硫代芳基砜2的制备
在装有磁力搅拌器的干燥的Schlenk管中加入二芳基二硫醚(1 mmol),双氧水(4 mmol),I2(20 mmol%)和乙醇(或二甲亚砜DMSO)(2 mL),常温搅拌溶解后,升温至60°C充分搅拌2~6 h.整个反应过程用高效薄层色谱板(TLC)进行监测.反应完毕后,反应液加入少量乙酸乙酯稀释,加入2匙300~400目硅胶粉,旋转蒸发仪旋干,再用300~400目硅胶柱层析干法上柱分离纯化,乙酸乙酯/石油醚(5:1)重结晶制得产品S-芳基硫代芳基砜,如图2所示.
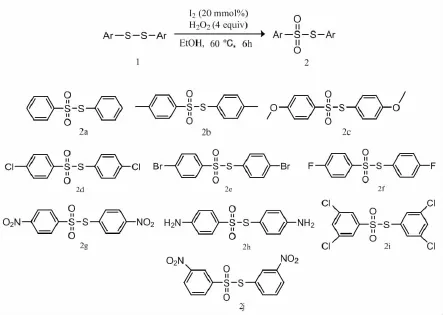
图2反应底物拓展范围
1.2.2产物2的波谱表征
2a:S-苯基硫代苯基砜,无色固体,产率92%.1H NMR(DMSO-d6,600 MHz/p.p.m.):7.97(d,J=8.0 Hz,2 H),7.88~750(m,3 H),7.47(d,J=8.0 Hz,2 H),7.29(t,J=8.0 Hz,2 H),7.24(t,J=8.0 Hz,1H);IR(KBr) v:3 030,1 606,1 591,1 494,1 405,1 316,1 092,531 cm-1.
2b:4,4’-二甲基二苯基硫代砜,无色晶体,产率94%.1H NMR(DMSO-d6,600 MHz/p.p.m.):7.90(d,J=8. 0 Hz,2 H),7.43(d,J=8.0 Hz,2 H),7.04(d,J=8.0 Hz,2 H),6.96(d,J=8.0 Hz,2 H),3.43(s,3 H),2.25(s,3 H);IR(KBr)v:3 071,3 067,2 985,2 895,1 600,1 562,1 405,1 330,1 153,1 080,512 cm-1.
2c:4,4’-二甲氧基二苯基硫代砜,无色固体,产率86%.1H NMR(DMSO-d6,600 MHz/p.p.m.):7.79(d,J=8.0 Hz,2 H),7.40(d,J=8.0 Hz,2 H),6.98(d,J=8.0 Hz,2 H),6.74(d,J=8.0 Hz,2 H);3.81(s,3 H),3.68(s,3 H);IR(KBr)v:3 077,2 989,2 893,1 606,1 591,1 494,1 405,1 316,1 092,1 050,501 cm-1.
2d:4,4’-二氯二苯基硫代砜,无色晶体,产率73%.1H NMR(DMSO-d6,600 MHz/p.p.m.):8.01(d,J=8.0 Hz,2 H),7.37(d,J=8.0 Hz,2 H),7.33(d,J=8.0 Hz,2 H),7.30(d,J=8.0 Hz,2 H);IR(KBr)v:3 030,3 052,1 600,1 543,1 402,1 343,1 135,1 092,734,547 cm-1.
2e:4,4’-二溴二苯基硫代砜,无色固体,产率79%.1H NMR(DMSO-d6,600 MHz/p.p.m.):7.88(d,J=8.0 Hz,2 H),7.78(d,J=6.0 Hz,2 H),7.43(d,J=8.0 Hz,2 H),7.34(d,J=8.0 Hz,2 H);IR(KBr)v:3 039,3 034,1 609,1 545,1 400,1 340,1 130,1 083,582,536 cm-1.
2f:4,4’-二氟二苯基硫代砜,无色固体,产率69%.1HNMR(DMSO-d6,600 MHz/p.p.m.):8.11(m,2 H),7.46(d,J=8.0 Hz,2 H),7.43(d,J=8.0 Hz,2 H),7.38(d,J=8.0 Hz,2 H);IR(KBr)v:3 030,1 601,1 548,1 407,1 321,1 262,1 145,1 063,528 cm-1.
2g:4,4’-二硝基二苯基硫代砜,淡黄色固体,产率51%.1H NMR(DMSO-d6,600 MHz/p.p.m.):8.37(d,J=8.0 Hz,2 H),8.12(d,J=8.0 Hz,2 H),8.07(d,J=8.0 Hz,2 H),7.75(d,J=8.0 Hz,2 H);IR(KBr)v:3 039,1 600,1 560,1 541,1 407,1 358,1 324,1 145,1 063,854,740,531 cm-1.
2h:4,4’-二氨基二苯基硫代砜,无色固体,产率79%.1H NMR(DMSO-d6,600 MHz/p.p.m.):7.66(d,J=8. 0 Hz,2 H),7.14(d,J=8.0 Hz,2 H),7.01(d,J=8.0 Hz,2 H),6.61(d,J=8.0 Hz,2 H),5.90(d,J=6.0 Hz,2 H),5.01(s,2 H);IR(KBr)v:3 605,3 039,1 606,1 580,1 540,1 400,1 358,1 310,1 140,1 063,852,742,537 cm-1.
2i:3,3’,5,5’-四氯二苯基硫代砜,无色固体,产率59%.1H NMR(DMSO-d6,600 MHz/p.p.m.):8.10(s,2 H),7.67(s,1H),7.47(s,1H),7.40(s,2H);IR(KBr)v:3 030,3 052,1 600,1 543,1 402,1 343,1 135,1 092,734,547 cm-1.
2j:3,3’-二硝基二苯基硫代砜,黄色固体,产率47%.1H NMR(DMSO-d6,600 MHz/p.p.m.):8.78(s,1 H),8.56~8.23(m,2 H),8.13(s,1 H),8.04(d,J=8.0 Hz,1 H),7.96~7.53(m,3 H);IR(KBr)v:3 069,1 608,1 580,1 539,1 407,1 332,1 320,1 147,1 058,852,743,550 cm-1.
2结果与讨论
2.1化合物的合成
2.1.1反应条件筛选
在合成化合物硫代芳基砜时,首先选用了二苯基二硫醚与双氧水在乙醇中的反应为模型,考察了底物与氧化剂的摩尔配比、反应温度等条件对反应结果的影响.
当二苯基二硫醚与双氧水以1:2的摩尔配比反应时,产物S-苯基硫代苯基砜的产率只有52%,而反应体系中副产物增加.而当将二苯基二硫醚与双氧水的摩尔配比调整为1:4时,反应体系中副产物明显减少,得到的产物S-苯基硫代苯基砜的产率提高到92%.可见,氧化剂双氧水的量对砜的生成影响较大.因此,在对反应温度进行考察的时候,底物与双氧水的摩尔配比选择1:4.
确定了底物与双氧水的配比之后,首先在室温下考察二苯基二硫醚与双氧水的反应,发现反应可以进行,但反应速度较慢,原料转化率较低.反应持续6 h,产率只有71%.而当其它条件不改变,提高反应温度为60℃时,反应只需2 h原料即转化完全,产物收率提高到92%.可见,该反应受温度影响也较大.以上反应条件的考察均是在碘为20 mmol%条件下进行的.
2.1.2底物的拓展
通过实验对比,获得较佳的反应条件如下:二苯基二硫醚(1 mmol)、双氧水(4 mmol)、I2(20 mmol%),60°C.为进一步研究该反应条件的普适性,继续探讨了含其它取代基团的二芳基二硫醚与双氧水的反应情况.
在合成其它S-芳基硫代芳基砜2(a~j)的过程中,当芳环上的取代基为供电子取代基时,反应比较容易进行,反应需要2 h即反应完毕,如芳环上取代基为甲基、甲氧基、氨基等取代基时.而当苯环上的取代基为卤原子或硝基等基团时,反应需要6 h完成.这可能是因为卤基和硝基是吸电子取代基,直接影响了硫醚的氧化.同时,这些带吸电子取代基化合物在乙醇中基本不溶,因此,当用这些底物反应时,体系改用了二甲亚砜(DMSO)为溶剂,反应效果较好.
2.1.3注意事项
反应结束后,当用硫代硫酸钠洗涤除去体系中的碘时,洗涤完毕TLC点板发现,产物点消失,考虑可能是该处理方法不当引起的.因此,尝试了不洗涤直接过柱纯化的方法,结果并未影响产物的纯化.
2.2化合物2(a~j)的结构分析
化合物2(a~j)在3 030 cm-1左右、1 600~1 500 cm-1区间内都有峰说明有苯环的存在,在1 350~1 310 cm-1之间都有吸收峰,证明化合物上有S=O键的存在,在1 100~1 080 cm-1则证明了各化合物中都有C-S键的存在.在1 300~1 050 cm-1处有峰,则证明C-O-C醚键的存在;在1 360~1 280 cm-1处有吸收峰,证明-NO2的存在.而在800~500 cm-1处有吸收峰,则证明C-X碳卤键的存在.
3结语
报道了一种双氧水氧化二硫醚制备硫代芳基砜的方法.该氧化体系(双氧水-乙醇/二甲亚砜)适用于二芳基二硫醚的氧化,尤其是芳环上具有供电子取代基的二硫醚.该方法反应条件温和、反应时间较短、操作简便安全.实验结果表明,该方法具有一定的应用适用性和普遍性.尽管如此,将反应放在更为环保的溶剂中如无机溶剂体系中反应将是又一新的课题.
[1]Carreno M C.Applications of Sulfoxides to Asymmetric Synthesis of Biologically Active Compounds[J].Chem Rev,1995(95): 1717-1760.
[2]Prilezhaeva E N.Rearrangements of sulfoxides and sulfones in the total synthesis of natural compounds[J].Russ Chem Rev,2001(70):897-920.
[3]ferna’ndez I,Khiar N.Recent developments in the synthesis and utilization of chiral sulfoxides[J].Chem Rev,2003(103): 3651-3706.
[4]Hollingworth G J,Katritzky A R.In Comprehensive Organic Functional Group Transformations[M].Elsevier:Oxford,1995:144-156.
[5]Patai S,Rappoport Z.The synthesis of sulphones,sulphoxides,and cyclic sulphides[M].New York:Wiley,1994.
[6]Backvall J E.Modern Oxidation Methods[M].New York:Wiley,2004:193-222.
[7]Brink G J,Arends I wice,Sheldon R A.Proposed mechanism of(PhenS)Pd-catalyzed.Aerobic oxidation of alcohols[J].Science,2000(287):1636-1639.
[8]Kaczorowska K,Kolarska Z,Mitka K,et al.Oxidation of sulfides to sulfoxides.Part 2:oxidation by hydrogen peroxide[J].Tetrohedron,2005(61):9315-9327.
[9]Sato K,Aoki M,Noyori.A“green”route to adipic acid:direct oxidation of cyclohexenes with 30 percent hydrogenperoxide[J]. Science,1998(281):1646-1647.
[10]Miranda L P.A novel rapid sulfoxidation of sulfides with cyclohexylidenebishydroperoxide[J].J Comb Chem,2002(4):523-529.
[11]Hiroyuki Miyamura.Polymer-micelle incarcerated ruthenium catalysts for oxidation of alcohols and sulfides[J].Tetrahedron,2005 (61):12177-12185.
[12]Varma R S,Saini R K,Meshram H M.Selective oxidation of sulfides to sulfoxides and sulfones by microwave thermolysis on wet silica supported sodium periodates[J].Tetrahedron Lett,1997(38):6525.
[13]Xu Liang.Chromium(VI)oxide catalyzed oxidation of sulfides to sulfones with periodic acid[J].J Org Chem,2003(68):5388-5391.
[14]Purrington S T.Mild selective oxidation of sulfides to sulfones[J].Org Prep PProced Int,1985(17):227-230.
[15]Shaabani A.The beneficial effect of manganese dioxide on the oxidation of organic compounds by potassium permanganate[J]. Catal Lett,2004(97):119-123.
[16]Masayuk K,Junya Y.Tantalum(V)or niobium(V)catalyzed oxidation of sulfides with 30%hydrogen peroxide[J].Tetrahedron,2009(65):10477-10484.
[17]Schultz H S,Freyermuth H B,Buc S R.New catalysts for the oxidation of sulfides to sulfones with hydrogen peroxide[J]. J Org Chem,1963(28):1140-1142.
A Method for Synthesizing S-aryl Aryl Thiosulfonate by Oxidation of Hydrogen Peroxide with Diaryl Disulfides
LI Shu-yan1,2,KE Yan-ping3
(1.Department of Food and Biology Engineering,Zhangzhou Institute of Technology,Zhangzhou 363000,Fujian,China;2.The Applied Technical Engineering Center of Further Processing and Safety of Agriculture Products,Higher Education Institution in Fujian Province,Zhangzhou 363000,Fujian,China;3.College of Materials and Energy,South China Agricultural University,Guangzhou 510642,Guangdong,China)
The paper took ArSSAr as the raw material,the inexpensive and environmentally friendly H2O2as the oxidant,t(H2O2)as the oxidant,with the promotion of iodine element(I2),ethanol or dimethyl sulfoxide(DMSO)as the solvent,made the synthesis of S-aryl thioaryl sulfone at 60℃,which was confirmed by 1H NMR and infrared IR in its production structure.Such method was characterized as mild reaction conditions,easy availability of materials and simple operation.
diaryl sulfide;hydrogen peroxide;S-aryl aryl thiosulfonate;oxidation
O62
A%%%
1007-5348(2017)03-0067-05
(责任编辑:邵晓军)
2016-12-28
福建省教育厅科技计划项目(JA13388);广东省科技计划项目(2016B020204005);漳州职业技术学院科研项目(ZZY1308).
李术艳(1981-),女,内蒙古亦峰人,漳州职业技术学院食品与生物工程系讲师,硕士;研究方向:有机化学.
