超声波乙醇浸提法提取橄榄叶总多酚工艺的研究
2017-05-17孔祥佳刘廉荣
孔祥佳,刘廉荣
(福建中医药大学药学院,福建福州350122)
超声波乙醇浸提法提取橄榄叶总多酚工艺的研究
孔祥佳,刘廉荣
(福建中医药大学药学院,福建福州350122)
目的研究橄榄叶中总多酚超声波乙醇浸提法的最佳工艺条件。方法固定超声波功率为500 W,选取提取时间、提取温度、乙醇浓度、固液比作为影响因素,以橄榄叶总多酚得率为评价指标。在单因素试验的基础上,进行四因素三水平正交试验,得到超声波乙醇浸提的优化组合条件。结果橄榄叶总多酚的最优提取工艺条件为提取时间50 min,提取温度35℃,乙醇浓度60%,固液比为1∶20(g/mL),各因素影响橄榄叶总多酚得率的主次关系为乙醇浓度>固液比>提取时间>提取温度。结论橄榄叶总多酚得率高达(8.90±0.14)%。
超声波乙醇浸提;橄榄叶;总多酚;正交试验
橄榄(Canarium album(Lour.)Raeusch)为橄榄科橄榄属常绿乔木,是中国南方亚热带特色药食兼用型果品[1-3],主要分布于福建省[4-5]。橄榄含有丰富的生物活性成分和较高的药理作用[3]。其中,多酚类物质是橄榄主要的生物活性成分之一,主要分布于橄榄果实内,其次集中在橄榄叶中,具有抑菌和抗氧化的作用[2-3,6-7]。由于天然植物源提取物的提取具有价低、安全、无毒等作用,从天然植物源中提取抑菌活性成分和抗氧化活性成分愈来愈受到人们的关注。因此研究橄榄果实或橄榄叶总多酚的提取工艺对药食同源橄榄的开发和应用具有重要意义。前人研究表明:有关橄榄果实多酚类物质提取方法主要涉及有机溶剂浸提法[8-9]、超声波提取法[8,10]、微波辅助提取法[8,11]等;而有关橄榄叶酚类物质提取方法主要采用有机溶剂浸提法[6-7]、微波辅助提取法[7]等。但超声波乙醇浸提法提取橄榄叶总多酚工艺的研究未见报道。本试验以福建主栽橄榄品种‘檀香’橄榄叶为试材,通过单因素试验和正交试验,研究超声波乙醇浸提法提取橄榄叶总多酚的工艺,为开发利用橄榄叶资源、开展橄榄叶多酚生物活性的研发提供参考依据和理论指导。
1材料
1.1实验材料以福建主栽橄榄品种‘檀香’橄榄叶为材料,采自福建省闽清县安仁溪橄榄科技示范场。
1.2实验试剂没食子酸为标样(中国食品药品检定研究院,批号:110831-201204);无水碳酸钠、无水乙醇均为分析纯;福林酚试剂为生化试剂(国药集团化学试剂有限公司)。
1.3仪器与设备752型紫外分光光度计(南京科捷分析仪器有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);FW177型中药粉碎机(天津市泰斯特仪器有限公司);AG-CP225D型离心机(德国Sartorius公司);AR2130型电子天平(奥豪斯仪器有限公司);Milli-Q型超纯水器(德国Millipore公司);HH-S型恒温水浴锅(郑州长城科工贸有限公司);SFG-02(B)型电热恒温鼓风干燥箱(黄石市恒丰医疗器械有限公司)。
2方法
2.1橄榄叶处理橄榄叶经清洗、晾干后,置于40℃电热恒温鼓风干燥箱中烘干,粉碎并过80目筛,用自封袋密封后存放于干燥器中备用。
2.2没食子酸标准曲线按照王宗举[6]的方法绘制没食子酸标准曲线。
2.3橄榄叶总多酚含量测定按照王宗举[6]的方法采用Folin-Ciocalteu法测定橄榄叶总多酚含量,按照公式(1)计算橄榄叶总多酚得率,单位以%计。

式中:C为按照没食子酸标准曲线方程计算得到的橄榄叶提取液总多酚含量/(mg/L);V为提取总多酚液体积/mL;M为橄榄叶质量/g。
2.4单因素条件对橄榄叶总多酚得率的影响①提取温度:精确称取1.0 g干燥橄榄叶粉末5份,分别加入4~5倍量的石油醚脱脂、脱色后,各加入60%乙醇20 mL,分别在30、40、50、60、70℃下超声浸提60 min。②乙醇浓度:精确称取1.0 g干燥橄榄叶粉末5份,各加入4~5倍量的石油醚脱脂、脱色后,分别加入30%、40%、50%、60%、70%乙醇20 mL,在40℃下超声浸提60 min。③固液比:精确称取1.0 g干燥橄榄叶粉末5份,各加入4~5倍量的石油醚脱脂、脱色后,分别加入60%乙醇10、15、20、25、30 mL,在40℃下超声浸提60 min。④提取时间:精确称取1.0 g干燥橄榄叶粉末5份,分别加入4~5倍量的石油醚脱脂、脱色后,各加入60%乙醇20 mL,分别在40℃下超声浸提20、30、40、50、60 min。以上各条件均固定超声功率为500 W。
2.5正交试验根据单因素试验与分析结果设计正交试验,进一步优化超声波乙醇浸提法提取橄榄叶总多酚的工艺条件。
2.6统计学方法利用Excel处理实验数据,采用SPSS 19.0对实验数据进行统计分析,多个样本均数比较采用方差分析。
3结果与分析
3.1没食子酸标准曲线的绘制由图1可知,以吸光度(y)与对应的没食子酸标准浓度(x)进行线性回归,得到没食子酸的标准曲线为y=0.1404x+0.0023,R2=0.9997,在0~4.8 mg/L浓度范围内呈良好的线性关系。

图1没食子酸标准曲线
3.2提取温度对橄榄叶总多酚得率的影响由图2可知,橄榄叶总多酚得率在提取温度为40℃时达到最大值,并随着提取温度增加,总多酚得率降低。这是由于随着提取温度升高,分子的运动速率加快,物料的传质、扩散、渗透、溶解速度提高,可使多酚类物质更易从细胞内转移到溶剂中,提高橄榄叶总多酚得率;但是提取温度越高,性质不稳定的多酚类物质越易氧化分解并发生缩合反应[8],从而使橄榄叶总多酚得率降低。因此,选取提取温度为40℃。

图2提取温度对橄榄叶总多酚得率的影响
3.3乙醇浓度对橄榄叶总多酚得率的影响由图3可知,橄榄叶总多酚得率在乙醇浓度为60%时达到最大值,并随着乙醇浓度增加,总多酚得率降低。这可能由于过高的乙醇浓度会增加其它醇溶性物质的溶出,导致其与多酚类物质竞争乙醇分子,从而使橄榄叶总多酚得率降低。因此,选取乙醇浓度为60%。
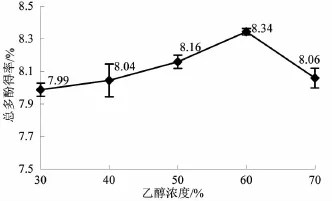
图3乙醇浓度对橄榄叶总多酚得率的影响
3.4固液比对橄榄叶总多酚得率的影响固液比是指溶质与溶剂的混合比例,可影响固相和液相间的浓度差。由图4可知,固液比固定在1∶20时,总多酚得率最高。这说明溶剂用量过低,与固相间的浓度差小,传质推动力小,无法充分提取橄榄叶中的总多酚;溶剂用量过多,虽可提高传质推动力,但也导致提取物中其它杂质的含量增加,橄榄叶总多酚的得率反而下降,影响提取效果。因此,选取固液比为1∶20。
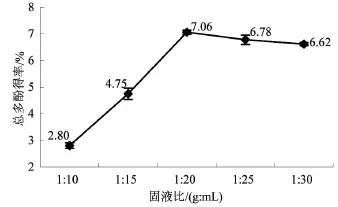
图4固液比对橄榄叶总多酚得率的影响
3.5提取时间对橄榄叶总多酚得率的影响由图5可知,橄榄叶总多酚得率在50 min时出现最大值,并随着提取时间的增加,总多酚得率下降。这说明适宜的提取时间可提高橄榄叶总多酚得率;但提取时间过长,会导致多酚类物质分解,并且增加提取物中其它杂质的含量,从而降低橄榄叶总多酚得率[12]。因此,选取提取时间为50 min。
3.6正交试验与分析根据单因素试验结果,在固定超声波功率为500 W的基础上,选取提取时间(A)、提取温度(B)、乙醇浓度(C)、固液比(D)四因素,进行四因素三水平L9(34)正交试验。正交试验因素水平见表1,正交试验结果及极差分析见表2,
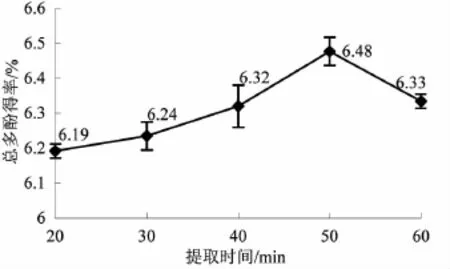
图5提取时间对橄榄叶总多酚得率的影响
正交试验方差分析见表3。
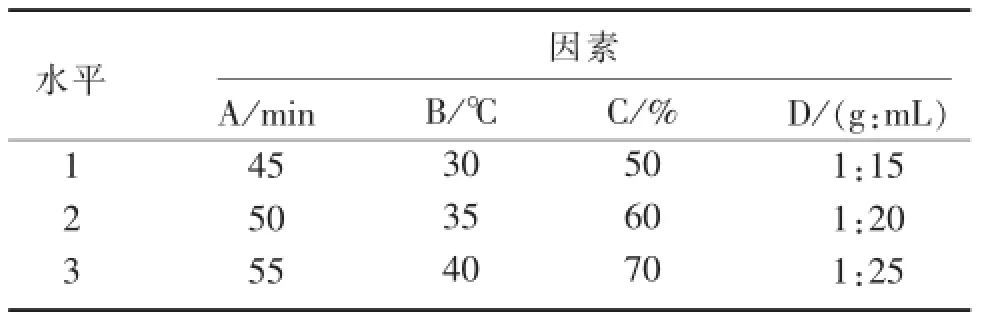
表1正交试验因素水平
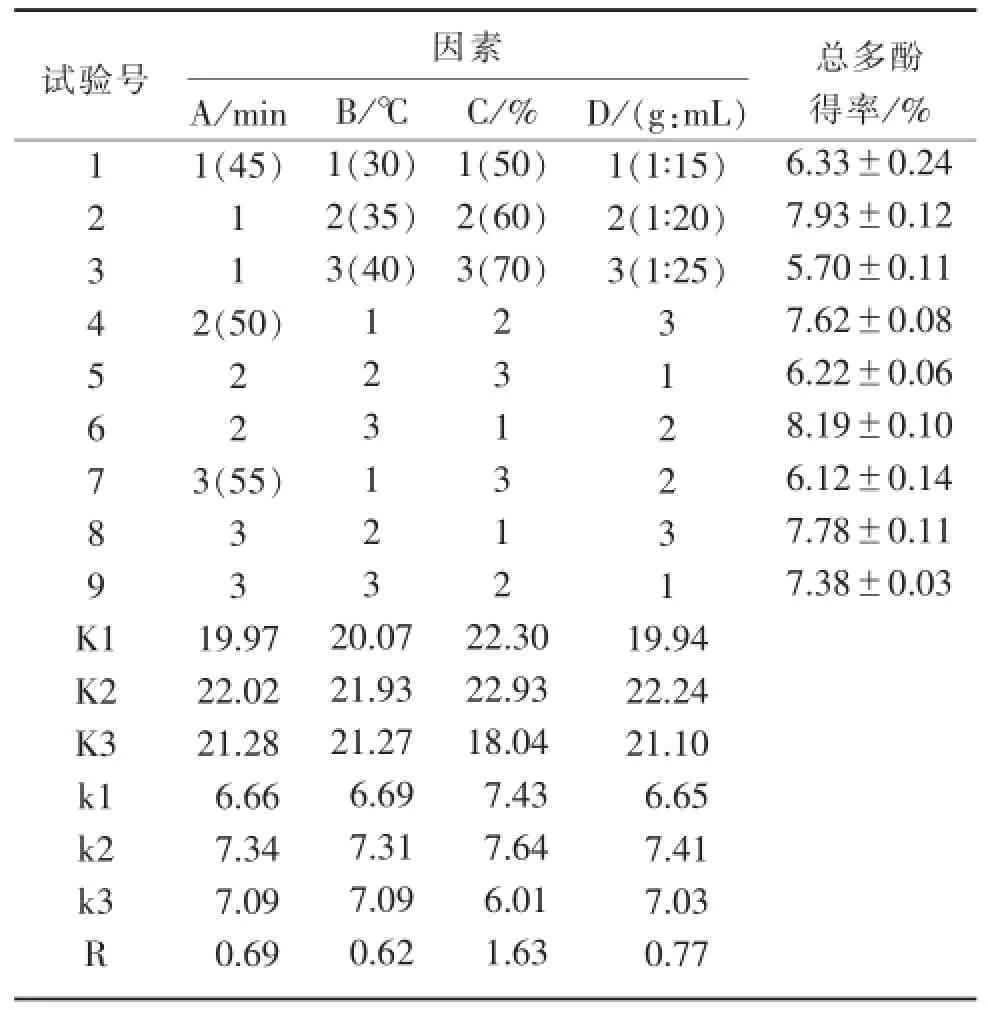
表2正交试验结果及极差分析(x±s)

表3正交试验方差分析
由表2可知,超声波乙醇浸提法提取橄榄叶总多酚的最优工艺条件组合为A2B2C2D2,即提取时间为50 min,提取温度为35℃,乙醇浓度为60%,固液比为1∶20。利用此最优工艺条件组合进行超声波乙醇浸提法提取橄榄叶总多酚的验证性重复试验,测得总多酚得率为(8.90±0.14)%。同时,通过极差R值可以得出,各影响因素的主次关系为乙醇浓度>固液比>提取时间>提取温度。
由表3可知,提取时间、提取温度、乙醇浓度、固液比这4个因素对橄榄叶总多酚得率的影响均呈非常显著性(P<0.01)。
4讨论
超声波作用于植物体时可引起机械振动,通过超声波振动产生高速率、高强度的机械作用和空化效应,有效破坏植物细胞。超声波提取技术就是利用上述原理,使植物细胞壁结构破坏或变形,加速溶剂向植物组织中渗透,并加快有效成分向溶剂中扩散,从而促进有效成分的溶解,提高有效成分的得率[13]。研究表明:超声波提取技术具有提取温度低、提取率高、提取时间短等特点,不仅能提高生产效率,而且能有效保持成分的活性,已广泛应用于多酚类物质及其它天然植物源活性成分的提取[12-15]。本试验在单因素结果的基础上,固定超声波功率为500 W,设计L9(34)正交试验对提取时间、提取温度、乙醇浓度、固液比进行优化,得出最优工艺条件为提取时间50 min,提取温度35℃,乙醇浓度60%,固液比为1∶20,各因素影响橄榄叶总多酚得率的主次关系为乙醇浓度>固液比>提取时间>提取温度。在此最优工艺条件下,橄榄叶总多酚得率高达(8.90±0.14)%,要高于王宗举[6]报道的采用均匀设计法提取橄榄叶多酚的得率,但低于郑贤明[7]报道的采用微波强化提取橄榄叶多酚的得率,这可能是实验材料及提取方法的差异造成的。
综上所述,采用正交试验方法对橄榄叶中总多酚的提取工艺进行优化,可获得最佳工艺条件,增强工艺的可操作性。
[1]国家药典委员会.中华人民共和国药典2015年版(一部)[S].北京:中国医药科技出版社,2015:197-198.
[2]林玉芳,陈清西.橄榄功能成分及其抗氧化作用研究进展[J].热带作物学报,2010,31(1):158-163.
[3]常强,苏明华,陈清西.橄榄化学成分与药理活性研究进展[J].热带作物学报,2013,34(8):1610-1616.
[4]孔祥佳,林河通,周鹤,等.鲜食橄榄果实的适宜采收期及其品质评价参数的研究[J].保鲜与加工,2016,16(2):6-14.
[5]福建省统计局.福建统计年鉴2015[DB/OL].(2015-08-26). http://www.stats-fj.gov.cn/tongjinianjian/dz2015/index-cn.htm.
[6]王宗举.橄榄叶多酚类化合物的提取、纯化和抗氧化性能研究[D].重庆:重庆工商大学,2010.
[7]郑贤明.橄榄叶多酚提取纯化及抗氧化活性的研究[D].福州:福建农林大学,2012.
[8]何志勇.橄榄酚类化合物的分离纯化和结构研究[D].无锡:江南大学,2007.
[9]林玉芳,陈清西,关夏玉,等.橄榄总多酚提取工艺优化研究[J].中国农学通报,2011,27(5):396-400.
[10]曾培源,朱贲峰.超声提取橄榄多酚工艺条件的优化[J].海峡药学,2014,26(3):17-19.
[11]HE Z Y,XIA W S.Microwave-assisted extraction of phenolics from Canarium album L.and identification of the main phenolic compound[J].Natural Product Research,2011,25(2):85-92.
[12]陈亮,李医明,陈凯先,等.植物多酚类成分提取分离研究进展[J].中草药,2013,44(11):1501-1507.
[13]XIANG L,ZHOU T J,YE Y C.Ultrasonic ethanol extraction technology of polyphenol from FRUCTUS CANARII[J].Medicinal Plant,2012,3(2):54-56,60.
[14]ALTEMIMI A,CHOUDHARY R,WATSON D G,et al.Effects of ultrasonic treatments on the polyphenol and antioxidant content of spinach extracts[J].Ultrason Sonochem,2014(24):247-255.
[15]房玉林,齐迪,郭志君,等.超声波辅助法提取石榴皮中总多酚工艺[J].食品科学,2012(6):115-118.
R284.2
A
1000-338X(2017)02-0034-04
2016-12-23
孔祥佳(1983—),女,博士,讲师,研究方向:天然产物提取及活性研究。
