1株噻吩磺隆降解菌(Pseudomonas syringae LXL—3)的分离及降解特性
2017-05-17李晓楼赵燕
李晓楼 赵燕

摘要:从长期使用噻吩磺隆的农田土壤中筛选到1株能高效降解噻吩磺隆的细菌LXL-3,按照16S rRNA分析方法并参照其生理生化特点,鉴定LXL-3为丁香假单胞菌(Pseudomonas syringae)。菌株LXL-3在含100 mg/L噻吩磺隆的培养基中培养48 h后,噻吩磺隆降解率可达81%以上。菌株LXL-3的适宜pH值和适宜温度分别为7.0~7.5、25~30℃,该菌还对噻吩磺隆和NaCl有很好的耐受性。研究表明,该菌在噻吩磺隆等农药污染物的生物治理方面具有较好的应用前景。
关键词:噻吩磺隆;丁香假单胞菌;生物降解
中图分类号:X172 文献标志码:A 文章编号:1002—1302(2016)01—0369—04
噻吩磺隆(thifensulfuron-methyl)属磺酰脲类除草剂,其化学名称为3-(4-甲氧基-6-甲基-1,3,5-三嗪-2-基)-1-(2-甲氧基甲酰基噻吩-3-基)-磺酰脲,常用作茎叶处理剂,通过抑制植物的乙酰乳酸合成酶(ALS)活性,干扰支链氨基酸的合成,最终导致敏感植物停止生长并死亡,目前在我国已广泛用于防除小麦、玉米、大豆等作物田间的阔叶杂草。噻吩磺隆在农业上的广泛应用在提高农业生产效率方面发挥了重要作用,但噻吩磺隆的残留也对生态环境、食用农产品安全及人类健康带来了诸多不利影响,并会对一些敏感农作物产生药害,有时甚至会严重影响到下茬作物的正常生长。
已有研究表明,磺酰脲类除草剂的降解可包括光解、水解和生物降解等多种途径,并认为微生物的降解作用是磺酰脲类除草剂的主要降解途径。例如,Jean等发现噻吩磺隆在未经灭菌处理的土壤中能快速降解,而在灭过菌的土壤中降解速度却非常缓慢,表明土壤中的微生物对噻吩磺隆的降解起到了关键作用。目前,有关微生物降解噻吩磺隆这一领域的研究工作报道较少,已有文献仅报道了一些噻吩磺隆降解菌株的分离以及相关降解特性的测试。例如,Geraldine等从土壤中分离获得了1株伯克霍尔德氏菌(Burkholderia cepa-cia),该菌株可较快地降解噻吩磺隆;黄星等人从土壤中分离到1株能高效降解噻吩磺隆的寡养单胞菌(Stenotroph-omonas sp.),并對该菌株的降解特性进行了系统研究;Hugh等则报道了7种可降解噻吩磺隆的细菌或放线菌。本研究以筛选出噻吩磺隆高效降解菌为研究对象,研究该菌株的生理生化特征及应用性能,以期为后续的应用研究奠定基础。
1材料与方法
1.1试剂与培养基
噻吩磺隆(≥98.5%)购自上海市农药研究所,噻吩磺隆标准品购自Sigma-Aldrich公司(美国),本试验中所用其他化学试剂均为分析纯或以上级别。
无机盐培养基:1.0 g NH4N03,0.5 g KH2P04,1.5 gK2HP04,0.5 g NaCl,0.2 g MgSO4·7H2O,1 L蒸馏水,pH值7.0。在无机盐培养基中加入噻吩磺隆即为噻吩磺隆分离培养基。
富集培养基:4 g牛肉浸出粉,10 g蛋白胨,5 g NaCl,3 g酵母浸出粉,1 L蒸馏水,pH值7.0。制作培养平板或者斜面时,在培养基中加入2%的琼脂。
1.2仪器
安捷伦1260/6430高效液相色谱-三重四级杆串联质谱仪(美国),安捷伦ZORBAX Eclipse Plus C18色谱柱(3.0×100 mm,1.8-Micron),IKATM匀浆机(德国),振荡培养箱(太仓华美),氮吹浓缩器,岛津UV-2550分光光度计(日本)。
1.3噻吩磺隆降解菌的分离与鉴定
用于分离噻吩磺隆降解菌的土壤样品取自四川遂宁农田,取土耕地使用磺酰脲类除草剂已有5年以上历史。在100 mL噻吩磺隆无机盐培养基(噻吩磺隆浓度为50 mL/L)中加入2.0 g土样,在30℃下振荡培养5 d(150 r/min)。检测降解效果,若5 d降解率大于30%,则吸取5 mL培养液转接到相同浓度的噻吩磺隆富集培养基中,并连续转接5次(若降解率不足30%,则重新取土样重复上述过程)。再次验证降解效果后,在噻吩磺隆无机盐培养基平板上涂布上述富集培养液,在30℃下倒置培养,挑取生长旺盛的菌落在培养平板上反复划线分离以得到纯培养物。最后,分离得到的纯培养物被接种到富集培养基上保存备用。
菌种的生理生化鉴定参照《常见细菌系统鉴定手册》和《Bergeys Mannual 0f Determinative Bacteriology》(9th edi-tion)进行,同时按照16S rRNA序列分析法进行菌种鉴定。
1.4降解菌株16S序列的测定
总DNA的提取采用CTAB法,16S rDNA引物设计参见文献[9]:
正向引物为5′-AGAGrITTGATCCTGGCTCAG-3′;
反向引物为5′-AAGGAGGTGATCCAGCCGCA-3′。
扩增反应体系如下:5.0μl 10×聚合酶反应缓冲液,4.0 μL dNTPs(2.5 mmoL/L),1.0μL引物(25μmoL/L),6.0μL Mg2+(25 mmoL/L),1.0μL模板DNA(浓度约为50 ng/μL),0.3 μL Taq DNA聚合酶(5 U/μL),加ddH2O至50μL。反应条件:95℃5 min;94℃30 s,52℃30 s,72℃75 s,30个循环;72℃10 min。扩增产物的测序由上海生工公司完成,后将所测序列输入GenBank数据库进行相关分析。
1.5噻吩磺隆的定量分析
提取:称取10.0 mL(或固体样品10.0 g)待测样品于100 mL具塞锥形瓶中,加入40 mL提取液(pH值7.8的磷酸盐缓冲溶液与甲醇等体积混合),加盖后振荡45 min(120 r/min),超声萃取5 min,布氏漏斗抽滤,滤液转移至50 mL容量瓶中,用提取液清洗、转移并定容至50 mL。移取20 mL上述溶液在40℃水浴中减压浓缩至10 mL,加10 mLpH值2.0的磷酸盐缓冲液并调节最终pH值至2.0~3.0。
净化:依次用5 mL甲醇、5 mL水、5 mL提取液淋洗活化固相萃取柱(Oasis HLB:200 mg,6 mL),将上述待净化液转移上柱,抽干。再用6 mL乙腈洗脱,收集至刻度管中,40℃氮吹至近干,取2.0 mL体积分数为50%的甲醇水溶液溶解样品,过0.22μm滤膜,待测。
测定:用安捷伦1260/6430高效液相色谱-三重四级杆串联质谱仪进行分析,外标法定量。流动相[A相(0.1%甲酸+4 mmoL乙酸铵),B相(甲醇),等度洗脱],质谱采集参数(母离子388,子离子141/167,碎裂电压125,碰撞能量10/10)。
1.5接种体的准备
在肉汤培养基中培养所筛选的降解菌株,并通过离心方式收集菌体(6 000 r/min离心5 min),收集到的菌体用无菌水洗涤3遍后再用无菌生理盐水重悬,使D600nm=1.0,该悬浮液用作后续降解试验的接种体(特别标注的除外)。
1.6温度对菌株LXL-3降解噻吩磺隆的影响
在以噻吩磺隆为唯一碳源的無机盐培养基(噻吩磺隆浓度100 mg/L,pH值7.0)中接种3%的上述接种体,然后分别置于20、25、30、35、40℃条件下振荡培养,每隔24 h以无菌操作的方式取样1次,测定噻吩磺隆残留浓度及D600nm值。
1.7 pH值对菌株LXL-3降解噻吩磺隆的影响
将含有100 mg/L噻吩磺隆的无机盐培养基的pH值分别调至6.0、6.5、7.0、7.5、8.0,然后分别接种3%的接种体,置于30℃下振荡培养,定时取样监测噻吩磺隆降解情况及D600nm值。
1.8菌株LXL-3对噻吩磺隆的耐受性
在含有不同浓度噻吩磺隆(50~800 mg/L)的无机盐培养基中分别接人菌株LXL-3,然后在30℃下振荡培养,定时取样测试D600nm,用以评价噻吩磺隆浓度对菌株LXL-3生长的影响。
1.9菌株LXL-3对NaCl的耐受性
调节无机盐培养基(含有100 mg/L噻吩磺隆)中的NaCl含量,使其NaCl含量分别为0.5%(作参照)、1.0%、2.0%、4.0%、6.0%、8.0%(共6组),然后分别接人等量的菌株LXL-3,在30℃下振荡培养,定时取样测试D600nm,用以评价菌株LXL-3对盐的耐受性。
1.10应用菌株LXL-3降解土壤中的噻吩磺隆
土壤样品取自四川省遂宁市射洪县农田,分4组,A组:灭菌土壤(新鲜土壤于121℃下灭菌30 min);B组:新鲜土壤;C组:灭菌土壤中添加菌株LXL-3;D组:新鲜土壤中添加菌株LXL-3。另外,每组中噻吩磺隆浓度均为100 mg/kg。最后将其置于30℃下培养,每隔24 h取样测定噻吩磺隆的残留浓度。
2结果与分析
2.1噻吩磺隆降解菌株的鉴定及特性
从土壤中分离到1株能以噻吩磺隆为唯一碳源的菌株,将其命名为LXL-3。该菌株为稍有弯曲的杆状菌,大小为(0.5~0.8)μm×(2.0~2.5)μm,革兰氏阴性,有1~7根鞭毛,可运动,不产芽孢,好氧生活,在营养肉汤平板上可形成表面湿润的圆形菌落。氧化酶、接触酶、明胶液化试验及V.P试验均为阳性,而淀粉水解试验和反硝化试验呈阴性。菌株TJXL-3经鉴定为丁香假单胞菌(Pseudomonas syringae),其生化鉴定结果与按照16S rRNA分析方法所得到的结果一致(菌株LXL-3的16S rRNA分析委托上海生工公司完成,GenBank登录号为KP125318)。
2.2温度和pH值对于菌株LXL-3生长及降解噻吩磺隆的影响
菌株LXL-3在25~30℃条件下的生长状况要优于其他温度条件,并且在这一温度下降解噻吩磺隆的效率也最高(图1、图2),在5 d后噻吩磺隆(起始浓度为100 mg/L)的降解率能达到99.0%以上,表明菌株LXL-3生长及降解噻吩磺隆的适宜温度为25~30℃。当温度为35℃时,菌株LXL-3的生长状况以及降解噻吩磺隆的效率会相对差一些,但是仍然处于较高的水平。若温度达到40℃,菌株的生长和噻吩磺隆降解率都会大幅度下降,在40℃下培养48 h,其D600nm和噻吩磺隆降解率分别仅为30℃时的68%、50%。以上结果表明,菌株LXL-3对高温是敏感的,若温度达到或高于40℃,其生长及降解噻吩磺隆的能力都将受到不利影响,因此菌株LXL-3仅适合应用于低于40℃的温度条件。
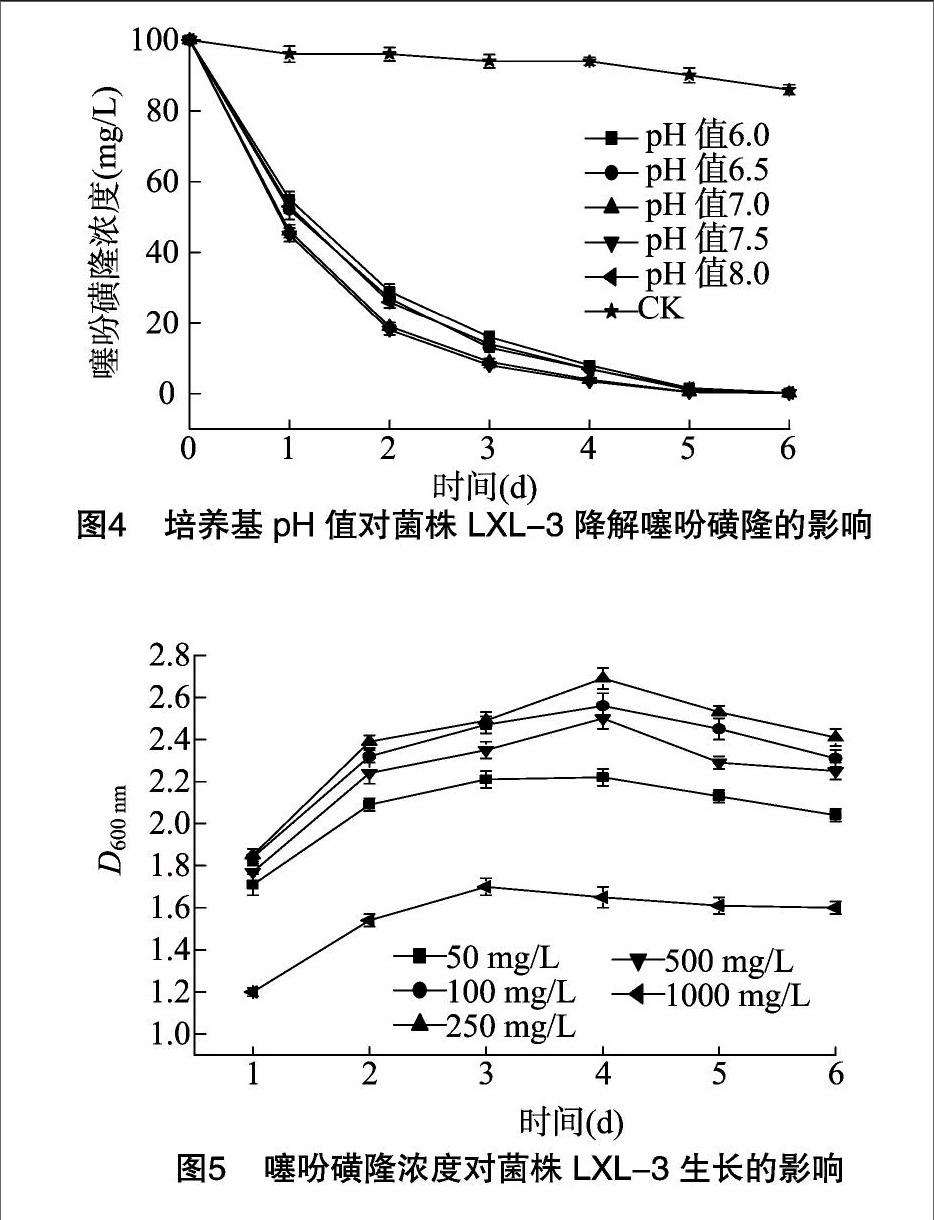
微生物的生长状况及降解能力等通常会受到pH值的影响。本研究结果表明,培养基的pH值为7.0时,菌株LXL-3的生长要优于在其他pH值条件(图3);而适宜于菌株LXL-3降解噻吩磺隆的pH值为7.0或7.5,pH值为6.0时则降解率显著降低(图4),说明菌株LXL-3的生长与噻吩磺隆的降解速度呈正相关。此外,pH值会在一定程度上影响到菌株LXL-3的生长和噻吩磺隆的生物降解,但其4 d后的降解率也显示,pH值对于菌株LXL-3降解噻吩磺隆的影响在降解后期并不十分显著,因为在5个不同的pH值条件下,培养4 d后菌株LXL-3降解噻吩磺隆(起始浓度为100 mg/L)的降解率都可以达到90%以上,表明菌株LXL-3拥有极强的噻吩磺隆降解能力(图3、图4)。已有研究表明,在不考虑生物降解的情况下,在pH值中性时噻吩磺隆最为稳定,在培养基为酸性或碱性时则有利于噻吩磺隆的水解;然而,在本试验中并没有表现出这一现象(图4),可推测这里的降解行为主要是菌株LXL-3的生物降解作用。本试验中的最大降解率发生在pH值中性条件下,这主要是由于菌株LXL-3在中性条件下生长更好,可能会产生更多的降解酶,并且多数降解酶在pH值中性条件下有更大的酶活性。
2.3噻吩磺隆浓度对菌株LXL-3生长的影响
当噻吩磺隆浓度从50 mg/L升高至250 mg/L时,D600nm值有增加的趋势,表明噻吩磺隆浓度为50 mg/L时不能充分满足试验条件下菌株LXL-3的碳源或能源需求,但在浓度达到250 mg/L时菌株生长达到基本饱和,继续增加噻吩磺隆可能会抑制该菌株的生长。当浓度由250mg/L增加到500 mg/L时,D600nm值有所下降,但统计学上的差异不显著;若增加至1000 mg/L,则菌株的生长受到明显抑制,但仍然可以生长(图5)。因此,初步判定菌株LXL-3在试验条件下能耐受浓度为500 mg/L的噻吩磺隆,在这一浓度下,菌株LXL-3的生长不会受到显著影响。依据本试验结果,可作以下推测:(1)由于500 mg/L的噻吩磺隆不会对菌株LXL-3的生长产生显著影响,故认为菌株LXL-3对噻吩磺隆有很好的耐受性。(2)菌株LXL-3拥有很强的降解噻吩磺隆的能力,能够用于较宽的噻吩磺隆浓度范围;菌株LXL-3显示了更快的噻吩磺隆降解速率(相比较文献报道的噻吩磺隆降解菌株而言)。(3)菌株LXL-3可能能用于噻吩磺隆污染的生物修复,特别是高浓度的噻吩磺隆污染。菌株LXL-3所拥有的噻吩磺隆降解能力可能与分离该菌株的农田土壤长期使用噻吩磺隆农药密切相关,按照记录,相关农田已经有使用噻吩磺隆5年以上的历史。通常,土壤微生物长期持续接触某种人工合成有机化合物可能会诱导出降解该化合物的能力,这些具备了新的降解特性的微生物可能与问题土壤中农药的快速失活密切相关。
2.4 NaCl浓度对菌株LXL-3生长的影响
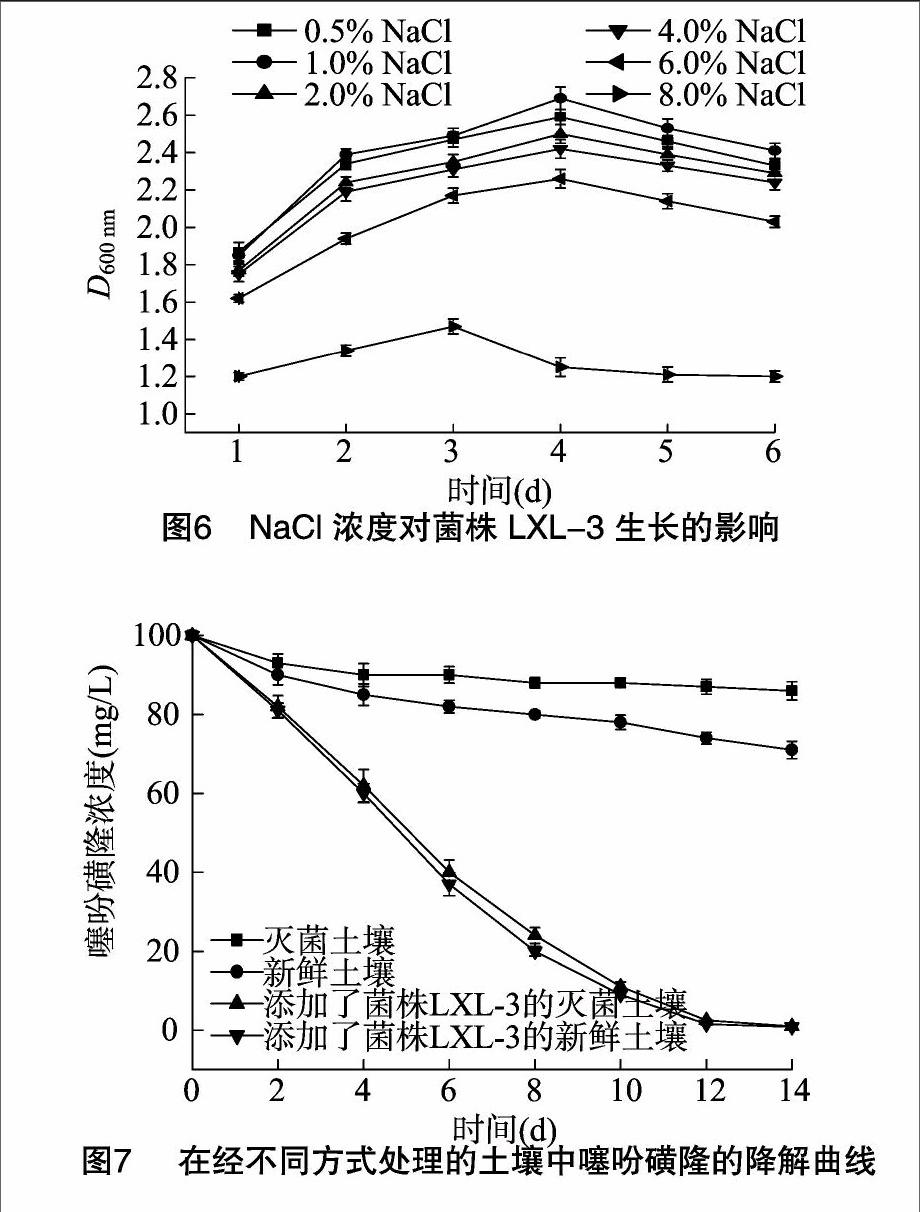
当NaCl浓度从0.5%升高至4.0%时,所测得的D600nm值未出现显著变化(图6),这表明菌株LXL-3至少能耐受4.0%的NaCl;同时,由于供试培养基中只有噻吩磺隆1种碳源,菌株LXL-3是以降解噻吩磺隆来获取碳源进行生长,表明该菌株在高盐压力下仍可保持对噻吩磺隆的降解能力。此外,当NaCl浓度从4.0%升高至6.0%时,菌株LXL-3的生长受到了较明显影响,D600nm值显著降低,但该菌株仍然能较好地生长;即使NaCl浓度提高至8.0%,菌株LXL-3仍可维持低水平的生长((图6),因此认为该菌株属中等或以上程度的耐盐菌。菌株LXL-3的耐盐性可能与采样地点的盐碱化有一定关系,微生物持续处于滲透压胁迫环境下,可诱导产生耐盐性能,这一般通过渗透调节或蛋白质调节这2种方式实现。
2.5土壤中噻吩磺隆的降解
通过添加菌株LXL-3到土壤中用以降解土壤中的噻吩磺隆是可行的,添加了菌株LXL-3的土壤中噻吩磺隆的降解率要明显高于未添加菌株LXL-3的土壤,噻吩磺隆(起始浓度是100 mg/kg)的10 d降解率约为90%,14 d降解率则可达到99%以上,趋于完全降解(图7)。然而,在不含菌株LXL-3的土壤中其10、14 d的降解率仅分别为29%、14%,说明菌株LXL-3具有较强的生存能力,并能在土壤中有效降解噻吩磺隆。此外,在新鲜土壤中噻吩磺隆的降解率要稍高于其在灭菌土壤中的降解率,存在于新鲜土壤中的某些拥有噻吩磺隆降解能力的天然微生物可能是导致这一现象的原因。在不含活微生物的灭菌土壤中,经历14 d后其噻吩磺隆的含量下降了14%(图7),噻吩磺隆数量随时间逐渐减少的现象则可能是由水解和光解作用所造成。Andersen等的研究已经证实磺酰脲类除草剂在土壤环境中的降解行为受很多因素的影响,如温度、pH值、光、微生物、土壤类型以及施用的肥料等。
3小结
在本研究中分离到1株能有效降解噻吩磺隆的细菌,该菌被命名为LXL-3,并被鉴定为丁香假单胞菌。在不同的条件下测试了该菌株的生理生化特征和噻吩磺隆降解性能,其中在含100 mg/L噻吩磺隆的无机盐液体培养基中,菌株LXL-3培养48 h后,噻吩磺隆的降解率可达81%以上。菌株LXL-3降解噻吩磺隆的适宜pH值为7.0~7.5,适宜温度为25~30℃。此外,该菌还对噻吩磺隆和NaCl有很好的耐受性,至少能耐受500 mg/L以上的噻吩磺隆和4.0%以上的NaCl。将菌株LXL-3添加到被噻吩磺隆污染的土壤,结果表明该菌株能在土壤中生长并发挥降解噻吩磺隆的作用。因此,菌株LXL-3可用于污染物的生物处理,在后续研究中尝试将菌株LXL-3制作成微生物活菌制剂用于噻吩磺隆及其他相关污染物的生物治理。
