新生儿出生后两次乙肝免疫球蛋白注射不提高HBV母婴传播阻断效果
2017-05-16张英易为李明慧张丹张禄雪胡玉红刘敏刘顺爱华文浩宋淑静万钢谢尧
张英 易为 李明慧 张丹 张禄雪 胡玉红 刘敏 刘顺爱 华文浩 宋淑静 万钢 谢尧
100015 北京大学地坛医院教学医院 (张英、谢尧), 首都医科大学附属北京地坛医院妇产科 (易为、胡玉红、刘敏),肝病中心肝病二科 (李明慧、张丹、张禄雪);检验科(华文浩、宋淑静),传染病研究所(刘顺爱),病案科(万钢)
·病毒病诊断与治疗·
新生儿出生后两次乙肝免疫球蛋白注射不提高HBV母婴传播阻断效果
张英 易为 李明慧 张丹 张禄雪 胡玉红 刘敏 刘顺爱 华文浩 宋淑静 万钢 谢尧
100015 北京大学地坛医院教学医院 (张英、谢尧), 首都医科大学附属北京地坛医院妇产科 (易为、胡玉红、刘敏),肝病中心肝病二科 (李明慧、张丹、张禄雪);检验科(华文浩、宋淑静),传染病研究所(刘顺爱),病案科(万钢)
目的 观察在标准免疫预防HBIG+乙肝疫苗(0、1、6)的基础上,于出生后1个月再次注射HBIG 200 IU 1次对提高HBV母婴阻断效果的作用。方法 入组HBsAg与HBeAg阳性、HBV DNA≥1.0×106IU/ml且妊娠期间未使用抗乙肝病毒药物的慢性HBV感染孕妇及其所生新生儿。新生儿被随机分配到对照组和实验组,对照组新生儿给予标准HBV预防免疫接种方案:200 IU HBIG+10 μg重组乙型肝炎疫苗(0、1、6个月),实验组:在标准预防的基础上于新生儿出生后1个月时再次注射200 IU HBIG。并于出生时和出生后7个月检测静脉血中HBsAg、抗HBs、HBV DNA。新生儿出生后7个月血清 HBsAg和/或HBV DNA阳性定义为HBV母婴阻断失败。结果 本研究共入组280例新生儿,后期随访过程中失访14例(实验组6例,对照组8例),最终完成随访266例(实验组134例,对照组132例),本研究对完成随访的人数进行统计分析。实验组和对照组母亲产前HBV DNA载量分别为7.31±0.66 log10IU/ml和7.32±0.74 log10IU/ml(t=0.11,P=0.92);实验组和对照组HBV阻断失败率分别为5.97%(8/134)和7.58%(10/132),差异无统计学意义(P=0.63);实验组新生儿的抗HBs阳性(≥10 mIU/ml)率及其水平分别为94.03%和(623.60±412.93 mIU/ml),与对照组的抗HBs阳性率(91.67%)及水平(620.38±399.10 mIU/ml)差异无统计学意义(P=0.48,P=0.95)。18例阻断失败新生儿母亲分娩前HBV DNA载量(7.58±0.62 log10IU/ml)高于248例阻断成功组(7.29±0.70 log10IU/ml)(P=0.09);阻断失败新生儿出生时静脉血HBsAg阳性百分率和HBV DNA阳性率均为100%,显著高于阻断成功新生儿HBsAg阳性率(35.89%)和HBV DNA阳性率(31.85%)(P0.001)。Logistic回归分析显示,新生儿静脉血中 HBsAg阳性为乙肝病毒母婴阻断失败的独立相关因素(OR1.39 95%CI1.14~1.68)。分层分析结果显示, 新生儿静脉血HBsAg在0.05-< 1、 1-< 10、≥10 IU/ml三个水平上HBV母婴阻断失败的风险率分别为11.18(95%CI1.23~101.88), 352.00(95%CI15.82~7833.20)和968.00(95%CI81.35~11519.19)。结论 标准免疫预防方案基础上于产后1个月追加1次200IU免疫球蛋白并不能提高母婴阻断成功率。
Fund programs: Beijing Healthcare System for the “High-level Technical Personnel Training Project” (2015-3-106), Beijing Municipal Science and Technology Commission “Capital Medicine Characteristic Research" Project (Z151100004015122), Beijing Science and Technology Commission Major Project (D121100003912001)
母婴传播是亚洲地区慢性乙型肝炎病毒感染的重要途径[1, 2]。在不进行免疫预防的情况下,HBsAg阳性、HBeAg阴性的母亲所分娩的婴儿被感染的比率为20%,而HBsAg阳性且HBeAg阳性的母亲所分娩的婴儿感染的比率达到90%[3, 4]。一些研究证实母亲产前HBV DNA水平是影响HBV母婴传播的最关键因素[5-9]。虽然进行了主被动联合免疫接种,仍有8%~30% HBV高病毒载量的母亲所分娩的婴儿被感染[10]。乙型肝炎疫苗+HBIG免疫接种是预防新生儿HBV感染的最有效方法[11, 12]。随着乙肝疫苗预防接种的推广和普及,在中国台湾地区HBsAg 血清阳性率从9.8%下降到0.6%,但是免疫接种的失败仍然是乙型肝炎病毒母婴传播的重要原因[13]。中国乙型肝炎病毒感染管理指南推荐对于HBsAg 阳性的孕妇所分娩的新生儿注射乙肝免疫球蛋白,且于产后1个月自愿选择注射第二针免疫球蛋白[14]。乙肝免疫球蛋白通过中和HBV病毒颗粒、阻止其进入肝细胞进而降低母婴传播[15],但是出生时一次剂量的免疫球蛋白并不能中和所有的病毒颗粒[16]。然而目前并没有相关研究观察额外剂量的免疫球蛋白对母婴阻断作用的效果。因此,我们进行了一项前瞻性随机对照研究,旨在观察高病毒载量HBV感染孕妇所分娩的新生儿在标准免疫预防接种的基础上于出生后的1个月补注射1次200 IU免疫球蛋白对提高HBV母婴阻断的效果。所有研究患者均签署知情同意书,本研究得到北京地坛医院伦理委员会批准。
1 材料与方法
1.1 研究对象 本研究入组了2012年1月至2015年10月期间在北京地坛医院分娩的新生儿。入组标准为:母亲HBsAg阳性超过6个月;HBeAg阳性且HBV DNA载量在孕28周和产前皆大于1×106IU/ml; 孕期肝功能正常。排除标准:母亲孕期羊水穿刺史;妊娠高血压疾病、胎膜早破、早产、前置胎盘、胎盘早剥等病史;孕期口服抗病毒药物或注射乙肝免疫球蛋白治疗;孕妇孕期合并感染HCV、HDV、HIV、梅毒、弓形虫、风疹病毒、CMV等。入组母亲所生新生儿随机分为对照组和实验组,对照组给予标准预防免疫接种程序:于出生后2 h内注射200 IU HBIG和10 μg重组乙型肝炎疫苗(大连,汉逊酵母),并与于产后1个月和6个月再次注射10 μg重组乙型肝炎疫苗进行加强。实验组:在标准免疫接种的基础上于新生儿出生1个月龄时再次注射200 IU HBIG。所有母亲完成了孕期规范的产科检查,收集母亲的基线资料,主要包括:年龄、产次、配偶HBV感染情况、既往胎儿感染情况、孕28周和产前HBV DNA载量、分娩方式等。新生儿资料主要包括:性别、出生体重、1 min Apgar评分等,采集新生儿出生时和出生后7个月静脉血,检测HBsAg、抗HBs、HBV DNA。
1.2 检测指标及方法 采集所有新生儿出生时和出生后7个月的血清样本并存储在- 80℃冰箱中。血清HBsAg、抗HBs、HBeAg由化学发光微粒子免疫分析法检测(Architect i2000分析仪;购自美国雅培诊断公司)。HBsAg的检测范围为0.05~250 IU/ml,抗HBs检测范围为0~1000 mIU/ml,HBeAg的检测限为1 S/CO。采用COBASAmpliPrep/COBAS TaqMan全自动实时荧光定量PCR检测试剂(检测下限为20 IU/ml) 检测血清HBV DNA定量(购自美国罗氏公司)。
1.3 观察指标 主要评价指标:HBV母婴传播失败率(定义为出生后7个月静脉血HBsAg阳性和/或HBV DNA阳性)。次要评价指标:新生儿7个月时抗HBs水平和抗HBs≥10 mIU/ml百分率。安全性指标:记录所有与注射HBIG和乙型肝炎疫苗相关的不良反应,如发热、皮疹、过敏反应、注射部位的红肿等。
1.4 统计学方法 应用统计软件SPSS13.0进行统计分析。计量资料以均数±标准差表示。正态分布资料的两组间数据的比较采用t检验完成,计数资料用率表示,组间差异采用卡方检验,母婴阻断失败的危险因素采用Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 基线特征及母婴阻断效果 本研究共入组280例新生儿,后期随访过程中失访14例(实验组6,对照组8例),最终完成随访266例(实验组134例,对照组132例)。实验组母亲妊娠28周和分娩前HBV DNA载量分别为7.52±0.60 log10IU/ml和7.31±0.66 log10IU/ml, 与对照组(分别为7.48±0.61 log10IU/ml和7.32±0.74 log10IU/ml)差异无统计学意义;两组母亲的年龄、产次、分娩方式和既往新生儿感染发生率相似,见表1。实验组新生儿出生时静脉血HBsAg阳性率和HBV DNA阳性率分别为36.57%和34.33%,与对照组(43.94%和38.64%)差异无统计学意义,两组新生儿性别,出生体重,1 min Apgar评分均差异无统计学意义,见表1。出生后7个月共18例(6.77%)新生儿发生HBV母婴传播,实验组8例(5.97%),对照组10例(7.58%),差异无统计学意义(P=0.63),见图1;实验组抗HBs阳性率和抗HBs水平分别为94.03%和(623.60±412.93 mIU/ml),与对照组91.67%和(620.38±399.10 mIU/ml)差异无统计学意义,见表1。
2.2 母婴阻断危险因素 阻断失败新生儿组母亲分娩前HBV DNA含量为7.58±0.62 log10IU/ml,与阻断成功组母亲分娩前HBV DNA含量(7.29±0.70 log10IU/ml)差异无统计学意义(P=0.09),阻断失败组和成功组母亲的年龄、产次、分娩方式和既往新生儿感染发生率相似,见表2。阻断失败组新生儿出生时静脉血HBsAg阳性百分率和HBV DNA阳性百分率均为100%,显著高于阻断成功组(HBsAg阳性和HBV DNA阳性率分别为35.89%和31.85%)(P<0.001),见表2。以新生儿出生时HBsAg和HBV DNA状态进行分组分析,HBsAg阳性新生儿的HBV母婴传播阻断失败率为16.82%(18/107),HBV DNA阳性新生儿阻断失败率为18.56%(18/97),而HBsAg阴性或HBV DNA阴性新生儿无一例阻断失败,见表3。
单因素分析显示,乙肝病毒母婴传播与出生时新生儿血清中的HBsAg阳性和HBV DNA阳性相关(P<0.001,P<0.001),见表2,而逻辑回归分析显示,静脉血中 HBsAg阳性为乙肝病毒母婴阻断失败的独立相关因素(OR1.39 95%CI1.14~1.68)。以新生儿出生时静脉血HBsAg水平分层分析显示,HBsAg在0.05-<1、1- <10和≥10 IU/ml水平上阻断失败的风险率分别为11.18(95%CI1.23~101.88)和352.00(95%CI15.82~7833.20) 和 968.00(95%CI81.35~11519.19),见表4。

表1 实验组和对照组基线资料均衡性比较及母婴阻断效果
注:HBV: 乙型肝炎病毒; HBsAg: 乙肝表面抗原;Anti-HBs:乙肝表面抗体
Notes:HBV: hepatitis B virus;HBsAg: hepatitis B surface antigen;Anti-HBs: antibody to hepatitis B surface antigen

表2 两种不同母婴阻断结局新生儿的基线资料均衡性比较
2.3 安全性 所有婴儿并未发现与乙肝免疫球蛋白或疫苗注射相关的发烧、皮疹或过敏反应。18个婴儿在注射部位出现红肿(实验组10例,对照组8例),并全部在2~3 d后消失。

表3 新生儿出生时HBsAg和HBV DNA状态与母婴传播的相关性

表4 新生儿出生时不同HBsAg水平母婴传播风险的Logistic回归分析
注:OR:优势比;CI:可置信区间
Notes:OR: Odd Ratio;CI:confidence interval
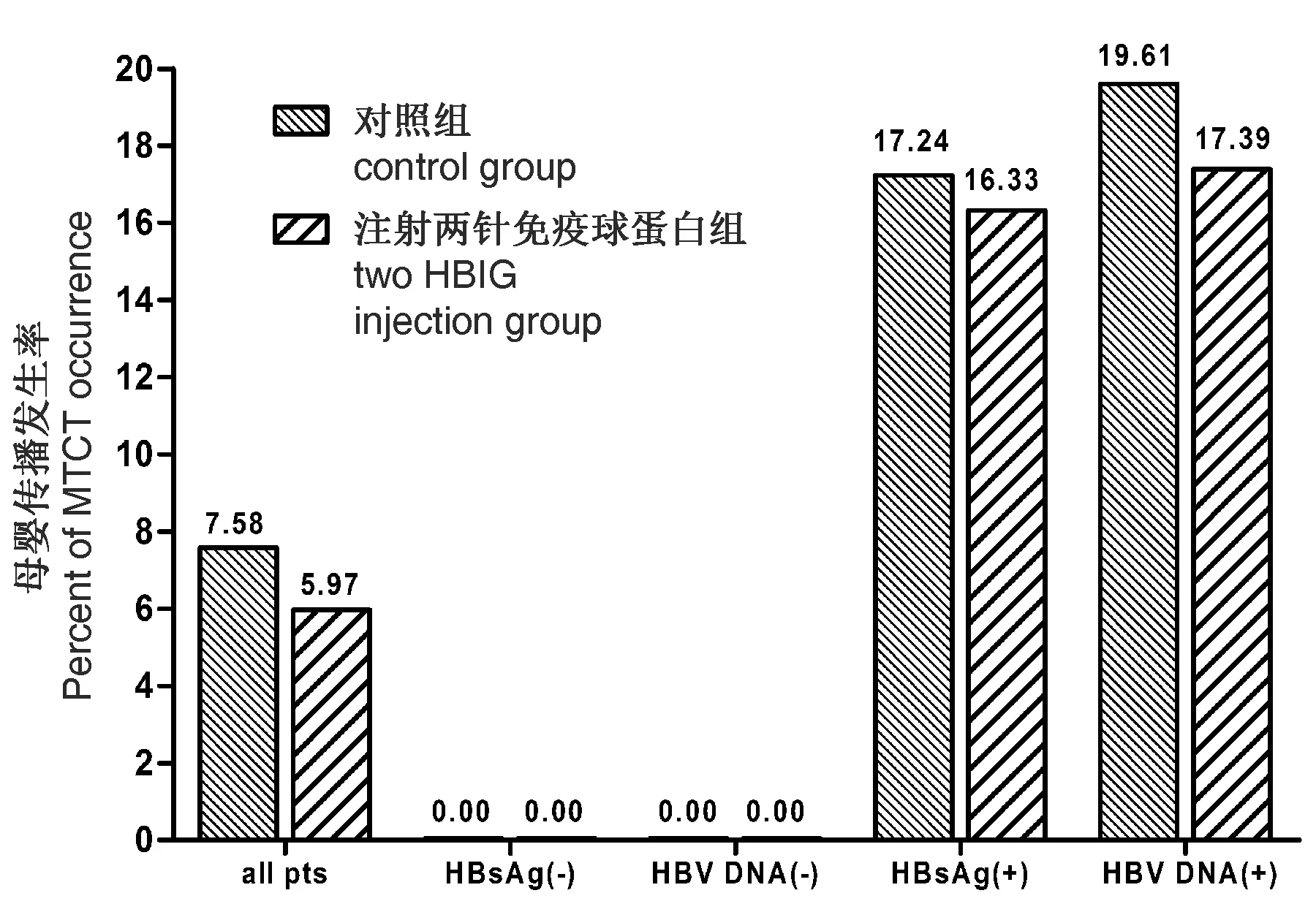
注:实验组和对照组差异无统计学意义MTCT: 母婴传播图1 根据新生儿出生时HBsAg 和HBV DNA状态,分析产后7个月母婴传播的情况 Note:There were no significant differences between control group and HBIG group MTCT: mother-to-child transmissionFig.1 Percentage of infants with HBV MTCT at 7 months after birth, by HBsAg and HBV DNA status
3 讨论
乙肝病毒母婴传播可以发生于子宫内、产时或产后[17],以产时感染为主[18]。母亲HBV DNA载量是母婴传播的独立危险因素[5, 19]。在HBsAg 和HBeAg阳性的母亲所分娩的新生儿脐带血或外周血中HBV DNA阳性的比例高达40%~66%[19, 20]。研究显示新生儿脐带血中的HBsAg水平和/或HBV DNA载量与母婴传播相关[19, 21, 22]。脐带血中HBsAg水平可以作为乙肝病毒母婴传播失败的预测指标[19, 23]。
在核苷类似物药物应用于抗乙肝病毒治疗前,肝移植患者为了预防再次感染HBV,在移植后应及时注射高剂量的HBIG以中和血液中的病毒[24-26]。与单纯接种乙肝疫苗相比较,出生后及时注射HBIG可显著提高HBV母婴传播阻断效果[27],对HBsAg阳性孕妇所分娩的新生儿进行标准的免疫预防,免疫球蛋白可以中和乙肝病毒颗粒并阻止其进入肝细胞,进而阻断HBV母婴传播,并可能通过清除新生儿血液中的HBsAg,减少血液中 HBsAg 所介导的树突样细胞功能的影响[28],进而提高新生儿免疫系统对乙肝疫苗的反应。然而,常规剂量的免疫球蛋白不足以中和胎儿在分娩过程中所暴露的所有病毒颗粒[16]。
本研究结果显示,高病毒载量母亲所生新生儿出生时静脉血HBsAg和HBV DNA阴性者无1例发生母婴传播阻断失败,而静脉血HBsAg阳性和HBV DNA阳性新生儿分别有16.82%和18.56%阻断失败率,且出生时静脉血HBsAg阳性是独立因素,并随HBsAg水平升高,母婴传播阻断失败率升高,进一步表明出生时静脉血HBsAg水平是预测HBV母婴传播发生的重要因素。
本研究的目的是希望在出生后1个月增加一次HBIG 200 IU 能提高HBV母婴传播阻断成功率,但研究结果表明,虽然增加HBIG注射新生儿的HBV阻断失败率低于标准免疫接种组,但差异未达到显著性意义。其原因可能为对一些高HBsAg水平新生儿,增加一次HBIG 200 IU注射仍不足以完全中和静脉中的病毒颗粒,也可能为增加HBIG注射的时间太晚,分娩时进入新生儿体内的病毒颗粒在增加HBIG注射前已进入新生儿肝细胞,当然,样本样不够大可能也是原因之一。如何进一步提高静脉血HBsAg阳性新生儿的HBV母婴传播阻断成功率,尚需进一步研究。
[1] Chen CJ, Wang LY, Yu MW. Epidemiology of hepatitis B virus infection in the Asia-Pacific region[J]. J Gastroenterol Hepatol, 2000, 15 Suppl: E3-E6. doi: 10.1046/j.1440-1746.2000.02124.x.
[2] Yao JL. Perinatal transmission of hepatitis B virus infection and vaccination in China[J]. Gut, 1996, 38 Suppl 2(supplement 2): S37-S38. doi: 10.1136/gut.38.Suppl_2.S37.
[3] Chang MH. Chronic hepatitis virus infection in children[J]. J Gastroenterol Hepatol, 1998, 13(5): 541-548. doi: 10.1111/j.1440-1746.1998.tb00685.x.
[4] Stevens CE, Beasley RP, Tsui J, et al. Vertical transmission of hepatitis B antigen in Taiwan[J]. N Engl J Med, 1975, 292(15): 771-774. doi: 10.1056/NEJM197504102921503.
[5] Wiseman E, Fraser MA, Holden S, et al. Perinatal transmission of hepatitis B virus: an Australian experience[J]. Med J Aust, 2009, 190(9): 489-492.
[6] Xu DZ, Yan YP, Choi BC, et al. Risk factors and mechanism of transplacental transmission of hepatitis B virus: a case-control study[J]. J Med Virol, 2002, 67(1): 20-26.
[7] Song YM, Sung J, Yang S, et al. Factors associated with immunoprophylaxis failure against vertical transmission of hepatitis B virus[J]. Eur J Pediatr, 2007, 166(8): 813-818. doi: 10.1007/s00431-006-0327-5.
[8] Singh AE, Plitt SS, Osiowy C, et al. O55 Factors associated with vaccine failure and vertical transmission of hepatitis B among a cohort of Canadian mothers and infants[J]. J Viral Hepatitis, 2011, 18(7): 468-473. doi: 10.1111/j.1365-2893.2010.01333.x.
[9] Burk RD, Hwang LY, Ho GY, et al. Outcome of perinatal hepatitis B virus exposure is dependent on maternal virus load[J]. J Infect Dis, 1994, 170(6): 1418-1423. doi: 10.1093/infdis/170.6.1418.
[10] Pan CQ, Duan ZP, Bhamidimarri KR, et al. An algorithm for risk assessment and intervention of mother to child transmission of hepatitis B virus[J]. Clin Gastroenterol Hepatol, 2012, 10(5): 452-459. doi: 10.1016/j.cgh.2011.10.041.
[11] Hepatitis B vaccines: WHO position paper—recommendations[J]. Vaccine, 2010, 28(3): 589-590. doi: 10.1016/j.vaccine.2009.10.110.
[12] Chen DS. Hepatitis B vaccination: The key towards elimination and eradication of hepatitis B[J]. J Hepatol, 2009, 50(4): 805-816. doi: 10.1016/j.jhep.2009.01.002.
[13] Ni YH, Chen DS. Hepatitis B vaccination in children: the Taiwan experience[J]. Pathol Biol (Paris), 2010, 58(4): 296-300. doi: 10.1016/j.patbio.2009.11.002.
[14] 慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志, 2011, 19(1): 13-24. doi: 10.3760/cma.j.issn.1007-3418.2011.01.007.
[15] Beasley RP, Hwang LY, Lin CC, et al. Hepatitis B immune globulin (HBIG) efficacy in the interruption of perinatal transmission of hepatitis B virus carrier state[J]. Initial report of a randomised double-blind placebo-controlled trial,1981, 2(8243): 388-393. doi: http://dx.doi.org/10.1016/S0140-6736(81)90832-1.
[16] Chotiyaputta W, Lok AS. Role of antiviral therapy in the prevention of perinatal transmission of hepatitis B virus infection[J]. J Viral Hepat, 2009, 16(2): 91-93. doi: 10.1111/j.1365-2893.2008.01067.x.
[17] Ma L, Alla NR, Li X, et al. Mother-to-child transmission of HBV: review of current clinical management and prevention strategies[J]. Rev Med Virol, 2014, 24(6): 396-406. doi: 10.1002/rmv.1801.
[18] Yuan J, Lin J, Xu A, et al. Antepartum immunoprophylaxis of three doses of hepatitis B immunoglobulin is not effective: a single-centre randomized study[J]. J Viral Hepat, 2006, 13(9): 597-604. doi: 10.1111/j.1365-2893.2006.00738.x.
[19] Zou H, Chen Y, Duan Z, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers[J]. J Viral Hepatitis, 2012, 19(2): 18-25. doi: 10.1111/j.1365-2893.2011.01492.x.
[20] Pande C, Kumar A, Patra S, et al. 252 High maternal hepatitis B virus DNA levels but not HBeAg positivity predicts perinatal transmission of Hepatitis B to the newborn[J]. Gastroenterology, 2008, 134(4 suppl 1): 760.
[21] Bai H, Zhang L, Ma L, et al. Relationship of hepatitis B virus infection of placental barrier and hepatitis B virus intra-uterine transmission mechanism[J]. World J Gastroenterology, 2007, 13(26): 3625-3630. doi:10.3748/wjg.v13.i26.3625.
[22] Best JM. Laboratory diagnosis of intrauterine and perinatal virus infections[J]. Clin Diagn Virol, 1996, 5(2-3): 121-129. doi.org/10.1016/0928-0197(96)00213-9.
[23] 易为,李明慧,胡玉红,等.新生儿不同时期静脉血HBsAg含量对HBV婴传播阻断失败的预测研究[J].中华实验和临床病毒学杂志,2011,25(5):338-341.doi:10.3760/cma.j.issn.1003_9279.2011.05.007.
[24] Rosenau J, Kreutz T, Kujawa M, et al. HBsAg level at time of liver transplantation determines HBsAg decrease and anti-HBs increase and affects HBV DNA decrease during early immunoglobulin administration[J]. J Hepatology, 2007, 46(4): 635. doi: 10.1016/j.jhep.2006.11.022.
[25] Lindenger C, Castedal M, Cahlin C, et al. Excellent liver transplantation survival and prevention of hepatitis B recurrence using hepatitis B immunoglobulin and nucleoside or nucleotide analogue along with treating physician adherence to treatment protocol[J]. Transplant Proc, 2013, 45(3): 1188-1192. doi: 10.1016/j.transproceed.2012.10.007.
[26] Yuan CH, Xiu DR, Jiang B, et al. HBV recurrence lowered by lamivudine/HBIG combination therapy in liver transplant patients: ten-year experience[J]. Hepatobiliary Pancreat Dis Int, 2013, 12(2): 149-153. doi: 10.1016/S1499-3872(13)60024-7.
[27] Zhang L, Gui XE, Teter C, et al. Effects of hepatitis B immunization on prevention of mother-to-infant transmission of hepatitis B virus and on the immune response of infants towards hepatitis B vaccine[J]. Vaccine, 2014, 32(46): 6091-6097. doi: 10.1016/j.vaccine.2014.08.078.
[28] Shi B, Ren G, Hu Y, et al. HBsAg inhibits IFN-alpha production in plasmacytoid dendritic cells through TNF-alpha and IL-10 induction in monocytes[J]. PLoS One, 2012, 7(9): e44900. doi: 10.1371/journal.pone.0044900.
(本文编辑:陈培莉)
Efficacy of two injections of hepatitis B immunoglobulin in infants to interrupt mother-to-children transmission of hepatitis B virus
ZhangYing,YiWei,LiMinghui,ZhangDan,ZhangLuxue,HuYuhong,LiuMin,LiuShunai,HuaWenhao,SongShujing,WanGan,XieYao
PekingUniversityDitanTeachingHospital,Beijing100015,China(ZhangY,XieY);DepartmentofObstetricsandGynecology,BeijingDitanHospital,CapitalMedicalUniversity,Beijing100015,China(YiW,HuYH,LiuM);LiverDiseasesCenter,BeijingDitanHospital,CapitalMedicalUniversity,Beijing100015,China(LiMH,ZhangD,ZhangLX,LiuSA,HuaWH,SongSJ,WanG)
XieYaoEmail:xieyao00120184@sina.com
Objective To investigate the efficacy of 200IU hepatitis B immunoglobulin (HBIG) injection at 1 month after birth to interrupt the mother-to-children transmission (MTCT) of hepatitis B virus (HBV). Methods Infants born to mothers who were hepatitis B surface antigen (HBsAg) and hepatitis B e antigen (HBeAg) positive, with HBV DNA load ≥1.0×106IU/ml and who did not receive antiviral drug treatment during pregnancy, were randomly divided into 2 groups. Infants in the control group were treated with standard immunoprophylaxis: 200 IU HBIG and 10 μg recombinant hepatitis B vaccine injection within 2 h after birth and a vaccine booster at 1 and 6 months after birth. For infants in the HBIG group the standard immunoprophylaxis and an additional 200 IU HBIG were administered at 1 month. HBsAg, the antibody to HBsAg (anti-HBs), and HBV DNA load were measured at birth and after 7 months. later.Immunoprophylaxis failure was defined as the presence of HBV DNA and HBsAg positivity or the presence of HBV DNA and HBsAg negativity at 7 months.Results In this prospective cohort study, of the 280 infants enrolled, 14 infants (HBIG/control: 6/8) were lost to follow-up and 266 subjects (HBIG/control: 134/132) completed the 7-month study. The log10HBV DNA load of mothers in the HBIG group and control group were (7.31±0.66) log10IU/ml and (7.32±0.74) log10IU/ml, respectively (P=0.92). The MTCT rate of the two groups was similar (5.97% vs. 7.58%,P=0.63). At 7 months, the HBsAg positive rate and the level of anti-HBs in the two groups were 94.03%(126/134)vs. 91.67% (121/132) and 623.60±412.93 mIU/mL vs. 620.38±399.10 mIU/ml, respectively with no significant difference (P=0.48 andP=0.95, respectively). The log10HBV DNA load of mothers in immunoprophylaxis failure group and success group was similar (P=0.09). The number of infants who were serum HBsAg positive and HBV DNA positive at birth in the immunoprophylaxis failure group were higher than those in the success group (100% and 100% vs. 35.89% and 31.85%,P<0.01, respectively). The serum HBsAg levels in infants at birth was the only independent relevant factor for HBV MTCT, with risk rates of 11.18 (95% Confidence interval (CI), 1.23-101.88), 352.00 (95%CI, 15.82-7833.20), and 968.00 (95%CI81.35-11519.19) for HBsAg levels of 0.05-< 1, 1-< 10, and ≥ 10 IU/ml, respectively, compared to infants with HBsAg levels < 0.05 IU/ml. Conclusions Administering 200IU HBIG injection at 1 month did not reduce the risk of HBV MTCT.
Hepatitis B immunoglobulin; HBV; Hepatitis B vaccine; Mother-to-child transmission
谢尧, Email:xieyao00120184@sina.com
10.3760/cma.j.issn.1003-9279.2017.02.013
北京市卫生系统高层次卫生人才项目(2015-3-106);北京市科技计划课题“首都医学特色”项目(Z151100004015122);北京市科学技术委员会重大项目(D121100003912001)
乙肝免疫球蛋白;肝炎病毒;乙型;乙肝疫苗;母婴传播
2017-01-19)
