物种多样性及生物量与地下水位的关系
——以海流兔河流域为例
2017-05-15徐贵青唐立松牛子儒
朱 丽,徐贵青,李 彦,唐立松,牛子儒
1 中国科学院新疆生态与地理研究所,荒漠与绿洲生态国家重点实验室,乌鲁木齐 830011 2 中国科学院大学,北京 100049 3 中国科学院阜康荒漠生态系统研究站,阜康 831505
物种多样性及生物量与地下水位的关系
——以海流兔河流域为例
朱 丽1,2,3,徐贵青1,3,*,李 彦1,3,唐立松1,3,牛子儒1,2,3
1 中国科学院新疆生态与地理研究所,荒漠与绿洲生态国家重点实验室,乌鲁木齐 830011 2 中国科学院大学,北京 100049 3 中国科学院阜康荒漠生态系统研究站,阜康 831505
以3条样带上117块植被群落调查样方为基础资料,研究了海流兔河流域植被物种多样性及生物量与地下水位之间的关系。结果表明:1)地下水位高低及地貌类型均会影响草本层植物群落组成及优势种构成。滩地样地中,随地下水位降低,优势草本的更替方向为寸草,芨芨草,马蔺,狗尾草,碱茅;沙坡样地中,优势草本的更替方向为大针茅,沙鞭,沙蓬,沙打旺。2)地下水位为1.5 m时是草本植物群落生长发育最适宜区域,物种多样性及丰富度达到最大,而灌木层物种多样性及丰富度随地下水位下降呈现波动变化的特征;当地下水位埋深小于5.0 m时,草本层物种多样性及丰富度明显高于灌木层,在地下水位埋深大于5.0 m时,草本层物种多样性指数开始出现低于灌木层的现象。3)草本植物多样性及丰富度和生物量之间关联性不强,滩地样地中,草本层地上生物量及地下生物量在地下水位为1.8 m时具有最大值,但植物群落结构较为单一;沙坡样地中,地上生物量最大值出现在地下水位为5.0 m的区域内,而地下生物量最大值出现在地下水位为3.5 m时。综上,物种多样性、地上及地下生物量与地下水位都不是简单的线性关系,而是有一个最适水位;高于或低于这个最适水位,多样性和生物量都会下降。
地下水位;海流兔河流域;物种多样性;生物量
生物多样性与生态系统功能的关系是生态学研究的重点内容[1- 5]。物种多样性作为群落生态学和生物多样性研究的核心问题之一,是维持区域生态系统功能稳定的基础[5- 8]。物种多样性的变化可以直接或间接反映出群落或生境中物种丰富度、均匀度的变化,以及不同自然地理条件与群落的相互关系[9],因此物种多样性在生态系统功能中占有重要地位。物种多样性变化的研究在国内外较为普遍,主要集中在物种多样性随海拔梯度的变化[10- 13]以及水分因子对物种多样性的影响[14- 16]方面。但相关的荒漠植物物种多样性的研究较为少见,尤其对极端干旱地区物种多样性变化与环境因子的研究极为有限。
干旱半干旱区特殊的环境条件导致其生态系统脆弱,成为植物多样性受威胁最严重的地区[8,17-18]。该类地区自然降雨稀少,植被生长经常需要地下水,地下水补给成为植物用水的关键部分[15,19],因而地下水位高低很大程度上影响了植被群落类型和物种多样性[20]。研究该类地区植被物种多样性与地下水的相互依存关系,对于生态环境环境保护具有重要意义[21]。近年来由于人口增加、过度放牧、滥垦土地,加之矿产资源大规模开发利用,致使海流兔河流域地下水位降低,牧区荒漠化加剧,植被物种多样性遭受了严重破坏[22-23]。本文采用野外调查的方法,通过研究地下水位与植被群落物种组成、物种多样性以及植被地上、地下生物量的关系,探讨地下水开发对研究区植被结构、物种多样性及生物量的影响,进而为土地沙化的治理及恢复提供基础数据。
1 研究区概况与研究方法
1.1 研究区概况
海流兔河流域位于内蒙古自治区和陕西省交界处,北起乌审旗的巴彦柴达木乡、南至韩家峁、西起乌审旗的查汗敖包、东至榆林大海则三队,流域面积约2602 km2,地理位置为108°56′—109°36′E,38°01′—38°42′N。该流域位于毛乌素沙漠与陕北黄土高原的过渡带,全区总的地势是北高、南低,东西高,中间低,海拔高程在982.0 m到1479.5 m之间,最高点位于乌审旗东北方向的巴彦敖包二队,高程为1479.5 m,最低点位于海流兔河汇入无定河的河口,高程982.0 m,最大相对高差500 m左右。本区以风沙滩地为主,仅在东南和西部部分地区为沙盖黄土梁岗,中部为海流兔河河谷。地貌类型根据成因和形态划分为河谷、滩地,沙丘及沙梁[21,24]。

图1 研究区位置和样地分布 Fig.1 The location of research area and the sample plot distribution
本区属温带大陆性季风气候,全年多风少雨,典型干旱、半干旱草原环境;年平均气温6.6—8.6℃,年日照2700h左右;年均降水量334.0—364.74 mm,多集中在7—9月份,为全年降水的65%—70%;年平均水面蒸发量1883.48—2186.9 mm,区内仅有一条河流即海流兔河,发源于乌审旗新庙巴嘎,河总长120.9 km,其中本区内长45.2 km。研究区包含第四系冲积、冲湖积层孔隙潜水和白垩系洛河组砂岩裂隙孔隙水两个含水层。主要植物种类有沙柳(Salixpsammophila)、小叶锦鸡儿(Caraganamicrophylia)、杨柴(Hedysarumlaeve)、油蒿(Artemisiaordosica)、乌柳(Salixcheilophila)、大针茅(Stipagrandis)、沙蓬(Agriophyllumsquarrosum)、山苦荬(Ixerisdenticulata)、猪毛菜(Salsolacollina)、沙打旺(Astragalusadsurgens)、狗尾草(Setariaviridis)等。
1.2 样地设置和地下水位调查
本文根据前期调查结合地貌类型,在流域上游沿西向和北向各设置1个样带,在流域中下游依据等高线地形图沿山脊线自西北向东南选取第3条样带。每条样带根据自然存在的不同地下水位埋深间隔一定距离选取5个样地。每个样地随机选取1—3个10 m×10 m灌木样方,在每个灌木样方内沿对角线方向选取3个1 m×1 m草本样方。由于研究区内自然生长的乔木稀少,且大部分是人工种植,因此本研究仅选取灌木及草本作为研究对象。共设置样方117块,其中灌木24块,草本93块。详细记录草本及灌木样方中所出现植物的名称、丛(株)数、冠幅、株高、分种盖度、频度等指针,同时记录样方所在地坡度、坡向及土壤类型等环境因素。样地地下水位的测定分两种情况进行,当地下水位埋深小于3 m时,利用人工土钻法测定;当埋深超过3 m时,则根据克里格空间插值的方法确定。利用GPS定位系统,测定样地中心经纬度及海拔等地理位置信息。
1.3 物种多样性分析
物种多样性的衡量一般通过对群落或生境内物种丰富度、物种均匀度的测量获得[25]。选用重要值评价植物种群在群落中的作用[26],计算公式为:重要值=相对盖度+相对密度+相对高度[27]。对样方内出现的每种植物重要值进行逐一计算。物种优势度受到相对密度、相对高度、相对频度和相对盖度等综合因素的影响[28],本文选择相对重要值对物种优势度进行衡量。调查样地的物种多样性,采用样地内各个样方的物种多样性平均值[29-30]。选用的多样性指数及计算方法如下:
Shannon-Wiener多样性指数
Simpson指数

Margalef丰富度指数
dMa=(S-1)/logN
Pielou1均匀度指数

Berger-Parker优势度指数
I=Nmax/N
式中,Pi为种i的相对重要值;Ni为种i的重要值;N为种i所在样方的各个种的重要值之和;Pi=Ni/N;S为种i所在样方的物种总数;Nmax为群落中最大种的重要值。
1.4 生物量测定
同时对地上生物量及地下生物量进行取样,地上生物量测定采用收获法,将样方内的植物齐地面刈割,除去粘附的土壤、砾石等杂质后带回实验室,在65℃恒温箱内烘干至恒重;地下生物量用土钻取样,每个小样方收获地上部分后,扫除地表杂物,每10 cm为一层采集地下根系,取样深度40 cm,样品按层装入布袋中,带回实验室。然后将其用水冲洗、分离,分离后将根系按层装入布袋中置于65℃烘箱内烘干至恒重。全部生物量均以烘干计重。
本文资料统计采用SPSS 17.0,采用LSD多重比较对地上及地下部分生物量与地下水位数据进行单因素方差分析,本文绘图均在Origin 8.5中完成。
2 结果
2.1 植物群落物种组成与地下水位
样方调查结果表明,研究样地共出现植物种类44种,其中灌木及半灌木12种,草本植物32种,分属25科41属,其中禾本科8种,菊科6种,豆科7种,藜科4种,其他科属均为1—2种。随地下水位降低,样带1从S1-1至S1-5出现的物种数依次为29、9、22、17、5;样带2从S2-1至S2-5出现的物种数依次为28、9、21、9、7;样带3从S3-1至S3-5出现的物种数依次是20、16、16、10、9。由此表明,随着地下水位的降低,植物物种数呈现逐渐减少的趋势。
以样带1为例,草本层植物名录及其重要值如表1所示。地下水位为0.5 m时的海子周边滩地上优势种主要为寸草(重要值0.89)及芨芨草(重要值0.61),其主要的伴生植物有碱茅,沙打旺及补血草。当地下水位逐渐上升到1.0 m时的沙坡地中,以大针茅(0.56)为其优势种,主要的伴生种是白茅及山苦荬,此时在局部的沙丘中,开始出现沙蓬及沙鞭等沙生植物。在地下水位为1.8 m的滩地上,芨芨草(重要值0.98)占据了优势地位,其相对优势物种是马蔺(重要值0.50)及寸草(重要值0.50)。在地下水位为2.0 m时的丘间低地上,一些适口性较差的植物例如芨芨草在此区域极少分布,逐渐以常见种大针茅(重要值0.52)及狗尾草(重要值0.48)为主,其主要伴生植物为白茅及沙打旺。当地下水位降至3.0 m时的滩地上,狗尾草(重要值0.60)仍占优势地位,且碱茅(重要值0.72)的竞争力有所增强,成为此区域的优势物种。蒲公英耐干旱且适应范围较广,基本出现在所有样地中,且在地下水位为4.0 m时其具有明显的竞争优势(重要值0.51)。随地下水位降低,草本群落物种数逐渐减少。在地下水位为6.0 m时的沙丘中,只有4种草本植物出现,而以沙生植物沙蓬(重要值1.83)为优势物种,其主要伴生种为碱茅和蒲公英。在地下水位最低点11.0 m时的沙梁上,仅有2种草本植物能生存,即沙蓬(重要值2.25)和沙打旺(重要值0.75)。
2.2 植物群落物种多样性与地下水位
由于本区不同地貌地形对植被群落物种构成具有较大影响,故本文根据取样样地地貌特征,主要分滩地(主要包括河滩,湖边及海子周边的滩地)、沙坡(主要包括沙丘及沙梁坡面)及丘间低地3种地貌类型对不同地下水位与草本群落物种多样性的关系进行研究。
草本层植物群落多样性指数随地下水位埋深的变化情况如图2所示。在地貌类型为丘间低地的6个样地中(图2),Shannon-wiener多样性指数与Margalef丰富度指数随地下水位降低呈现先增后减的趋势,Shannon-wiener多样性指数在地下水位为1.5 m时具有最大值,为(2.239±0.04);Margalef丰富度指数在地下水位为2.0 m时具有最大值,达(2.023±0.069),两者均在地下水位为8.0 m时具有最小值,分别为(0.573±0.05)及(0.242±0.002)。Pielou1均匀度指数随地下水位降低逐渐下降,而Berger-parker优势度指数则随地下水位降低逐渐上升。在5个滩地样地中(图2),Shannon-wiener指数与Margalef丰富度指数具有相同变化趋势,在地下水埋深为0—1.5 m时,Shannon-wiener指数在2.135—2.314之间变化,Margalef丰富度在2.191—2.237之间变化;而当地下水埋深为1.8—3.0 m时,Shannon-wiener指数在1.843—1.957之间变动,Margalef丰富度在1.487—1.606之间变化。均匀度指数及优势度指数随地下水位降低总体变化趋势不大,分别在0.800—0.932及0.290—0.445之间变化。在地貌类型为沙坡的样地中(图3),Shannon-wiener指数与Margalef丰富度指数随地下水位降低逐渐减小,且在地下水位为15.0 m时趋近于0,而在地下水位埋深为1.0 m时的海子周边沙坡上,两者均具有最大值,分别为(1.877±0.145)及(1.634±0.300),当地下水位大于3.5 m时,多样性指数与丰富度指数随地下水位降低急剧下降。优势度指数最大值出现在地下水位为15.0 m时的样地上,此时仅发现沙蓬能够在此生存。
2.3 不同生长型植物群落物种多样性之间的关系
本文生长型分类主要参照1975年Whittaker等的分类系统[31],本文选择灌木及草本两个主要类型作为研究对象。

表1 样带1中不同地下水位埋深草本植物群落物种组成和重要值
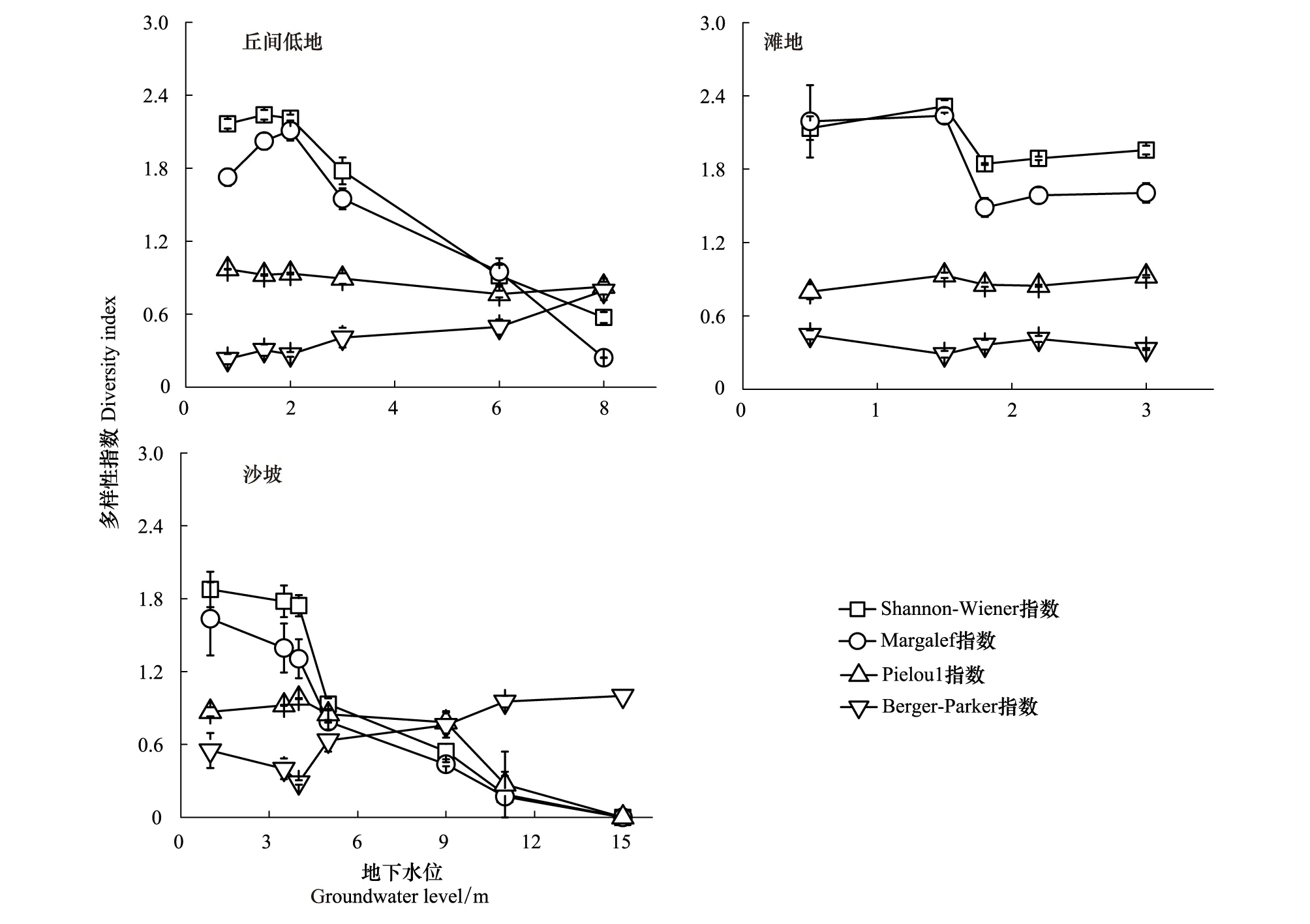
图2 不同地下水位埋深对草本植物群落物种多样性的影响Fig.2 The species diversity of the herbaceous communities under different groundwater level
图3显示了研究区15个样地灌木层及草本层植物群落物种多样性及丰富度沿不同地下水位的变化趋势。由图3可知,灌木层植物群落物种多样性及丰富度随地下水位降低呈现波动变化的趋势,草本层植物群落物种多样性及丰富度则随地下水位降低呈现逐渐减小的趋势。对于灌木层,Shannon-wiener指数在地下水位为2.0 m时达到最大值,为1.534,Margalef指数在地下水位为15.0 m时具有最大值,为1.442。图3表明,当地下水位0.5—5.0 m时,草本层植物群落物种多样性明显高于灌木层,但两者之间的差距随地下水位降低而逐渐缩小,在地下水位埋深大于5.0 m时,草本层多样性指数开始出现低于灌木层多样性指数的趋势。在地下水位为0.5 m时,草本层Shannon-Wiener指数是灌木层的4.1倍, Margalef指数是灌木层的12.2倍,而在地下水位为15.0 m时,草本层Shannon-Wiener指数及Margalef指数均降至0,而灌木层仍具有较高的值。

图3 不同生长型植物群落物种多样性与地下水位之间的关系Fig.3 The species diversity of the herb and the shrub communities under different groundwater level
2.4 生物量与地下水位
研究区主要3类地貌类型中草本层植物群落地上生物量与地下水位的方差分析结果如图4所示。在丘间低地样地中(图4),地上生物量在地下水位为1.5m时具有最大值,为(324.3±35.2) g/m2;当地下水位为0.8—2.0m时,地上生物量与地下水位之间均不存在显著性差异,而当地下水位高于3.0 m时,地上生物量明显减小;当地下水位为6.0 m时,地上生物量仅为(129.8±12.9)g/m2。在滩地样地中(图4),地上生物量在地下水位为1.8 m时最高,为(715.30±25.46) g/m2;当地下水位降至3.0 m时,地上生物量仅有(163.92±16.16) g/m2;地下水位为0.5—1.5m与地下水位为1.8 m时的地上生物量存在显著性差异(P<0.05),且地下水位低于3.0 m与地下水位高于3.0 m的地上生物量也存在显著性差异(P<0.05)。在沙坡样地中(图4),地上生物量最大值出现在地下水位为5.0 m时,为(431.01±7.97) g/m2,且调查研究表明沙蓬在此区生长较适宜,相对密度高达65.8%。地上生物量最小值出现在地下水位为15 m时,仅为(83.34±28.91) g/m2,较最大值减少了80.7%。地下水位为1—3.5 m与地下水位为5.0 m时的地上生物量具有显著性差异(P<0.05),且地下水位为1—3.5 m与地下水位9—15.0 m时地上生物量也差异显著(P<0.05)。
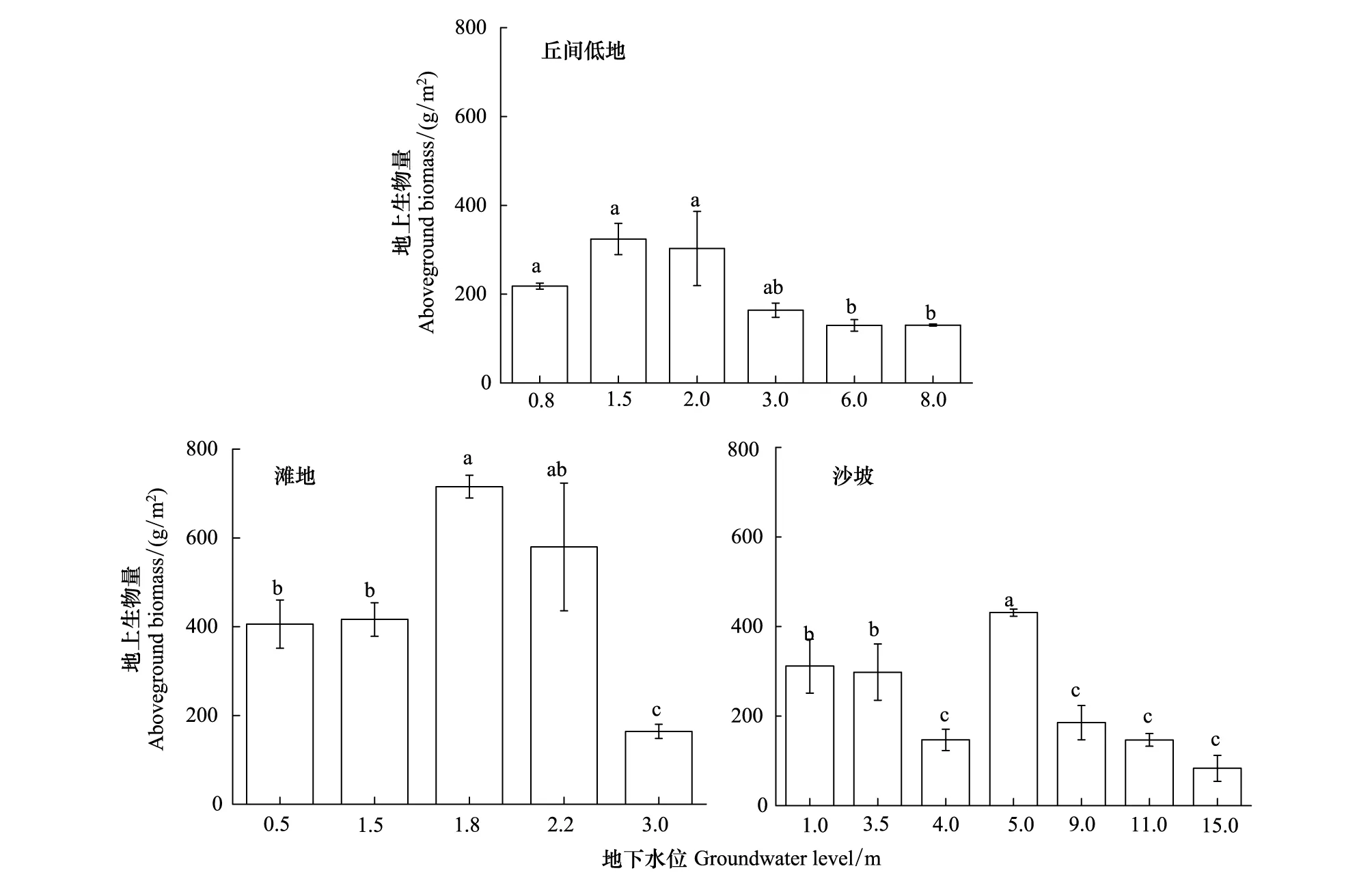
图4 不同地下水位埋深草本层的地上生物量Fig.4 The aboveground biomass of the herbaceous communities under different groundwater level
如图5显示了研究区主要3类地貌类型中草本层植物群落地下生物量与地下水位之间的关系。在丘间低地样地中(图5),当地下水位为1.5 m时,地下生物量最大,为(603.46±71.39) g/m2,较地上生物量增加46.3%;且当地下水位低于3 m时,地下生物量明显减少;当地下水位为6.0 m时,地下生物量仅为(90.1±7.5) g/m2。在滩地样地中(图5),当地下水位为1.8 m时,地下生物量最高,为(781.67±50.54) g/m2,且地下水位为1.8—2.2 m时的区域地下生物量明显高于其他区域。当地下水位为3.0 m时,地下生物量最低,为(297.37±57.76) g/m2,较最大值降低了62.0%。沙坡样地中(图5),地下生物量最大值出现在地下水位为3.5 m的沙坡上,为(381.16±61.57) g/m2;当地下水位低于5 m时,地下生物量显著减少(P<0.05),且当地下水位为15.0 m时,地下生物量仅有(34.50±11.97) g/m2。
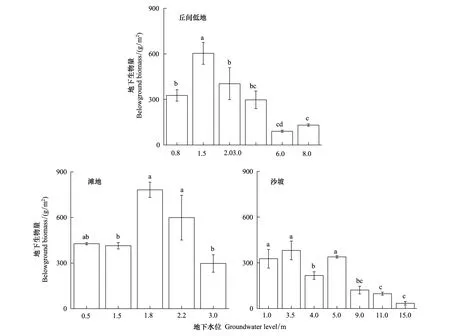
图5 不同地下水位埋深草本层的地下生物量 Fig.5 The belowground biomass of the herbaceous communities under different groundwater level
3 讨论
(1)荒漠区植物群落对地下水位的回应体现之一是优势种群随地下水位空间变化的过渡[32],而草本植物群落的外貌通常以优势种和种类组成为特征,因此优势种的更替成为群落变化的标志[33]。样带1草本植物群落组成及重要值的分析表明,地下水位埋深及地貌类型均会影响草本植物群落组成及重要值,在地下水位为0.5、1.8、3.0 m时的滩地上,主要优势种依次为寸草和芨芨草、芨芨草和马蔺、狗尾草和碱茅;在地下水位为1.0、6.0、11 m时的沙坡中,主要优势种依次为大针茅、沙蓬、沙蓬和沙打旺。由此可知,寸草、大针茅、马蔺和芨芨草等草本植物存在最适生长的地下水位,这在一定程度上反映了不同植物对水分的利用及环境的适应具有各自的策略和特征[34],而蒲公英、沙打旺等植物适应范围较广,不受水位埋深控制,基本出现在所有的样地上。
(2)草本植物群落物种多样性及丰富度的研究表明,植物群落生长主要受地下水位埋深的影响。地下水位小于1.5 m时,植物群落物种多样性及丰富度随地下水位下降而增大,并在地下水位为1.5 m时植物群落物种多样性及丰富度达到最大。地下水位大于1.5 m时,沙坡地及丘间低地植物群落物种多样性及丰富度随地下水位下降而降低,草本植物生长发育受到限制,表明植物生长对地下水位有很强的依赖性。由此可知,地下水位为1.5 m时是植被生长发育最适宜区域,有学者将此水位埋深界定为生态交错带临界水位[34],是地下水资源开发过程中的生态敏感区。以上分析显示,草本植物群落有一个最适生长的地下水位范围,而后随着地下水降低,物种多样性指数逐渐降低,植物种类逐渐减少,植物群落结构趋向简单,表明地下水埋深是研究区草本植物生长的重要影响因素,是植被生存所依赖的最为重要的水分来源,这与前人的研究结果相似[32]。
(3)植物生长型(growth form)是表征群落外貌特征的重要指针[30]。对不同生长型植物群落物种多样性之间的关系研究表明,当地下水位埋深小于5.0 m时,草本层植物群落物种多样性及丰富度明显高于灌木层,但两者之间的差距随地下水位降低而逐渐缩小,在地下水位埋深大于5.0 m时,草本层多样性指数开始出现低于灌木层多样性指数的现象。前人的相关研究成果显示当地下水位埋深大于5.0 m时,表层土壤得到毛管水的补给减少而形成干旱,一些浅根草本植物因此无法生存,而一些深根系灌木植物的根系则可以向下延伸以获得维持生存与生长的水分[35-36]。故当地下水位埋深小于5.0 m时,灌木层植物群落物种多样性及丰富度较草本层高。
(4)研究区主要3类地貌类型中草本层植物群落地上及地下部分生物量与地下水位埋深之间的关系研究表明:在丘间低地样地中,在地下水位为1.5 m时,草本层植物群落地上生物量、地下生物量均具有最大值,植物多样性及丰富度的研究结果同样显示,其最大值出现在此地下水位埋深上,由此可知,1.5 m水位埋深区域植物群落生物量最高、种群生长发育最好。在滩地样地中,当地下水位为1.8 m时,地上生物量及地下生物量同时达到最大值,而植物群落物种多样性及丰富度在该地下水位上具有最低值,主要是由于此水位埋深区域马蔺和芨芨草相对盖度及冠幅较大的植物具有明显的竞争优势,群落结构单一。而当地下水位降至3.0 m时,其生物量最低,只有一些耐干旱的植物如猪毛菜,狗尾草,蒲公英等在此分布。在沙坡样地中,草本层植物群落地上生物量最大值出现在地下水位为5.0 m的沙坡上,而地下生物量最大值出现在地下水位为3.5 m的沙坡上,且当地下水位低于9.0 m时,地下水位对地上生物量及地下生物量的影响均不显著,表明当地下水位低于9.0 m时,沙坡草本层生物量与地下水位不存在明显的依赖关系。以上分析显示,植物多样性及丰富度和生物量之间没有明显的关联性,地下水埋深与植物的关系方面并不是简单的统计线性关系,而是植被、土壤、地下水综合作用的复杂系统[32]。
4 结论
(1)地下水位高低及地貌类型均会影响草本层植物群落组成及重要值。滩地样地中,随地下水位降低,优势草本的更替方向为寸草,芨芨草,马蔺,狗尾草,碱茅。而在沙坡样地中,优势草本随地下水位降低的更替方向为大针茅,沙鞭,沙蓬,沙打旺。
(2)草本植物生长对地下水位有很强的依赖性,地下水位为1.5 m时是草本植物群落生长发育最适宜区域,物种多样性及丰富度达到最大,而后随地下水位降低,草本植物生长发育受到限制。
(3)草本层植物群落生长有一个最适地下水位范围,而灌木层植物群落物种多样性及丰富度随地下水位下降呈现波动变化的特征,且当地下水位埋深高于5.0 m时,草本层植物群落物种多样性及丰富度明显高于灌木层,在地下水位埋深低于5.0 m时,草本层多样性指数开始出现低于灌木层多样性指数的现象。
(4)草本植物多样性及丰富度和生物量之间没有明显的关联性,丘间低地样地中,当地下水位为1.5 m时,群落生物量最高、种群生长发育最好;滩地样地中,当地下水位为1.8 m时,草本层植物群落地上生物量及地下生物量具有最大值,植物群落结构则较为单一;沙坡样地中,当地下水位为5.0 m时, 地上生物量及地下生物量最大值分别出现在不同的地下水位范围,且当地下水位低于9.0 m时,生物量与地下水位不存在明显的依赖关系。
[1] 王勇军, 黄从德, 张健, 杨万勤, 王宪帅. 岷江干旱河谷灌丛物种多样性、生物量及其关系. 干旱区研究, 2010, 27(4): 567- 572.
[2] 张全国, 张大勇. 生物多样性与生态系统功能: 进展与争论. 生物多样性, 2002, 10(1): 49- 60.
[3] 江小雷, 张卫国, 严林, 王刚. 植物群落物种多样性对生态系统生产力的影响. 草业学报, 2004, 13(6): 8- 13.
[4] 张全国, 张大勇. 生物多样性与生态系统功能: 最新的进展与动向. 生物多样性, 2003, 11(5): 351- 363.
[5] Maestre F T, Quero J L, Gotelli N J, Escudero A, Ochoa V, Delgado-Baquerizo M, García-Gómez M, Bowker M A, Soliveres S, Escolar C, García-Palacios P, Berdugo M, Valencia E, Gozalo B, Gallardo A, Aguilera L, Arredondo T, Blones J, Boeken B, Bran D, Conceição A A, Cabrera O, Chaieb M, Derak M, Eldridge D J, Espinosa C I, Florentino A, Gaitán J, Gatica M G, Ghiloufi W, Gómez-González S, Gutiérrez J R, Hernández R M, Huang X W, Huber-Sannwald E, Jankju M, Miriti M, Monerris J, Mau R L, Morici E, Naseri K, Ospina A, Polo V, Prina A, Pucheta E, Ramírez-Collantes D A, Romão R, Tighe M, Torres-Díaz C, Val J, Veiga J P, Wang D L, Zaady E. Plant species richness and ecosystem multifunctionality in global drylands. Science, 2012, 335(6065): 214- 218.
[6] Thibaut L M, Connolly S R. Understanding diversity-stability relationships: towards a unified model of portfolio effects. Ecology Letters, 2013, 16(2): 140- 150.
[7] Guo Q F, Berry W L. Species richness and biomass: dissection of the hump-shaped relationships. Ecology, 1998, 79(7): 2555- 2559.
[8] 张雪妮, 吕光辉, 杨晓东, 贡璐, 秦璐, 何学敏, 刘昊奇. 基于盐分梯度的荒漠植物多样性与群落、种间联接回应. 生态学报, 2013, 33(18): 5714- 5722.
[9] 孙儒泳, 李博, 诸葛阳. 普通生态学. 北京: 高等教育出版社, 1993: 136- 136.
[10] 郭正刚, 程国栋, 王根绪. 青藏高原北部高海拔地区嵩草草甸植物多样性分析. 冰川冻土, 2004, 26(1): 95- 100.
[11] Itow S. Species turnover and diversity patterns along an evergreen broad-leaved forest coenocline. Journal of Vegetation Science, 1991, 2(4): 477- 584.
[12] Baruch Z. Ordination and classification of vegetation along an altitudinal gradient in the Venezuelan páramos. Vegetatio, 1984, 55(2): 115- 126.
[13] 贺金生, 陈伟烈. 陆地植物群落物种多样性的梯度变化特征. 生态学报, 1997, 17(1): 91- 99.
[14] 张雪妮, 吕光辉, 王庭权, 马玉, 阿布里孜 阿不都热合曼, 赵晓英, 郭振洁, 朱修逸. 荒漠区垂直河岸带植物多样性格局及其成因. 生态学报, 2015, 35(18): 5966- 5974.
[15] 曾晓玲, 刘彤, 张卫宾, 孙钦明, 沈雪莹, 司朗明. 古尔班通古特沙漠西部地下水位和水质变化对植被的影响. 生态学报, 2012, 32(5): 1490- 1501.
[16] Wilson J B, Lee W G, Mark A F. Species diversity in relation to ultramafic substrate and to altitude in southwestern New Zealand. Vegetatio, 1990, 86(1): 15- 20.
[17] 马淼, 李博, 陈家宽. 植物对荒漠生境的趋同适应. 生态学报, 2006, 26(11): 3861- 3869.
[18] 尹林克. 中国温带荒漠区的植物多样性及其易地保护. 生物多样性, 1997, 5(1): 40- 58.
[19] Rodriguez-Iturbe I. Ecohydrology: a hydrologic perspective of climate-soil-vegetation dynamics. Water Resources Research, 2000, 36(1): 3- 9.
[20] 张琳, 杨劼, 呼格吉勒图, 宋炳煜, 丁越岿. 水位梯度对毛乌素沙地柳湾林群落特征影响. 中国沙漠, 2012, 32(5): 1296- 1300.
[21] 金晓媚, 张强, 杨春杰. 海流兔河流域植被分布与地形地貌及地下水位关系研究. 地学前缘, 2013, 20(3): 227- 233.
[22] 张二勇. 鄂尔多斯盆地内蒙古能源基地地下水开发与植被演化风险评价研究[D]. 北京: 中国地质大学, 2010.
[23] 陈仲新, 谢海生. 毛乌素沙地景观生态类型与灌丛生物多样性初步研究. 生态学报, 1994, 14(4): 345- 354.
[24] 张强. 海流兔流域生态植被变化与环境影响因素研究[D]. 北京: 中国地质大学, 2011.
[25] 史惠兰, 王启基, 景增春, 王长庭, 王杰, 王柳英. 江河源区人工草地群落特征、多样性及其稳定性分析. 草业学报, 2005, 14(3): 23- 30.
[26] 叶卫英, 尹林克, 钱翌, 严成. 乌鲁木齐市周边荒山植物群落类型及其物种多样性. 新疆农业大学学报, 2005, 28(1): 44- 58.
[27] 董鸣. 陆地生物群落调查观测与分析. 北京: 中国标准出版社, 1997: 3- 23.
[28] 徐志伟. 不同放牧强度高寒草甸种群优势度的动态变化. 青海大学学报: 自然科学版, 2003, 21(6): 4- 6.
[29] 于丹丹, 唐立松, 李彦, 徐贵青. 古尔班通古特沙漠白梭梭群落林下层物种多样性的空间分异. 干旱区研究, 2010, 27(4): 559- 566.
[30] 马克平, 黄建辉, 于顺利, 陈灵芝. 北京东灵山地区植物群落多样性的研究Ⅱ丰富度、均匀度和物种多样性指数. 生态学报, 1995, 15(3): 268- 277.
[31] Whittaker R H, Niering W A. Vegetation of the Santa Catalina Mountains, Arizona. V. Biomass, production, and diversity along the elevation gradient. Ecology, 1975, 56(4): 771- 790.
[32] 赵文智, 刘鹄. 荒漠区植被对地下水埋深响应研究进展. 生态学报, 2006, 26(8): 2702- 2708.
[33] 范永刚, 胡玉昆, 李凯辉, 于建梅, 王鑫. 不同干扰对高寒草原群落物种多样性和生物量的影响. 干旱区研究, 2008, 25(4): 531- 536.
[34] 张俊, 赵振宏, 王冬, 马洪云, 郭莉. 鄂尔多斯高原地下水浅埋区植被与地下水埋深关系. 干旱区资源与环境, 2013, 27(4): 141- 145.
[35] 郑丹, 李卫红, 陈亚鹏, 刘加珍. 干旱区地下水与天然植被关系研究综述. 资源科学, 2005, 27(4): 160- 167.
[36] 徐海量, 宋郁东, 王强, 艾合买提. 塔里木河中下游地区不同地下水位对植被的影响. 植物生态学报, 2004, 28(3): 400- 505.
Relationships among plant species diversity, biomass, and the groundwater table in the Hailiutu River basin
ZHU Li1,2,3, XU Guiqing1,3,*, LI Yan1,3, TANG Lisong1,3, NIU Ziru1,2,3
1StateKeyLaboratoryofDesertandOasisEcology,XinjiangInstituteofEcologyandGeography,ChineseAcademyofSciences,Urumqi830011,China2UniversityofChinaAcademyofSciences,Beijing100049,China3FukangStationofDesertEcology,ChineseAcademyofSciences,Fukang831505,China
Based on the data from 117 sampling plots, the relationships between plant species diversity, biomass, and the groundwater table in the Hailiutu River basin were investigated. The main findings of this study can be summarized as follows: 1) The value and species composition of herbs in the plant community are greatly affected by the groundwater table and geomorphic type. In the flat land of river beds or lake beaches, a decrease in the groundwater table, resulted in a shift in dominant herbaceous plants fromCarexduriuscul,Achnatherumsplendens,Irislacteavar,Setairaviridis, toPuccinelliatenuiflorain sequence; however, on the slope of the sand-dune, the dominance was shown fromStipagrandis,Psammochloavillosa,AgriophyllumsquarrosumtoAstragalusadsurgensin sequence. 2) The species diversity and richness of the herbaceous plant community had a maximum value when the groundwater table was 1.5 m; therefore, the region with the depth of groundwater table at 1.5 m is the most suitable region for the herbaceous plant community growth and development. The species diversity and richness of the herb layer were significantly higher than those of the shrub layer when the groundwater depth was less than 5.0 m. However, when the groundwater table was greater than 5.0m, the species diversity of the herb layer was lower than that of the shrub layer. 3) The correlation among herbaceous plant diversity, richness, and biomass was not significant; in the flat land of river beds or lake beaches, the herb layer aboveground and underground biomass had a maximum value when the groundwater table was 1.8 m with simple plant community structure. However, on the slope of the sand dune, the aboveground biomass reached the highest value when the depth of groundwater table was 5.0 m, but the underground biomass was at a maximum when the groundwater table was 3.5 m. In conclusion, we found that there was no simple linear relationship among plant diversity, plant biomass, and groundwater table. There is an optimal ground water table level for both plant diversity and biomass: values higher or lower than this value will cause a reduction in plant diversity or biomass.
groundwater level; Hailiutu river basin; plant diversity; biomass
国家自然科学基金新疆联合基金项目(U1603105);国家自然科学基金项目(41671051);中国科学院前沿科学重点研究项目(QYZDJ-SSW-DQC014)
2015- 10- 30;
日期:2016- 08- 02
10.5846/stxb201510302194
*通讯作者Corresponding author.E-mail: xugq@ms.xjb.ac.cn
朱丽,徐贵青,李彦,唐立松,牛子儒.物种多样性及生物量与地下水位的关系——以海流兔河流域为例.生态学报,2017,37(6):1912- 1921.
Zhu L, Xu G Q, Li Y, Tang L S, Niu Z R.Relationships among plant species diversity, biomass, and the groundwater table in the Hailiutu River basin.Acta Ecologica Sinica,2017,37(6):1912- 1921.
