抗巨噬细胞移动抑制因子单抗对结肠炎小鼠结肠NF-κB、IκB表达的影响▲
2017-05-13唐光耀张启芳王柏涛唐澄海孟云超李西融张海莲
唐光耀 张启芳 王柏涛 唐澄海 孟云超 李西融 张海莲 张 晶
(1 桂林医学院研究生学院,广西桂林市 541004;广西壮族自治区南溪山医院2消化内科,3 病理科,桂林市 541002)
抗巨噬细胞移动抑制因子单抗对结肠炎小鼠结肠NF-κB、IκB表达的影响▲
唐光耀1张启芳2*王柏涛1唐澄海3孟云超2李西融3张海莲2张 晶3
(1 桂林医学院研究生学院,广西桂林市 541004;广西壮族自治区南溪山医院2消化内科,3 病理科,桂林市 541002)
目的 探讨抗巨噬细胞移动抑制因子单抗对结肠炎小鼠结肠NF-κB p65、IκBα表达的影响。方法 采用葡聚糖硫酸钠(DSS)诱导制备小鼠急性溃疡性结肠炎(UC)的模型,应用抗MIF单抗干预,观察抗MIF单抗对小鼠UC发病的干预作用。该实验分为正常对照组、UC模型组、抗MIF单抗干预组和生理盐水组。造模及药物干预期间观察小鼠一般情况并行疾病活动指数(DAI)评分,第8天断颈处死全部小鼠,行结肠大体损伤评分,HE染色光镜下观察结肠病理改变,免疫组化染色观察NF-κB p65、IκBα在结肠组织炎症细胞的表达情况。结果 与正常组相比,UC模型组中NF-κB p65的表达显著增加,而IκBα的表达稍增加,在抗MIF单抗治疗后,NF-κB p65的水平明显低于UC模型组,并且IκBα含量增高。结论 抗MIF单抗对DSS诱导的急性UC的小鼠具有保护作用,减低了小鼠结肠组织NF-κB p65的表达水平,提高IκBα的表达水平,从而达到抑制UC小鼠结肠组织NF-κB通路的过度激活的作用。
抗巨噬细胞移动抑制因子单抗;葡聚糖硫酸钠(DSS);溃疡性结肠炎(UC);核因子-κB(NF-κB);NF-κB抑制蛋白(IκB)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性自身免疫性疾病,主要累及结肠黏膜及黏膜下层,其病因及病理机制尚未清楚阐明[1]。许多动物实验和临床研究证实其发病与免疫异常密切相关[2]。近年来生物治疗解决了部分患者的病痛,但仍然存在较多的问题。因此,寻找更多的治疗途径尤其重要。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种具有多种生物功能的前炎症因子,主要抑制巨噬细胞的游走,促使活化免疫细胞和巨噬细胞分泌多种炎症因子,参与免疫与炎症疾病的进展[3]。最近研究已证实MIF在UC的发生发展中起着重要作用,但其具体分子机制尚未阐明[4]。NF-κB作为一种多向性、多功能的核转录因子,作用于靶细胞分泌多种炎症因子[5]。研究发现其在UC的发病中起重要作用,并且NF-κB在UC患者肠黏膜中表达增加[6]。因此,本实验通过DSS诱导建立急性UC模型,从而观察应用抗MIF单抗后小鼠的外部变化,并且通过检测结肠组织的NF-κB活化水平及其抑制因子的表达水平,评价抗MIF单抗是否能抑制NF-κB通路的激活从而缓解小鼠结肠炎的发展。
1 材料与方法
1.1 实验动物及分组 SPF级雄性BALB/c小鼠40只,鼠龄8~9周,体质量(24±2)g,购自湖南斯莱克景达实验动物公司(许可证号码:SCXK湘 2011-0003)。进行适应性喂养7 d后,随机分为正常对照组、UC模型组、抗MIF单抗干预组、生理盐水组,每组10只。
1.2 药品与设备 ①药品准备:抗MIF单抗,购自重庆探生科技有限公司(批号:FAB 20140001);Anti-NF-κB p65抗体购自英国abcam公司(批号:GR200963-5);Anti-IKB alpha抗体购自英国abcam公司(批号:GR111613-8);葡聚糖硫酸钠(DSS,MW 36000~50000),购自美国MP Biomedicals生物医学公司(批号:000452423);二抗HRP鼠兔通用型,购自北京中杉金桥生物技术有限公司(批号:K152318A);②设备准备:液氮罐(乐山市东亚机电工贸有限公司);冰箱(青岛海尔公司);-80℃超低温冰箱(德国Thermo公司 );电子称ACS-D11(上海三峰);制冰机FM-130(北京长河流科学仪器公司);精密天平ML4002(德国梅特勒-托利多);微量移液器1 000 μL(百得);微量移液器100 μL(赛默飞世尔科技);微量移液器10 μL(德国Eppendorf);小鼠解剖器械套件(美国哈佛仪器);电热恒温水浴箱;石蜡自动包埋脱水机;石蜡切片机;光学显微镜显微摄像系统;日本 Olympus 数码相机。
1.3 模型制备及药物干预 正常对照组自由饮水 7 d,其余三组建立溃疡性结肠炎模型采用自由饮用5% DSS溶液7 d。抗MIF单抗(4 mg/mL)与生理盐水1 ∶3体积比稀释后,抗MIF单抗干预组与生理盐水组于1 d、2 d、4 d、6 d,分别行腹腔注射抗MIF单抗和生理盐水0.2 mL·只-1·d-1。造模及给药期间,每天观察并记录各组小鼠精神状态、皮毛、活动、饮食、体重变化、粪便性状等情况,并根据Cooper的经典评分方法[7],进行疾病活动指数(disease activity index,DAI)评分。
1.4 标本收集与处理 第8天用颈椎脱臼法处死小鼠,剖腹暴露结肠,截取盲肠末端至肛门的整个肠段,沿肠系膜缘纵轴切开,预冷生理盐水冲洗干净肠内容物后,在滤纸上将肠壁展开,肉眼观察结肠标本的炎症和溃疡情况,对结肠进行大体损伤评分[8]。一部分在液氮中速冻后保存于-80℃冰箱中,另一部分在HE染色镜下观察各组小鼠结肠组织病理改变并行组织学损伤评分[9];免疫组化染色镜下观察NF-κBP65、IκBα的表达水平,一抗稀释浓度依次为1 ∶500、1 ∶600。阳性结果判断:高倍镜下选取3个不重叠视野,以胞质出现棕黄色或棕褐色颗粒为阳性细胞,计数各视野阳性细胞率(阳性细胞数/该视野细胞总数×100%)。
1.5 统计学方法 采用SPSS 18.0软件进行分析处理,计量资料以(x±s)表示,多组间均数比较采用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠一般情况 正常对照组小鼠精神较好,皮毛有光泽、顺滑,反应迅捷,体重均不同程度增加,粪便成条形、大便未见血性样;与正常对照组比较,UC模型组和生理盐水组小鼠皮毛明显凌乱、无光泽,严重者毛发干枯,反应迟滞,活动度明显减低,出现拱背、扎堆现象,体重明显下降,粪便稀样、次数增多、便血严重;抗MIF单抗干预组小鼠毛色较正常对照组略黯淡,部分稍显杂乱,但不如模型组和生理盐水组明显,精神状态良好,体重减轻幅度小,部分小鼠出现轻微便血现象。
2.2 小鼠DAI评分 观察每日小鼠的体重、大便性状和隐血情况。疾病的活动情况与DAI评分成正比。与正常对照组相比,其余三组差异有统计学意义(P<0.05),表明模型制备成功;与抗MIF单抗干预组相比,UC模型组和生理盐水组与其差异均具有统计学意义(P<0.05);而UC模型组和生理盐水组间差异无统计学意义(P>0.05)。见表1。
2.3 结肠大体损伤评分 肉眼观察正常对照组小鼠结肠未见水肿充血,未见糜烂、溃疡,肠壁血管清晰,均匀光滑;模型组和生理盐水组结肠充血水肿、肠壁僵硬、色泽晦暗,散在出现明显出血点和溃疡,伴有糜烂,与周围组织粘连;抗MIF单抗干预组小鼠结肠肠壁色泽暗淡,充血水肿,出现微小出血点,但其程度、范围、溃疡个数均不及模型组和生理盐水组显著。见表1。
2.4 HE染色组织学评分 正常对照组小鼠结肠黏膜及黏膜下层结构完整无缺损,上皮细胞排列整齐,腺体形态规则,浆膜层血管无充血现象;UC模型组结肠黏膜上皮糜烂严重,黏膜固有层大部分腺体结构破坏,肉芽组织形成,提示可能曾存在浅溃疡,黏膜固有层及黏膜下层被大量炎症细胞浸润;抗MIF单抗干预组结肠黏膜上皮无糜烂,腺体结构正常,血管内红细胞聚集,呈充血现象,黏膜固有层炎症细胞浸润,但炎症细胞数量及浸润深度不及UC模型组和生理盐水组;生理盐水组结肠黏膜上皮缺损、断裂,轻度糜烂,炎症细胞主要集中在黏膜固有层。见图1、表2。

表1 小鼠DAI评分及结肠大体损伤评分 (x±s,分)
注:*P<0.05;与UC模型组比较,#P<0.05;与抗MIF单抗干预组比较,▲P<0.05。
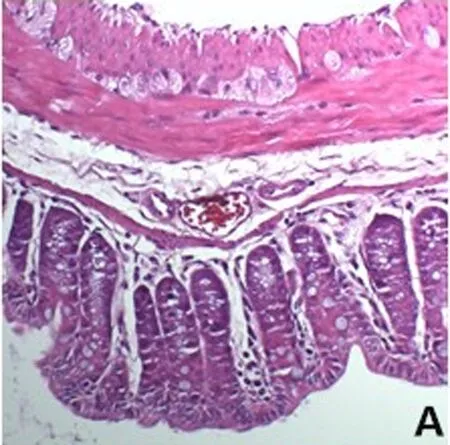
A 正常对照组
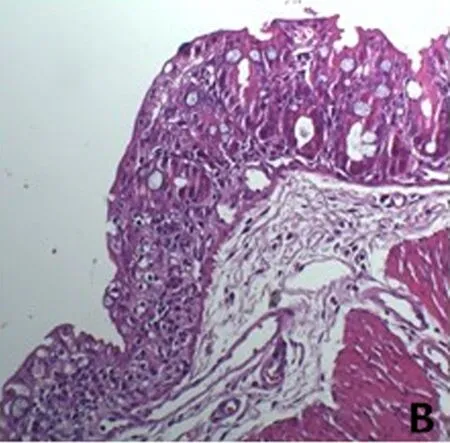
B UC模型组

C 抗MIF单抗干预组

D 生理盐水组
2.5 免疫组化SP法检测小鼠结肠组织NF-κB p65的表达 小鼠结肠NF-κB p65主要表达于黏膜上皮、单核细胞及巨噬细胞,正常对照组结肠黏膜炎症细胞少量表达在胞质内,而在UC模型组和生理盐水组中,结肠黏膜炎症细胞均呈强表达,胞核为主;抗MIF单抗干预组中结肠黏膜炎症细胞表达减少,表达在胞质内。
NF-κB 的激活途径可通过降解IκBs的方式来活化NF-κB, 活化的NF-κB随后进入细胞核内与DNA结合。由此可知,NF-κB出现核转移是其激活的一种重要指标。实验结果发现,与对照组相比,实验组中NF-κB被激活,大量的NF-κB进入核内,从而导致细胞核内NF-κB的含量增加;抗MIF单抗干预组中细胞核内NF-κB含量降低,大量NF-κB滞留在细胞质中。模型组NF-κB持续激活,大量NF-κB进入到细胞核内。单抗组解除了对IκB表达的抑制,IκB和NF-κB结合滞留在细胞质中。我们发现UC模型组中NF-κB p65的表达细胞数显著性增加(与对照组比较,差异有统计学意义,P<0.01),而给予抗MIF单抗治疗后NF-κB p65结果降低(与UC模型组比较,差异有统计学意义,P<0.01),从而缓解炎症发展。见图2、表2。


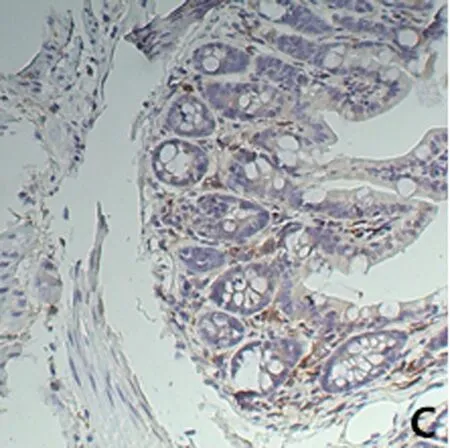

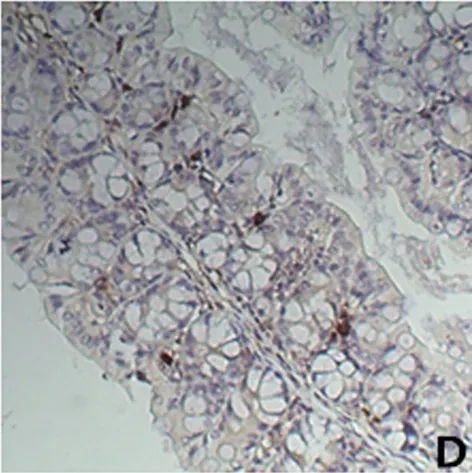
A 正常对照组 B UC模型组 C 抗MIF单抗干预组 D 生理盐水组
2.6 免疫组化SP法检测小鼠结肠组织IκBα的表达 IκBα在各组小鼠结肠上皮组织中均不表达,但在炎症细胞中表达。对照组结肠IκBα在黏膜炎症细胞的胞质中表达,并且在黏膜、黏膜下层及固有层的炎症细胞中均有表达;而在UC模型组和生理盐水组中,小鼠结肠黏膜的炎症细胞表达增加,IκBα在结肠组织中的表达稍增加(与对照组比较,差异性有统计学意义,P<0.05);抗MIF单抗组中结肠黏膜炎症细胞表达减少,IκBα在结肠组织中的表达也显著增多(与模型组比较,差异有统计学意义,P<0.05)。见图3、表2。
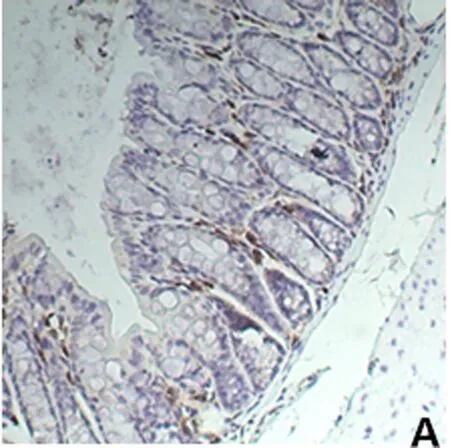


A 正常对照组 B UC模型组 C 抗MIF单抗干预组 D 生理盐水组

组别n阳性细胞率病理学评分NF⁃κBIκB正常对照组100.3±0.48#▲8.93±1.91#▲9.13±1.98#▲UC模型组1013.6±1.17∗▲58.63±2.41∗▲13.23±2.11∗▲抗MIF单抗干预组106.3±1.16∗#25.40±2.46∗#31.80±2.09∗#生理盐水组1013.9±1.52∗▲58.23±2.76∗▲13.60±1.96∗▲
注:*与正常对照组比较,P<0.05;与UC模型组比较,#P<0.05;与抗MIF单抗干预组比较,▲P<0.05。
3 讨 论
随着经济的发展,生活和饮食习惯的改变,近10年来我国UC发病率逐年升高[10]。随着抗TNF-α类新型制剂的成功运用[11],尝试使用生物制剂治疗UC减轻炎症程度已成为当前基础与临床研究领域的热点和突破点。典型的NF-κB是p50和p65构成的异源二聚体,可通过调控多种基因的表达,从而参与免疫反应、炎症反应、细胞凋亡、肿瘤发生等多种生物进程中[12]。其次,NF-κB激活通路多种,其中最经典的通路是通过降解IκBs释放NF-κB进入细胞核内,结合目的基因促进其翻译转录[13]。NF-κB通路的过度激活导致了IBD的发生和发展。
本实验通过DSS诱导制备小鼠急性UC模型,通过对小鼠DAI评分及结肠大体及组织损伤的观察,确立UC模型的成功建立。研究发现,应用抗MIF单抗的小鼠,较模型组而言,小鼠的体重减轻幅度、粪便性状、结肠的大体损伤、光镜下结肠组织病理改变等均有显著改善,结果表明抗MIF单抗能有效地减轻DSS诱导的急性UC小鼠的外在表现及结肠大体及组织的损伤,有一定的治疗作用,对UC小鼠有一定的保护作用。本实验进一步通过免疫组化SP法检测小鼠结肠组织NF-κB p65及其抑制因子IκBα的表达,结果显示抗MIF单抗组小鼠结肠组织的NF-κB p65的表达较模型组减少,而IκBα较模型组的表达增多,两者比较具有显著性差异。研究结果表明抗MIF单抗对小鼠UC的发病的确能起到一定的保护作用。我们知道,NF-κB的核转移是其激活的一个重要指标,通过免疫组化结果,我们发现UC模型组中细胞核NF-κB p65的表达量明显高于细胞质表达。这提示模型组NF-κB持续激活,大量NF-κB进入到细胞核内,从而促进NF-κB的过度活化,加速炎症反应的进程。在抗MIF 单抗治疗组中,抗MIF单抗促进IκBα的表达量,从而导致NF-κB与IκB结合滞留于细胞质中,最终缓和炎症的发生。
近年来在对UC发病机制的研究中发现,UC患者NF-κB的活性显著升高,特别是活动期UC病人,肠黏膜的基底膜巨噬细胞和上皮细胞中的p65亚基表达明显升高[14]。NF-κB的P65亚基和细胞质抑制性蛋白IκBs(IκBα、IκBβ、IκBε)结合后遮蔽NF-κB的核定位信号,阻止NF-κB向核内转移与核内κB转录位点结合[15]。MIF 启动子上有NF-κB 的转录结合位点,其表达受到NF-κB信号通路的调控,研究发现IL-1β能通过NF-κB途径诱导离体子宫内膜细胞中MIFmRNA的表达及蛋白的分泌。MIF 又可间接促使移入核内的NF-κB增多,激活NF-κB的活性[16]。IκBα的降解与低表达是NF-κB活化的关键步骤。在以往研究中发现MIF可以抑制蛋白IκB的产生,使移入核内的NF-κB增多,结合相应基因的核转录结合位点,启动mRNA转录,增加翻译产物,从而释放大量黏附分子和炎性因子[17]。MIF与NF-κB互相促进表达,形成正反馈,由此产生级联反应,使机体内炎症因子失衡。
本实验通过免疫组化SP法检测小鼠结肠组织的NF-κB p65、IκBα的表达,发现应用抗MIF单抗的小鼠,较UC模型组而言,其中NF-κB p65表达下降,抑制IκBα因子表达增加。结果表明使用MIF单抗解除对IκB抑制,IκB表达增多并与NF-κB结合,同时减少了NF-κB的向核内转移,间接证明了MIF单抗阻断了NF-κB通路的过度激活,NF-κB作为信号传导途径中的枢纽,抑制了炎症细胞的细胞因子表达,减轻了肠道炎症反应。
本次实验从分子信号转导通路层面对抗MIF单抗对小鼠溃疡性结肠炎可能产生的干预作用进行了探讨,初步判定抗MIF单抗通过抑制NF-κB信号通路及其下游炎症因子的表达发挥作用 ,经实验证实了MIF单抗的疗效,减轻了炎症。希望在进一步的研究中能确定NF-κB向核内转移后NF-κB核细胞的阳性率,且能定量研究NF-κB的活化情况。
[1] Danese S,Fiocchi C.Ulcerative colitis[J].N Engl J Med,2011,365(18):1713-1725.
[2] 徐 燕,何树泉,李洪亮.溃疡性结肠炎的肠黏膜免疫细胞研究进展[J]. 赣南医学院学报,2013,33(1):156-160.
[3] Lue H,Kleemann R,Calandra T, et al. Macrophage migration inhibitory factor(MIF): mechanisms of action and role in disease[J]. Microbes Infect,2002,4(4):449-460.
[4] Hao NB,He YF,Luo G, et al. Macrophage migration inhibitory factor polymorphism and the risk of ulcerative colitis and Crohn's disease in Asian and European populations: a meta-analysis[J]. BMJ Open,2013,3(12):e003729.
[5] Oeckinghaus A, Hayden MS, Ghosh S, et al. Crosstalk in NF-kB signaling pathways[J]. Nat Immunol,2011,12(8):695-708.
[6] Atreya I, Atreya R, Neurath M F. NF-kappa B in inflammatory bowel disease[J]. J Intern Med,2008,263(6):591-596.
[7] Cooper HS, Murthy SN, Shah RS, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J]. Lab Invest,1993,69(2):238-249.
[9] Dieleman LA, Palmen MJ, Akol H, et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J]. Clin Exp Immunol,1998,114(3):385-391.
[10]Ye L, Cao Q, Cheng J, et al. Review of inflammatory bowel disease in China[J].Scientific World Journal,2013:296470.
[11]Sandborn WJ, Feagan BG, Marano C, et al. Subcutaneous golimumab maintains clinical response in patients with moderate-to-severe ulcerative colitis[J]. Gastroenterology,2014,146(1): 96-109.e1.
[12]Tergaonkar V. NFkappaB pathway:a good signaling paradigm and therapeutic target[J] .Int J Biochem Cell Biol,2006,38(10):1647-1653.
[13]邢飞跃,赵克森,姜 勇. NF-κB的信号通路与阻断策略[J]. 中国病理生理杂志,2003,19(6):849-855.
[14]Zhang Y, Wang Z, Liu J, et al. Cell surface-anchored syndecan-1 ameliorates intestinal inflammation and neutrophil transmigration in ulcerative colitis[J]. J Cell Mol Med,2017,21(1):13-25.
[15]Dyson HJ, Komives EA. Role of disorder in IκB-NFκB interaction[J]. IUBMB Life,2012,64(6):499-505.
[16]Veillat V, Lavoie CH, Metz CN, et al. Involvement of nuclear factor-kappaB in macrophage migration inhibitory factor gene transcription up-regulation induced by interleukin-1beta in ectopic endometrial cells[J]. Fertil Steril,2009,91(5 Suppl):2148-2156.
[17]Daun JM, Cannon JG. Macrophage migration inhibitory factor antagonizes hydrocortisone-induced increases in cytosolic Ikappa Balpha[J]. Am J Physiol Regul Integr Comp Physiol,2000,279(3):R1043-R1049.
Effect of anti-macrophage migration inhibitory factor on NF-κB、IκB Expression in mice with ulcerative colitis
TANGGuangyao1,ZHANGQifang2,WANGBaitao1,TANGDenghai3,MENGYunchao2,LIXirong3,ZHANGHailian2,ZHANGJing3
(1GraduateSchoolofGuilinMedicalCollege,Guilin,Guangxi541004China;2DepartmentofGastroenterology; 3DepartmentofPathology,NanxishanHospitalofGuangxiZhuangAutonomousRegion,Guilin541002)
Objective To investigate the effect of anti-macrophage migration inhibitory factor monoclonal antibody on NF-κB p65、IκBα expression in mice with ulcerative colitis. Methods Acute ulcerative colitis was induced by 5% dextran sulfate sodium(DSS). Then the protective effect of anti-MIF Ab on ulcerative colotis in mice was observed. Forty mice were randomly distributed into normal control group, UC model group, anti-MIF Ab intervention group and saline group.During modeling and the period of administration, to observe score Disease Activity and general situations Index(DAI) of mice, after 8 days killing all mice,performing the gross damage score in colon, observing the colonic histopathological changes under the light microscope on HE staining.The expression of NF-κB p65、IκBα protein was detected by immunohistochemical staining. Results Compared with normal control mice, the level of NF-κB p65 protein increased significantly in colon tissue of mice with UC,the level of IκBα slightly increased. After treatment with anti-MIF Ab , the expression level of NF-κB p65 significantly lower than that in UC model group,but the expression level of IκBα increased. Conclusions These findings suggest that anti-MIF Ab had a protective effect on DSS-induced ulcerative colitis in mice down-regulating NF-κB p65 protein expression. Thus to inhibit the NF-κB signaling pathway, excessive activation in the colon tissue of UC mice.
Macrophage migration inhibitory factor monoclonal antibody(anti-MIF Ab); Dextran sulfate sodium(DSS); Ulcerative colitis(UC); Nuclear factor-κB (NF-κB); Inhibitor of NF-κB(IκB)
广西桂林市科学研究与技术开发计划项目(编号:科技攻关20140120-7-2);广西医疗卫生重点科研课题(编号:重2011018)
R 574.1
A
1673-6575(2017)02-0170-05
10.11864/j.issn.1673.2017.02.04
2017-01-27
2017-03-25)
*通信作者
