老年人原发性IgA肾病临床病理及预后分析
2017-05-12刘林林王娟朱林波郑建楠姚丽王力宁
刘林林 王娟 朱林波 郑建楠 姚丽 王力宁
·论著·
老年人原发性IgA肾病临床病理及预后分析
刘林林 王娟 朱林波 郑建楠 姚丽 王力宁
目的 本研究拟比较老年人与非老年人原发性IgA肾病临床病理及预后的差异,探讨老年人原发性IgA肾病临床及病理特点。方法 选择2009年1月至2016年12月在中国医科大学附属第一医院肾内科住院并进行肾活检确诊为原发性IgA肾病的患者157例,其中年龄≥60岁患者77例设为观察组,年龄为14~59岁患者80例设为对照组。收集入选患者的临床及病理资料,组间均数比较采用Mann-Whitney U检验。结果 与对照组相比,观察组IgA肾病患者的高血压发生率和尿蛋白定量水平更高[高血压:77.92%比36.25%,P<0.001;24h尿蛋白定量:(3.08±2.92) g/d比(2.03±1.91) g/d,P=0.009],而估算的肾小球滤过率、血红蛋白、血清白蛋白水平更低[估算的肾小球滤过率:(58.73±28.29) ml·min-1·(1.73 m2)-1比 (86.02±36.68) ml·min-1·(1.73 m2)-1,P<0.001;血红蛋白:(122.18±18.79) g/L 比 (130.41±21.27) g/L,P=0.011;血清白蛋白:(32.75±7.89) g/L 比 (37.26±6.41) g/L,P<0.001]。病理损害方面,观察组球性硬化和各种程度硬化的肾小球比例低于对照组患者(球性硬化:0.17±0.17 比 0.25±0.26,P=0.014;各种硬化:0.18±0.18 比 0.30±0.29,P=0.003),肾小管间质损害更重(以T0/T1,2比例表示,0.75/1.29,P<0.001),新月体形成的小球比例和肾小动脉硬化发生率更高(新月体:0.11±0.23 比 0.05±0.05,P=0.049;肾小动脉硬化:87.01% 比 37.5%,P<0.001)。随访期间观察组终末期肾脏病发生率更高(15.09% 比 3.39%,P=0.045)。结论 与非老年人原发性IgA肾病患者相比,老年人原发性IgA肾病患者临床表现、小管间质损害和肾小动脉硬化更重,肾脏预后更差。
老年;IgA肾病;临床病理;终末期肾脏病;预后
原发性IgA肾病是目前全世界范围内最常见的原发性肾小球肾炎之一[1],该病主要的病理特征为系膜细胞增生和系膜基质增多,免疫病理表现为IgA(主要是糖基化异常的IgA1多聚体)伴或不伴补体C3沉积于系膜区。原发性IgA肾病可见于任何年龄段的患者,但主要是20~40岁的青壮年;该病起病隐匿,预后不佳,临床表现多种多样,可以表现为单纯血尿,也可表现为肾病综合征,甚至出现快速进展的肾功能不全。最近的研究报道证实约50%的原发性IgA肾病患者30年内可进展为终末期肾脏疾病(end stage renal disease, ESRD)[2]。
近年来,随着人口老龄化的不断进展以及肾活检技术的广泛应用,老年原发性IgA肾病患者在全部原发性IgA肾病患者中所占的比例不断增高[3],已经成为原发性IgA肾病中不可忽视的一个群体。目前人们对于此类患者的临床病理特点认识尚不足。本研究选择中国医科大学附属第一医院近7年确诊的老年原发性IgA肾病患者,并随机选择同时期确诊的非老年成人原发性IgA肾病患者,比较两者临床病理及预后之间的差异,探讨老年人原发性IgA肾病的临床病理及预后特点,以期为评估和诊治老年原发性IgA肾病患者提供更多的思路和线索。
资料与方法
一、研究对象与分组
选择2009年1月至2016年12月在中国医科大学附属第一医院肾内科住院并进行肾活检确诊为原发性IgA肾病的患者157例,其中年龄≥60岁患者77例设为观察组,年龄为14~59岁患者80例设为对照组。纳入标准:①经肾活检确诊为原发性IgA肾病;②年龄≥14岁;③临床及病理资料完整。排出标准:排除所有继发性IgA肾病,包括过敏性紫癜、银屑病、强直性脊柱炎、系统性红斑狼疮、类风湿性关节炎、肝病等。
二、方法
1.临床及病理资料的收集 收集所有入选患者的一般临床资料,包括性别、年龄、是否有慢性扁桃体炎病史、是否曾经出现过肉眼血尿、是否合并高血压、血常规、血清白蛋白、血红蛋白、血清低密度脂蛋白胆固醇、血清三酰甘油、血清尿酸、24h尿蛋白定量、通过慢性肾脏病流行病学合作研究(CKD-EPI)公式[4]估算的肾小球滤过率(estimated glomerular filtration rate, eGFR)、免疫抑制剂及肾素-血管紧张素-醛固酮系统拮抗剂(renin angiotensin aldosterone system inhibitors, RASI)的使用情况、随访时间(以月计算)以及ESRD的发生情况等。
肾活检的组织标本需保证光镜标本肾小球数不少于8个,肾组织标本均行光镜和免疫荧光检测。病理评估由两位病理医师分别独立完成,采用Lee分级法[5]和牛津分级法[6]进行综合评估。根据Lee分级的程度进一步分为轻中度(LeeⅠ/Ⅱ/Ⅲ)和重度(LeeⅣ/Ⅴ)两类,按照牛津分级对入选患者系膜增生(M)、内皮增生(E)、节段硬化(S)以及小管-间质损害分别评估。此外,还收集肾小球球性硬化的比例、存在各种硬化总肾小球比例(包括球性硬化、节段硬化、不全硬化)、有新月体形成的肾小球比例以及是否存在肾小动脉硬化(包括管壁增厚或玻璃样变性)。
2.相关定义 本研究的终点事件定义为随访期间内发生ESRD或死亡。ESRD的具体定义为eGFR<15 ml·min-1·(1.73 m2)-1或开始接受肾脏替代治疗(腹膜透析、血液透析或肾移植手术)。高血压定义为成人静息条件下收缩压≥140 mmHg和(或)舒张压≥90 mmHg,或者需长期应用降压药以维持正常水平的血压。
三、统计学处理
采用SPSS 16.0软件进行统计分析,正态分布的连续性变量以均数±标准差表示,分类变量以频数表示;组间均数比较采用Mann-Whitney U检验,分类变量比较采用χ2检验,相关性分析采用Pearson检验;P<0.05表示差异有统计学意义。
结 果
一、临床基本情况比较
观察组和对照组原发性IgA肾病患者在性别比例、慢性扁桃体炎病史、肉眼血尿病史、低密度脂蛋白胆固醇水平、三酰甘油水平、血尿酸水平以及RASI和免疫抑制剂的使用率方面比较,均无明显的统计学差异(P>0.05)。观察组患者高血压的发生率和24h尿蛋白定量高于对照组,而eGFR水平、血红蛋白以及血清白蛋白水平低于对照组,2组间的差异具有统计学意义(P<0.05)。(表1)
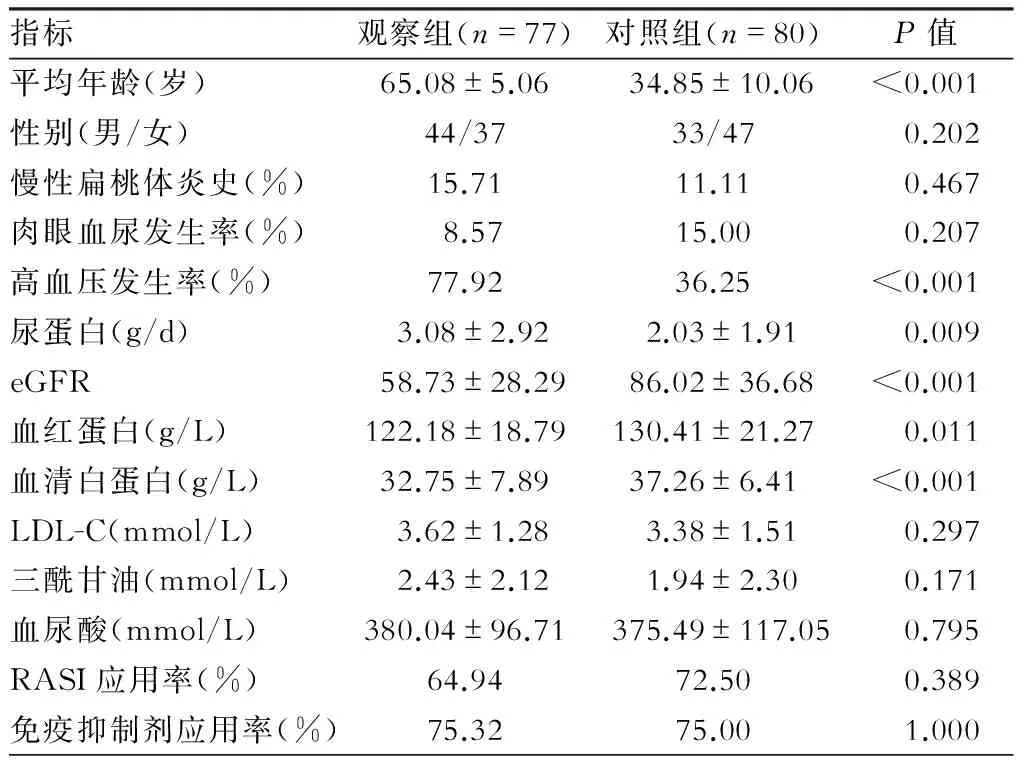
表1 2组患者的临床特征比较
注:eGFR单位为ml·min-1·(1.73 m2)-1;LDL-C为低密度脂蛋白胆固醇
二、肾脏病理特征比较
2组患者按照Lee氏分级标准,轻中度(Lee分级Ⅰ/Ⅱ/Ⅲ)与重度损害(Lee分级Ⅳ/Ⅴ)的患者比例没有明显差异(P=0.225);按照牛津分级,2组患者的系膜增生、内皮增生、节段硬化损伤的程度亦没有统计学差异,但观察组患者肾小管间质损害比对照组患者严重(以T0/T1,2比例表示,P<0.05)。(表2)
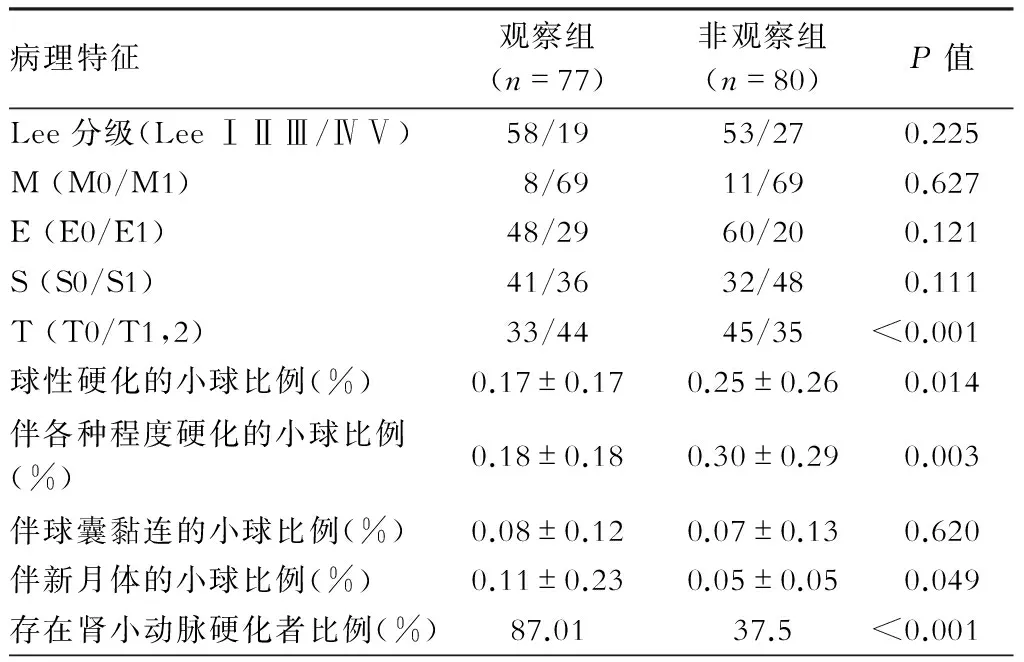
表2 2组患者的病理特征比较
注:M为系膜增生,E为内皮增生,S为节段硬化,T为小管-间质损害
此外,观察组患者出现球性硬化和各种程度硬化的肾小球比例低于对照组患者(P<0.05),但伴有新月体形成的肾小球比例高于对照组(P<0.05)。2组患者发生球囊黏连的肾小球比例没有明显差异,观察组患者肾小动脉硬化发生率高于对照组(P<0.05)。
三、预后
为比较观察组与对照组的临床预后情况,本研究进一步选取2组患者中随访时间1年以上或1年内即发生终点事件,且临床病理及随访资料完整者,比较2组患者终点事件(即ESRD或死亡)的发生率。53例观察组患者和59例对照组患者被纳入预后的比较分析,观察组平均随访时间(46.65±24.06)个月,对照组平均随访时间(41.46±24.09)个月,2组比较无统计学差异(P>0.05)。53例观察组患者中有8例发生ESRD(发生率15.09%),59例非老年人患者中有2例发生ESRD(发生率3.39%),2组ESRD发生率比较差异有统计学意义(P<0.05)。本研究中所有研究对象在随访期间无死亡事件发生。
讨 论
人口老龄化是全世界人口现状的一项重要课题,2012年中国60岁及以上的老年人口数量已经达到1.94亿,老龄化水平达到14.3%,预计2025年以前,中国高龄老年人口将始终保持平均每年100万的增长态势。衰老不仅是人体的生理性改变,同时也是许多慢性疾病发生、发展及预后的高危因素。肾脏是衰老最快的脏器之一,肾脏的衰老能够加剧慢性肾脏病的发生、发展。有研究显示,老年人群的慢性肾脏病发病率是年轻人群的3~13倍,目前已经成为全球性的公共健康问题[7-8]。
原发性IgA肾病是终末期肾脏疾病最常见的原因,可在任何年龄发病,但患病人群以中青年为主。根据既往报道,20世纪90年代的数据显示仅有2.3%的原发性IgA肾病患者年龄在50岁以上[9],但目前这一人群比例已经增加至18.3%[3]。该种现象可能与全球人口老龄化有关,也可能与老年人肾活检的接受度提高有关。实际上,原发性IgA肾病的诊断必须依靠肾脏病理,而老年人常合并高血压、糖尿病以及心脑血管疾病等情况,因此轻度尿异常的老年患者通常不会选择肾活检,甚至老年患者尿液检查也不如年轻患者规律积极,这些均可能导致老年原发性IgA肾病患者的漏诊,使老年患者原发性IgA肾病的实际患病率高于文献所报道。
老年原发性IgA肾病患者比例不断增加,但目前年龄对于原发性IgA肾病的疾病进展及预后的影响尚未完全明确。一项荟萃分析显示老年可能是原发性IgA肾病进展至ESRD的危险因素,特别是在亚洲人群当中[10]。也有一些研究探讨了老年原发性IgA肾病的特点,但结论不尽相同[11-13]。老年原发性IgA肾病的临床病理及预后特点已成为目前的研究热点,明确此类患者的特点对于改善其预后具有重要的意义。
本研究回顾性分析77例老年原发性IgA肾病患者及随机选择的同时期80例非老年人原发性IgA肾病患者的临床及病理资料,结果显示老年原发性IgA肾病患者的高血压发生率和尿蛋白定量水平高于非老年原发性IgA患者,而eGFR水平、血红蛋白以及血白蛋白水平低于非老年原发性IgA患者;老年原发性IgA肾病患者新月体形成、小管-间质损害以及肾小动脉硬化比对照组严重;老年患者发生ESRD风险更高,肾脏预后更差。老年原发性IgA肾病患者的这些特点可能主要与肾脏本身结构和功能的衰老有关。随着年龄的增长,肾脏血流量减少,肾脏血管的顺应性下降,系统或肾脏的局部炎症反应增强以及肾脏本身的代偿能力下降[14]。此外,老年原发性IgA肾病患者合并症较多,例如高血压、高脂血症、高尿酸血症等,这些合并症本身就是原发性IgA肾病进展的危险因素,可能加速原发性IgA肾病的进展,导致其预后不良[15-17]。但是本研究并未发现观察组和对照组之间血脂和血清尿酸水平存在明显差异,这与之前的一些研究并不一致,可能与入选患者的个体差异有关。值得注意的是,老年人原发性IgA肾病的治疗不仅应考虑原发性IgA肾病本身,还应考虑老年患者的合并症。
新近有研究发现DNA损伤和端粒功能下降可以导致衰老细胞分泌蛋白LL37,该现象为原发性IgA肾病进展过程中所特有,同时与中性粒细胞的功能有关[18-19]。研究者进一步筛查差异基因发现,3个重要的衰老基因(即PLAU、JUN和FOS)与DNA损伤、端粒功能下降导致的衰老、中性粒细胞功能以及原发性IgA肾病有关,因此他们推测DNA损伤和端粒功能下降可能在原发性IgA肾病中发挥重要的作用,而中性粒细胞也是原发性IgA肾病中的重要作用因子。这些研究进一步证实了衰老与原发性IgA肾病之间的关系,同时这些标记物形成的机制网络可能在原发性IgA肾病的发生发展过程中发挥重要作用,并可望成为未来重要的治疗靶点[20]。
本研究中,与对照组相比,观察组原发性IgA肾病患者肾小球球性硬化及各种硬化的肾小球比例均更低,这是否意味着老年原发性IgA肾病患者肾小球的免疫炎症反应较轻尚不可知。关于这一问题,既往研究也报道不一[11-13],研究结果的差异也可能与统计方法、纳入研究对象的差异有关。然而,这一结果似乎与观察组患者临床表现更重(如蛋白尿量更大、eGFR更低、预后更差)的现象不符。事实上,慢性肾脏病患者的临床表现及预后不仅与肾小球的病变有关,也与小管间质的损害密切相关。本研究中,观察组患者肾小管间质病变比对照组患者更严重,也许能够解释老年原发性IgA肾病患者临床表现更为严重的原因。
此外,本研究也存在一些局限性。首先,本研究是一项回顾性、小样本量的单中心研究,并且排除失访患者后进行预后数据的分析,可能造成研究偏倚,影响本研究结论的可靠性;其次,尽管患者的Lee分级在组间没有统计学差异,但本研究中2组患者的组间差异无法完全排除由原发性IgA肾病不同阶段的病理损害所导致。因此,本研究的结论需要未来高质量、大样本、多中心的研究加以验证。
总之,与非老年原发性IgA肾病患者相比,老年原发性IgA肾病患者临床表现更重,小管间质和肾小动脉硬化更重,肾脏预后更差。因此,应积极对待老年原发性IgA肾病患者,争取做到早诊断、早治疗、积极干预合并症,以期改善此类患者的长期预后。
[1] Wyatt RJ, Julian BA. IgA Nephropathy[J]. N Engl J Med, 2013, 368(25): 2402-2414.
[2] Moriyama T, Tanaka K, Iwasaki C, et al. Prognosis in IgA nephropathy: 30-year analysis of 1,012 patients at a single center in Japan[J]. PLoS ONE, 2014, 9: e91756.
[3] Goto M, Kenji W, Kawamura T, et al. A scoring system to predict renal outcome in IgA nephropathy: a nationwide 10-year prospective cohort study[J]. Nephrol Dial Transplant, 2009, 24(10): 3068-3074.
[4] Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate[J]. Ann Intern Med, 2009, 150(9): 604-612.
[5] Lee SMK, Rao VM, Franklin WA, et al. IgA nephropathy: morphologic predictors of progressive renal disease[J]. Hum Pathol, 1982, 13(4): 314-322.
[6] Working Group of the International IgA Nephropathy Network and the Renal Pathology Society. The Oxford classification of IgA nephropathy: rationale, clinicopathological correlations, and classification[J]. Kidney Int, 2009, 76(5): 546-556.
[7] Minutolo R, Borrelli S, De Nicola L. CKD in the elderly: kidney senescence or blood pressure-related nephropathy?[J]. Am J Kidney Dis, 2015, 66(2): 184-186.
[8] König M, Gollasch M, Demuth I, et al. Prevalence of Impaired Kidney Function in the German Elderly: Results from the Berlin AgingStudy II (BASE-II)[J]. Gerontology, 2017, 63(3): 201-209.
[9] Radford MG, Donadio JV, Bergstralh EJ, et al. Predicting renal outcome in IgA nephropathy[J]. J Am Soc Nephrol, 1997, 8(2): 199-207.
[10]Duan ZY, Cai GY, Chen YZ, et al. Aging promotes progression of IgA nephropathy: a systematic review and meta-analysis[J]. Am J Nephrol, 2013, 38(3): 241-252.
[11]Oshima Y, Moriyama T, Itabashi M, et al. Characteristics of IgA nephropathy in advanced-age patients[J]. Int Urol Nephrol, 2015, 47(1): 137-145.
[12]张琦, 吴杰, 段姝伟, 等. 老年原发性IgA肾病的临床病理相关研究及预后影响因素分析[J]. 中国中西医结合肾病杂志, 2016, 17(4): 307-311.
[13]金波, 梁少珊, 陈浩, 等. 老年原发性IgA肾病患者的临床病理特点和长期预后的相关危险因素分析[J]. 肾脏病与透析肾移植杂志, 2014, 23(5): 412-417.
[14]Sobamowo H, Prabhakar SS. The kidney in aging: physiological changes and pathological implications[J]. Prog Mol Biol Transl Sci, 2017, 146: 303-340.
[15]Coppo R. Clinical and histological risk factors for progression of IgA nephropathy: an update in children, young and adult patients[J]. J nephrol, 2016, DOI: 10.1007/s40620-016-0360-z.
[16]Caliskan Y, Ozluk Y, Celik D, et al. The Clinical Significance of Uric Acid and Complement Activation in the Progression of IgA Nephropathy[J]. Kidney Blood Press Res, 2016, 41(2): 148-157.
[17]Bakan A, Oral A, Elcioglu OC, Takir M, et al. Hyperuricemia is associated with progression of IgA nephropathy[J]. Int Urol Nephrol, 2015, 47(4): 673-678.
[18]Jiang H, Schiffer E, Song Z, et al. Proteins induced by telomere dysfunction and DNA damage represent biomarkers of human aging and disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008,105 (32): 11299-11304.
[19]Lu YY, Yang X, Chen WQ, et al. Proteins induced by telomere dysfunction are associated with human IgA nephropathy[J]. J Zhejiang Univ Sci B, 2014, 15(6): 566-574.
[20]Jiang H, Liang L, Qin J, et al. Functional networks of aging markers in the glomeruli of IgA nephropathy: a new therapeutic opportunity[J]. Oncotarget, 2016, 7(23): 33616-33626.
Clinicopathologic and prognostic analyses in elderly patients with primary IgA nephropathy
LIULin-lin,WANGJuan,ZHULin-bo,ZHENGJian-nan,YAOLi,WANGLi-ning.
DepartmentofNephrology,theFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China
WANGLi-ning,E-mail:lfn540@126.com
Objective To compare the differences in clinicopathologic characteristics and prognosis between elderly and non-elderly patients with IgA nephropathy, and to explore the clinical and pathological characteristics of elderly patients with IgA nephropathy.Methods One hundred and fifty-seven patients with primary IgA nephropathy diagnosed by renal biopsy in the First Affiliated Hospital of China Medical University between January 2009 and December 2016 were enrolled in this study. Seventy-seven patients at the age of 60 years old and above were included as the elderly group, and 80 patients at the age between 14 and 59 were included as the control group. The clinical and pathological data of the included patients were collected, and comparison of the means between the groups was performed using Mann-Whitney U test.Results The elderly group had a higher incidence of hypertension and higher levels of urinary protein excretion (hypertension: 77.92% vs. 36.25%,P<0.001; urinary protein excretion: 3.08±2.92 g/day vs. 2.03±1.91 g/day,P=0.009), lower levels of estimated glomerular filtration rates (eGFR), hemoglobin, serum albumin (eGFR: 58.73±28.29 ml·min-1·(1.73 m2)-1vs. 86.02±36.68 ml·min-1·(1.73 m2)-1,P<0.001; hemoglobin: 122.18±18.79 g/L vs. 130.41±21.27 g/L,P=0.011; serum albumin: 32.75±7.89 g/L vs. 37.26±6.41 g/L,P<0.001) than in the non-elderly group. On the pathological lesions, the elderly group had lower ratio of global and all categories of glomerulosclerosis (global sclerosis: 0.17±0.17 vs. 0.25±0.26,P=0.014; all categories of glomerulosclerosis: 0.18±0.18 vs. 0.30±0.29,P=0.003), more severe tubular-interstitial injury (expressed as the ratio of T0/T1,2) (0.75 vs. 1.29,P<0.001), a higher ratio of the glomeruli with crescents formation and a higher incidence of renal arteriole sclerosis (crescents formation: 0.11±0.23 vs. 0.05±0.05,P=0.049; arteriole sclerosis: 87.01% vs. 37.5%,P<0.001) than in the non-elderly group. During the period of follow-up, the elderly group had a higher incidence of end-stage renal disease than in the non-elderly group (15.09% vs. 3.39%,P=0.045).Conclusions The elderly patients with IgA nephropathy had more severe clinical manifestations, tubular-interstitial injury and renal arteriole sclerosis, and poorer renal prognosis in the non-elderly patients.
Elderly; IgA nephropathy; Clinicopathologic characteristics; End-stage renal disease; Prognosis
10.3969/j.issn.1671-2390.2017.04.002
国家自然科学基金资助(No.81370870);国家自然科学基金青年项目(No.81500525);辽宁省自然基金(No.2014021046)
110001 沈阳,中国医科大学附属第一医院肾内科
王力宁,E-mail:lfn540@126.com
2017-01-12
2017-03-15)
