植物根际促生菌的分离及对桔梗的促生效应
2017-05-11冀玉良
冀玉良
(商洛学院 生物医药与食品工程学院,陕西商洛 726000)
植物根际促生菌 (plant growth-promoting rhizobacteria,PGPR)是一类生存在植物的根内或者根周围的可促进植物生长及其对矿质营养的吸收和利用,并能抑制有害生物的有益菌类[1-3]。目前已鉴定出很多种的PGPR菌株,并且发现利用根际促生菌研发成促生菌剂应用于消除植物生长过程中的连作障碍方面具有极大的优势和应用潜力[4-7]。药用植物桔梗在生长过程中面临的最大难题就是连作障碍[8-9],虽然接种植物根际促生菌剂在玉米、小麦、蔬菜等植物上的应用已取得了较好的促生作用效果[10-13],但目前关于桔梗促生菌及其促生菌剂的研究尚不多见。另外目前对促生菌普遍研究的都是从一种植物根际分离的促生菌对本植物的促生作用,从一种植物根际分离的促生菌对另一种植物的促生作用的研究较少,尤其研究油菜根根际促生菌对桔梗的促生效应未见报道。本研究用多种不同配方的培养基从油菜的根际、根表筛选出有促生效应的功能菌株,并采用种子萌发试验测定不同菌株对桔梗的促生效应,筛选对桔梗具有优良的促生性能的菌株,为研制克服桔梗连作障碍的PGPR接种剂提供良好的菌种资源,进一步探索根际促生菌对药用植物的促生作用机制,为植物根际促生菌的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 土样的采集
土壤样品来自陕西省商州区油菜园(33.52°N,109.57°E,海拔798 m)健康油菜幼苗根际土。采用五点取样法,取表层以下5~10 cm处的根围土壤,将五处土壤混在一起放入无菌自封袋中带回,置于4℃冰箱中备用。
1.1.2 桔梗种子
桔梗种子购于商州区沙河子镇种子专营店。
1.1.3 培养基
牛肉膏蛋白胨培养基(NA培养基),King's B培养基(KB培养基),NBRIP培养基,硅酸盐培养基,LB培养基,蛋白胨氨化培养基,Ashby无氮培养基。培养基配方见文献[6]。
1.2 方法
1.2.1 植物根际土壤样品前期处理
在无菌操作台中,将采来的健康油菜幼苗根际土壤样品混合均匀,称取土样10 g,迅速倒入含有90 mL无菌水的三角瓶中(内装玻璃珠30粒),30 ℃、180 r·min-1振荡培养 0.5 h,按 8个浓度梯度(10-2~10-9g·mL-1)稀释后,分别取0.1 mL土壤稀释液涂布于NA、KB平板上,各设3个重复,于30℃培养箱培养3~5 d。
1.2.2 植物根际促生细菌的筛选
选择以上合适的稀释度平板,按照形态、大小、颜色,挑取形态各异的典型单个菌落,在LB培养基上纯化后得到斜面菌株,保存于4℃冰箱。按照参考文献的方法将获得的菌株分别点接至NBRIP培养基和硅酸盐培养基,筛选具备解磷、解钾的菌株[6-7];将同时具有解磷、解钾能力的菌株转接到蛋白胨氨化培养基中,进行产NH3能力鉴定[6-7];将同时具有解磷、解钾和产NH3能力的待测菌株接入Ashby液体培养基中培养3 d,于620 nm处测其OD值,比较OD值的大小,鉴定各菌株的固氮能力[6-7];制作生长素IAA标准曲线,将同时具有解磷、解钾和产NH3能力的待测菌株接入特定液体培养基(添加0.5 g·L-1L-色氨酸)中,测定产IAA能力[6-7]。
1.2.3 种子萌发试验
将筛选的菌株接种到含有100 mL的LB液体培养基中,于30℃摇床培养3 d,待细菌浓度达108cfu·mL-1时,将发酵菌液依次稀释为6个梯度(10-1~10-6)的接种菌悬液。
在无菌环境下将桔梗种子用10%H2O2处理20 min,再用无菌蒸馏水冲洗6~7遍,晾干。然后将消毒的桔梗种子在对应浓度的菌悬液中浸泡20 min后,点播于装有湿润滤纸的灭菌培养皿中,以每皿放入30粒种子为宜,并向每皿中加入相应浓度梯度的菌悬液(菌悬液加入量以浸湿滤纸和种子为宜),每个处理做3个重复,对照组以无菌水代替菌悬液。加好后将培养皿置于28℃恒温箱中进行黑暗培养,萌发过程中每48 h添加1次等量的相应浓度梯度菌悬液和无菌水,定期观察种子出芽的情况。种子萌发以胚根伸出1 mm为标准,第12 d时统计发芽率,培养18 d后,测定幼苗茎长度。
发芽率=发芽的种子总数/供试的种子总数×100%。
2 结果与分析
2.1 根际促生菌的筛选
用2种不同配方的培养基,从油菜根际土壤中经分离、纯化共获得81株菌,通过初筛得到19株菌具备溶磷和解钾能力,通过进一步复筛,其中6个菌株又具备产氨、固氮、产IAA的能力,分别为 N-1、N-3、N-15、N-33、K-18、K-25。这些菌株的编号及相关信息如表1所示。

表1 6株促生菌的形态特征
2.1.1 菌株产氨能力
将19株具有溶磷和解钾能力的菌株转接到蛋白胨氨化培养基中,30℃培养48 h后,在培养液中加入 4~6 滴纳氏试剂,N-3、N-33、N-1、N-15、K-25、K-18这6种菌分别出现棕红色沉淀,而不接种的蛋白胨氨化培养基未出现红色沉淀。由此表明这6株菌具备产NH3的能力。6株菌的颜色由深到浅依次为K-25、N-15、K-18、N-33、N-1、N-3,相应的产氨能力由强到弱。
2.1.2 菌株固氮能力
具固氮能力的菌株在固氮培养基中能生长,菌体浓度越大,在620 nm处测得的OD值也越大。表2表示各菌液的OD值和菌株的固氮能力,从中可知,6株菌的固氮能力由强到弱依次为 K-25、N-15、K-18、N-1、N-33、N-3。通过对产氨和固氮能力的测定后发现,菌株K-25的产氨能力和固氮能力都是最强的。
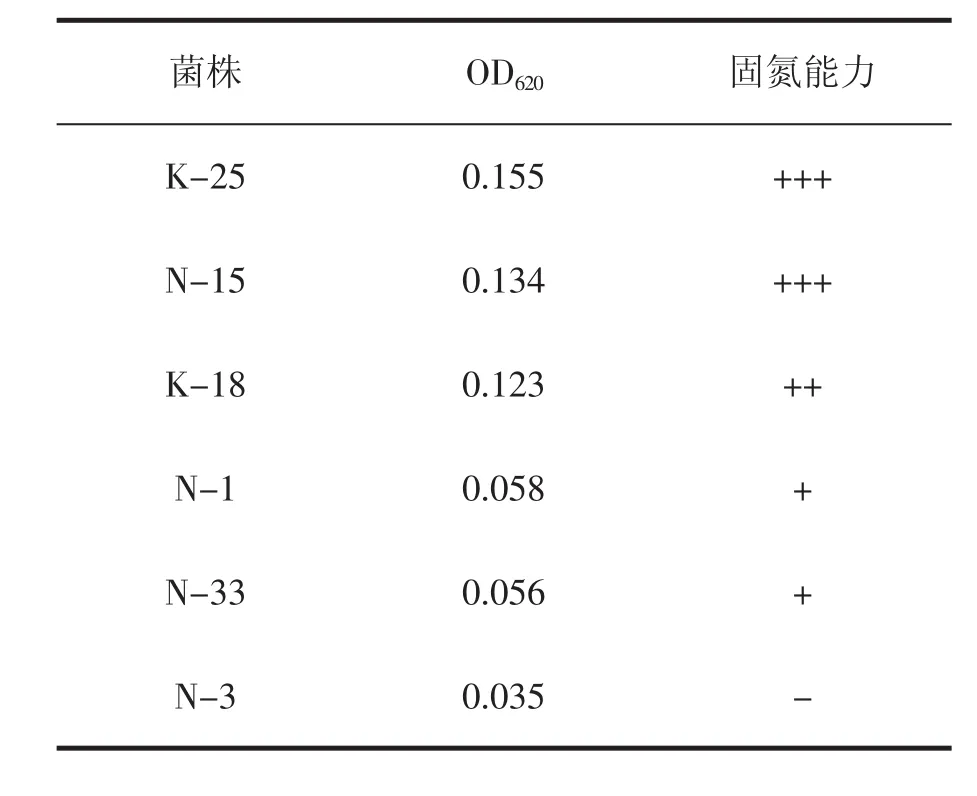
表2 6株促生菌的固氮能力
2.1.3 菌株生长素含量
根据生长素在530 nm波长下的吸光度大小与其含量成一次线性关系制得标准曲线,以吸光度(Y)对生长素IAA浓度(X)进行回归分析,得到回归方程为:Y=0.0171X+0.0284,R2=0.9993。测定各菌株培养液在530 nm波长处的光密度值,计算 IAA 产量(mg·L-1)(表 3)。可以看出,OD 值越大相应的IAA含量越高,菌株K-18产生的生长素含量最少,菌株N-3产生的生长素含量最多。产生长素含量由高到低依次为N-3、N-33、N-1、N-15、K-25、K-18。
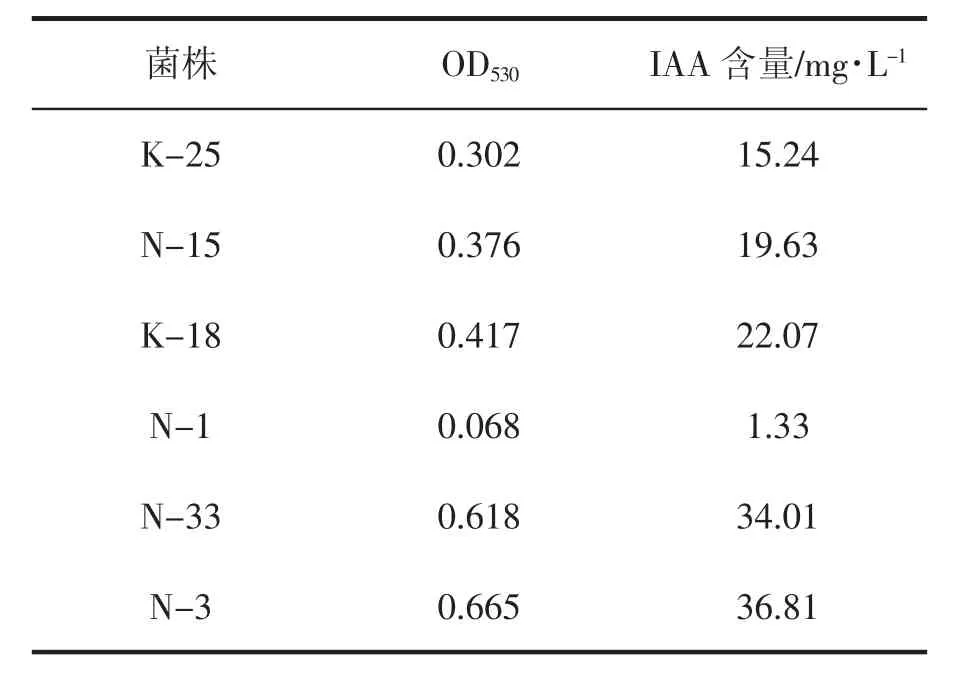
表3 6株促生菌的IAA含量
2.2 促生菌对种子萌发的影响
图1中的(b)(c)(d)分别为接种3株促生菌菌悬液后桔梗种子的萌发情况,从中可以看出,与未接菌悬液的萌发种子幼苗相比,在N-1、K-25、N-15接种菌的影响下,桔梗幼苗的茎粗、茎长均超过对照组,具有明显的促生作用。
图2、图3分别显示了接种不同稀释度的6株功能菌菌悬液后桔梗种子发芽率和茎长的变化趋势。从中可以看出,在不同稀释度的N-3和N-33菌悬液分别处理下的桔梗种子发芽率与茎长明显低于对照组。接种N-33的桔梗种子在10-5稀释度菌悬液下发芽率最高,为23.33%,比对照组发芽率低13.34%;平均茎长为0.71 cm,比对照组平均茎长少0.36 cm。接种N-3的桔梗种子在10-5稀释度菌悬液下发芽率最高,为16.67%,比对照组发芽率低20%;平均茎长为0.62 cm,比对照组平均茎长少0.46 cm。

图1 促生菌对桔梗幼苗生长的影响

图2 促生菌对桔梗种子发芽数的影响
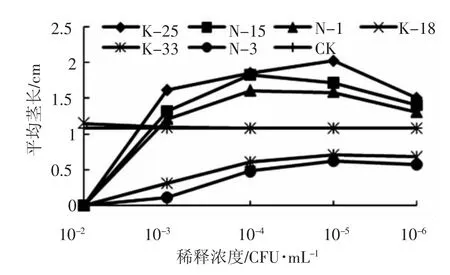
图3 促生菌对桔梗幼苗茎长的影响
接种K-25的桔梗种子在10-5稀释度菌悬液下发芽率最高,为70%,比对照组发芽率高33.33%;平均茎长为2.03 cm,比对照组平均茎长长0.95 cm。接种N-15的桔梗种子在10-4稀释度菌悬液下发芽率最高,为60%,比对照组发芽率高23.33%;平均茎长为1.83cm,比对照组平均茎长长0.75 cm。接种N-1的桔梗种子在10-4稀释度菌悬液下发芽率最高,为56.67%,比对照组发芽率高19.99%;平均茎长为1.61cm,比对照组平均茎长长0.53 cm。
K-25菌株在10-5稀释度菌悬液下的促生效果最强,其次为N-15菌株在10-4稀释度菌悬液下的促生效果较强,而N-1菌株在10-4稀释度菌悬液下的促生效果略低于N-15菌株在10-4稀释度菌悬液下的促生效果。在K-18菌株作用下的桔梗种子生长效果与对照组基本上没有差别,说明没有明显的促生效应。
在稀释度为 10-2的 N-3、N-33、N-1、N-15、K-25这5种菌悬液的作用下,桔梗种子都没有发芽,而在此稀释度的K-18菌作用下,桔梗种子的平均发芽率与平均茎长分别为40%、1.15 cm,略高于对照组。结合各促生菌生长素的含量来分析,推测桔梗种子在10-2稀释度的各菌悬液作用下都没有发芽可能是因为生长素含量太高,从而抑制了桔梗的生长。因为K-18产生的生长素含量较少,所以在该浓度下对桔梗有促生作用,但在更小的菌悬液浓度下也没有促生作用。
3 结论与讨论
本研究从油菜根际土壤中分离到19株同时具有溶磷和解钾能力的功能菌,其中6株菌(N-1、N-3、N-15、N-33、K-25、K-18)具备产氨、产 IAA和固氮能力。种子萌发试验测定显示接种N-1、N-15、K-25三株菌的桔梗种子发芽率和幼苗茎长均明显高于未接菌的对照组,3株菌K-25、N-1、N-15对桔梗具有明显的促生作用,其中K-25菌株的促生效果最强。这些结果证明了从一种植物根际能够分离到对另一种植物有促生作用的功能菌株,促生菌株在不同植物根际的分布和作用存在交叉现象。由于不同植物的根际环境不完全相同,一种植物根际可能具有另一种植物根际促生菌所不具备的一些特性,因此在促生菌的分离中应该利用这种交叉现象来筛选某种植物的促生菌。
既然促生菌在不同植物根际存在交叉现象,在研发促生菌剂时也应该考虑促生菌之间的互补性,即将不同植物根际的促生菌组合在一起制成复合接菌剂,这样可能会收到更好的促生效果。就本研究来说,从油菜根际土壤中筛选到的对桔梗具有促生作用的3株优良菌株,可以再配合从桔梗根际筛选的促生菌来研发和制备桔梗促生菌剂。
PGPR一般通过产生长素、产嗜铁素、溶磷解钾等多种机制促进植物生长[14-17],目前筛选促生菌一般也都以此为依据,如杨蓉等[18]以此为指标,从番茄、黄瓜、茄子、辣椒4种蔬菜作物的根际土壤中分别筛选出对黄瓜幼苗和番茄幼苗生长有显著促生作用的细菌。另外植物根际细菌对植物起促生作用还是抑制作用,主要取决于不同物种的植物以及菌种代谢产物的浓度是否合适[7],对此在本研究中也得到印证。本研究发现N-3和N-33菌株产生长素含量高,但对桔梗种子萌发和生长有抑制的现象,这说明促生菌产生长素的量和促生作用之间并不一定成正相关,促生菌对桔梗的促生作用有一定的生长素范围,生长素含量太大往往反而对桔梗幼苗生长会产生抑制。因此,促生菌的筛选可以以溶磷、解钾,产氨、产IAA和固氮能力等多项指标为依据,但必须进一步通过接种菌悬液的种子萌发试验来验证,而且具体到应用上,由于实际生态环境的复杂性[19],最终更要通过大田试验来验证促生菌的促生效应。造成N-3和N-33菌株对桔梗生长抑制现象的主要原因可能是这两株菌在生长代谢过程中产生的其他次生代谢产物抑制了植物的正常生长,对此还有待进一步做深入的探索。
参考文献:
[1]李琬,刘淼,张必弦,等.植物根际促生菌的研究进展及应用现状[J].中国农学通报,2014,30(24):1-5.
[2]康贻军,程洁,梅丽娟,等.植物根际促生菌作用机制研究进展[J].应用生态学报,2010,21(1):232-238.
[3]KARAKURTH,KOTAN R,DADASOGLU F,etal.Effects of plant growth promoting rhizobacteria on fruitset,pomologicaland chemicalcharacteristics,color values,and vegetative growth of sour cherry[J].Turkish Journal of Biology,2011,35(3):291-293.
[4]檀国印,杨志玲,袁志林,等.植物根际促生菌及其在克服连作障碍中的潜力[J].热带作物学报,2013,34(1):135-141.
[5]王玲娜.内蒙芹菜连作障碍微生物修复研究[D].陕西杨凌:西北农林科技大学,2010.
[6]康贻军,程洁,梅丽娟,等.植物根际促生菌的筛选及鉴定[J].微生物学报,2010,50(7):853-861.
[7]邓振山,党军龙,张海州,等.植物根际促生菌的筛选及其对玉米的促生效应[J].微生物学通报,2012,39(7):980-988.
[8]冀玉良.刺槐根瘤菌对桔梗的促生作用研究[J].江西农业学报,2014,26(5):72-75.
[9]冀玉良.根瘤菌对桔梗幼苗根际土壤微生物各群和酶活性的影响[J].商洛学院学报,2015,29(6):49-54.
[10]ABBASM K,SHARIF S,KAZMIM,etal.Isolation ofplantgrowth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth,yield and nutrientuptake of plants[J].Plant Biosystems,2011,145(1):159-168.
[11]麻耀华,尹淑丽,张丽萍,等.复合微生态制剂对黄瓜根际土壤微生物数量和酶活性的影响[J].植物保护,2012,38(2):46-50.
[12]舒秀丽,赵柳,孙学振,等.不同土壤改良剂处理对连作西洋参根际微生物数量、土壤酶活性及产量的影响[J].中国生态农业学报,2011,19(6):1289-1294.
[13]段玉琪,陈冬梅,晋艳,等.不同肥料对连作烟草根际土壤微生物及酶活性的影响[J].中国农业科技导报,2012,14(3):122-126.
[14]魏兰芳,谢春琼,李兴国,等.不同植物促生细菌对番茄生长的影响[J].河南农业科学,2009(3):89-92.
[15]KUMAR H,DUBEY R C,Maheshwari D K.Effect of plant growth promoting rhizobia on seed germination,growth promotion and suppression of Fusarium wilt of fenugreek[J].Crop Protection,2011,30(11):1396-1403.
[16]BHATTACHARYYA P N,JHA D K.Plant growthpromoting rhizobacteria:emergence in agriculture[J].WorldJournal of Microbiology&Biotechnology,2012,28(4):1327-1350.
[17]谭石勇,易永健,汪洪鹰,等.苎麻促生菌的筛选、鉴定及其促生效应[J].微生物学通报,2015,42(3):525-533.
[18]杨蓉,房世杰,杨文琦,等.植物根际促生细菌(PGPR)分离筛选与鉴定[J].新疆农业科学,2011,48(12):2337-2342.
[19]郭军康,董明芳.根际促生菌影响植物吸收和转运重金属的研究进展[J].生物环境学报,2015,24(7):1228-1234.
