蒲葵中化合物EHHM对肝癌HepG2细胞增殖作用的研究
2017-05-11程新生邵明王欣缪丁丁高金亭
程新生+邵明+王欣+缪丁丁+高金亭


[摘要] 目的 探讨EHHM对肝癌HepG2细胞增殖能力的抑制作用。 方法 分别用浓度为0.1、1.0、5.0 μg/mL的EHHM培养液培养HepG2细胞及正常肝细胞LO2,采用等体积超纯水培养液培养为对照,采用MTT法、生长曲线法和平皿克隆实验测定细胞的增殖能力。 结果 EHHM作用HepG2细胞24、48、72 h后,细胞生长被明显抑制,与对照比较差异有统计学意义(P < 0.05),并呈现了时间和浓度的依赖性,LO2细胞数或克隆数与对照相近(P > 0.05)。 结论 EHHM可抑制HepG2细胞增殖能力,对正常肝细胞LO2无明显效果。
[关键词] 蒲葵;HepG2;生长曲线法;抗癌作用
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-7210(2017)03(a)-0024-04
Study on role of Livistona Chinensis compound EHHM on hepatocellular carcinoma HepG2 cell proliferation
CHENG Xingsheng1 SHAO Ming2 WANG Xin3 MIAO Dingding1 GUO Jinting1
1.Department of Courage Pancreas Surgery, Shenzhen Nanshan Hospital of Guangdong Medical University, Guangdong Province, Shenzhen 518052, China; 2. Department of Anorectal Surgery, Shenzhen Nanshan Hospital of Guangdong Medical University, Guangdong Province, Shenzhen 518052, China; 3.Department of Hematology, Shenzhen Nanshan Hospital of Guangdong Medical University, Guangdong Province, Shenzhen 518052, China
[Abstract] Objective To investigate the inhibitory effect of EHHM on the proliferation of HepG2 cells. Methods HepG2 cells and normal liver cells LO2 were cultured in EHHM medium with a concentration of 0.1,1.0,5.0 μg/mL respectively, using equivalent voume ultrapure water nutrient solution was as control, the proliferation of cells was measured by MTT assay, growth curve and plate cloning. Results After 24, 48, 72 h of EHHM acts on HepG2 cells, cell growth was inhibited obviously, there was significant difference compared with the control group (P < 0.05), and it showed a time and concentration dependent, the number of LO2 cells and the number of clones were similar to those of the control group (P > 0.05). Conclusion EHHM can inhibit the proliferation of HepG2 cells and has no obvious effect on LO2.
[Key words] Livistona chinensis; HepG2; Growth curve; Antitumor effect
肝癌是一種发病机制复杂的恶性肿瘤,研究表明,肝癌在我国呈现多发态势,一直严重影响着居民生命健康[1]。近年来,针对天然植物有效成分抗癌作用的研究逐渐成为新的热点[2]。蒲葵(Livistona Chinensis R. Br.),属于棕榈科的常绿乔木,作为一种观赏性植物,广泛存在于自然环境[3]。在前期研究中,发现蒲葵尤其是蒲葵子具有消瘀止血、抗癌败毒等功效[4],民间亦常用其治疗食管癌、鼻咽癌和白血病等恶疾,有显著效果[5]。国外文献针对蒲葵的报道也证实其对肿瘤血管和肿瘤细胞具有较强抑制效果[6]。近年,随着化学提纯技术的发展,对蒲葵有效成分的提取和分析成为可能。前期实验中,研究者从蒲葵中分离提纯出了多种天然单体化合物,通过体外肿瘤抑制实验筛选到一个能高效特异抑制肝癌细胞系生长增殖的单体化合物,是一种新的天然化合物,命名为E-[6'-(5'-hydroxypenty1)trieosy1]-4-hydroxy-3methoxycinnamate,简称为EHHM。为了进一步验证该化合物能否抑制肝癌细胞生长,本研究通过MTT法、生长曲线法和平皿克隆实验等方法,对比分析了EHHM对肝癌细胞和正常肝细胞的生长抑制或者促进作用。为发现蒲葵提取物的有效成分及推动其在临床上的应用提供科学依据。
1 材料与方法
1.1 试剂及材料
人肝癌细胞株HepG2购自美国典型物保藏中心细胞库,WTT试剂盒购自武汉博士德公司,RPMI 1640培养基购自Gibco公司。其他所涉及试剂均为进口分析纯。
1.2 细胞培养
使用含10%FBS的RPMl l640培养基,在37℃、10%(体积分数)CO2的温箱中培养肝癌细胞株HepG2细胞。在相同条件下,使用含有10%FBS的DMEM培养基培养正常肝细胞LO2。EHHM和超纯水依据体积比分别制成培养HepG2和LO2培养的培养基。
1.3 MTT法检测EHHM对HepG2细胞生长能力的影响
先饥饿培养HepG2和LO2细胞24 h后,用含胰酶消化处理计数,然后在96孔培养板中每孔加入150 μL(含有3.5×103个/mL细胞)含10%FBS的RPMI1640培养基的细胞悬液,分别加入最终浓度0.1、1.0、5.0 μg/mL的含EHHM的培养液,加入等体积超纯水培养液为对照,放置于37℃、10%(体积分数)CO2培养箱中培养24、48、72 h后。弃上清液,每孔加入20 μL MTT溶液继续培养4 h,吸除培养液,每孔再加入100 μL DMSO,震荡均匀后,选择490 nm波长,测定每个培养孔的光密度值(OD)。其抑制率或者增殖率的计算公式如下[7]:
肿瘤细胞生长抑制率% =(1-实验组平均OD值/对照组平均OD值)×100%。
1.4 生长曲线法
将HepG2和LO2细胞分别接种于培养基,配成10×103个/mL的细胞悬液,加到96孔培养板中,每孔100 μL,在实现组中分别加入最终浓度0.1、1.0、5.0 μg/mL的EHHM培养液,加入等体积超纯水培养液为对照,放置于37℃、10%(体积分数)CO2培养箱中培养,然后按0、1、2、3、4、5、6、7 d分别取样,然后使用0.4%台盼蓝液10 μL染色后,计数活细胞数,然后绘制细胞生长曲线[8]。
1.5 平皿克隆实验
按照上述实验方法,操作后,将HepG2和LO2细胞分别在6孔板中每孔平行加入100、500、1000个细胞,分别用不同培养基培养,加入等体积超纯水培养基为对照,每隔1~2 d补充适量培养基,连续培养至14周。当对照组的细胞克隆集落即将融合时,终止培养,在处理后,加适量结晶紫染色液染色10~30 min,然后用流水缓慢洗去染色液,空气干燥。观察细胞生长形成的克隆集落数。参考Li等[9]的方法,将≥50 μm或50个细胞的细胞团视为一个克隆。
1.6 统计学方法
采用统计软件SPSS 22.0对数据进行分析,正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 EHHM对HepG2细胞生长的抑制作用
不同浓度的EHHM作用于肝癌细胞系HepG2细胞24、48、72 h后,测量得到的OD值见表1;EHHM浓度为0.1、1.0、5.0 μg/mL在培养24 h后,对HepG2细胞的抑制率分别是(2.200±0.008)%、(16.390±0.014)%和(27.800±0.036)%;48 h的抑制率分别是(22.491±0.021)%、(41.264±0.049)%、(68.959±0.063)%;72 h的抑制率分别是(4.470±0.011)%、(38.223±0.038)%和(64.011±0.088)%。在HepG2细胞组的各个时间段,实验组OD值与对照比较,差异有统计学意义(P < 0.05),并呈现了时间和浓度的依赖性。
2.2 EHHM对LO2细胞生长的抑制作用
不同浓度的EHHM作用于正常肝脏LO2细胞24、48、72 h后,测量得到的OD值见表2。EHHM浓度为0.1、1.0、5.0 μg/mL在培养24 h后,对LO2细胞的抑制率分别是(4.052±0.012)%、(3.683±0.031)%和(9.392±0.028)%;48 h的抑制率分别是(20.578±0.058)%、(12.245±0.021)%和(12.010±0.012)%;72 h的抑制率分别是(3.324±0.007)%、(9.570±0.018)%和(6.705±0.012)%。含EHHM的培养基培养LO2细胞的各个时间段的OD值与对照比较,差异无统计学意义(P > 0.05),说明EHHM对LO2细胞增殖无影响。
2.3 不同浓度的EHHMr溶液对肝癌HepG2细胞生长过程的影响
根据不同浓度的EHHM分别作用于肝癌细胞系HepG2细胞和正常肝脏LO2细胞1、2、3、4、5、6、7 d后绘制的生长曲线图(图1~3),结果显示:随着EHHM 0.1 μg/mL培养基浓度的增大,肝癌细胞系HepG2细胞数相对数值呈增加趋势,而正常肝脏LO2细胞的细胞数相对数值呈下降趋势;EHHM对肝细胞癌细胞系HepG2生长过程有明显的抑制作用,并且随着浓度增加,其抑制作用更明显,但是对LO2细胞的無明显抑制作用。
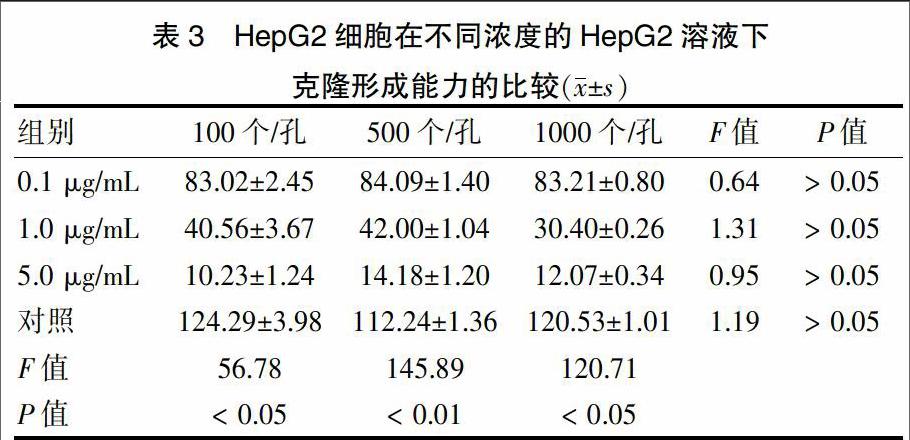
2.4 HepG2细胞在不同浓度的EHHM溶液下克隆形成能力的比较
在同一孔中,不同EHHM浓度下的HepG2细胞的克隆形成率间差异均有统计学意义(P < 0.05),且随浓度增高,抑制能力越强;但在相同浓度下,不同细胞数的克隆形成率间差异无统计学意义(P > 0.05)。见表3。
3 讨论
目前,恶性肿瘤已经严重威胁到人类的身体健康,给人类带来了巨大的经济负担和精神压力。肿瘤的防治也成为世界范围内广泛重视的课题,世界各国每年投入了大量人力、物力进行研究。其中,原发性肝癌(PLC)更是一种较常见的恶性肿瘤[10],有90%属于肝细胞性肝癌(HCC),HCC在全球范围内均存在较高的发病率和病死率[11]。而在我国南方部分城市,HCC的发病率和病死率更是世界水平的3~4倍,严重影响我国人民健康水平[12]。肝癌的病因及确切分子机制尚不完全清楚,目前认为其发病是多因素、多步骤的复杂过程,受环境和因此双重因素影响。而针对恶性肿瘤这类疾病尚缺乏理想安全的治疗药物[13]。近年,随着科技的不断发展,近年来,研究者已将目光转向天然植物,希望从中寻找新的抗肿瘤药物[14],这已逐渐成为新药研究的主要发展方向之一[15]。
传统中医认为,蒲葵可用于治疗各种癌症。国内外研究均发现蒲葵提取物在抑制肝细胞癌上有明显疗效[16-17]。国内报道中发现,蒲葵的乙醇提取物,对宫颈癌细胞株Hela、人胃癌细胞株SGC7901和人肝癌细胞株Bel7402等三种癌细胞均有一定的抑制作用,具有一定的抗癌活性[18-19]。同时,国外也有报道[20],蒲葵的水提取物对鼠成纤维瘤细胞、人乳腺和结肠癌细胞具有体外抑制作用,且抑制效果较为明显。在动物实验中发现,其对小鼠模型的成纤维细胞瘤有较好的治愈效果,且未显示毒性作用。
本研究采用三种不同的实验方法,研究了EHHM在体外抗肿瘤的作用。其中MTT法对的结果表明,EHHM对肝癌细胞系HepG2细胞呈现抑制作用,在给药24 h内效果明显,EHHM溶液浓度越高对HepG2细胞的抑制作用越大,其中在浓度为5.0 μg/mL时,时间为48 h时,抑制率最大,为48.959%;同时,EHHM对正常肝细胞LO2无明显抑制作用,表明EHHM对正常肝细胞无毒副作用。生长曲线法可以清晰显示EHHM对HepG2细胞的抑制随着浓度和时间增加而增加,而对正常肝细胞LO2无明显抑制作用。利用平皿克隆实验发现,随着EHHM溶液浓度的增加,对肝癌细胞系HepG2细胞的抑制能力越大。总之,MTT法、生长曲线法和平皿克隆实验均提示EHHM对肝癌细胞癌细胞系HepG2的有明显的抑制作用,且抑制效果随着药物浓度和时间效应增加而相应增高。三种实验方法结果基本一致,验证了EHHM的对HepG2细胞的生长抑制效果。
由于药物对癌细胞的生长抑制作用是一个相对比较复杂的过程,有膜受体途径、电机制等等。本研究仅仅对EHHM对肝癌细胞系HepG2细胞的抑制用进行了验证,但是仍未揭示其内在的作用机制。因此,对于后来的研究者,可以针对EHHM对HepG2细胞的生长抑制的机制做进一步的研究。
综上所述,肿瘤可以通过过度生长,造成局部组织压迫和侵袭破坏,对机体产生危害。而针对肝癌患者的治疗,传统上主要通过手术及化疗治疗,但效果一直不佳。本研究表明,EHHM对肝癌细胞的生长、增殖以及侵袭能力有明显的抑制作用,对正常细胞不具有抑制作用,因此EHHM可能是潜在的一种无毒副作用的新型抗癌治疗药物,具有一定的药用价值。不过,针对EHHM抗肝癌的临床应用仍需要进一步的基础研究作为支撑。
[参考文献]
[1] 张金坤,王燕燕.原发性肝癌发生机制及其治疗的研究进展[J].中国药房,2015,2(29):4171-4173.
[2] 刘蒙,董卫国.原发性肝癌非手术治疗的研究进展[J].世界华人消化杂志,2009,7(12):1224-1228.
[3] 陈艳,林新华,李少光,等.葵子的体外抗癌活性[J].福建医科大学学报,2008,42(2):93-95.
[4] 黄月凤,许海婷,陈平,等.蒲葵籽的化学成分及其抗癌活性成分研究[J].海峡药学,2011,23(4):38-40.
[5] 肖剛.中医治疗恶性肿瘤用药例举[J].中国城乡企业卫生,2016,(6):97-98.
[6] Liu ZP,Cui JG,Liu HX,et al. Chemical constituents from leaves of Livistona chinensis [J]. Guihaia,2007,27(1):140-142.
[7] 王坤,祝葆华,王宏强,等.低氘水对肝癌HepG2细胞增殖和侵袭能力的抑制作用[J].广东医学院学报,2013,31(3):241-244.
[8] 宋维华,许超迁,孙建平,等.MTT法测定矿物质提取物MICOM及中药提取物AN4的体外抗肿瘤活性[J].哈尔滨医科大学学报,2001,35(6):402-403.
[9] Li X,Pan Y,Fan R,et al. Adenovirus-delivered CIAPIN1 small interfering RNA inhibits HCC growth in vitro and in vivo [J].Carcinogenesis,2008,8(29): 587-1593.
[10] 郑莹,李德錄,沈玉珍,等.上海市原发性肝癌流行状况和趋势分析[J].外科理论与实践,2004,9(4):292-294.
[11] 高静,吴春晓,谢丽,等.上海市2006-2008年原发性肝癌发病及死亡资料分析[J].肿瘤,2012,32(7):526-530.
[12] 廖颖,张桂萍,李祖茂.南充地区恶性肿瘤45411例临床分析[J].广东医学,2015,11(22):3526-3529.
[13] 王闻楚.E-cadherin通过Notch信号通路介导前列腺癌耐药的分子机制[D].南宁:广西医科大学,2015.
[14] 杨华升,李秀惠,钱英.中医药治疗原发性肝癌的现状与思考[J].中西医结合肝病杂志,2015,25(6):373,376.
[15] Sartippour Maryam R,Liu CH,Shao ZM,et al. Livistona extract in-hibits angiogenesis and cancer growth [J]. Oncol Reports,2001,8(6):1355.
[16] Cheung S,Tai J. In vitro studies of the dry fruit of Chinese fan palm Livistona Chinensis [J]. Oncology Reports,2005,14(5):1331.
[17] 方鲲鹏,章社民,钱叶本,等.Talin-1与原发性肝癌的侵袭和迁移[J].肝胆外科杂志,2014,13(6):464-470.
[18] 朱岳麟,陈少丽,冯利利,等.蒲葵籽乙醇提取物化学成分及抗癌活性分析[J].化学与生物工程,2007,10:35-37.
[19] 李芳飘.原发性肝癌手术治疗效果分析[J].实用癌症杂志,2015,9(1):72-75.
[20] Schierbeck H,Pullerits R,Pruunsild C,et al. HMGB1 levels are increased in patients with juvenile idiopathic arthritis,correlate with early onset of disease,and are independent of disease duration [J]. Journal of Rheumatology,2013,40(9):1604-1613.
