盐肤木对重金属铬胁迫的生理生化反应研究
2017-05-10陈晶穆燕陈明李明浩赵薇薇汤才国黄胜威詹福如
陈晶, 穆燕, 陈明, 李明浩, 赵薇薇, 汤才国, 黄胜威,*, 詹福如,*
盐肤木对重金属铬胁迫的生理生化反应研究
陈晶1,2, 穆燕1, 陈明1, 李明浩1, 赵薇薇1, 汤才国1,2, 黄胜威1,*, 詹福如1,*
1.中国科学院离子束生物工程学重点实验室, 国家林业局能源林研究中心, 合肥230031 2.中国科学技术大学生命科学学院, 合肥 230027
通过土培试验研究了不同质量浓度的重金属铬(0、30、50、80 mg·kg–1) 胁迫对盐肤木根长、茎长、地上及地下部分干重,叶绿素、丙二醛、脯氨酸含量,超氧化物歧化酶(SOD)、过氧化氢酶(CAT) 活性的影响,探究了铬胁迫下盐肤木对铬的生理生化响应和耐受能力,为应用盐肤木修复重金属铬污染土壤提供依据。研究结果表明,在重金属铬胁迫下,盐肤木叶片的叶绿素含量略有降低,丙二醛含量升高。当铬浓度低于50 mg·kg–1时,随浓度升高,盐肤木叶片的脯氨酸含量、SOD和CAT活性均升高。当铬浓度为80 mg·kg–1时,其含量和活性相对下降,但对其正常生长均无显著影响,说明盐肤木耐受铬的能力较强,作为重金属污染地恢复的先锋植物具有很好的应用前景。
盐肤木; 铬胁迫; 丙二醛; 脯氨酸; 植物修复; 重金属污染
1 前言
土壤重金属污染影响植物的生长发育、农作物品质,会通过食物链传递给动物,破坏生物体的正常生理代谢活动,危害人体健康[1]。减少重金属污染、保护生态环境和人民健康迫在眉睫。重金属污染修复可分为工程修复、物理修复、化学修复和生物修复四大类[2]。植物修复具有经济成本低、环境价值高、具有生态景观效应等优点,尤其适用于低浓度重金属的去除,在环境污染治理中占据着重要地位[3]。
盐肤木为漆树科盐肤木属落叶小乔木,在我国境内分布广泛,资源丰富,是我国主要经济树种[4–5]。盐肤木适应能力强,耐干旱、耐贫瘠,根蘖力强,是重要的造林及园林绿化树种[6–7]。盐肤木不仅抗逆性强,而且单位面积生物量大,成片栽植年累计采青可达4吨/亩,收获后并妥善处理后可有效清除土壤中的污染物,是重金属污染地恢复的先锋植物,在锰、铀尾矿渣重金属污染物和镭- 226污染土壤修复中显示了良好的应用前景[8–10]。
重金属对植物生理生化变化及其本质影响的研究越来越多,但多数集中于小麦、玉米等农作物和蔬菜等作物上,对重金属胁迫下盐肤木等林木树种的生理指标变化、耐性机理方面报道不多,还有待加强[11]。因此,开展对盐肤木的重金属耐受性研究,一方面丰富植物对重金属耐受性的机理机制,指导植物重金属耐性品种的选育,还可以为重金属污染土壤的生物修复提供借鉴和参考。本研究选用盐肤木作为重金属铬污染的修复植物,发现其对铬的耐受性强,在重金属胁迫下,生长相对正常,富集能力强,具有很大的研究价值和应用前景。
2 材料与方法
2.1 供试植物和土壤
供试植物: 试验所用植物为盐肤木; 所用盐肤木种子采收于中国科学院合肥物质科学研究院技术生物与农业工程研究所试验田。
供试土壤: 试验所用土壤采自于中国科学院合肥物质科学研究院技术生物与农业工程研究所试验田,土壤性质如表1所示。土壤采回后放于干净实验台上风干,风干后敲碎,去除大颗粒杂质,研磨,过2 mm不锈钢筛,拌匀备用。
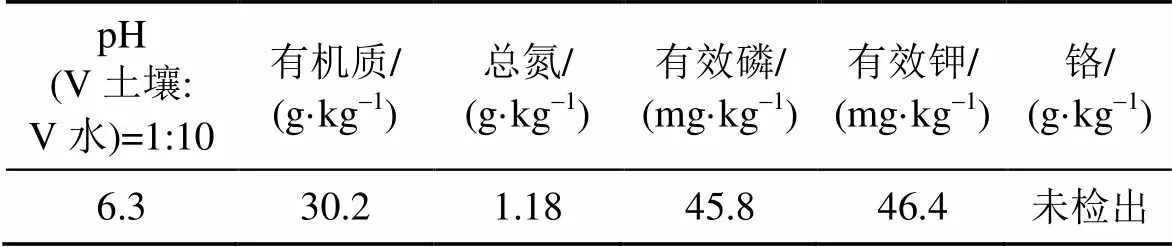
表1 供试土壤的基本性质
2.2 主要实验试剂
10% H2O2(w:w) 溶液,3 mmo1·L-1Ca(NO3)2。
2.3 试验方法
2.3.1 植物培养
将供试盐肤木种子在10% H2O2(w:w) 溶液中消毒15 min,再用双蒸水冲洗,浸泡在3 mmo1×L-1Ca (NO3)2中6 h,再转移至培养箱中避光发芽。培养两周后,植物幼苗用于实验。
2.3.2 盆栽设置
实验在恒温培养室中进行。室温(26±2) ℃,光照强度5000 1x—6500 1x。称取风干土壤3 kg,装入直径20 cm,高15 cm瓷花盆中。重金属铬 (Ⅵ) 浓度设定分别为CK (0 mg·kg-1),T1 (30 mg·kg-1),T2 (50 mg·kg-1) 和T3 (80 mg·kg-1),用H2Cr2O7分析纯试剂配制水溶液一次性加入土壤中至指定浓度,充分混匀。
2.3.3 试验处理
上述盆栽实验中,重金属加入土壤后,加入双蒸水使土壤含水量保持在60%—70%,平衡2周后移入筛选植物幼苗,每盆种植3株盐肤木幼苗。盆栽过程中,每2 d随机改变盆的方向。每个处理设置3个平行,并设置无植物对照组,盆栽时间为60 d。
2.3.4 植物样品采集
盆栽实验结束后,各处理盐肤木分为根部和地上部分分别收获。取土后的根系用蒸馏水冲洗,再用滤纸吸干附着的水分。根系和地上部分在80℃干燥12 h,称其干重。
2.3.5 生理化指标测定
(1) 生物量测定
收获植物时,根长和茎长采用直尺直接测定,从植物根部与茎部交界处分别测量,单位cm,测量精度0.01 cm。生物量测定采用干燥后的植物样品,分别用电子天平测定根部和地上部分干重,单位g,测量精度0.0001 g。
(2) 植物叶片叶绿素测定
每株盐肤木上、中、下部三个部位各取一片新鲜叶片,采用SPAD-502叶绿素含量测定仪 (浙江托普仪器有限公司)测定叶绿素相对含量。
(3) 植物丙二醛(Malonaldehyde content,MDA)和脯氨酸含量测定
丙二醛含量测定采用硫代巴比妥酸法测定[12]。脯氨酸含量采用磺基水杨酸法[13]测定。
(4) 植物体内抗氧化酶系测定
过氧化氢酶(CAT) 活性采用紫外吸收法测定。以每分钟内D240减少0.1的酶量为1个活性U; 超氧化物歧化酶(SOD) 活性测定采用氮蓝四唑(NBT) 法[14],以抑制氮蓝四唑光化还原50% 做为一个活性U表示。
2.4 数据处理
取3组平行样数据平均值,数据采用SPSS18.0统计软件进行处理和数据分析。
3 结果与分析
3.1 重金属铬胁迫对盐肤木生长的影响
本试验表明,低浓度铬胁迫对盐肤木的生长无明显抑制效应,高浓度铬胁迫可以抑制盐肤木生长(图1)。随着土壤中铬浓度的增加,盐肤木的根长、茎长、地上部分干重以及地下部分干重均逐渐降低。当铬浓度分别为30 mg·kg-1、50 mg·kg-1时,盐肤木的根长分别比对照降低了3. 31%、5. 21%,茎长分别比对照降低了4. 25%、6. 90%,地上部分干重分别比对照下降了5.65%、9. 46%,地下部分干重分别比对照下降了2.87%、4.66%,但与对照相比,均无显著性差异 (>0.05)。低浓度的重金属铬对于盐肤木的生长虽有不同程度的抑制作用,但影响不显著,显示盐肤木对于重金属具有较强的耐受性。但是,当土壤中铬浓度达到80 mg·kg-1时,茎长与对照相比降低16.34%,地上部分干重比对照下降21.42%,地下部分干重比对照下降25.55%,与对照相比存在显著性差异 (<0.05),表明土壤中铬含量为80 mg·kg-1时,已经超出了盐肤木的耐受极限,对其生长发育造成了极大破坏。
3.2 铬胁迫对盐肤木生理特征的影响
叶绿素是植物光合作用的物质基础,其含量高低是判定植物光合作用强弱的一个重要生理指标。从图2 (a)可以看出,随着铬胁迫浓度的增加,盐肤木叶绿素含量缓慢降低。当铬浓度分别为30 mg·kg-1、50 mg·kg-1、80 mg·kg-1时,盐肤木叶绿素含量分别比对照降低了5.93%、5.43% 和 9.79%,但与对照相比,均无显著性差异 (>0.05)。重金属胁迫降低叶绿素含量的原因是由于重金属抑制原叶绿素酸脂还原酶的合成[15]。李海茹[16]对日本楤木的研究表明,在20 mg·kg-1镉胁迫条件下,日本楤木体内叶绿素含量比对照降低5.15%。黄斌等[17]研究表明,土壤中铬浓度达到20 mg·kg-1时,李氏禾体内叶绿色含量降低了50% 以上,生长发育严重受阻。本研究中,三种铬浓度胁迫条件下,叶绿色含量虽然降低但是与对照相比并无显著性差异,表明重金属铬胁迫对盐肤木叶绿素含量影响并不显著。
植物在逆境中,细胞原生质膜中的不饱和脂肪酸会发生过氧化作用产生丙二醛(MDA)。重金属是脂质过氧化的诱变剂,促进脂质过氧化产物丙二醛积累。MDA 含量是反映膜脂过氧化水平的一个指标。从图2 (b)可以看出,重金属处理条件下,盐肤木的MDA含量表现出上升的趋势,且MDA含量和铬浓度呈明显正相关。当铬浓度分别为30 mg·kg-1、50 mg·kg-1、80 mg·kg-1时,盐肤木MDA含量分别比对照增加了308.86%、518.35% 和738.61%,与对照相比均存在显著性差异 (<0.05),且高浓度铬胁迫条件下过氧化作用大于低浓度铬胁迫。王爱国等[17]的研究表明在逆境条件下,丙二醛含量升高反映了植物遭受重金属伤害的程度。植物体内活性氧产生和清除系统受到破坏,所积累的活性氧能引发膜脂过氧化作用。土壤中铬浓度达到20 mg·kg-1时,李氏禾体内MDA含量与对照相比升高了194.24%[18],生长发育受到明显抑制。在50 mg·L-1铬胁迫条件下,白皮松叶体内MDA含量比对照升高了126.1%[19]。本研究中铬胁迫条件下丙二醛含量的升高,表明在重金属铬处理条件下,尤其是80 mg·kg-1浓度铬胁迫条件下,盐肤木体内的抗氧化防御能力遭到了严重破坏,其生长发育也受到了一定影响。
脯氨酸作为重要的渗透调节物质,它的积累对逆境适应有重要意义,脯氨酸含量的增加可能是植物对重金属的耐受机制之一[19–23]。当铬浓度分别为30 mg·kg-1、50 mg·kg-1、80 mg·kg-1时,盐肤木脯氨酸含量分别比对照增加了347.82%、647.82%和 439.13%,与对照相比存在显著性差异 (<0.05)。低浓度铬条件下(0—50 mg·kg-1),脯氨酸质量分数随着铬浓度升高而增大,而在铬浓度达80 mg·kg-1时,脯氨酸质量分数相对下降,说明环境中铬浓度为80 mg·kg-1时,已经超过盐肤木的抗性强度临界值,表现为脯氨酸相对含量降低,根和茎的生长发育也受到抑制。Schat等[24]的研究表明,重金属胁迫下,脯氨酸稳定生物大分子结构,使细胞和组织持水平衡,作为渗透调节物质保持膜结构的完整性使细胞免受伤害。对铬胁迫条件下罗汉果生理指标变化的研究表明,铬胁迫可以显著增加罗汉果体内脯氨酸含量,在低浓度 (50 μmol·L-1) 铬处理条件下,罗汉果幼苗脯氨酸含量增加了100.86%; 当铬的浓度提高到200 μmol·L-1时,罗汉果幼苗中脯氨酸的含量与对照比上升了627.02%[25]。本研究中,铬胁迫条件下,盐肤木体内脯氨酸含量的增加,可能作为贮氨的一种形式,以减轻过多的游离氨积累造成的对植物的毒害,提高盐肤木对逆境的耐受性。
3.3 铬胁迫对盐肤木超氧化物歧化酶(SOD)、过氧化氢酶(CAT) 活性的影响
从图3可以看出,铬处理条件下,随着土壤中铬浓度增加时,盐肤木SOD活性也随之增加,但当铬到达一定浓度后,又出现轻微下降。当铬浓度分别为30 mg·kg-1、50 mg·kg-1、80 mg·kg-1时,盐肤木SOD活性分别比对照增加了7.92%、57.0%和 51.13%,与对照相比存在显著性差异(<0.05)。SOD是重要的活性氧清除酶,与植物生物和非生物胁迫抗性有很重要的关系。对水稻[26]、狭叶羽扇豆[27]、烟草[28]等的研究,发现在盐害环境下 SOD 活性升高。SOD 的表达量高低活性的强弱直接决定了植物的抗逆性[29]。Zn浓度为500 mg·L-1的胁迫条件下,白皮松体内SOD酶活增加了78.72%,但是铬浓度为50 mg·L-1的胁迫条件下,白皮松体内SOD酶活与对照相比,不仅没有增加,反而降低了50.93%,表明白皮松对铬的耐受性要低于对Zn的耐受性[19],且其对铬的耐受性也低于盐肤木。本研究中,当铬浓度为80 mg·kg-1时,SOD活性相对下降,表明高浓度铬胁迫条件下,铬在盐肤木体内的不断累积导致了大量的自由基的产生,白由基的积累水平超过了SOD的清除能力,使盐肤木受到膜脂过氧化伤害,生长发育受到一定的抑制。
过氧化氢酶(CAT) 是在生物演化过程中建立起来的生物防御系统的关键酶之一,其生物学功能是催化细胞内过氧化氢分解,防止过氧化,在生物与非生物逆境中维持生物体内的氧化平衡[30]。铬胁迫条件下,盐肤木体内CAT活性表现为增加。当铬浓度分别为30 mg·kg-1、50 mg·kg-1、80 mg·kg-1时,盐肤木CAT活性分别比对照增加了5.64%、22.09%和 21.35%,与对照相比存在显著性差异 (<0.05)。铬胁迫条件下,李氏禾体内CAT酶活性也表现为增加,20 mg·L-1铬胁迫条件下,CAT酶活性与对照相比增加了120.68%,表明在重金属铬引起的胁迫反应中,CAT发挥了重要作用[13]。此外,本研究中铬胁迫浓度较低时植物体内CAT活性增速较快,而当铬浓度增加到一定水平时,CAT增速减缓,表明高浓度的铬胁迫 (80 mg·kg-1) 已经超出了盐肤木的耐受性,更高浓度的铬胁迫会盐肤木体内的多种功能膜及酶系统受到一定程度的破坏,严重影响其生长发育。
4 讨论
本试验结果表明,在低浓度重金属铬 (0—50 mg·kg-1)的胁迫下,盐肤木的生物发育并未受到明显抑制。铬胁迫条件下,盐肤木丙二醛含量、脯氨酸含量、SOD活性、CAT活性也随之升高,提高植物对逆境的抗性。根长、茎长及干重与对照相比,均无显著性差异。综合实验结果,盐肤木对重金属铬的积累和耐受性强,在重金属胁迫下,生长相对正常,在植物修复重金属污染方面具有很大的研究价值和应用前景。
[1] BEGUM A, AMINMD N. Selected elemental compositon of the muscle tissue of three species of fish,,and, from the fresh water Dhanmondi Lake in Bangladesh[J]. Food Chemistry. 2005 (93): 439–443.
[2] 陈磊,胡敏予. 重金属污染土壤的植物修复技术研究进展[J]. 化学与生物工程,2014,31 (4): 6–8.
[3] 王玉富,郭媛,汤清明, 等. 亚麻修复重金属污染土壤的研究与应用[J]. 作物研究,2015,29 (4): 443–448.
[4] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1999.
[5] hUH j e, lEE e o, kIM m s, et al. Penta-- galloyl-beta-- glucose suppresses tumor growth via inhibition of angiogenesis and stimulation of apoptosis: roles ofcyclooxygenase-2 and mitogen-activated protein kinase pathways[J]. Carcinogenesis,2005,26 (8): 1436–1445.
[6] 刘春强. 盐肤木基础研究与利用[J]. 中国林业,2008,12A (23): 53–55.
[7] 任宪威. 树木学[J]. 北京: 中国林业出版社, 1997: 425.
[8] 向言词, 冯涛, 曾荣今, 等. 利用植物阻控铀尾矿渣重金属移迁的方法. 专利公告号: CN101491810.
[9] 严明理,冯涛,刘阿梅,等. 一种促进常绿乔木在锰矿退化区生长的方法. 专利公告号: CN102511279.
[10] 丁德馨,胡南,李广悦,等. 一种利用功能植物群落修复226Ra污染土壤的方法. 专利公开号: 103495595A.
[11] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社,1999.
[12] 鲍士旦. 土壤农化分析[M]. 第3版. 北京院中国农业出版社,2000.
[13] 郝再彬,苍晶,徐仲. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社,2004.
[14] 曲敏,秦丽楠. 两种检测SOD酶活性方法的比较[J]. 食品安全质量检测学,2014,5 (10): 3318–3323.
[15] STOBART A K, GRIFFITHS W T. The effect of Cd2+on the biosynthesis of chlorophyll in leaves of barley[J]. Physiologia Plantarum, 1985, 63 (3): 293–298.
[16] 李海茹. 日本惚木对土壤重金属的抗性研究[D]. 天津: 天津理工大学图书馆,2013.
[17] 王爱国,罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯,1990,26 (6): 51–57.
[18] 黄斌,张达,李洋,等. 铬污染对李氏禾生理指标的影响[J]. 东北农业大学学报,2012,43 (1): 121–126.
[19] 周军. 重金属离子锌和铬对白皮松针叶和茎电阻抗图谱参数及生理指标的影响[D]. 保定: 河北农业大学图书馆, 2011.
[20] RUDOLPH A S, CROWE J H, CROWE L M. Effects of three stabilizing agents--proline,betaine,and trehalose--on membrane phospholipids[J]. Archives of Biochemistry and Biophysics, 1986, 245(1): 134–143.
[21] ARAKAWA T, TIMASHEFF S N. The stabilization of proteins by osmolytes[J]. Biophysical Journal, 1985, 47 (3): 411–4.
[22] ANJUM I, RISHI V, AHMAD F. Compatibility of osmolytes with Gibbs energy of stabilization of proteins. Biochimica et BiophysicaActa[J]. Protein Structure and Molecular Enzymology, 2000, 1476 (1): 75–84.
[23] MATYSIK J, BHALU B. Molecular mechanisms of quenching of reactive oxygen species by proline under stress in plant[J]. Current Science, 2002, 82 (5): 525–532.
[24] SCHAT H, SHARMA S S. Heavy metal induced accumulation of free proline in a metal-tolerant and a nontolerant ecotype of[J]. Physiologic Plant, 1997, 101: 477–482.
[25] 张永霞,石贵玉,李霞, 等. 铬胁迫对罗汉果幼苗生理生化指标的影响[J]. 中国农学通报2011,27 (2): 12–16.
[26] HAH C K, KIM J P, JUNG J. Induction of antioxygenic enzymes as defense systems in plant cells against low temperature stress: Mn2+-induced SOD activation and enhancement of cold tolerance in rice seedlings[J]. Agricultural Chemistry and Biotechnology, 1991, 34 (2): 168–173.
[27] YU Q, RENGEL Z. Drought and salinity differentially influence activities of superoxide dismutases in narrow-leafed lupins[J]. Plant Science, 1999, 142 (1): 1–11.
[28] YU Q, OSBORNE L D, RENGEL Z. Increased tolerance to Mn deficiency in transgenic tobacco overproducing superoxide dismutase[J]. Amals of Botany, 1999, 84: 543–547.
[29] 覃鹏,刘飞虎,梁雪妮.超氧化物歧化酶与植物抗逆性[J]. 黑龙江农业科学, 2000(1): 31–34.
[30] 黄永洪,花慧. 猪肝过氧化氢酶提取条件的研究[J]. 生物技术通讯, 2005, 16 (1): 40–42.
Response of physiology and biochemistry ofto heavy metal chromium stress
CHEN Jing1,2, MU Yan1, CHEN Ming1, LI Minghao1, ZHAO Weiwei1, TANG Caiguo1,2, HUANG Shengwei1,*, ZHAN Furu1,*
1. Key Laboratory of Ion Beam Bioengineering, Hefei Institutes of Physical Science, Chinese Academy of Sciences, Bioenergy Forest Research Center of State Forestry Administration, Hefei 230031, China 2. School of Life Sciences, University of Science and Technology of China, Hefei 230027, China
A soil culture experiment was carried out to study the effectiveness of root length, stem length, dry weight of above and underground, the content of chlorophyll, malonyldialdehyde, proline, and the activity of superoxide dismutase (SOD), catalase (CAT) ofafter treated with different concentrations of chromium solution (0 mg·kg–1, 30 mg·kg–1, 50 mg·kg–1, 80 mg·kg–1).The physiological and biochemical responses and tolerance ofto chromium stress were investigated to provide a basis for application ofin repairing chromium contaminated soil. The results showed that the content of chlorophyll ofdecreased and MDA increased under chromium stress. When the concentration of chromium was 0-50 mg·kg–1, the content of proline, the activity of SOD and CAT increased with the increasing of the concentration of chromium, and relatively decreased when the concentration of chromium was up to 80mg·kg–1.However, it had no significant effect on normal growth ofThe results indicated that the's tolerance to chromium was strong, and it had good application prospect in ecological restoration of heavy metal contaminated soils as pioneer plants.
; chromium stress; malonyldialdehyde; proline; phytoremediation; heavy metal contaminated
10.14108/j.cnki.1008-8873.2017.02.004
Q14
A
1008-8873(2017)02-026-06
2015-10-23;
2015-12-22
林业公益性行业科研专项(201404110), 国家自然科学基金资助项目(11375232), 合肥物质科学中心培育项目(2012FXCX006)
陈晶(1992—), 女, 安徽池州人, 硕士, 主要从事能源植物抗逆研究, E-mail: jingchen@mail.ustc.edu.cn
黄胜威, 男, 博士, 助理研究员, 主要从事林木抗逆基因鉴定及分子育种研究, E-mail: swhuang@ipp.ac.cn
詹福如, 男, 博士, 研究员, 主要研究离子束技术及其应用, E-mail: zfr@ipp.ac.cn
陈晶,穆燕,陈明,等. 盐肤木对重金属铬胁迫的生理生化反应研究[J]. 生态科学,2017,36(2): 26-31.
CHEN Jing,MU Yan,CHEN Ming,et al. Response of physiology and biochemistry ofto heavy metal chromium stress [J]. Ecological Science,2017,36(2): 26-31.
