Apatinib联合5-Fu协同抑制乳腺癌MCF-7细胞的体外研究
2017-05-10安改丽黄尚科赵新汉
安改丽 李 旭 冯 璐 黄尚科 白 俊 赵新汉
Apatinib联合5-Fu协同抑制乳腺癌MCF-7细胞的体外研究
安改丽 李 旭 冯 璐 黄尚科 白 俊 赵新汉
目的 探讨阿帕替尼(Apatinib)联合5-氟尿嘧啶(5-Fu)对乳腺癌 MCF-7 细胞的抑制作用。方法 采用人乳腺癌细胞株MCF-7,首先采用MTT法及应用流式细胞仪测定不同浓度apatinib作用后对其细胞增殖和周期的影响,其次将MCF-7细胞分为4组,即对照组、Apatinib单药组、5-Fu单药组、Apanitib+5-Fu联合组。对各组细胞给予相应药物处理,48 h后分别应用流式细胞仪检测各组药物对 MCF-7 细胞株凋亡的作用。结果 Apatinib单药对MCF-7细胞有增殖抑制作用,且存在时间剂量依赖关系,而对其细胞周期影响不大。与对照组相比,Apatinib联合5-Fu作用后有协同诱导凋亡作用,经流式细胞仪检测,Apatinib组诱导的细胞凋亡率为12.05%,5-Fu组为25.76%。与单药组比,Apatinib+5-Fu联合组凋亡率升高更为明显,达34.90%(P< 0.05)。结论 Apatinib和5-Fu的联合应用在体外协同抑制乳腺癌MCF-7细胞并诱导凋亡,使抗肿瘤活性显著增强。
阿帕替尼;;5-氟尿嘧啶;MCF-7;细胞增殖;细胞凋亡
(ThePracticalJournalofCancer,2017,32:702~705)
乳腺癌是女性最常见的恶性肿瘤之一,严重威胁女性的生活质量和身心健康。在我国,乳腺癌的发病率逐年上升,尤其是在农村地区,乳腺癌的致死率极高[1]。乳腺癌分子靶向治疗是指针对乳腺癌发生、发展有关的癌基因表达产物和信号通路进行治疗。肿瘤新生血管生成在乳腺癌的发生、发展过程中起到了重要作用,因此抗肿瘤血管生成已成为肿瘤治疗的1个重要的靶点,也是近年来抗肿瘤治疗领域研究的热点。甲磺酸阿帕替尼片是口服小分子酪氨酸激酶抑制剂,靶向血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2),发挥抗肿瘤血管生成作用。临床前研究及临床试验均证实其对多种小鼠肿瘤模型的肿瘤生长以及对多种实体瘤均有抑制作用[2]。从肿瘤的发生、血管新生等多方面入手来抑制肿瘤,可以提高抗肿瘤效果。靶向治疗与化疗联合的生物化疗模式成为乳腺癌治疗的新焦点,因此本实验旨在研究新型抗肿瘤血管生成药物apatinib与经典化疗药物5-Fu联合对乳腺癌MCF-7细胞凋亡的影响,为其临床联合用药提供体外实验的理论依据。
1 材料与方法
1.1 实验材料
人乳腺癌细胞株MCF-7(西安交通大学医学院医学中心实验室惠赠);阿帕替尼(Apatinib)(江苏恒瑞公司);5-Fu(江苏倍达医药科技有限公司),DMEM培养基(美国GIBCO公司);胎牛血清(以色列Biological Industries公司);噻唑兰(MTT)(美国sigma公司);二甲基亚砜(DMSO)(美国sigma公司);Annexin V-APC/7-AAD双染凋亡试剂盒(深圳晶美生物公司);细胞培养箱(美国Thermo公司);Genios 多功能酶标仪(美国TECAN公司);FACScan 流式细胞仪(美国BD公司);电泳和转膜装置(美国BIO-RAD 公司);Odyssey 双色红外荧光成像系统扫描仪(美国LI-COR公司产品);倒置显微镜(DXM1200)(日本Nikon 公司)。
1.2 方法
1.2.1 细胞培养 对乳腺癌细胞MCF-7采用含10%小牛血清的DMEM培养基进行培养,于37 ℃、5% CO2饱和湿度培养箱内培养,待其贴壁生长至70%~80%时,用0.25%胰蛋白酶消化传代。取对数生长期的细胞进行后续实验。
1.2.2 药物稀释方法 将Apatinib药物用100 % DMSO溶解配置成母液,保存于-20 ℃条件下。实验用时稀释,使DMSO溶液终浓度<0.5%,不影响细胞生长。
1.2.3 药物干预分组 共分为4组,根据文献资料回顾及预实验结果分别设:空白对照组、apatinib单药组、5-FU单药组、apatinib+5-FU联合组4组。检测细胞增殖抑制率时apatinib浓度为:2.5、5、10、20、40 μmol/L,检测细胞周期时apatinib浓度为:0、2、4、8 μmol/L,检测细胞凋亡时apatinib单药组浓度为5 μmol/L,5-FU单药组浓度为2 μg/mL,联合组中药物所加的浓度与单药组相同,对照组不加任何药物做参考。
1.2.4 检测项目及方法 MTT法检测细胞活性,计算细胞抑制率。取对数生长期的乳腺癌细胞MCF-7(5 000个细胞/孔)接种于96孔板上,每孔加入100 μl细胞悬液,培养24 h后,倾去培养基,将经处理的不同浓度(2.5、5、10、20、40 μmol/L)的阿帕替尼分别加入孔内,每组设6个复孔,每孔加100 μl。以与实验组中含有最大浓度DMSO的培养液为空白对照组,不含细胞的无血清培养基为调零孔,分别于培养24、48、72 h后每孔加入MTT溶液(5 mg/mL)10 μL,继续孵育4 h后终止培养,小心吸去药液及培养液,每孔加入DMSO 150 μL,振荡10 min,充分溶解结晶物。用酶标仪在490 nm处测定OD值。细胞抑制率(%)=(1-试验孔平均OD值/对照孔平均OD值)×100%,根据上述结果绘制细胞生长抑制率曲线。所有实验均重复3次。
流式细胞仪检测细胞周期:取对数生长期的MCF-7细胞,以2 mL/孔接种至6孔板内,使细胞终浓度为2×105/ml,DMEM培养基孵育24 h后,实验组分别加入不同浓度的apatinib(0,2,4,8 μmol/L),每组设3个复孔,然后置于37 ℃、5% CO2饱和湿度培养箱内培养48h后,收集各处理组细胞,用4 ℃预冷的PBS洗涤细胞2次,弃去上清,用预冷的70%乙醇固定,4 ℃保存,检测前去除固定液,加入RNA酶工作液及碘化丙啶,4 ℃避光染色30 min,过300目滤网后上流式细胞仪,数据经计算机处理,分析得出细胞周期各时相比例,所有试验均重复3次。
流式细胞仪检测细胞凋亡:取对数生长期的MCF-7细胞,以2 mL/孔接种至6孔板内,使细胞终浓度为2×105/ml,含10%胎牛血清的DMEM培养基孵育24 h后,实验组分别加入apatinib、5-FU单药及两药联合,对照组不加任何药物作为参考,每组设3个复孔,然后置于37 ℃、5% CO2饱和湿度培养箱内培养48 h后,以不含EDTA的胰酶消化各处理组细胞并收集,用4 ℃预冷的PBS洗涤细胞2次,离心后弃去上清,加入500 μl的Binding Buffer悬浮细胞,分别加入5 μl Annexin V-APC和5 μl的7-AAD染液,混匀室温避光放置15 min后上流式细胞仪检测,所有试验均重复3次。
1.3 统计学处理
应用SPSS 18.0统计分析软件进行分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 apatinib对MCF-7细胞毒作用
MTT法检测apatinib对MCF-7细胞毒作用,结果发现,不同浓度的apatinib作用于MCF-7乳腺癌细胞24~72 h后,其生长抑制率见表1,绘制生长抑制曲线如图1,提示阿帕替尼在体外对MCF-7细胞有明显的生长抑制作用,其抑制率随浓度增加而升高,呈明显的时间-剂量依赖关系。
2.2 apatinib不影响MCF-7的细胞周期分布
经终浓度为0、2、4、8umol/L的apatinib处理的MCF-7细胞,其G0/G1期细胞比例分别为48.53%、46.35%、48.21%、49.33%,S期细胞比例分别为49.12%、52.57%、50.43%和50.45%,G2期细胞比例分别是2.35%、1.08%、1.36%、1.23%,可见,随着apatinib浓度的增加,MCF-7细胞周期的分布并没有受到影响,apatinib并不是细胞周期特异性药物。

表1 apatinib对MCF-7的细胞毒作用
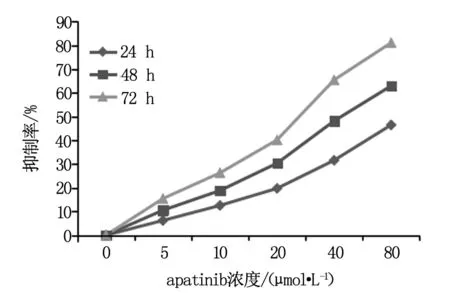
图1 不同浓度apatinib对MCF-7细胞的抑制作用
2.3 流式细胞仪检测细胞凋亡结果
MCF-7细胞分别经处理48 h后,采用Annexin V-APC/7-AAD法经流式细胞仪测定细胞凋亡。结果发现:对照组、apatinib单药组、5-Fu单药组,apatinib+5-Fu联合组细胞凋亡率分别为:7.73%、12.05%、25.76%、34.90%(图2);单药处理组及联合处理组与对照组进行两两比较,细胞凋亡率均有升高,差异有统计学意义(P<0.05),见表2。

表2 apatinib、5-Fu单药及联合对MCF-7细胞凋亡率的影响
3 讨论
乳腺癌的靶向治疗是指针对乳腺癌发生、发展调控分子通路的靶点在细胞分子水平上设计的相应药
物,通过与调节分子或受体结合,抑制这些下游基因的活化或受体的表达,使肿瘤细胞生长抑制或凋亡。细胞凋亡失控是肿瘤发生、发展的1个重要环节,肿瘤细胞抵抗凋亡是肿瘤细胞耐受各种抗肿瘤治疗如放疗、化疗并影响预后的重要原因[3]。Apatinib是1种新型的小分子酪氨酸酶抑制剂,在小鼠肿瘤模型显示了抗肿瘤活性,选择性抑制血管内皮生长因子受体2(VEGFR-2)磷酸化及抗血管新生[4]。在临床前研究中,apatinib在胃癌、结直肠癌、肝癌、肉瘤及非小细胞肺癌等多种移植瘤小鼠模型中均有明显的抑瘤作用,且与奥沙利铂、氟尿嘧啶、阿霉素及多西他赛联合应用在上述移植瘤鼠模型上有协同作用[5-6]。最近有文献报道在实体瘤的体外研究中发现apatinib可以逆转P-gp介导的肿瘤多药耐药,apatinib可以增加ABCB1底物长春新碱、紫杉醇和阿霉素对ABCB1/P-gp高表达人乳腺癌耐药细胞株MCF-7/Adr的细胞毒性[7-8]。已经完成及正在进展的多项3期临床试验中,apatinib治疗晚期胃癌、非小细胞肺癌及肝癌均显示有较好的疾病控制率及可耐受的不良反应[9-10]。
近年的研究认为由于细胞周期紊乱、周期失控引起细胞无限生长,最终导致细胞恶性转化,化疗药物可通过将肿瘤细胞停滞于G0/G1期,阻止细胞进入S期,从而抑制肿瘤细胞分裂,发挥抗肿瘤活性,本实验采用流式细胞仪检测处理后MCF-7细胞周期分布,结果显示,经不同浓度apatinib处理的各组细胞,其细胞周期各期比例并无统计学差异,因此我们认为apatinib对MCF-7细胞发挥抑制作用并不影响其细胞周期。
氟尿嘧啶类化疗药物在早期乳腺癌术后辅助治疗、乳腺癌复发转移后姑息治疗中占有重要地位。该药是细胞周期特异性药物,其主要作用是在体内经酶转化为5-氟脱氧尿嘧啶核苷酸而具有抗肿瘤活性,5-FU通过抑制胸腺嘧啶核苷酸合成酶而抑制DNA的合成。本研究将apatinib与5-Fu联合起来,经过流式细胞仪检测,发现联合组细胞凋亡比例明显高于apatinib单药组及5-Fu单药组,且3组用药组与对照组之间两两比较,差异均有统计学意义(P<0.05)。我们的研究结果提示,apatinib和5-Fu联合应用在一定程度上使抗肿瘤活性增强,这为临床上治疗乳腺癌采用生物化学治疗模式提供了一定的参考,后续我们将对其可能的抗肿瘤机制做进一步的研究,为该方案的临床应用提供更加充分的实验证据。
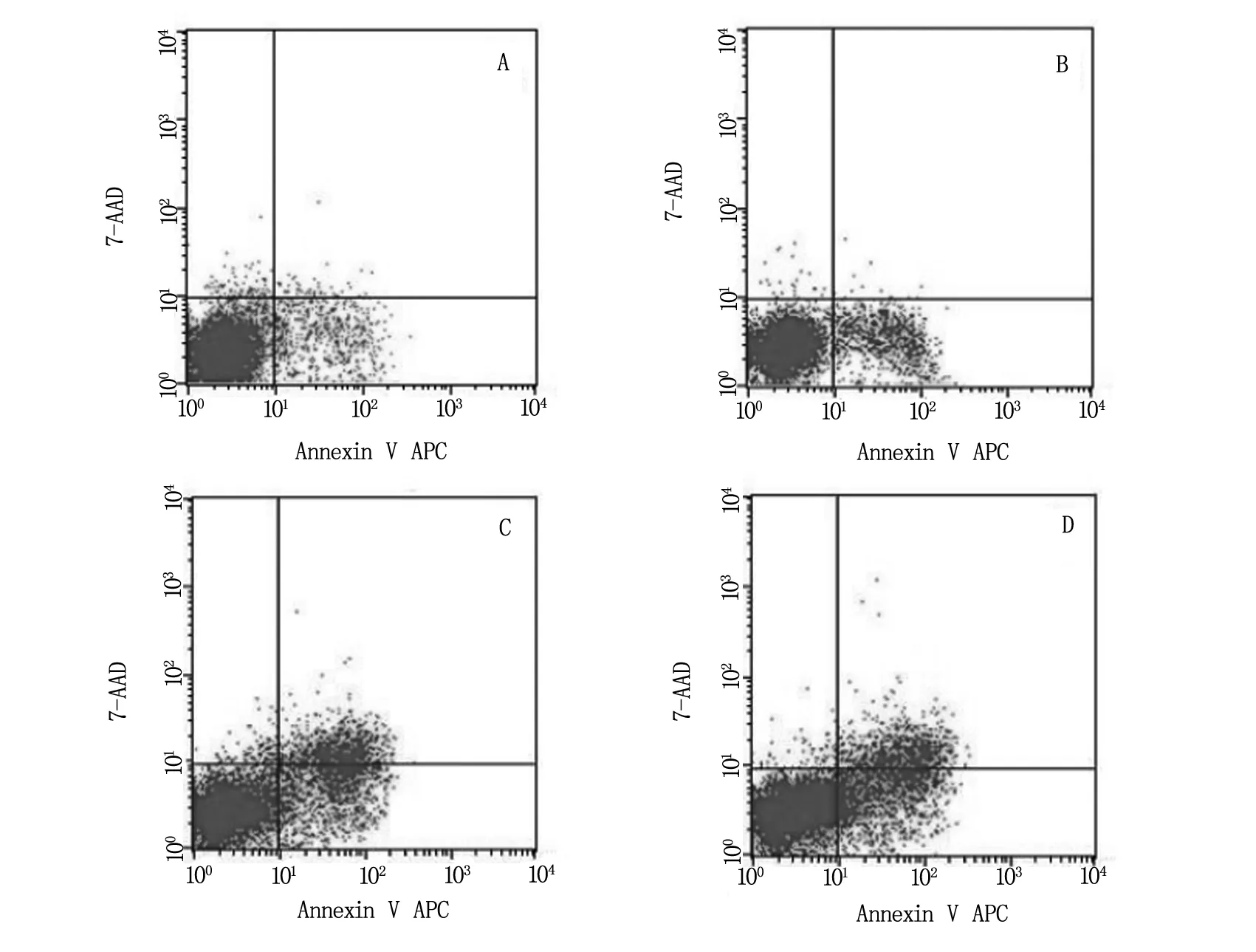
A为对照组,B为apatinib组,C为5-Fu组,D为apatinib+5-Fu组
[1] Chen W,Zheng R,Zhang S,et al.Annual report on status of cancer in China〔J〕.Chin J Cancer Res,2014,26(1):48-58.
[2] Chen p,Iruela AL,Lou L,et al.VEGFR inhibitor YN968D1 xenograft dose response studies against human colon cancer Lsl74t and HT29〔J〕.Proc Amer Assoc Cancer Res,2006,47(9):1764-9.
[3] Oliveras FC,Vazquez MA,Cufi S,et al.Inhibitor of apoptosis(IAP) survivin is indispensable for survival of HER2 gene-amplified breast cancer with primary resistance to HER1/2-targeted therapies〔J〕.Biochem Biophys Res Commun,2011,407(2):412-419.
[4] Li J,Zhao XM,Chen L,et al.Safety and pharmacokineties of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies〔J〕.BMC Cancer,2010,10(5):529-534.
[5] Yan JM,Yong JL,Hong BH,et al.Apatinib(YN968D1) Reverses Multidrug Resistance by Inhibiting the Efflux Function of Multiple ATP-Binding Cassette Transporters〔J〕.Cancer Res,2010,70(20):7981-7991.
[6] Fan M,Zhang J,Wang Z,et al.Phosphorylated VEGFR2 and hypertension:potential biomarkers to indicate VEGF-dependency of advanced breast cancer in anti-angiogenic therapy〔J〕.Breast Cancer Res Treat,2014,143(1):141-151.
[7] Allikmets R,Schriml LM,Hutchinson A,et al.A human p- lacenta-specific ATP-binding cassette gene (ABCP)on chromosome 4p22 that is involved in multidrug resistance〔J〕.Cancer Res,1998,58(23):5337-5339.
[8] Doyle LA,Yang W,Abruzzo LV,et al.A multidrug resistance transporter from human MCF-7 breast cancer cells〔J〕.Proc Nati Acad Sci USA,1998,95(26):15665-15670.
[9] Kessler T,Fehrmann F,Bieker R,et al.Vascular endothelial growth factor and its receptor as drug targets in hematological malignancies〔J〕.Curr Drug Targets,2007,8(3):257-268.
[10] Scott AJ,Messersmith WA,Jimeno A.Apatinib.A promising oral antiangiogenic agent in the treatment of multiple solid tumors〔J〕.Drugs Today (Barc),2015,51(4):223-229.
(编辑:吴小红)
Inhibitive Effects of Apatinib and 5-Fu on Breast Cancer Cell Line ECA109 in Vitro
ANGaili,LIXu,FENGLu,etal.
ShaanxiProvincialPeople'sHospital,Xi'an,710068
Objective To investigate the inhibitive effects of Apatinib and 5-Fu on breast cancer cell line MCF-7 cells.Methods MCF-7 cells were treated with Apatinib at different concentrations and different times,cell growth inhibition was assessed by MTT,the cell cycle changes of the cells in response to apatinib treatment were observed by flow cytometry.MCF-7 cells were divided into 4 different groups:the control group,Apatinib group,5-Fu group and Apatinib + 5-Fu group.The cell apoptosis was detected by flow cytometry via Annexin V-APC/7-AAD double staining after 48 hours.Results Apatinib significantly inhibited the proliferation of MCF-7 cells in vitro,and the inhibition effects presented with time-and dose-dependent response,but produced no significant effect on the cell cycle.Apatinib+5-Fu treatment obviously increased the apoptotic rate of the MCF-7 cells,the difference has statistical significance compared with the control group(P<0.05).Conclusion Apatinib and 5-Fu can enhance the anti-tumor activity through inducing cell apoptosis.
Apatinib;5-Fluorouracil;MCF-7;Cell proliferation;Cell apoptosis
710068 陕西省人民医院(安改丽,白 俊);710061 陕西省肿瘤医院(李 旭);710061 西安交通大学医学院第一附属医院(安改丽,冯 璐,黄尚科,赵新汉)
赵新汉
10.3969/j.issn.1001-5930.2017.05.002
R737.9
A
1001-5930(2017)05-0702-04
2016-05-24
2017-03-08)
