[C2m im][Ala]丙氨酸离子液体水溶液粘滞流动的活化参数
2017-05-10佟静刘璐张朵郑煦陈霞杨家振
佟静 刘璐 张朵 郑煦 陈霞 杨家振
(辽宁大学化学院,沈阳110036)
[C2m im][Ala]丙氨酸离子液体水溶液粘滞流动的活化参数
佟静*刘璐 张朵 郑煦 陈霞 杨家振
(辽宁大学化学院,沈阳110036)
在288.15-328.15 K温度范围内,测量了不同浓度的氨基酸离子液体[C2m im][Ala]水溶液的密度和粘度,根据Jones-Do le方程得到了较大正值的粘度B系数并且d B/d T<0。借助Feakins理论,计算了溶质对溶液粘滞流动活化自由能贡献Δμ2≠0,根据Δμ2≠0随温度的线性变化,进而得到流动活化熵ΔS2≠0和活化焓ΔH2≠0;在Eyring液体粘度的过渡态理论基础上,提出了预测离子液体[C2m im][Ala]水溶液粘度的半经验新方法,其预测值与相应的实验值很好的一致。
离子液体;溶液粘度;粘度B系数;粘滞流动活化参数;过渡态理论
1 引言
众所周知,离子液体是新型功能材料和对环境友好的绿色溶剂,由于其优良的物理和化学特性,近年来发展成为多学科交叉的热门研究领域。目前已应用于有机合成、催化反应等与化学相关的各个领域1-3。然而,离子液体粘度普遍偏高是阻碍其应用的重要方面,因此,如何降低其粘度就成为离子液体研究领域的一个重要问题4,5。研究发现,如果粘滞的离子液体与少量的其它溶剂混合,就会极大地降低离子液体的粘度,其中溶液就是降低离子液体粘度的有效方法6,7。
另外,氨基酸离子液体(AAILs)是一类新的功能离子液体。由于氨基酸广泛存在于自然界的生物体中,也把这类离子液体称作自然离子液体(natural ILs)或生物离子液体(bio-ILs),可以预见它们在生命科学研究、医药学研究中将会得到广泛应用。然而,对离子液体水溶液粘度性质的研究较少,但在实际应用过程中,氨基酸离子液体溶液的基础物理化学知识又是不可或缺的。粘度数据不仅为理论研究提供依据,也是相关工业开发应用的重要基础。但是现存的粘度数据存在一些缺点:种类不全面,缺乏粘度数据的其他相关信息7-12。因此,作为我们前期研究工作的继续12-16,本文研究了288.15-328.15 K温度范围内不同浓度[C2m im][Ala]水溶液的密度和粘度,应用Jones-Dole方程确定了不同温度下的溶液粘滞流动B系数17-19,进而在Eyring过渡态理论基础上提出了一个估算离子液体溶液粘度的半经验新方法。
2 实验部分
2.1 试剂与仪器
自制的去离子水13。实验药品的来源和纯度详见表1。用电子天平(METTLER TOLEDO AL104,瑞士)称重,最大误差为0.2mg。用奥地利Anton Paar公司生产的DMA 4500型振动管数字密度计测量这些样品的密度,仪器最大误差为0.00005 g· cm-3。用杭州中旺科技有限公司生产的Z-Clock 200粘度计测量这些样品的粘度。
2.2 离子液体的合成
本实验采用酸碱中和方法,经过两步合成出[C2m im][A la]丙氨酸离子液体(见图1),此方法离子液体的产量高,且容易分离,具体步骤有关文献已作详细叙述12-14。所得产品通过核磁共振氢谱(1H NMR)进行了表征,并进行了元素分析测试,样品纯度≥0.99。用Karl Fischer法(上海市安亭电子仪器厂ZSD-2 13 type自动水份滴定仪)测定样品的含水量,其质量分数w=3860×10-6。用AgNO3-HNO3溶液进行检测,没有发现卤素离子。
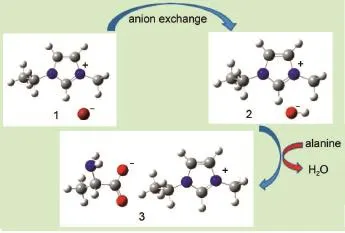
图1 用中和法合成离子液体[C2m im][Ala]示意图Fig.1 Schem e of p reparation of ionic liquids[C2m im][A la] by theneutralizationmethod1:[C2mim]Br;2:[C2mim][OH];3:[C2mim][Ala]
2.3 密度和粘度的测定
在质量摩尔浓度0.01-1.10mol·kg-1范围内,用重量法配制一系列离子液体[C2m im][A la]水溶液样品,并作空气浮力校正。
在288.15-328.15 K温度范围内,测量样品密度。密度计用标准方法标定,然后测定不同温度下纯水密度,与文献值相比较20,测量误差在±0.00002 g·cm-3之内。仪器本身的控温精度为±0.01K。
在288.15-328.15 K温度范围内测量样品的粘度。首先用多次经亚沸提纯器处理的二次蒸馏水测定该仪器系数k,用带有二级控温装置的恒温水浴控制测量温度,控温精度为±0.02K。
3 结果和讨论
3.1 [C2m im][A la]离子液体水溶液的平均摩尔体积和表观摩尔体积
将在288.15-328.15 K范围内测得的不同浓度样品的密度值列入表2中,表中的每一个值都是三次测量的平均值。

表1 实验试剂来源和纯度Table1 Sourceand purity of thematerials
利用表2中的离子液体溶液密度值,计算溶液的平均摩尔体积Vm:

其中Mm为溶液的平均摩尔质量。
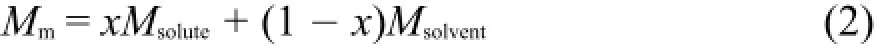
其中x为溶质的摩尔分数,其值从质量摩尔浓度换算得到21。将用方程(1)计算得到的溶液的摩尔体积Vm值列入表S1(Supporting Information)中。
利用方程(3)可从密度数据得到[C2m im][A la]离子液体水溶液的表观摩尔体积φVB22:

其中ρ0是水的密度;MB=199.25 g·mol-1,是溶质[C2m im][A la]离子液体的摩尔质量;ρ是离子液体水溶液的密度;m是离子液体水溶液的质量摩尔浓度。在指定温度下,表观摩尔体积与浓度的关系可用下面经验方程表示:

其中a0和a1为经验参数,a0等于无限稀释表观摩尔体积φVB0,不同温度的φVB值列入表S2(Supporting Information)中。
3.2 离子液体[C2m im][A la]水溶液的粘度和B系数

表2 288.15-328.15K不同浓度[C2m im][A la]溶液的密度测定值(ρ)Tab le2 Valuesof density(ρ)for aqueous[C2m im][A la]w ith variousmolalitiesat288.15-328.15K

表3 288.15-328.15K不同浓度[C2m im][A la]溶液的动力粘度值(η) Tab le 3 Valuesof viscosity(η)for aqueous[C2m im][A la]w ith variousm olalitiesat 288.15-328.15 K
表3列入了测得的不同温度和浓度下的[C2m im][A la]离子液体水溶液的粘度,表中的每个数据都是三次测量的平均值。
强电解质水溶液的粘度可以用Jones-Dole经验方程(5)描述17-21:

式中η和η0分别为溶液和溶剂的粘度,c为物质的量浓度,单位为mol·L-1(见表S3(Supporting Information)),其值可用测定的溶液密度数据换算21,A为表示长程静电力的参数,B为溶液粘滞流动的粘度B系数。将方程(5)重排可得到确定粘度B系数的工作方程:
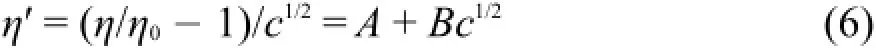
式中η′是外推函数,列入表S4(Supporting Information)中。将外推函数η′对c1/2作图,可得到一组很好的直线,直线的斜率就是粘度B系数。图2为293.15、303.15、313.15和323.15 K下η′对c1/2作图的直线,288.15、298.15、308.15、318.15和328.15 K下η′对c1/2作图的直线见图S1(Supporting Information)。按方程(6)作线性拟合,将得到粘度B系数、参数A的值及其相关系数的平方r2和标准偏差s一并列入表4中。

图2 293.15、303.15、313.15、323.15 K下外推函数η′对c1/2作图Fig.2 Plotting extrapolation function ofη′vs c1/2at 293.15,303.15,313.15,323.15K■293.15K;●303.15 K;▲313.15 K;▼323.15K
从表4可见,方程(6)中的参数A和B都与温度成线性关系,可用下面的经验方程表示:

将A对T作线性拟合,得到q0=-0.4835 L1/2·mol-1/2,q=0.0014L1/2·mol-1/2·K-1,拟合相关系数的平方
1r2=0.990,拟合的标准偏差s=2.1×10-3L1/2· mol-1/2。将粘度B系数对T作线性拟合,得到q2= 4.6039 L·mol-1,q3=-0.0111 L·mol-1·K-1,拟合相关系数的平方r2=0.993,拟合标准偏差s=0.013 L·mol-1。将方程(7)和(8)代入方程(6)则得到:
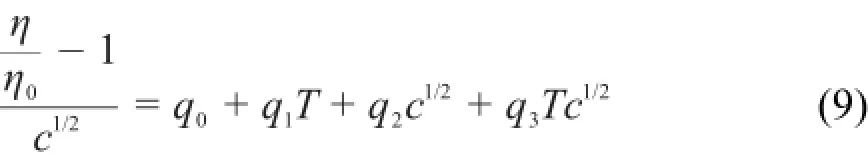
用方程(9)能够在288.15-328.15 K温度范围内,预测浓度小于1mol·kg-1的[C2m im][A la]水溶液的粘度(见表S5(Supporting Information)),将预测值ηpre对相应的实验值ηexp作图(见图3),能得到斜率近似为1的直线。
3.3 离子液体水溶液的流动活化参数
Feakins等18,19在Eyring液体过渡状态理论23基础上推导出定量描述无限稀释溶液的粘度B系数与液体流动活化自由能间的关系式:

其中φ分别为溶剂和溶质摩尔体积为溶剂的摩尔流动活化自由能,为溶质对溶液活化自由能的贡献。王健吉等24,25指出方程(10)中值可以用Eyring过渡状态理论公式计算:
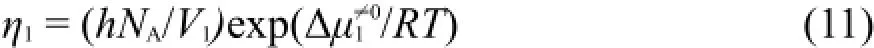
其中h为Planck常数,NA为Avogadro常数,V1为溶剂水的摩尔体积。把按方程(11)计算的Δμ1≠0和按方程(10)计算的Δμ2≠0值均列入表5中。
从表5中可见,Δμ2≠0随温度的变化可用下面的经验方程描述:
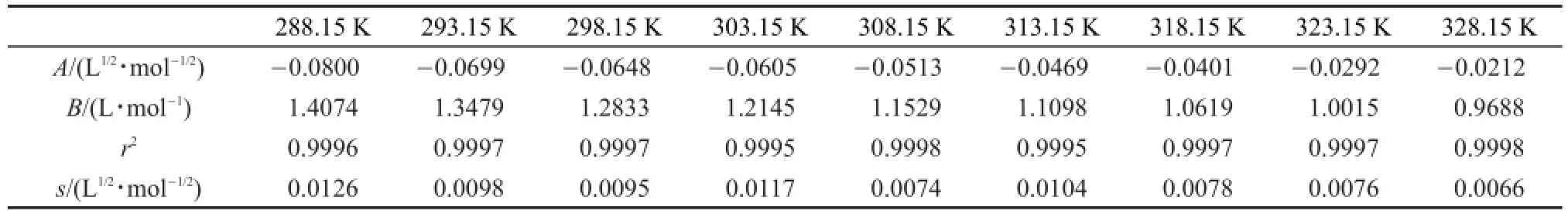
表4 288.15-328.15K时[C2m im][A la]溶液的参数A,粘度B系数及相关系数平方r2和标准误差sTable4 Parameter A,B coefficientof viscosity for aqueous[C2m im][Ala]with the correlation coefficien t square r2and the standard deviation s at 288.15-328.15 K

图3 [C2m im][A la]溶液粘度预测值ηpre对实验值ηexp作图Fig.3 Plotting pred icted valuesof viscoity,ηprefor theaqueous[C2m im][Ala]vs the corresponding experimentalvalues,ηexpηpre=5.29×10-6+0.995ηexp;r2=0.9998;s=6.33×10-6Pa·s.■288.15K;●293.15K;▲298.15 K;▼303.15K;◆308.15K;◀313.15K;▶318.15 K;■323.15 K;★328.15 K

其中ai(i=0,1)是经验参数。根据方程(12),拟合Δμ2≠0和T,可以得到ai(i=0,1)的值:a0=(511.4± 6.7)kJ·mol-1;a1=(-1.023±0.022)kJ·K-1·mol-1;拟合相关系数平方为0.994,标准偏差是±0.84 kJ· mol-1。根据热力学关系,溶液粘性流动的其它活化函数:活化熵(ΔS2≠0)和活化焓(ΔH2≠0)可以用下述方程来计算:

根据方程(13)和(14)计算的结果列在表5中,从表5中可以看出在给定质量摩尔浓度的溶液中,活化[C2m im][A la]溶液粘性流体的活化焓,ΔH2≠0,几乎是与温度无关的常数,因此摩尔活化热容这表明对[C2m im][A la]溶液粘性流体的活化过程是一个等库仑反应26(等库仑反应指的是带电粒子数和电荷相同的反应双方。这种典型的反应往往有近零的热容量变化,从而随着温度的升高具有恒定的焓变)。
3.4 预测溶液粘度的半经验方法
Eyring23将他的反应速率的过渡状态理论推广到液体的输运现象中,得到了一个简单的粘度方程:

其中η为粘度,ΔG≠和V分别为液体粘性流动的活化Gibbs自由能和摩尔体积。这个方程不仅能够解释液体的粘度η随温度T的变化规律,而且还可以用它处理溶液的粘度。在二元溶液中应用,方程(15)中的V应改为溶液的平均摩尔体积Vm,其中ΔG≠为溶液粘性流动的平均活化Gibbs自由能,其定义为:其中分别为溶剂和溶质对平均活化Gibbs自由能ΔG≠的贡献。如果把换成与浓度无关标准状态的则方程(16)变为:

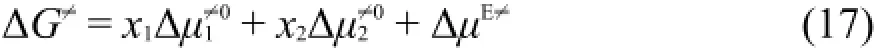
其中ΔμE≠为过量活化Gibbs自由能,ΔμE≠与体系过量Gibbs自由能GE有类似的意义22,这样一来方程(15)可以写成:
取对数:
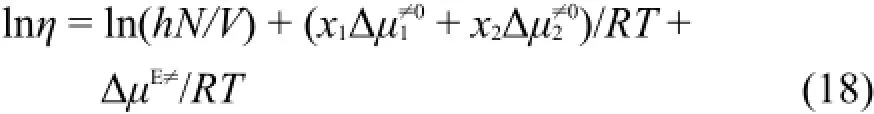
利用粘度实验值η、Δμ1≠0和Δμ2≠0计算ΔμE≠/RT值并将其列入表6中。表6中的ΔμE≠/RT和溶液浓度m关系可以用下面经验方程表示:

表5 [C2m im][Ala]水溶液粘性流动的活化热力学参数Tab le5 Thermodynam ic parametersof theactivation for viscous flow of aqueous[C2m im][A la]


表6 [C2m im][A la]水溶液的ΔμE≠/RT值Table6 ValuesofΔμE≠/RT of aqueous[C2m im][Ala]
其中βi(i=0,1,2)是经验常数。按方程(19)将ΔμE≠/ RT vsm拟合,拟合相关系数的平方大于0.99,说明方程(19)能够很好地描述ΔμE≠/RT和溶液浓度m关系。将得到的经验常数值βi、拟合相关系数的平方r2和拟合标准偏差s列入表6的底部。将方程(18)和方程(19)结合得到预测溶液粘度的新Eyring半经验方程:


图4 用Eyring半经验方程预测的溶液粘度值ηpre′对实验值ηexp作图Fig.4 Plotting the viscosity values,ηpre′,of aqueous [C2m im][A la]estimated by using the sem i-empirical method vs the corresponding experimentalones,ηexpηpre′=-3.32×10-9+1.001ηexp;r2=0.9998;s=6.1×10-6Pa·s.■288.15K;●293.15K;▲298.15 K;▼303.15K;◆308.15K;◀313.15 K;▶318.15 K;■323.15 K;★328.15 K
将计算得到的溶液粘度的预测值ηpre′列入表S6 (Supporting Information)中。用新Eyring半经验方程预测溶液粘度值ηpre′,用预测值对实验值ηexp作图能够得到一条很好直线(见图4),其斜率接近1,相关系数平方为0.9998,说明用半经验方程预测的溶液粘度与相应的实验值十分相似,说明新Eyring半经验方程是预测[C2m im][A la]水溶液粘度的有用工具。
4 结论
在288.15-328.15 K温度范围内测定了不同浓度氨基酸离子液体[C2m im][Ala]水溶液密度和粘度,Jones-Dole方程能很好地适用于离子液体[C2m im][A la]水溶液并获得了粘度B系数,根据Feakins理论,得到了离子液体[C2m im][A la]对溶液粘滞流动活化自由能的贡献和温度之间的线性关系,进而得到了活化熵和活化焓在恒定溶液浓度的条件下,基本不随温度变化,这说明离子液体[C2m im][A la]水溶液粘滞流动活化过程是等库仑反应。在Eyring过渡状态理论基础上本文提出了一个预测溶液粘度新方法,用这个新方法预测离子液体[C2m im][A la]水溶液的粘度值,与相应的实验值相比十分类似。到目前为止,对溶液粘度的研究和预测多集中于单一电解质溶液,很少有人预测多组分电解质溶液的粘度27,28。然而,本文提出的新方法能够很容易推广到混合电解质溶液中,其预测方程为:

其中下角标i代表物种,i=1为溶剂,其余为溶质,n为溶液中的物种数;j+1代表多项式的项数。
Supporting In form ation:1H NMR of[C2m im][A la];the values of molar volume,Vm,and the apparent molar volume,ϕVB,for aqueous[C2mim][A la]with variousmolalities at 288.15-328.15 K;the values of concentration of substance,c, theextrapolation function,η′,the predicted values,ηpre,andηpre′for aqueous[C2m im][Ala];plottingη′vs c1/2at T=288.15, 298.15,308.15,318.15,328.15 K have been included.This information is available free of charge via the internet at http:// www.whxb.pku.edu.cn.
(1)Zhang,S.;Wang,J.;Lu,X.;Zhou,Q.Structures and InteractionsofIonic Liquids;Springer:Heidelberg,Germany, 2014.doi:10.1007/978-3-642-38619-0
(2)Greaves,T.L.;Drummond,C.J.Chem.Rev.2007,108(1),206. doi:10.1021/cr068040u
(3)Rantw ijk,F.V.;Sheldon,R.A.Chem.Rev.2007,38(107), 2757.doi:10.1021/cr050948h
(4)Tariq,M.;Freire,M.G.;Saramago,B.;Coutinho,J.A.P.; Lopes,J.N.C.;Rebelo,L.P.N.Chem.Soc.Rev.2011,41,829. doi:10.1039/c1cs15146k
(5)Sun,X.;Luo,H.;Dai,S.Chem.Rev.2012,112,2100. doi:10.1021/cr200193xd
(6)Riyazuddeen;Usmani,M.A.J.Chem.Eng.Data 2011,56, 3504.doi:10.1021/je2000205
(7)Liu,W.;Zhao,T.;Zhang,Y.;Wang,H.;Yu,M.J.So lut.Chem. 2006,35,1337.doi:10.1007/s10953-006-9064-7
(8)Tao,G.H.;He,L.;Liu,W.S.;Xu,L.;Xiong,W.;Wang,T.; Kou,Y.Green Chem.2006,8,639.doi:10.1039/b600813e
(9)Fukumoto,K.;Ohno,H.Chem.Commun.2006,3081.
(10)Fukumoto,K.;Yoshizawa,M.;Ohno,H.J.Am.Chem.Soc. 2005,127,2398.doi:10.1021/ja043451i
(11)Ohno,H.;Fukumoto,K.Acc.Chem.Res.2007,40,1122. doi:10.1021/ar700053z
(12)Tong,J.;Hong,M.;Chen,Y.;Wang,H.;Guan,W.;Yang,J.Z.J. Chem.Thermodyn.2012,54,352.doi:10.1016/j.jct.2012.05.012
(13)Hong,M.;Sun,A.;Yang,Q.;Guan,W.;Tong,J.;Yang,J.Z.J. Chem.Thermodyn.2013,67,91.doi:10.1016/j.jct.2013.07.008
(14)Hong,M.;Sun,A.;Liu,C.;Guan,W.;Tong,J.;Yang,J.Z.Ind. Eng.Chem.Res.2013,52,15679.doi:10.1021/ie402890r
(15)Hong,M.;Liu,R.J.;Yang,H.X.;Guan,W.;Tong,J.;Yang,J. Z.J.Chem.Thermodyn.2014,70,214.doi:10.1016/j. jct.2013.11.004
(16)Tong,J.;Liu,Q.S.;Zhang,P.;Yang,J.Z.J.Chem.Eng.Data 2007,52,1497.doi:10.1021/je700102g
(17)Jenkins,H.D.B.;M arcus,Y.Chem.Rev.1995,95,2695. doi:10.1021/cr00040a004
(18)Feakins,D.;Freemantle,D.J.;Law rence,K.G.J.Chem.Soc. Faraday Trans.I1974,70,795.doi:10.1039/f19747000795
(19)Feakins,D.;Waghorne,W.E.;Law rence,K.G.J.Chem.Soc. Faraday Trans.I 1986,82,563.doi:10.1039/f19868200563
(20)Lide,D.R.Handbook ofChemistryand Physics,82nd ed.;CRC Press:Boca Raton,2001.
(21)Huang,Z.Q.An Introduction to the Theory ofElectrolyte Solution,revised ed.;Science Press:Beijing,1983.[黄子卿.电解质溶液理论导论,修订版.北京:科学出版社,1983.]
(22)Harned,H.S.;Owen,B.B.The PhysicalChemistry of Electro lyte Solutions,3rd ed.;Reinhold:New York,1958. doi:10.1149/1.2427250
(23)Eyring,H.J.Chem.Phys.1936,4,283.doi:10.1063/1.1749836
(24)Liu,W.B.;Wang,J.J.;Wang,C.L.;Lu,J.S.Acta Phys.-Chim. Sin.1992,8,742.[刘文彬,王健吉,王彩兰,卢俊梭.物理化学学报,1992,8,742.]doi:10.3866/PKU.WHXB19920606
(25)Liu,W.B.;Wu,Y.P.;Wang,J.J.;Lu,J.S.Acta Phys.-Chim. Sin.1995,11,590.[刘文彬,吴艳平,王健吉,卢俊梭.物理化学学报,1995,11,590.]doi:10.3866/PKU.WHXB19950705
(26)Mountain,B.W.;Seward,T.M.Geochimica etCosmochimica Acta 2003,67,3005.doi:10.1016/S0016-7037(00)00303-X
(27)Hu,Y.F.;Lee,H.Electrochim Acta 2003,48,1789. doi:10.1016/j.electacta.2003.03.002
(28)Hu,Y.F.Chem.Eng.Sci.2004,59,2457.doi:10.1016/j. ces.2003.11.005
Parameters of the Activation of Viscous Flow of Aqueous[C2mim][Ala]
TONG Jing*LIU Lu ZHANG Duo ZHENG Xu CHEN Xia YANG Jia-Zhen
(College ofChemistry,Liaoning University,Shenyang 110036,P.R.China)
The density and viscosity ofaqueous solutions ofan ionic liquid(IL)based on alanine,[C2m im][Ala], w ith variousmola lities w erem easured in the tem perature range of T=288.15-328.15 K w ith inte rvals of5 K. From the Jones-Dole equation,a viscosity B-coefficientwith a large positive value and d B/d T<0 were obtained. According to Feakins,the contribution of the solute to the activation free energy for viscous flow of the solution, Δμ2≠0,was ob tained.The rela tionship betweenΔμ2≠0and tem peratu re w as linea r,a llow ing the standard m ola r activation entropy,ΔS2≠0,and enthalpy,ΔH2≠0,to be obtained.On the basis of Eyring′s theory,a new sem i-empirical method to estimate the viscosity ofaqueous[C2m im][Ala]was proposed.The values estimated using thismethod agreed wellw ith the corresponding experimentalones.
Ionic liquid;Viscosity ofsolution;Viscosity B-coefficient;Activation parameter for viscous flow ofsolution;Transition-state theory
.Email:tongjinglnu@sina.com;Tel:+86-24-62207801.
Theprojectwas supported by theNationalNatural Science Foundation of China(21273003).
国家自然科学基金(21273003)资助项目©Editorialoffice of Acta Physico-Chim ica Sinica
O642
10.1039/b606613e
doi:10.3866/PKU.WHXB201610251
www.whxb.pku.edu.cn
Received:September13,2016;Revised:October25,2016;Published online:October25,2016.*
