采用双能量CT碘定量法研究肝硬化患者脾脏血流动力学变化*
2017-05-10北京大学深圳医院医学影像中心广东深圳518036
北京大学深圳医院医学影像中心(广东 深圳 518036)
谢婷婷 石 桥 张嘉瑜王成林 成官迅
采用双能量CT碘定量法研究肝硬化患者脾脏血流动力学变化*
北京大学深圳医院医学影像中心(广东 深圳 518036)
谢婷婷 石 桥 张嘉瑜王成林 成官迅
目的应用双能量CT碘定量的方法,探讨肝硬化患者脾脏血流动力学改变。方法选择37例经临床确诊肝硬化患者及21例健康者(正常对照组),采用双能量CT行上腹部扫描,平扫为常规扫描,动脉期、门静脉期、延迟期行能谱成像(GSI)模式扫描,将数据传输至ADW4.5工作站并应用能谱分析软件进行后处理,在物质分离碘基图上测量碘浓度。在脾脏随机取直径约为20 mm的ROI,所得3个ROI的碘基值均值为脾脏增强扫描动脉期碘基值Ia及门静脉期碘基值Iv,并计算出脾动脉碘分数(AIF=Ia/Iv)。对正常对照组及肝硬化组统计学参数进行单因素分析,组间均数两两比较, P<0.05认为差异具有统计学意义。结果肝硬化组与正常对照组动脉期碘基值Ia(F=9.387,P<0.01)、脾动脉碘分数AIF(F=11.830,P<0.01)组间均数差异均存在统计学意义,且肝硬化门脉高压组Ia及AIF均明显高于正常对照组(102.32±15.75) vs(90.41±12.85),(0.90±0.15) vs.(0.77±0.13)mg I/ml);两组间静脉期碘基值Iv差异无统计学意义。结论肝硬化与正常对照两组病例间,脾脏的血流动力学存在明显差异,表现为肝硬化组脾动脉血流量高于正常对照组,双能CT的碘定量功能可用于评价肝硬化患者脾动脉的血流动力学改变。
肝硬化;脾脏;双能量;血流动力学
CT对肝硬化患者的脾脏血流动力学变化研究较少,双能量CT成像采用瞬时高低能量切换扫描获得高低两组扫描数据,实现物质定量分离,可直接测定增强扫描不同时期脾脏实质的碘浓度,从而反映肝硬化患者脾脏血流动力学的变化[1]。本研究采用双能量CT碘定量法测定肝硬化患者脾脏的碘浓度,探讨肝硬化脾脏的血流动力学变化及其临床意义。
1 材料与方法
1.1 一般资料
1.1.1 肝硬化组:收集2014年7月至2016年7月北京大学深圳医院临床诊断为肝硬化门脉高压的病例,共37例,其中男21例,女16例,年龄26~75岁,平均年龄(51±10)岁;均为乙肝肝硬化。对肝硬化组进行CTP评分,且与CT扫描间隔小于3天,CTP评分及分级见表1。肝硬化组患者中,CTP评分5~13分,平均(7±2)分。肝硬化CTP分级A级20例,B级12例,C级5例。
(1)肝硬化临床诊断标准:参考2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的病毒性肝炎防治方案[2]。
(2)排除标准:脾脏肿瘤、脾脏囊肿直径>5mm、门静脉病变。
1.1.2 正常对照组:临床申请上腹部CT平扫及三期增强扫描病例中,随机选取最后临床诊断无肝脏、脾脏疾病,且影像学检查未发现肝脏、脾脏异常、门静脉病变的病例作为正常对照组(排除标准同肝硬化组),共21例,其中男17例,女4例,年龄14~82岁,平均年龄(50±14)岁。
1.2 检查方法采用美国GE DiscoveryCT750HD能谱CT机行动脉期、静脉期及延迟期增强扫描。扫描范围从膈顶上方至脐上方。对比剂采用碘海醇,规格:350mgI/mL(100mL/瓶,北京北陆药业股份有限公司),剂量为1.2~1.5mL/Kg,采用高压注射器自肘正中静脉以3.0~3.5mL/s流速团注。扫描参数:螺距0.984,X线管旋转速度为0.6s/周,探测器宽度为0.625mm×64层,电压为高低能量(140和80kVp)瞬时(0.5ms)切换,管电流为640mA。
1.3 ROI选择及碘测定增强扫描时动脉期由检测扫描触发,监测的ROI设定在腹主动脉,阈值达120HU后5.4s触发扫描。门静脉扫描于动脉期开始后30s进行。在能谱扫描后自动生成以水和碘为基物质的能量图像。将扫描所得数据应用ADW4.5后处理工作站的能谱CT软件分析,在物质分离碘基图上测量动脉期及门静脉期碘浓度。随机选取同一层面脾脏各3个直径为20mm的圆形ROI,其平均值代表该时相的碘浓度。使所选层面ROI设置在各时相尽量保持一致,选取时尽量避开直径小于5mm的囊肿(如图1-4所示),测得脾脏增强扫描动脉期、门静脉期肝实质碘浓度Ia及Iv,并计算出脾动脉碘分数(arterial iodinefraction,AIF=Ia/ Iv)[3-5]。

2 结 果
照组及肝硬化门脉高压组统计学参数进行单因素分析,组间均数两两比较,P<0.05认为差异具有统计学意义。
肝硬化组与正常对照组动脉期碘浓度Ia(F=9.387,P<0.0 1)、脾动脉碘分数AIF(F=11.830,P<0.01)组间均数差异均存在统计学意义,且肝硬化组Ia及AIF均高于正常对照组(102.32±15.75) vs.(90.41±12.85)mgI/ml,(0.90±0.15)vs.(0.77±0.13)mg I/ml)。见表2。
3 讨 论
3.1 双能CT碘定量评价肝动脉血流动力学的原理双能量CT成像是基于单源瞬时kVp切换技术,能在小于0.5ms时间内使用高低球管电压(80、140kVp)瞬时切换并实现两组数据同时采样[6],测量出物质X线衰减系数。在双能量CT成像中,任何感兴趣物质都可以通过两种基物质的组合产生相同的衰减效应来表达,这个过程即为物质分离定量功能[7-8]。在医学影像成像中,人体组织含水丰富,含碘的造影剂广泛应用,且水-碘的衰减系数高低差别明显,既包含了医学中常见的物质,图像又易于解释,所以常选用水-碘作为基物质对。在增强扫描中物质分离碘基图上表达的是碘空间和时间分布信息[9],测量得到的碘浓度可以直接反映组织器官的摄碘能力,间接反映其血供。
3.2 脾动脉碘浓度与血流动力学特点脾脏是介于动脉和静脉之间的脏器,它具有独特的血液循环系统,脾脏由脾动脉供血,血液经脾动脉、小梁动脉及中央动脉进入红髓,形成漏斗状或直管状毛细血管网;脾脏的微循环研究表明,进入脾脏的血液只有10%通过动脉毛细血管进入脾血窦(闭锁循环),而90%被排放到红髓的网眼中,然后直接通过脾血窦内皮细胞间小孔进入窦腔(开放循环)而进入静脉系统,而形成开放性血行通路,因此,正常脾脏动脉血流具有低阻力的特点[10-11]。增强扫描后,造影剂随着血流沿着脾动脉进入脾脏,脾脏实质的CT值、ROI碘含量开始上升,动脉期脾脏实质所测得的碘浓度主要反映脾动脉血流量;本研究得出肝硬化组与正常组动脉期碘浓度存在统计学差异,且肝硬化组动脉期碘浓度均值为(102.32±15.75)mgI/mL,高于正常组(90.41±12.85)mg I/mL;动脉期与门静脉期碘浓度之比为脾动脉碘分数(Arterialiodine fraction,AIF),反映脾动脉占脾脏总血供的比例,肝硬化组与正常组AIF存在统计学差异,且肝硬化组AIF高于正常组,提示肝硬化后脾动脉血流量增加。原因可能与以下因素相关:(1)当肝硬化后,肝脏血流灌注下降,肝功能受损,导致肝脏对前列腺素F、血栓素A、组胺及缓激肽等血管活性物质的灭活障碍,继而引起舒、缩血管物质平衡失调[12-13],扩血管物质在血液中比例升高,血管阻力下降,脾动脉血流量增多;(2)肝硬化时脾血窦腔内扩张淤血、压力增高、脾髓索增厚和纤维化,使小动脉流经脾髓索到脾血窦的距离加大,红细胞通过脾髓索的时间延长,从而使开放性血行通路受阻而出现、即进入静脉循环受阻,出现动脉期脾脏血流量增多。

表1 肝功能Child-Turcotte-Pugh(CTP )评分与分级标准
表2 正常对照组与肝硬化组碘定量参数比较

表2 正常对照组与肝硬化组碘定量参数比较
注:Ia动脉期碘浓度;Iv门静脉期碘浓度;AIF脾动脉碘分数
分组 Num.(例)Ia(mg I/mL)Iv(mgI/mL)AIF(%)正常对照组(N)2190.41±12.85113.69±12.320.77±0.13肝硬化组(C)37102.32±15.75119.80±18.190.90±0.15 F值9.3871.79411.830 P0.0030.1860.001
肝硬化组与正常组的门静脉期碘浓度进行单因素分析,P值为0.186,无统计学意义。这可能与门静脉期脾脏仍不断接受脾动脉的血流汇入,但同时存在脾静脉的血流流出,故门静脉期测得的脾脏实质碘浓度无法反映脾静脉的血流量有关。
综上,肝硬化与正常对照组两组病例间,脾脏的血流动力学存在明显差异,表现为肝硬化组脾动脉血流量高于正常对照组。双能CT的碘定量功能可用于评价肝硬化患者脾动脉的血流动力学改变。
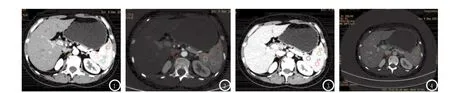
图1-4 分别为增强扫描动脉期碘基图像、动脉期水基图像、门静脉期碘基图像及门静脉期碘基图像,在脾脏实质各选取一个直径为20 mm的ROI,分别为L1-3(动脉期所选ROI)、L4-6(门静脉期所选ROI),所得各3个ROI的平均值为该时相脾脏实质的碘浓度,可测得脾脏增强扫描动脉期碘浓度Ia及门静脉期碘浓度Iv。ROI放置层面及位置尽量保持一致。
[1]赵丽琴,贺文,李剑颖,等.应用能谱CT研究肝硬化门静脉高压患者肝血流动力学变化[J].中华放射学杂志,2011,45(8):782-783.
[2]中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,6:324-329.
[3]赵丽琴,贺文,胡志海,等.肝动脉碘分数在不同肝功能分级肝硬化患者中的变化特点[J].首都医科大学学报,2013,34(3):329-332.
[4]丁贺宇,王成林,黎永滨,等.肝硬化与正常肝脏双重血流量定量对比研究[J].中国CT和MRI杂志,2013,11(6):52-55.
[5]Zhao L-Q,He W,Yan B,Wang H-Y,Wang J. The evaluation o f h a e m o d y n a m i c s i n cirrhotic patients with spectral CT[J].Br J Radiol. 2013,86(1028):20130228.
[6]Takahashi H,Shigefuku R, Yoshida Y,et al.Correlation between hepatic blood flow a n d l i v e r f u n c t i o n i n alcoholic liver cirrhosis[J]. World J Gastroenterol, 2014,20(45):17065-74.
[7]Johnson TR,Krauss B,Sedlmair M, et al. Material differentiation by dual energy CT:initial experience[J].Eur Radiol 2007,17(6):1510-1517.
[8]谢婷婷,王成林,丁贺宇,等.采用双能量CT碘定量法研究正常活体肝脏的肝动脉和门静脉血供特点[J].中华放射学杂志,2013,47(6):526-528.
[9]Karcaaltincaba M,Aktas A.Dual-energy CT revisited with multidetector CT:review of principles and applications[J].Diagn Interv Radiol,2011,17(3):181-194.
[10]同济医科大学病理学教研室,中山医科大学病理学教研室,外科病理学[M].湖北科学技术出版社,1999,600-602.
[11]黄生传,张秉亨,赵新民,等.彩色多普勒超声对肝炎后肝硬化脾肿大脾内血流的研究[J].中国医学影像技术,2002,18(2)164-165.
[12]彭晓静,邓晶,马雯婷.急慢性肝炎和肝硬化55例脾脏血流动力学的检测[J].南京医科大学学报(自然科学版),2005,25(6):420-421.
[13]蒙秋华,曾庆思,伍筱梅,等.CT双期扫描评价肝硬化患者腹部多器官血流动力学改变的价值[J].广东医学,2010,31(8)1017-1019.
(本文编辑:张嘉瑜)
Quantitative Study of Hemodynamics of Spleen on Cirrhosis Patients by Dual-energy CT*
XIE Ting-ting, SHI Qiao, ZHANG Jia-yu, et al., Medical Imaging Center, Peking University Shenzhen Hospital, Shenzhen 518036, Guangdong Province, China
ObjectiveUsing iodimetric analysis of dual-energy CT (DECT), to investigate the hemodynamics of spleen on cirrhosis patients.MethodsA total of 37 cases of liver cirrhosis (study group) and 21 cases without liver disease (normal control group) were selected in this study. All cases were underwent upper abdomen scanning, plain scanning was underwent standard model, arterial phase, portal venous phase and delayed phase enhancement were underwent Gemstone Spectral Imaging(GSI) scanning by DECT scanner(American GE Discovery CT 750 HD) with the same scanning parameters and contrast media contain iodine. The original data was transferred to work station ADW4.5 and post-processing by GSI software. Iodine concentration measurement was underwent on material decomposition of iodine base figure. A total of 3 region of interest (ROI) with diameter of 20 mm were selected in spleen, and the mean iodine concentration was calculate by the three ROIs. So that iodine concentration of arterial phase (Ia) and portal venous phase (Iv) can be measured during the corresponding enhancement stage. The arterial iodine fraction (AIF=Ia/Iv) could be calculated. ALL parameters from study group and control group were compared by single factor analysis, and the differences of these measures were detected by ANOVA test.ResultsBoth of the Ia and AIF had statistical significance between the liver cirrhosis group and control group with F=9.387, P<0.01 and F=11.830, P<0.01. Ia and AIF of liver cirrhosis group were higher than control group (102.32±15.75)vs. (90.41±12.85), (0.90±0.15)vs. (0.77±0.13)mg I/ml. There was no statistically significant difference between the two group on portal venous phase (P>0.05).ConclusionThe hemodynamics of spleen was obvious different between the liver cirrhosis group and control group. Iodine quantitative function of dual-energy CT can be used for evaluation of spleen hemodynamics on cirrhosis patients.
Liver Cirrhosis; Spleen; Dual-energy CT(DECT); Hemodynamics
R657.3
A
深圳市科技计划项目(项目编号:JYCJ2015040309144 3313);2014年深圳市科技创新委员会知识创新计划(项目编号:JYCJ201404151 62338812):
10.3969/j.issn.1672-5131.2017.05.024
2017-04-07
成官迅
