咖啡酸苯乙酯通过Nrf-2 途径抑制地塞米松诱导的成骨细胞凋亡
2017-05-09李洪伟郭开今李东亚
林 强,李洪伟,郭开今,周 冰,李东亚
·论 著·
咖啡酸苯乙酯通过Nrf-2 途径抑制地塞米松诱导的成骨细胞凋亡
林 强1,李洪伟2,郭开今2,周 冰2,李东亚2
目的 探讨Nrf-2途径在咖啡酸苯乙酯(CAPE)抑制地塞米松(DEX)诱导成骨细胞凋亡中的作用。 方法 用细胞贴壁法培养小鼠颅顶前骨细胞(MC3T3-E1),采用10 μmol/L DEX建立细胞损伤模型,以不同浓度CAPE(0.05、0.25、1 μmol/L)预处理细胞2 h后加入地塞米松共孵育24 h;细胞增殖-毒性检测试剂盒(CCK-8)检测细胞增殖活性;依据CCK-8检测结果确定药物浓度后将实验分为对照组、咖啡酸苯乙酯组(CAPE组)、地塞米松组(DEX组),咖啡酸苯乙酯+地塞米松组(CAPE+DEX组);DCFH-DA荧光探针检测细胞内活性氧(reactive oxygen species, ROS)水平;Caspase-3活性检测试剂盒检测Caspase-3酶活性,Western blot法检测Nrf-2 途径相关蛋白Nrf-2和血红素氧合酶1(heme oxygenase,HO-1)蛋白表达水平;流式细胞仪检测细胞凋亡率。 结果 10 μmol/L DEX作用下细胞形态发生明显变化,损伤作用明显。与对照组相比,DEX组内细胞存活率显著下降(P<0.01),而细胞内 ROS水平、细胞凋亡率及Caspase-3酶活性显著增加(P<0.01);同时,Nrf-2途径相关蛋白 Nrf-2及HO-1表达量减少,差异有统计学意义(P<0.01)。与DEX组相比,CAPE+DEX组细胞存活率显著上升(P<0.01),Nrf-2途径相关蛋白 Nrf-2及HO-1表达明显增加(P<0.01);此外,CAPE+DEX组细胞内 ROS 水平、细胞凋亡率及Caspase-3酶活显著降低,差异有统计学意义(P<0.01)。 结论 咖啡酸苯乙酯可以通过Nrf-2途径降低细胞内ROS水平进而减轻地塞米松诱导的氧化应激所致细胞损伤及凋亡。
咖啡酸苯乙酯;地塞米松;成骨细胞;Nrf-2信号通路;细胞凋亡
糖皮质激素在临床上广泛应用于抗炎、免疫调节等方面的治疗。然而长期或大剂量应用糖皮质激素带来的糖皮质激素性骨质疏松症(glucocorticoid inducedoste oporosis,GIOP)成为治疗过程中严重的并发症之一[1-2]。近来的研究表明氧化应激在GIOP的发生和发展中发挥重要作用,局部的氧化应激可抑制成骨细胞活性并诱导其凋亡,然而其具体机制尚不明确[3-4]。基于以上研究,如何在发病早期减少成骨细胞的凋亡、控制局部氧化应激、改善骨细胞内部微环境,从而增强骨组织的修复能力、阻止病情的进一步演变,成为治疗激素性骨质疏松症的重要目标。咖啡酸苯乙酯(caffeic acid phenethyl ester, CAPE)作为蜂胶成分中天然的生物活性成分,具有抗炎症、抗氧化、免疫调节等独特的生理药理作用[5]。亦有研究表明咖啡酸苯乙酯能有效调节局部组织细胞的氧化应激水平、减少组织损伤[6]。但在地塞米松诱导成骨细胞损伤过程中,咖啡酸苯乙酯是否通过抑制成骨细胞内氧化应激而发挥对其保护作用,仍有待进一步研究。因此,本研究拟通过体外培养小鼠MC3T3-E1型颅顶前骨细胞,观察咖啡酸苯乙酯对地塞米松作用下成骨细胞凋亡的抑制作用,并探讨其作用机制,为咖啡酸苯乙酯应用于GIOP的防治提供实验依据。
1 材料与方法
1.1 试剂与材料 MC3T3-El细胞株(购自中国科学院细胞库,上海);咖啡酸苯乙酯(上海紫一试剂厂);地塞米松(美国Sigma);α-MEM培养基(HyClone);胎牛血清(杭州四季青);细胞增殖-毒性检测试剂盒(CCK-8)(日本同仁);BCA蛋白浓度测定试剂盒(江苏碧云天);兔抗小鼠Nrf-2抗体(美国CST);兔抗小鼠血红素氧合酶1(heme oxygenase,HO-1)抗体(美国Abcam);碱性磷酸酶标记的山羊抗兔二抗(中杉金桥公司);Tubulin-α rabbit Antibody(美国Bioworld);BCIP/NBT碱性磷酸酯酶显色试剂盒(江苏碧云天);Annexin V-FITC/PI细胞凋亡检测试剂盒(南京凯基);Caspase-3活性检测试剂盒(江苏碧云天);倒置相差显微镜(日本Olympus)酶联免疫检测仪(美国Thermo);流式细胞仪(Beeton-Dickinson);Western blot电泳仪(Bio-Rad);荧光显微镜(日本Nikon)。
1.2 细胞培养 MC3T3-El细胞培养于含10%FBS的α-MEM培养基中,在37 ℃、5%的CO2、饱和湿度恒温培养箱中孵育。隔日换液,待细胞长满90%后,再经不含EDTA的0.25%胰蛋白酶37 ℃常规消化,加入3 mL α-MEM培养基,反复吹打成单细胞悬液,计数并调整细胞密度,传代培养。实验分组及处理:①空白对照组:正常培养,无特殊处理;②咖啡酸苯乙酯组(CAPE组):细胞长满约70%左右,置于含CAPE(0.05、0.25、1、4 μmol/L)培养基中培养24 h;③地塞米松组(DEX组):细胞长满约70%左右,置于含10μmol/L DEX培养基中培养24 h;④咖啡酸苯乙酯+地塞米松组(CAPE+DEX组):细胞以CAPE预处理2 h后加入10 μmol/L DEX培养基中共孵育24 h。
1.3 细胞存活率测定 采用细胞增殖/毒性检测法(CCK-8)[7]。将细胞以5×103个/孔接种于96孔板中培养。按前述分组处理细胞24 h后吸弃上清液,每孔加入含10%CCK-8的培养基100 μL,培养箱内避光孵育1.5 h;取含10%CCK-8的培养基100 μL加入没有细胞含药物孔作为阴性对照。用酶标仪测定在450 nm的吸光度(OD)值。
存活率(%)= (实验组OD值-阴性对照组OD值)/
(对照组OD值-阴性对照组OD值)
×100%
1.4 细胞凋亡检测 采用Annexin V- FITC/ PI 法检测[8]。取对数生长期的MC3T3-El细胞,接种于100 mm 培养板中。在含10%FBS的α-MEM 培养基中,按前述分组处理细胞24 h后用不含EDTA胰酶消化后收集细胞,PBS洗涤细胞二次,2000 rpm离心5 min后收集5×105个/mL细胞,加入500 μL的缓冲液悬浮细胞,加入5 μL的Annexin V-FITC混匀后,加入5 μL的碘化丙啶(propidium iodide)混匀,室温、避光4 ℃ 孵育作用15 min后,用FACS Calibur型流式细胞仪检测细胞凋亡率。
1.5 Caspase-3活性检测 应用Caspase-3活性检测试剂盒检测Caspase-3酶活性。参照Liu等[9]实验方法,细胞以1×106个/孔接种于6孔板培养,按前述分组处理细胞24 h后PBS洗涤细胞二次(离心,2000 r/min,5 min)收集细胞。在收集的沉淀细胞中加入50 μL冷裂解缓冲液(lysis buffer)。冰上裂解30 min,其间涡旋振荡3~4次,每次10 s,吸取上清用Braford法测定蛋白浓度。吸取50 μL的细胞裂解上清,加入2×反应缓冲液(reaction buffer),加入50 μL Caspase-3底物并于37 ℃避光孵育4 h。酶标仪在X=405 nm定其吸光值。
1.6 细胞内活性氧(reactive oxygen species,ROS)水平检测 应用荧光探针二氯二氢荧光素双醋酸盐(DCFH-DA)检测细胞内ROS水平[10]。取对数生长期的MC3T3-El细胞,接种于100 mm培养皿中。在含10% FBS 的α-MEM 培养基中,按前述分组处理细胞24 h后。用不含FBS的α-MEM培养基洗涤3次后,加入DCFH-DA工作液(100 μM的DCFH- DA),37 ℃孵育30 min后,用不含FBS的α-MEM培养基洗涤3次后,荧光显微镜下观察各组细胞内荧光强度并在400倍视野下随机选择3个视野进行拍照。Image-Pro-Plus图像分析软件分析平均荧光强度。
1.7 Western blot法检测Nrf-2 途径相关蛋白 将细胞以1×106个/孔接种于6孔板培养,按前述分组处理细胞24 h后分别提取总蛋白,用BCA蛋白浓度测定试剂盒测定总蛋白浓度,将各组配平成相同浓度后,经电泳、转膜、封闭后,进行孵育抗体,以NBT/BCIP碱性磷酸酯酶显色试剂盒显色,结果扫描[10]。

2 结 果
2.1 细胞损伤模型的建立 不同浓度DEX(0.01、0.1、1、10 μmol/L)作用24 h后,细胞的存活率分别为(93.468±20.211)%、(90.562±15.301)%、(73.188±17.309)%、(58.361±10.208)%,细胞存活率较对照组下降(6.532±20.886)%、(9.438±17.382)%、(26.813±17.371)%、(41.638±19.708)%。与对照组比较,10 μmol/L DEX处理后的MC3T3-El细胞存活率明显下降(P<0.01),见图1。倒置相差显微镜下对照组内MC3T3-E1细胞贴壁生长,呈“铺路石”样排列,见图2a;加入10 μmol/L DEX后,贴壁MC3T3-E1细胞减少,细胞回缩、变亮变圆,细胞间连接结构减少,细胞间隙增大,部分细胞结团、脱落,溶解为黑色点状物,细胞出现不同程度的形态学损伤,见图2b。因此,选用10 μmol/L DEX建立细胞损伤模型。

1:对照组;2-5分别为:0.01、0.1、1、10 μmol/L地塞米松浓度 与对照组比较,*P<0.05,**P<0.01
图1 不同浓度地塞米松处理MC3T3-E1细胞24 h后细胞存活率

a:对照组;b:地塞米松组 图示加入10 μmol/L地塞米松后,细胞出现不同程度的形态学损伤
图2 10 μmol/L地塞米松对MC3T3-El细胞形态的影响(×100)
2.2 CCK-8检测结果 不同浓度CAPE(0.05、0.25、1、4 μmol/L)作用24 h后,细胞的存活率分别为(91.715±8.399)%、(91.757±6.445)%、(88.273±8.420)%、(76.248±6.420)%,较对照组下降(8.328±10.527)%、(8.286±9.740)%、(11.770±8.420)%、(23.794±8.022)%。CAPE浓度在0~1 μmol/L对MC3T3-E1细胞增殖无明显影响(P>0.05),见图3。因此,应用不同浓度的CAPE(0、0.05、0.25、1 μmol/L)预处理细胞2 h后与10 μmol/L DEX共同作用24 h后,细胞存活率分别为(30.985±4.775)%、(56.816±7.047)%、(67.068±3.702)%、(62.600±4.909)%,细胞存活率较DEX组分别增加(25.831±11.664)%、(36.083±4.170)%、(31.615±7.560)%。0.25 μmol/L CAPE细胞存活率较DEX组显著增加(P<0.01),且1 μmol/L浓度CAPE对于损伤后细胞存活率无进一步改善作用,因此后续实验选用CAPE的浓度为0.25 μmol/L,见图4。

1:对照组;2-5分别为:0.05、0.25、1、4 μmol/L咖啡酸苯乙酯浓度 与对照组比较,*P<0.01
图3 不同浓度咖啡酸苯乙酯处理MC3T3-E1细胞24 h后细胞存活率
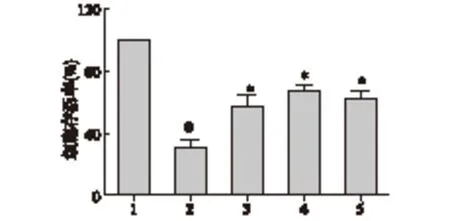
1:对照组;2:DEX组(10 μmol/L DEX);3-5分别为:0.05、0.25、1 μmol/L CAPE处理2 h后与10 μmol/L DEX作用组 与对照组比较,#P<0.01;与DEX组比较,*P<0.01
图4 不同浓度CAPE处理对DEX(10 μmol/L)作用下细胞存活率的影响
2.3 流式细胞仪检测结果 Annexin V和PI染色结果显示,与对照组相比,DEX组(10 μmol/L)细胞凋亡率显著升高(P<0.01),而CAPE+DEX组较DEX组细胞凋亡率显著下降(P<0.01)。见图5、图6。
2.4 不同处理组MC3T3-E1细胞内ROS水平 10 μmol/L DEX作用24 h后,在荧光显微镜下观察DEX组细胞内ROS平均荧光强度较对照组显著增强,差异有统计学意义(P<0.01);加入0.25 μmol/L CAPE预处理细胞2 h后与DEX共同孵育24 h,荧光显微镜下观察到细胞内ROS平均荧光强度较DEX组显著减弱,差异有统计学意义(P<0.01)。见图7。

图5 0.25 μmol/L CAPE对10 μmol/L DEX诱导MC3T3-E1细胞凋亡的影响

与对照组比较,*P<0.01;与DEX组比较,#P<0.01
图6 各组MC3T3-E1细胞凋亡率
2.5 不同处理组MC3T3-E1细胞中相关蛋白表达 CAPE组与对照组的Nrf-2、HO-1表达未见明显差异,加入10 μmol/L DEX后Nrf-2、HO-1表达明显减少(P<0.01);0.25 μmol/L CAPE预处理2 h后与DEX共同孵育24 h,Nrf-2及HO-1蛋白表达量较DEX组增加(P<0.01),见图8。
2.6 不同处理组MC3T3-E1细胞内Caspase-3酶活性 DEX作用24 h后Caspase-3酶活性显著增强,加入0.25 μmol/L CAPE预处理2 h后与DEX共同孵育24 h,Caspase-3酶活性较DEX组显著降低,差异有统计学意义(P<0.01)。见图9。

a:荧光显微镜下各组MC3T3-E1细胞中ROS荧光强度(荧光显微镜 ×400);b:与对照组比较,*P<0.01;与DEX组比较,#P<0.01图7 各组MC3T3-E1细胞内ROS水平

a:Western blot 检测;b:Nrf-2及HO-1蛋白的相对表达量与对照组比较,*P<0.01;与DEX组比较,#P<0.01图8 各组MC3T3-E1细胞中Nrf-2及HO-1表达(Western blot)

与对照组比较,*P<0.01;与DEX组比较,#P<0.01
图9 各组MC3T3-E1细胞中Caspase-3酶活力
3 讨 论
近年来,随着对GIOP研究的深入,细胞凋亡、氧化应激、骨胶原代谢异常等均在其中发挥着一定的作用,但尚无完整理论来阐述这一过程[11]。目前的观点认为糖皮质激素的直接作用在发病初始发挥着关键作用。大量研究表明糖皮质激素不仅抑制骨髓基质细胞向成骨细胞方向分化,还可诱导成骨细胞凋亡引起骨修复功能障碍、骨强度下降,最终致骨质疏松症的发生[12]。在本实验研究中CCK-8结果显示MC3T3-E1细胞活性随着DEX浓度增加而降低且呈浓度依赖性;此外,流式细胞凋亡检测结果显示在10 μmol/L DEX培养24 h后,与对照组相比细胞凋亡率显著增加。
Caspase家族作为细胞凋亡过程中的参与者与介导者,发挥着重要的作用,其中又以Caspase-3最为重要,在凋亡信号传导的许多途径中发挥功能[13]。正常情况下,Caspase-3以无活性的酶原形式存在于胞质中,在凋亡的早期阶段被活化为由两个大亚基(17 kD)和两个小亚基(12 kD)组成的复合物,其中17 kD的活化片段被认为是凋亡程序的执行蛋白,裂解相应的底物,最终导致细胞凋亡,因此,活化的Caspase-3片段被认为是凋亡发生的标志[14]。本实验中MC3T3-E1细胞在加入地塞米松后Caspase-3酶活性增加且细胞凋亡率升高,表明地塞米松可以通过激活Caspase-3启动其介导的细胞凋亡过程从而促进成骨细胞凋亡。应用CAPE后,DEX上调的MC3T3-E1细胞凋亡率及Caspase-3活性显著下降,表明CAPE可减轻地塞米松诱导的MC3T3-E1细胞损伤及细胞凋亡。
ROS是生物体内有氧代谢产生的含氧自由基,主要包括超氧阴离子(O2-)、羟基(OH-)和过氧化氢(H2O2)等[15]。正常情况下,ROS有助于维持机体的正常生理功能,然而过量的ROS可作为第2信使,促进线粒体Ca2+内流、线粒体通透性转换孔(MPTP)的开放、Caspase的激活,导致细胞凋亡。此外,异常增多的ROS能够通过促进脂质过氧化、减少抗氧化物酶、促进成骨细胞凋亡等途径加速骨量丢失[16-17]。本实验研究在进行细胞损伤指标检测过程中发现:在加入10 μmol/L DEX作用MC3T3-E1细胞24 h后,细胞内氧化型二氯荧光素(DCF)的荧光强度显著增强,细胞内ROS水平升高;在此过程中,细胞凋亡率显著升高;然而,在加入CAPE后,上述指标呈现回降现象,可见CAPE通过降低细胞内ROS蓄积,减轻细胞氧化应激损伤,从而减轻地塞米松诱导的细胞凋亡。
目前认为Nrf-2是调控细胞外源性刺激因子和氧化损伤的关键转录因子,在参与细胞抗氧化应激和外源性有毒物质诱导的主要防御机制中发挥重要的作用[18-19]。静息状态下,Nrf-2在胞浆中处于一种非活性状态,当处于应激状态时,Nrf-2转移入核内,与基因中的抗氧化反应元件结合,启动下游Ⅱ相代谢酶基因的表达和转录,以增加细胞对氧化应激的抵抗作用,使细胞免于凋亡[20]。在被Nrf2激活的众多的抗氧化酶中,HO-1具有较好的抗氧化能力、抑制细胞凋亡的作用。亦有研究发现在治疗激素诱导的MC3T3-E1细胞凋亡过程中,沉默Nrf-2基因后抗氧化基因表达明显降低,而氧化应激损伤明显增强,提示Nrf-2通路在调节激素诱导的成骨细胞内氧化还原状态紊乱中发挥重要作用。本研究结果表明DEX显著降低细胞内Nrf-2和HO-1蛋白表达水平;而应用CAPE后,细胞内Nrf-2和HO-1蛋白表达量均增加。本实验结果进一步表明CAPE可激活细胞内Nrf-2途径并增加Ⅱ相代谢酶基因的表达,增强细胞抗氧化能力。
综上所述,咖啡酸苯乙酯通过增强MC3T3-E1细胞内Nrf-2途径内抗氧化蛋白的表达水平,清除细胞内异常增多的ROS,从而遏制了Caspase-3介导的细胞凋亡通路的启动,减轻地塞米松诱导的细胞损伤及凋亡。同时,为咖啡酸苯乙酯进一步应用于激素性骨质疏松症的防治提供实验依据和理论基础。
[1] Weinstein RS. Glucocorticoid-induced osteoporosis and osteonecrosis[J]. Endocrinol Metab Clin North Am, 2012, 41(3): 595-611.
[2] Diez-Perez A, Hooven FH, Adachi JD,etal. Regional differences in treatment for osteoporosis. The Global Longitudinal Study of Osteoporosis in Women (GLOW) [J]. Bone, 2011, 49(3): 493-498.
[3] Sun WX, Zheng HY, Lan J. Edaravone protects osteoblastic cells from dexamethasone through inhibiting oxidative stress and mPTP opening[J]. Mol Cell Biochem, 2015, 409(1-2): 51-58.
[4] Yang M, Huang Y, Chen J,etal. Activation of AMPK participates hydrogen sulfide-induced cyto-protective effect against dexamethasone in osteoblastic MC3T3-E1 cells[J]. Biochem Biophys Res Commun, 2014, 454(1): 42-47.
[5] Murtaza G, Karim S, Akram MR,etal. Caffeic acid phenethyl ester and therapeutic potentials[J]. Biomed Res Int, 2014. DOI: 10.1155/2014/145342.
[6] Kim H, Kim W, Yum S,etal. Caffeic acid phenethyl ester activation of Nrf2 pathway is enhanced under oxidative state: structural analysis and potential as a pathologically targeted therapeutic agent in treatment of colonic inflammation[J]. Free Radic Biol Med, 2013, 65:552-562.
[7] Lee S, Yoon CY, Byun SS,etal. The role of c-FLIP in cisplatin resistance of human bladder cancer cells[J]. J Urol, 2013, 189(6): 2327-2334.
[8] Liu L, Gu L, Ma Q,etal. Resveratrol attenuates hydrogen peroxide-induced apoptosis in human umbilical vein endothelial cells[J]. Eur Rev Med Pharmacol Sci, 2013, 17(1): 88-94.
[9] Liu Y, Zhang SP, Cai YQ. Cytoprotective effects of selenium on cadmium-induced LLC-PK1 cells apoptosis by activating JNK pathway[J]. Toxicol In Vitro, 2007, 21(4): 677-684.
[10] Hseu YC, Chou CW, Senthil Kumar KJ,etal. Ellagic acid protects human keratinocyte (HaCaT) cells against UVA-induced oxidative stress and apoptosis through the upregulation of the HO-1 and Nrf-2 antioxidant genes[J]. Food Chem Toxicol, 2012, 50(5): 1245-1255.
[11] Zhang S, Li D, Yang JY,etal. Plumbagin protects against glucocorticoid-induced osteoporosis through Nrf-2 pathway[J]. Cell Stress Chaperones, 2015, 20(4): 621-629.
[12] Maricic M. Update on glucocorticoid-induced osteoporosis[J]. Rheum Dis Clin North Am, 2011, 37(3): 415-431.
[13] 赵建宁, 包倪荣, 王与荣, 等. 地塞米松诱导原代培养的成骨样细胞凋亡的分子细胞学研究[J]. 医学研究生学报, 2004, 17(1): 15-17.
[14] Zhang N, Zhong J, Han S,etal. MicroRNA-378 Alleviates Cerebral Ischemic Injury by Negatively Regulating Apoptosis Executioner Caspase-3[J]. Int J Mol Sci, 2016, 17(9). DOI: 10.3390/ijms17091427.
[15] Krivoruchko A, Storey KB. Forever young: mechanisms of natural anoxia tolerance and potential links to longevity[J]. Oxid Med Cell Longev, 2010, 3(3): 186-198.
[16] Suh KS, Rhee SY, Jung WW,etal. Chrysanthemum zawadskii extract protects osteoblastic cells from highly reducing sugar-induced oxidative damage[J]. Int J Mol Med, 2013, 32(1): 241-250.
[17] Ray PD, Huang BW, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J]. Cell Signal, 2012, 24(5): 981-990.
[18] 段家翔, 甯交琳, 鲁开智. Nrf2出核转运机制及意义的研究进展[J]. 医学研究生学报, 2014, 27(8): 874-877.
[19] 王笑亮, 王汉东. Nrf2在中枢神经系统疾病中的神经保护作用[J]. 医学研究生学报, 2011, 24(7): 754-757.
[20] Zhang M, An C, Gao Y,etal. Emerging roles of Nrf2 and phase II antioxidant enzymes in neuroprotection[J]. Prog Neurobiol, 2013, 100(1):30-47.
(本文编辑:叶华珍; 英文编辑:王建东)
Caffeic acid phenethyl ester inhibits the apoptosis induced by dexamethasone via the regulation of Nrf-2 pathway in osteoblasts
LIN Qiang1, LI Hong-wei2,GUO Kai-jin2,ZHOU Bing2, LI Dong-ya2
(1.GraduateSchool,XuzhouMedicalUniversity,Xuzhou221004,Jiangsu,China; 2.DepartmentofOrthopedics,theAffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221002,Jiangsu,China)
Objective To explore the effect of caffeic acid phenethyl ester (CAPE) on the apoptosis of MC3T3-E1 preosteoblasts induced by dexamethasone (DEX). Methods MC3T3-E1 cells were exposed to DEX (10 μmol/L) to establish a model of osteoblast injury. The incubated MC3T3-E1 cells were pretreated with various concentrations of CAPE for 2 hours, and then cultured in combination with 10 μmol/L DEX for 24 hours. Cell proliferation was evaluated by cell count kit (CCK-8). The final concentration of drug was determined by the results of CCK-8, then cells randomly divided into four groups: Control group, CAPE group, DEX group, and CAPE+DEX group. Cell apoptosis rate was detected by Annexin V-FITC/PI staining and flow cytometry in each group. Caspase-3 activity was monitored by Caspase-3 activity assay kit; Intracelluar ROS was detected by DCFH-DA fluorescence staining.The expressions of Nrf-2 and HO-1 were examined by Western blot. Results Dexamethasone could induced MC3T3-E1 cell injury with overt morphological and cell activity changes at 24 hours, especially the 10 μmol/L DEX. Compared with control group, and the cell activi- ty was decreased significantly (P<0.01), while the level of intracellular ROS, cell apoptosis rate and Caspase-3 activity increased significantly (P<0.01). Moreover, the Nrf-2 and HO-1 was decreased significantly (P<0.01). Compare with DEX group, expression of Nrf-2 and HO-1 (P<0.01vsDEX group) in CAPE+DEX group were significantly increased (P<0.01). In addition, the levels of ROS, apoptosis and Caspase-3 activity were significantly lower in the CAPE+DEX group (P<0.01). Conclusion CAPE inhibits the level of ROS in osteoblasts via regulating Nrf-2 pathway, resulting in the reduction of apoptosis induced by dexamethasone.
Caffeic acid phenethyl ester; Dexamethasone; Osteoblast cell; Nrf-2 pathway; Apoptosis
徐州市科学技术局项目(KCl4SHl02)
1.221004徐州,徐州医科大学研究生学院; 2. 221002徐州,徐州医科大学附属医院骨科
李洪伟,E-mail:lihongwei2000@126.com
林 强,李洪伟,郭开今,等.咖啡酸苯乙酯通过Nrf-2 途径抑制地塞米松诱导的成骨细胞凋亡[J].东南国防医药,2017,19(2):126-131.
R681
A
1672-271X(2017)02-0126-06
10.3969/j.issn.1672-271X.2017.02.004
2016-11-05;
2017-02-15)
