超声内镜引导下无水乙醇注射法与外科手术法治疗良性胰岛素瘤的对比研究*
2017-05-09蒋艳娟覃山羽姜海行覃凤燕刘芷玲罗佐杰秦映芬周嘉梁瑜祯梁敏梁杏欢陈俊强覃新干
蒋艳娟,覃山羽,姜海行,覃凤燕,刘芷玲,罗佐杰,秦映芬,周嘉,梁瑜祯,梁敏,梁杏欢,陈俊强,覃新干
(广西医科大学第一附属医院 1.消化内科;2.内分泌科;3.胃肠腺体外科,广西 南宁 530021)
超声内镜引导下无水乙醇注射法与外科手术法治疗良性胰岛素瘤的对比研究*
蒋艳娟1,覃山羽1,姜海行1,覃凤燕1,刘芷玲1,罗佐杰2,秦映芬2,周嘉2,梁瑜祯2,梁敏2,梁杏欢2,陈俊强3,覃新干3
(广西医科大学第一附属医院 1.消化内科;2.内分泌科;3.胃肠腺体外科,广西 南宁 530021)
目的评估超声内镜(EUS)引导下无水乙醇注射法治疗良性胰岛素瘤的疗效与安全性,并与外科手术治疗法相比较。方法回顾性分析2011年4月-2016年2月在广西医科大学第一附属医院经EUS引导下无水乙醇注射法治疗或外科手术法治疗的38例良性胰岛素瘤临床资料。结果97.4%(37/38)的患者有典型的Whipple三联征,82.9%(29/35)患者低血糖发作时胰岛素释放指数(I/G)>0.3。术前B超、CT、磁共振成像(MRI)、正电子发射计算机断层显像(PET/CT)和EUS定位诊断胰岛素瘤阳性率分别为50.0%、67.6%、66.7%、75.0%和89.7%。18例行EUS引导下无水乙醇注射治疗(EUS-FNI组),20例行外科手术治疗(外科手术组),EUS-FNI组术后均无并发症发生,外科手术组中40.0%(8/20)患者出现并发症。与外科手术组相比,EUS-FNI组在手术时间、术中出血、术后并发症、术后住院时间和住院总费用上均明显降低(P<0.05)。所有患者均得到随访,EUS-FNI组最后一次无水乙醇注射治疗后所有患者血糖平稳在正常范围;外科手术组20例患者中,90.0%(18/20)患者术后无低血糖症状再发作,监测血糖在正常范围,10.0%(2/20)患者术后低血糖症状发作较术前减少。结论EUS引导下无水乙醇注射法治疗良性胰岛素瘤安全、有效。与外科手术法相比,具有微创、经济、并发症少和术后恢复快等优势。
胰岛素瘤;超声内镜;细针穿刺;乙醇注射;外科手术
胰岛素瘤是胰腺神经内分泌肿瘤的一类,起源于胰岛β细胞,约占胰岛细胞瘤的70.0%~80.0%,年发病率约为1/100~4/100[1]。该病可引起患者反复低血糖症状发作,进行性损害中枢神经系统,危害极大,一经确诊须尽快治疗。目前胰岛素瘤的治疗仍以外科手术治疗为主,超声内镜(endoscopic ultrasound,EUS)引导下无水乙醇注射法是近几年应用于胰岛素瘤治疗的新方式,具有微创、安全、并发症少和效果显著的特点[2-4]。本文回顾性分析我院经病理确诊的38例良性胰岛素瘤临床资料,评估EUS引导下无水乙醇注射法治疗良性胰岛素瘤的疗效与安全性,并与外科手术治疗法相比较,以评估前者的临床应用价值。
1 资料与方法
1.1 一般资料
选择2011年4月-2016年2月在广西医科大学第一附属医院经EUS引导下细针穿刺(endoscopic ultrasound-guided fine-needle aspiration,EUS-FNA)活检或手术病理检查明确诊断的38例良性胰岛素瘤的临床资料,其中18例行EUS引导下无水乙醇注射治疗(EUS-FNI组),20例行外科手术治疗。纳入标准:EUS-FNA病理活检或手术病理明确诊断为良性胰岛素瘤患者。排除标准:胰岛细胞癌;影像学提示肿瘤有转移或周边组织、器官浸润者。其中,男13例,女25例,年龄8~66(43.55±13.16)岁;病程1周~10年。本研究38例患者均经病理检查明确诊断为良性胰岛素瘤。38例患者共发现46个病灶,35例为单发,3例为多发(3例均发生在胰尾,病灶数量分别为2、4、5个);胰头10例,胰体12例,胰尾16例;肿瘤直径0.2~3.0(1.50±0.65)cm。EUS-FNI组与外科手术组胰岛素瘤患者的男女构成比、年龄、肿瘤直径、是否单发、肿瘤分布特点基本相近,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 研究方法
回顾性分析38例良性胰岛素瘤病例的临床特点、临床表现、定性及定位诊断方式、治疗方式和随访情况,其中EUS-FNI组需分析多次治疗病例手术时间、术中出血、术后住院日、住院费用计算标准:对患者每次手术时间、术中出血、术后住院日、住院费用进行统计,计算累加结果,以累加结果为最终结果。
1.3 统计学方法
采用SPSS 19.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,采用配对资料t检验比较;计数资料以例数或百分率进行描述,采用χ2检验比较。以P<0.05为差异有统计学意义。

表1 胰岛素瘤患者的一般临床特征Table 1 Baseline characteristics of patients with insulinoma
2 结果
2.1 临床表现
38例患者中37例(97.4%)有典型的Whipple三联征表现:反复发作不同程度的低血糖表现,多于晨起或劳力运动后出现,症状发作时血糖小于2.8 mmol/L。轻症者表现为饥饿、乏力、头晕、心悸和出冷汗等;重症者表现为意识模糊,四肢抽搐,晨间叫不醒,甚至意识丧失;低血糖发作时进食或口服葡萄糖后症状缓解。4例(10.5%)患者被误诊为癫痫;27例(71.1%)患者体重超标[体质指数(body mass index,BMI)≥24]。
2.2 实验室检查
38例患者经多次测定空腹血糖或症状发作时血糖,其中37例患者最低血糖小于2.8 mmol/L,最低血糖范围为0.35~3.20 mmol/L,平均(1.46± 0.63)mmol/L。当血糖低于2.8 mmol/L时,35例患者行同步胰岛素及同步C-肽测定,同步胰岛素测定范围为9.04~866.42 mU/L,同步C-肽测定范围为0.87~6.11 ng/ml,同时计算胰岛素释放指数(I/G)为0.04~8.70。参照胰岛素瘤定性诊断标准[5]:空腹或低血糖发作时血糖<2.8 mmol/L,同步血清胰岛素>36 mU/L,I/G>0.3,同步血清C-肽>200 pmol/L(0.6 ng/ml),血糖、同步血清胰岛素、I/G和同步血清C-肽定性诊断胰岛素瘤的阳性率分别是97.4%(37/38)、85.7%(30/35)、82.9%(29/35)和100.0%(35/35)。见表2。

表2 胰岛素瘤患者空腹或低血糖发作时实验室检查结果Table 2 Laboratory tests of patients with insulinoma when they on fasting or hypoglycemia
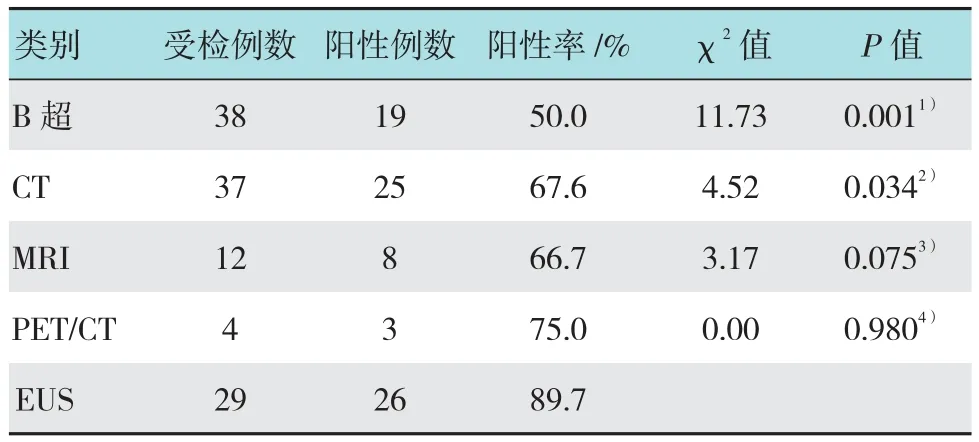
表3 胰岛素瘤患者术前定位诊断比较Table 3 Comparison of patients with insulinoma in localization diagnosis before surgery
2.3 影像学检查
38例患者术前均完善影像学检查,其中行B超检查38例,检出19例;行CT检查37例,检出25例;行磁共振成像(magnetic resonance imaging,MRI)检查12例,检出8例;行正电子发射计算机断层显像(positron emission computed tomography,PET/CT)检查4例,检出3例;行EUS检查29例,检出26例。胰岛素瘤定位诊断的阳性率依次为:B超50.0%(19/38)、CT 67.6%(25/37),MRI 66.7%(8/12),PET/CT 75.0%(3/4),EUS 89.7%(26/29)。EUS定位诊断胰岛素瘤阳性率明显高于B超及CT(P<0.05),与MRI及PET/ CT相比差异无统计学意义(P>0.05)。见表3。
2.4 治疗方式
EUS-FNI组18例患者共行29次EUS引导下无水乙醇注射治疗,其中3例注射3次,5例注射2次,10例注射1次。多次注射患者中,2例为多发(均在胰尾部,数量分别为2,4个);5例瘤体较大(直径1.5~2.7 cm)或紧邻胰管、血管,为确保安全,以小剂量分次进行注射;1例由于病灶较小(直径0.4 cm),治疗过程中未能准确将无水乙醇注入瘤体内而行了重复治疗。每次平均注射量(0.94±0.69)ml,每例平均注射量(1.42±1.14)ml。
20例患者接受外科手术治疗,行胰岛素瘤剜除术12例、胰体尾切除术3例、胰体尾切除+脾切术5例;开腹手术14例,腹腔镜手术6例(2例因术中无法定位病灶而中转开腹手术,1例因腔镜下无法分离病灶而中转开腹)。38例患者均手术成功,EUS-FNI组平均手术时间和平均术中出血量分别为(31.17± 14.06)min和(1.02±0.42)ml;外科组平均手术时间和平均术中出血量分别为(212.05±70.95)min和(196.25±154.12)ml。与外科手术组相比,EUS-FNI组平均手术时间、平均术中出血量明显减少,差异有统计学意义(P<0.05)。见表4。
2.5 治疗结果及术后恢复情况
EUS-FNI组10例注射1次患者术后30 min内血糖升高,无低血糖症状再发作;8例多次注射患者在首次注射后,低血糖发作频次不同程度减少,依据个体情况再次或多次注射治疗后无低血糖症状再发作。外科手术组20例患者切除肿瘤30~45 min后,血糖均不同程度升高,术后1或2周内血糖平稳在正常范围,无低血糖症状再发作。所有患者术后检测生命征、血常规、淀粉酶、C反应蛋白等,EUS-FNI组术后均无出血、穿孔和急性胰腺炎等并发症的发生,外科手术组术后8例(40.0%)患者出现并发症(胰漏并胸腔积液、胰腺假性囊肿2例,胰漏并腹部切口愈合不良1例,单纯胰漏2例,单纯胸腔积液2例,腹腔脓肿1例),除1例患者术口裂开肠管膨出行二次手术治疗外,其余的均保守治疗成功。EUS-FNI组术后平均住院日、平均住院费用和术后并发症发生率均明显低于外科手术组(P<0.05)。见表5。

表4 EUS-FNI组与外科手术组操作结果比较Table 4 Comparison of operating results between EUS-FNI group and surgical group

表5 EUS-FNI组与外科手术组术后住院日、住院费用及并发症比较Table 5 Comparison of postoperative hospitalizations,costs and complications between EUS-FNI group and surgical group
2.6 随访情况
EUS-FNI组患者在最后1次注射治疗后1、3、6、12和24个月对其进行规律随访,随访2~27个月,随访期间所有患者血糖平稳在正常范围,无低血糖症状再发作;复查EUS提示病灶较治疗前回声明显减低,复查造影增强超声胃镜(contrast enhanced endoscopic ultrasonography,CE-EUS)提示病灶由富血供变为乏血供表现,复查CT提示病灶体积稍变小,未见病灶消失病例;目前最长随访时间为27个月,该患者生活规律、饮食正常,未再出现低血糖。外科治疗组20例患者均获得电话随访,随访9~60个月,其中18例(90.0%)患者随访期间无低血糖症状再发作,监测血糖平稳在正常范围,影像学复查未发现复发病灶;2例(10.0%)患者低血糖症状发作较术前明显减少,但多次影像学复查未见残留或复发病灶。
3 讨论
胰岛素是最常见的胰腺神经内分泌肿瘤,其特点是90.0%良性、90.0%单发、90.0%直径小于2 cm[5]。典型的Whipple三联征及低血糖发作时I/G>0.3是胰岛素瘤的重要诊断标准,结合同步血清胰岛素浓度≥36 pmol/L,C-肽浓度≥200 pmol/L大多可明确诊断[6]。本研究97.4%的患者有典型的Whipple三联征,82.9%的患者低血糖发作时I/G>0.3,85.7%的患者同步血清胰岛素浓度≥36 mU/L,100.0%的患者C-肽浓度≥200 pmol/L,支持胰岛素瘤的诊断。EUS是目前定位诊断胰腺神经内分泌瘤的最准确的方法,ISHIKAWA等[7]报道,其对胰头部及胰尾部神经内分泌瘤的定位准确率分别为100.0%及92.5%,明显高于腹部B超及CT。EUS-FNA不仅可获取穿刺物作常规细胞学检查,还可利用细胞块技术行免疫组化提高胰腺实性占位的诊断敏感性[8]。本研究B超、CT、MRI、PET/CT和EUS术前定位诊断胰岛素瘤的阳性率分别为50.0%、67.6%、66.7%、75.0%和89.7%,EUS诊断阳性率明显高于B超及CT,与既往文献报道相似;文献[9]报道MRI诊断胰岛素瘤的平均阳性率为53.3%,PET/CT的敏感性可达90.0%以上,本研究EUS、MRI、PET/CT诊断胰岛素瘤阳性差异无统计学意义,考虑与纳入病例数量少有关。
目前胰岛素瘤的标准治疗为外科手术,手术治疗的治愈率在89.0%~98.0%[10]。外科手术治疗胰岛素瘤中以开腹手术为经典式,该手术创伤大、并发症多、术后恢复慢,且影响美观;腹腔镜下切除术是外科手术治疗胰岛素瘤的另一种方法,1996年由GANGER等[11]首先报道。MEHRABI等[12]汇总了114篇文献包括6 222例经外科手术治疗的胰岛素瘤临床资料,发现开腹手术和腹腔镜手并发症发生情况相近,分别为35.4%和32.8%,并统计了胰岛素瘤腹腔镜手术治疗问世近20年的应用情况,仅14.1%患者使用此方法。其原因在于腹腔镜手术的局限性,一方面其适用范围窄,另一方面该方式可出现不能定位或无法切除病灶而中转开腹手术,本研究3例腹腔镜手术中转开腹手术的患者中2例因术中不能定位病灶,1例因病灶较深无法切除。
EUS引导下无水乙醇注射治疗是近几年应用于胰岛素瘤治疗的新方法,2006年JÜRGENSEN等[2]首次将EUS引导下无水乙醇注射治疗应用于胰岛素瘤患者,初步显示其可行性。本研究通过线性阵列EUS,避开胰管、血管、神经,明确肿瘤位置,使用25G穿刺针经胃壁或十二指肠壁进行穿刺,确保针道在肿瘤内部后,使用1 ml精密注射器,取适量无水乙醇,缓慢注入肿瘤内部,直至高回声云雾状在肿瘤内扩展开来,撤针前持针瘤内停留约1 min,减少乙醇携带造成穿刺道邻近正常组织的坏死。整个操作过程耗时与外科手术时间相比大大缩短,减少了潜在的麻醉风险和麻醉费用;由于穿刺针小,仅对胃壁或十二指肠壁轻微损伤,加之操作过程中在多普勒严密监控下完成,避免了穿刺针误穿入血管或胰管的风险,减少了胰腺炎、出血和感染等并发症的发生,有利于术后恢复;该操作除穿刺针耗材外,无其他高费用耗材,减少了治疗费用。2013年,本院完成国内首例EUS引导下无水乙醇瘤内注射治疗胰岛素瘤[13],术前均经EUSFNA获取病理组织,并通过细胞块免疫组化检查特异性标志物(如Syn、CgA、Ki-67)及核分裂计数确诊为良性胰岛素瘤,到目前为止共完成18例治疗。通过与外科手术治疗相比发现,EUS-FNI组手术时间、术中出血、术后并发症、术后住院时间及住院费用明显小于外科手术组,体现了EUS引导下无水乙醇注射治疗胰岛素瘤的明显优势。
胰瘘、出血、胸腔积液、腹腔脓肿、切口愈合不良和胰腺假性囊肿是胰岛素瘤手术治疗后的常见并发症,其中胰漏发生率最高。本研究外科手术组并发症发生率为40.0%,其中胰漏发生率为25.0%(5/20)。早期报道的EUS引导下无水乙醇注射治疗胰岛素瘤也出现了不同程度的并发症,包括胰腺炎、胰腺假性囊肿等[2,14]。本研究EUS-FNI组18例患者术后均无并发症发生,与YANG等[4]报道一致。笔者总结经验如下:①相对无菌操作:尽管胃肠道为有菌环境,仍保证穿刺针、操作台、注射器相对无菌,减少外界细菌经穿刺针道进入胰腺内,减少术后感染的风险;②穿刺针选择:选择直径较小的25G穿刺针,一方面可减少对胃壁、十二指肠壁的损伤,另一方面有利于控制注射乙醇速度,避免乙醇注射太快渗透至周围正常组织,从而减少出血、穿孔、术后胰腺炎的风险;③无水乙醇量的选择:根据病灶大小和瘤体解剖位置及毗邻关系选择无水乙醇注射量,如对紧临胰管或血管的病灶尽可能减少每次注射量;④治疗次数的选择:采用小剂量、重复注射治疗的方式,以缓解临床症状为目标,而不是追求一次性完整的肿瘤消融。
结合既往的研究结果[2,4,14],笔者认为与外科手术相比,EUS引导下无水乙醇注射治疗胰岛素瘤具有更广泛应用前景:适用于临床上难以耐受手术、有手术禁忌证者或拒绝手术者;也适用于胰腺内多发病灶或复发病灶,无法完全手术切除者,本研究对2例多发病灶患者经分次、瘤内分别少量无水乙醇注射治疗,均达到满意效果。
综上所述,EUS引导下无水乙醇注射治疗胰岛素瘤具有疗效确切、安全、微创、经济、术后恢复快和适用范围广等优点。然而,由于本研究系回顾性分析,且纳入病例数少,随访时间短,尚能不对两者的远期疗效进行比较,有待大样本前瞻性对照研究及长期随访证实其治疗价值。
[1] OKABAYASHI T, SHIMA Y, SUMIYOSHI T, et al. Diagnosis and management of insulinoma[J]. World J Gastroenterol, 2013, 19(6): 829-837.
[2] JÜRGENSEN C, SCHUPPAN D, NESER F, et al. EUS-guided alcohol ablation of an insulinoma[J]. Gastrointestinal Endoscopy,2006, 63(7): 1059-1062.
[3] QIN S Y, LU X P, JIANG H X. EUS-guided ethanol ablation of insulinomas: case series and literature review[J]. Medicine (Baltimore), 2014, 93(14): e85.
[4] YANG D, INABNET W B 3RD, SARPEL U, et al. EUS-guided ethanol ablation of symptomatic pancreatic insulinomas[J]. Gastrointest Endosc, 2015, 82(6):1127.
[5] 赵玉沛. 胰腺病学[M]. 北京: 人民卫生出版社, 2007: 558-565.
[5] ZHAO Y P. Pancreatology[M]. Beijing: People’s Medical Publishing House, 2007: 558-565. Chinese
[6] 中华医学会外科学分会胰腺外科学组. 胰腺内分泌肿瘤的诊断和外科治疗指南(讨论稿)[J]. 中华外科杂志, 2009, 47(5):257-259.
[6] Department of pancreatic surgery, Chinese Academy of Medical Sciences. Guidelines for the diagnosis and surgical treatment of pancreatic endocrine tumors (discussion draft)[J]. Chinese Journal of Surgery, 2009, 47(5): 1257-259. Chinese
[7] ISHIKAWA T, ITOH A, KAWASHIMA H, et al. Usefulness of EUS combined with contrast-enhancement in the differential diagnosis of malignant versus benign and preoperative localization of pancreatic endocrine tumors[J]. Gastrointest Endosc, 2010, 71(6): 951-959.
[8] QIN S Y, ZHOU Y, LI P, et al. Diagnostic efficacy of cell block immunohistochemistry, smear cytology, and liquid-based cytology in endoscopicultrasound-guided fi ne-needle aspiration of pancreatic lesions:a single-institution experience[J]. PLoS One, 2014, 9(9): e108762.
[9] MEHRABI A, FISCHER L, HAFEZI M, et al. A systematic review of localization, surgical treatment options, and outcome of insulinoma[J]. Pancreas, 2014, 43(5): 675-686.
[10] PLACZKOWSKI K A, VELLA A, THOMPSON G B, et al. Secular trends in the presentation and management of functioning insulinoma at the Mayo Clinic, 1987-2007[J]. J Clin Endocrinol Metab, 2009, 94(4): 1069-1073.
[11] GANGER M, POMP A, HERRERA M F. Early experience with laparoscopic resections of islet cell tumors[J]. Surgery, 1996, 120(6): 1051-1054.
[12] MEHRABI A, FISCHER L, HAFEZI M, et al. A systematic review of localization, surgical treatment options, and outcome of insulinoma[J]. Pancreas, 2014, 43(5): 675-686.
[13] 覃山羽, 姜海行, 雷荣娥, 等. 超声内镜引导下无水酒精瘤内注射治疗胰岛细胞瘤的观察研究[J]. 微创医学, 2013, 8(6): 669-671.
[13] QIN S Y, JIANG H X, LEI R E, et al. Observational study on EUS-guided ethanol ablation of insulinoma[J]. Journal of Minimally Invasive Medicine, 2013, 8(6): 669-671. Chinese
[14] DEPREZ P H, CLAESSENS A, BORBATH I, et al. Successful endoscopic ultrasound-guided ethanol ablation of a sporadic insulinoma[J]. Acta Gastroenterol Belg, 2008, 71(3): 333-337.
(曾文军 编辑)
Comparison between EUS-guided ethanol ablation and surgical treatment of benign insulinoma*
Yan-juan Jiang1, Shan-yu Qin1, Hai-xing Jiang1, Feng-yan Qin1, Zhi-ling Liu1, Zuo-jie Luo2, Ying-fen Qin2, Jia Zhou2, Yu-zhen Liang2, Min Liang2, Xing-huan Liang2, Jun-qiang Chen3, Xin-gan Qin3
(1.Department of Gastroenterology; 2.Department of Endocrinology; 3.Department of Gastrointestinal Gland Surgery, the First Aff i liated Hospital of Guangxi Medical University, Nanning, Guangxi 530021, China)
ObjectiveTo evaluate the safety and efficacy of endoscopic ultrasound (EUS) guided ethanol ablation of benign insulinoma and compare its’ advantages and disadvantages with surgical treatment.MethodsFrom April 2011 to February 2016, clinical data of 38 patients with benign insulinoma treated by EUS-guided ethanol ablation or surgical treatment were retrospectively analyzed.Results97.4% (37/38) patients had a typical clinical manifestation of Whipple’s triad, and the I/G ratio of 82.9% patients (29/35) was more than 0.3 with their onset of hypoglycemia. The positive preoperative etiologic diagnosis rates of transabdominal ultrasonography, CT, MRI, PET/CT and EUS were 50.0%, 67.6%, 66.7%, 75.0%, 89.7% respectively. In the current study, 18 patients underwent EUS-guided ethanol ablation (EUS-FNI group) and 20 patients received surgicaltreatment (surgical group). Compared with the surgical group, the operation time, intraoperative hemorrhage volume, postoperative complications, length of stay and hospitalization costs were significantly reduced in the EUS-FNI group (P< 0.05). No treatment-related complications was observed in EUS-FNI group, while 40.0% (8/20) patients in surgical group had complications. During the follow-up period, all these patients maintained stable blood glucose without taking medication, and there’s no recurrence of insulinoma in EUS-FNI group after the last treatment with alcohol injection; In surgical group, only 90.0% (18/20) patients had no recurrence, episode of hypoglycemia was less after the operation in 10.0% (2/20) patients.ConclusionEUS-guided ethanol ablation of benign insulinoma is safe and effective, compared with traditional surgical treatment, EUS-guided ethanol ablation is minimally invasive, costs less, recovers fast after treatment and has fewer complications.
insulinoma; endoscopic ultrasound; fi ne-needle aspiration; ethanol ablation; surgical treatment
R736.7
A
10.3969/j.issn.1007-1989.2017.04.002
1007-1989(2017)04-0008-06
2016-09-12
广西壮族自治区卫生和计划生育委员会自筹经费科研项目(No:Z2016322);国家自然科学基金(No:31360221)
覃山羽,E-mail:qsy0511@163.com
