银杏内酯A对LPS诱发肝细胞损伤的保护作用及机制
2017-05-03姜璐王伟芹路士华高金柱曹志群
姜璐,王伟芹,路士华,高金柱,曹志群
(1山东中医药大学附属医院,济南250014;2中国中医科学院西苑医院)
·基础研究·
银杏内酯A对LPS诱发肝细胞损伤的保护作用及机制
姜璐1,王伟芹1,路士华1,高金柱2,曹志群1
(1山东中医药大学附属医院,济南250014;2中国中医科学院西苑医院)
目的 探讨银杏内酯A(GA)对脂多糖(LPS)诱发肝细胞损伤的保护作用及可能机制。方法 将大鼠肝细胞随机分为6组:正常组、LPS组、LPS+CLI-095组、LPS+GA 20 μmol/L组、LPS+GA 10 μmol/L组、LPS+GA 20 μmol/L +LY294002组。MTT法检测细胞活性,Western blotting法检测肝细胞Toll样受体4(TLR4)表达,检测肝细胞NF-κB活性[NF-κB p65、磷酸化-NF-κB p65 (p-p65)、磷酸化-IκBα (p-IκBα)、NF-κB p65基因结合活性],检测培养液中炎症细胞因子IL-1β、IL-6、TNF-α水平。结果 与正常组比较,LPS组肝细胞TLR4表达增加(P<0.05),NF-κB p65、p-p65、p-IκBα水平升高(P均<0.05),NF-κB p65基因结合活性增强(P<0.05),培养液中IL-1β、IL-6、TNF-α水平升高(P均<0.05),细胞活性降低(P<0.05)。与LPS组比较,GA剂量依赖性地抑制TLR4表达及NF-κB信号激活(P均<0.05),降低上述炎症因子的释放(P均<0.05),同时提高细胞活性(P<0.05)。TLR4抑制剂CLI-095干预后,LPS引起的肝细胞上述变化被阻断(P<0.05)。PI3K/Akt抑制剂LY294002可抵消GA对肝细胞的保护作用(P均<0.05)。结论 GA可抑制LPS引起的肝细胞炎症反应、提高细胞活性,其机制可能与抑制LPS引起的TLR-NF-κB信号过度激活有关;PI3K/Akt通路参与了LPS诱发肝细胞损伤过程。
肝细胞;银杏内酯A;脂多糖;炎症;Toll 样受体4;核因子-κB
多种生物及非生物因素均可引起肝细胞炎症反应,致肝脏损伤,抑制肝细胞过强的炎症反应是一项重要的保护肝脏措施。在肝脏的炎症反应过程中Toll 样受体4(TLR4)-NF-κB信号通路有重要作用[1]。文献显示脂多糖(LPS)常用于制备肝细胞炎症反应模型,其诱发炎症的机制与TLR4-NF-κB信号通路有关[2]。银杏内酯A(GA)是中药银杏干燥叶的提取物之一,研究[3]显示,GA具有抗炎活性,但其对LPS诱发的肝细胞炎症反应是否具有抑制作用鲜见报道。2015年6月,我们采用LPS诱发肝细胞炎症反应,并观察GA对肝细胞炎症反应及TLR4-NF-κB信号通路的影响。
1 材料与方法
1.1 材料 GA(德国Fluka公司);MTT、LPS、CLI-095、LY294002(美国Sigma公司);DMEM培养液、胎牛血清(美国Gibco公司);TLR4兔抗大鼠一抗、山羊抗兔二抗(武汉博士德生物工程公司);NF-κB p65、p-p65、p-IκBα、IL-1β、IL-6、TNF-α ELISA试剂盒(武汉华美公司;Cell Signaling公司);TranAMTMNF-κB p65 Chemi 转录因子分析试剂盒(美国Active Motif公司);CO2培养箱(美国Thermo公司);ChemiDoc XRS 化学发光成像系统(美国Bio-Rad公司);酶标仪(美国Molecular Devices公司)。
1.2 大鼠原代肝细胞分离及培养 参照文献[4]方法分离原代肝细胞,将SD大鼠麻醉后,胶原酶(0.5 g/L)两步法对肝细胞进行原位灌流消化分离,以DMEM培养液(加入10%胎牛血清及20 U/L胰岛素)洗涤细胞后进行重悬,细胞最终密度调整为1×106/L,将细胞接种于细胞培养瓶,置于5%CO2、37 ℃饱和湿度环境中培养。
1.3 GA干预后肝细胞活性检测 肝细胞常规培养24 h后,分别加入0、5、10、20、30 μmol/L GA继续培养24 h,然后加入0.5 μg/mL的MTT避光培养4 h。移去孵育液,将培养皿底部的结晶加入DMSO进行溶解,酶标仪检测570 nm波长下吸光度,评价细胞活性。
1.4 GA干预LPS孵育肝细胞后的活性检测 将肝细胞分为6组:正常组、LPS组、LPS+CLI-095组、LPS+GA 20 μmol/L组、LPS+GA 10 μmol/L组、LPS+GA 20 μmol/L+LY294002组。肝细胞常规培养24 h后,各组分别加入相应药物(其中LPS剂量为20 ng/mL;CLI-095剂量为5 μmol/L;LY294002剂量为10 μmol/L)继续培养24 h。然后加入0.5 μg/mL的MTT避光培养4 h。移去孵育液,将培养皿底部的结晶加入DMSO进行溶解,酶标仪检测570 nm波长下吸光度,评价细胞活性。
1.5 肝细胞TLR4表达检测 采用Western blotting法。提取各组肝细胞总蛋白,取40 μg蛋白以SDS聚丙烯酰胺凝胶电泳进行分离,转移至硝酸纤维素膜,37 ℃环境中用封闭液封闭1 h后分别加入1∶1 000的TLR4、β-actin一抗,4 ℃孵育过夜,洗涤后加入相应1∶1 000的二抗,37 ℃环境中孵育2 h,加入显影液显影后,通过化学发光成像系统检测,以目的蛋白条带与β-actin条带灰度比值作为蛋白相对表达量,实验重复3次。
1.6 肝细胞中NF-κB活性测定 用细胞裂解液将细胞裂解,离心后收集上清液,参照文献[5]报道采用ELISA法检测其中的NF-κB p65、p-p65及p-IκBα。从肝细胞中提取核蛋白,参照文献[5]采用TranAMTMNF-κB p65 Chemi 转录因子分析试剂盒检测NF-κB p65基因结合活性。每个样本设3个复孔,取平均值。
1.7 肝细胞中炎症因子水平检测 收集细胞培养液,采用ELISA法检测培养液中IL-1β、IL-6及TNF-α,每个样本设3个复孔取平均值,严格按说明书操作。
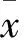
2 结果
2.1 GA对肝细胞的安全性评价 0、5、10、20、30 μmol/L GA培养肝细胞24 h,细胞活性分别为(100±5.64)%、(102±6.05)%、(105±6.99)%、(103±7.21)%、(106±8.02)%,各剂量间细胞活性比较差异无统计学意义(P均>0.05)。
2.2 GA对LPS孵育肝细胞活性的影响 正常组、LPS组、LPS+CLI-095组、LPS+GA 20 μmol/L组、LPS+GA 10 μmol/L组、LPS+GA 20 μmol/L+LY294002组细胞活性分别为(100±6.37)%、(55.36±5.66)%、(95.35±6.94)%、(86.49±9.30)%、(69.61±5.27)%、(59.99±7.02)%,与正常组比较,LPS组细胞活性下降(P<0.05)。与LPS组比较,LPS+CLI-095组、LPS+GA 20 μmol/L组与LPS+GA 10 μmol/L组细胞活性显著升高(P均<0.05),且LPS+GA 20 μmol/L组细胞活性高于LPS+GA 10 μmol/L组(P<0.05)。
2.3 GA对LPS孵育的肝细胞TLR4表达的影响 正常组、LPS组、LPS+CLI-095组、LPS+GA 20 μmol/L组、LPS+GA 10 μmol/L组、LPS+GA 20 μmol/L+LY294002组TLR4相对表达量分别为(0.18±0.03)%、(1.06±0.15)%、(0.38±0.05)%、(0.24±0.03)%、(0.59±0.07)%、(0.79±0.11)%,与正常组比较,LPS组TLR4表达显著升高(P<0.05)。与LPS组比较,LPS+GA 20 μmol/L组与LPS+GA 10 μmol/L组TLR4表达显著降低(P<0.05),且LPS+GA 20 μmol/L组TLR4表达低于LPS+GA 10 μmol/L组(P<0.05)。
2.4 GA对LPS孵育的肝细胞NF-κB活性的影响 见表1。GA可剂量依赖性抑制LPS引起的NF-κB信号激活(P<0.05),而PI3K/Akt抑制剂LY294002可抵消GA对NF-κB信号的抑制作用(P<0.05)。正常组、LPS组、LPS+CLI-095组、LPS+GA 20 μmol/L组、LPS+GA 10 μmol/L组、LPS+GA 20 μmol/L+LY294002组GA对LPS孵育的肝细胞NF-κB p65基因结合活性的OD值分别为0.23±0.03、0.79±0.11、0.30±0.04、0.36±0.06、0.58±0.08、0.68±0.08,与正常组比较,LPS组NF-κB p65基因结合活性升高(P<0.05);与LPS组比较,LPS+CLI-095组、LPS+GA 20 μmol/L组、LPS+GA 10 μmol/L组NF-κB p65基因结合活性下降(P均<0.05);与LPS+GA 20 μmol/L组比较,LPS+GA 10 μmol/L组、LPS+GA 20 μmol/L+LY294002组NF-κB p65基因结合活性升高(P均<0.05)。
2.5 GA对LPS孵育的肝细胞炎症因子水平的影响 见表1。
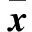
表1 GA对LPS孵育的肝细胞NF-κB信号及炎症因子水平的影响(±s)
注:与正常组比较,*P<0.05;与LPS组比较,△P<0.05;与LPS+GA 20 μmol/L组比较,#P<0.05。
3 讨论
多种肝脏疾病均涉及炎症反应,抑制炎症反应是多种肝脏疾病的重要治疗策略之一。诸多中药及其有效提取成分通过抗炎作用而起到肝脏保护作用。GA是中药银杏干燥叶的提取物之一,其在多种疾病的动物及细胞模型中显示了良好的抗炎作用[3],但其对肝细胞炎症反应的作用报道较少。为了排除GA本身对肝细胞可能存在的毒性,本研究以不同浓度的GA孵育肝细胞,结果显示0~30 μmol/L GA对肝细胞活性影响无统计学意义,表明在此浓度范围内GA对肝细胞不产生毒性,可安全用于实验。
LPS现已广泛用于动物及细胞中诱发炎症反应,制备炎症模型。本研究采用LPS对肝细胞进行刺激,结果显示经LPS刺激,肝细胞释放大量炎症因子IL-1β、IL-6及TNF-α,这与既往文献报道LPS增加细胞炎症因子分泌的结果一致[6]。而经过GA治疗,肝细胞释放的上述炎症因子显著减少,表明GA对LPS引起的肝细胞炎症反应有抑制作用。另外,本研究结果显示LPS刺激后肝细胞活性显著降低,而GA剂量依赖性提高肝细胞活性,表明GA对LPS引起的肝细胞损伤具有保护作用,可能与抑制LPS引起的炎症反应有关。研究[7]显示,LPS可通过TLR2、TLR4等发挥作用,其中TLR4是LPS的主要受体之一,TLR4被激活后可引起一系列炎症反应。NF-κB是TLR4下游的一个重要转录因子[8],通常位于细胞质内,因与抑制因子IκB结合而处于无活性状态。当LPS与TLR4结合,IκB被磷酸化而失去对NF-κB的抑制作用,NF-κB发生磷酸化而被激活,进入细胞核促进其靶基因的转录,其中包括炎症因子IL-1β、IL-6及TNF-α等基因转录。本研究结果显示,LPS能显著增加肝细胞TLR4表达,TLR4下游的NF-κB信号被激活,表现为NF-κB p65、p-p65及p-IκBα水平显著升高、NF-κB p65基因结合活性显著增加。为确认TLR4在LPS导致的NF-κB激活及炎症因子释放中的作用,本研究在予以LPS刺激同时,将一组细胞予TLR4阻滞剂CLI-095,结果显示CLI-095阻断了LPS引起的肝细胞NF-κB激活及炎症因子释放,表明LPS引起的肝细胞NF-κB激活及炎症因子释放是由TLR4介导的。此与既往文献报道结果一致[9]。另外,本研究结果显示,GA剂量依赖性抑制LPS刺激引起的TLR4表达上调及NF-κB激活,提示GA抑制炎症因子释放的机制可能与抑制TLR4-NF-κB信号通路有关。
TLR4表达受多种信号调控,近年研究显示PI3K/Akt是调节TLR4表达的重要信号通路[10,11]。在多种细胞中,PI3K/Akt激活可显著减少LPS诱发的IL-6、TNF-α等炎症因子释放。本研究结果发现LY294002可显著抑制GA保护肝细胞、抑制NF-κB激活及炎症因子释放的作用,表明PI3K/Akt参与介导了GA的药理作用发挥。
综上所述,GA可抑制LPS引起的肝细胞炎症反应、提高细胞活性,其机制可能与抑制LPS引起的TLR-NF-κB信号过度激活有关;PI3K/Akt通路参与了LPS诱发肝细胞损伤过程。
[1] Lai L, Chen Y, Tian X, et al. Artesunate alleviates hepatic fibrosis induced by multiple pathogenic factors and inflammation through the inhibition of LPS/TLR4/NF-κB signaling pathway in rats [J]. Eur J Pharmacol, 2015,765:234-241.
[2] Yao H, Hu C, Yin L, et al. Dioscin reduces lipopolysaccharide-induced inflammatory liver injury via regulatingTLR4/MyD88 signal pathway [J]. Int Immunopharmacol, 2016,36:132-141.
[3] Zhao Q, Gao C, Cui Z. Ginkgolide A reduces inflammatory response in high-glucose- stimulated human umbilical vein endothelial cells through STAT3-mediated pathway [J]. Int Immunopharmacol, 2015,25(2):242-248.
[4] 周钧,王琴,王群伟,等.去甲斑蝥素对 LPS 诱导的体外培养的肝细胞损伤的保护作用[J].中南大学学报(医学版),2012,37(3):285-289.
[5] Li Z, Zheng J, Zhang N, et al. Berberine improves airway inflammation and inhibits NF-κB signaling pathway in an ovalbumin-induced rat model of asthma [J]. J Asthma, 2016,53(10):999-1005.
[6] Lv R, Zhou W, Zhang LD, et al. Effects of hydroxyethyl starch on hepatic production of cytokines and activation of transcription factors in lipopolysaccharide-administered rats [J]. Acta Anaesthesiol Scand, 2005,49(5):635-642.
[7] Lüttgenau J, Herzog K, Strüve K, et al. LPS-mediated effects and spatio-temporal expression of TLR2 and TLR4 in the bovine corpus luteum [J]. Reproduction, 2016,151(4):391-399.
[8] Fu H, Hu Z, Di X, et al. Tenuigenin exhibits protective effects against LPS-induced acute kidney injury via inhibiting TLR4/NF-κB signaling pathway [J]. Eur J Pharmacol, 2016,791:229-234.
[9] Odena G, Chen J, Lozano JJ, et al. LPS-TLR4 pathway mediates ductular cell expansion in alcoholic hepatitis [J]. Sci Rep, 2016,6:35610.
[10] Ke B, Shen XD, Ji H, et al. HO-1-STAT3 axis in mouse liver ischemia/reperfusion injury: regulation of TLR4 innate responses through PI3K/PTEN signaling [J]. J Hepatol, 2012,56(2):359-366.
[11] 杨如会,刘并进.西红花酸对RAW264.7巨噬细胞TLR4/NF-κB信号通路的抑制作用及机制探讨[J].山东医药,2015,55(9):15-17.
山东省中医药管理局基金资助项目(2009-33)。
10.3969/j.issn.1002-266X.2017.09.008
R575
A
1002-266X(2017)09-0028-03
2016-12-25)
