NFAT5基因报告载体的构建及其与miR-155关系的实验研究*
2017-05-03李文婷张亚洁张同威贾赤宇
舒 彬,李文婷,刘 真,张亚洁,尹 斌,赵 盼,张同威,贾赤宇△
(1.河北北方学院研究生部,河北张家口 075000;2.解放军第三○九医院烧伤整形科,北京 100091)
·论 著·
NFAT5基因报告载体的构建及其与miR-155关系的实验研究*
舒 彬1,李文婷2,刘 真2,张亚洁2,尹 斌2,赵 盼1,张同威2,贾赤宇2△
(1.河北北方学院研究生部,河北张家口 075000;2.解放军第三○九医院烧伤整形科,北京 100091)
目的 通过生物信息软件预测出miR-155的靶基因,构建miR-155靶基因荧光素酶基因报告载体,验证其与miR-155的对应关系。方法 以数据库 miR Base为依据,对miR-155进行生物信息学分析,通过Target Scan、Mir Base、Pic Tar三大软件预测miR-155的靶基因;将设计合成的T淋巴细胞核因子5(NFAT5)及其突变序列NFAT5-mu序列分别克隆至荧光素酶报告质粒pMIR-REPORTTMLuciferace;将第4代人胚胎肾293AD(HEK-293AD)细胞按随机数字表法分为4组:miR-155 mimics+pMIR-NFAT5组、miR-155 mimics+pMIR-NFAT5-mu组、miR-155 inhibitor+pMIR-NFAT5组、miR155 Negative control+pMIR-NFAT5组与对照质粒(pRL-TK)共转染24 h后用双荧光素酶检测试剂盒测定相对荧光素酶活性。结果 Mirbase、TargetScan、PicTar预测交叉结果显示,NFAT5基因3′UTR与miR-155存在结合互补位点;构建pMIR-NFAT5、pMIR-NFAT5-mu重组质粒经酶切及测序鉴定正确;双荧光素酶报告基因检测系统显示:pMIR-NFAT5+miR155 mimics组较pMIR-NFAT5+miR-control 组荧光素酶活性降低,差异有统计学意义(P<0.01);而其他组间差异无统计学意义(P>0.05)。结论 成功构建pMIR-NFAT5、pMIR-NFAT5-mu荧光素酶报告基因重组质粒;证实miR-155对NFAT5基因mRNA 3′-UTR具有靶向调控作用,为下一步研究miR-155在吸入性肺损伤机制中的作用提供前期实验室数据和方法。
T淋巴细胞核因子5;miR-155;荧光素酶基因报告载体
急性吸入性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)是指心源性以外的各种肺内、外致病因素(创伤,休克,严重感染,吸入有毒气体,某些药物中毒)引起的急性、进行性、缺氧性呼吸衰竭。据统计,烧伤患者合并吸入性损伤约占5%~10%,重度吸入性损伤的病死率高达80%,是烧伤早期主要死亡原因之一[1-2]。其发病机制主要是炎症因子骤然增加,所致的失控炎症反应有关[3-4]。核因子κB(NF-κB)信号转导通路的激活和大量的巨噬细胞的浸润在ALI/ARDS的病理生物学过程中有着重要作用[5-6]。微RNA(miRNA)作为最大的一类基因表达调控因子,miRNA通过与靶mRNA的3′-UTR区互补或部分互补的结合,使mRNA降解或介导其翻译抑制,参与基因转录后水平调控,在细胞发育、增殖、分化和凋亡等生物学行为中发挥着重要作用[6]。本课题组证实,miR-155在免疫应答中起重要作用[7]。本文拟构建miR-155靶基因荧光素酶基因报告载体,验证其与miR-155的对应关系,为下一步研究miR-155在吸入性肺损伤机制中的作用提供前期实验室数据和方法。
1 材料与方法
1.1 材料
1.1.1 主要仪器 Bio-ard chromo4荧光定量PCR仪(美国Bio-ard公司),化学发光测定仪Luminometer(美国Promega公司),基因扩增仪(杭州博日科技有限公司),Q3000型Quawell分光光度计(北京鼎国昌盛生物技术有限责任公司),L1低温链接仪(珠海黑马医学仪器有限公司),低温台式高速离心机(德国Eppendorf公司),恒温CO2细胞培养箱(日本Sanyo公司),Gen5酶标仪(美国生物科技公司),超净工作台(苏州尚田洁净有限公司),倒置显微镜、数码相机(日本Olympus公司),恒温培养振荡器(上海智城分析仪器制造有限公司),全自动雪花制冰机IMS-30(雪花电器有限公司),DW-86L628超低温保存箱(海尔集团),M8/4R酶标洗板仪(日本Olympus公司),可透射仪(北京金博益生物技术有限公司),DYY-7C型电泳仪电泳(北京市六-仪器厂)。
1.1.2 主要试剂 质粒抽提试剂盒(美国Omega公司),寡核苷酸片段(Invitrogen 公司),胶回收试剂盒(北京天根生化科技有限公司),限制性内切酶HindⅢ、SpeⅠ、ApaⅠ、BamHI(广州锐博有限公司),2×ligation solution Master Mix(中科瑞泰生物科技有限公司),DNA marker(北京庄盟国际生物基因科技有限公司),质粒中量制备试剂盒(AxyGen公司),溴化乙锭(ethidium bromide,EB),琼脂粉(美国Sigma公司),GeneJammer转染试剂(美国Stratagene公司)。
1.1.3 菌种及细胞 E.coli DH5α菌株、HEK-293AD细胞由解放军总参谋部总医院结核病研究所生物化学实验室孙卫国博士惠赠:pMIR-REPORTTMLuciferace质粒受赠于Promega公司;pRL-TK质粒购自Promega公司,见图1。

图1 pMIR-REPORTTM Luciferace(A)和 pRL-TK(B)质粒图谱
1.2 方法
1.2.1 miR-155的靶基因的预测 miR-155是人类第21号染色体非编码转录本BIC第3个外显子内,人、鼠、狗、猩猩,以及鸡的基因组中广泛存在;以数据库miR Base(http://www.mirbase.org/)为基础,同时参考TargetScan和PicTar软件预测miR-155的靶基因,并结合文献中报道与炎症相关的基因作为进一步筛选的条件。
1.2.2 靶基因的载体的构建与鉴定
1.2.2.1 寡核苷酸序列的合成 从MirBase网站检索miR-155,以鼠类为研究对象,选定mmu-miR-155,进入TargetScan网页界面,获取活化性T淋巴细胞核因子5(NFAT5) mRNA 3′-UTR与miR-155结合的序列,设计目标序列NFAT5和突变序列NFAT5-mu,包括:含有miR-155作用位点,并适当向上游和下游延伸5~10 nt,分别在5′端插入Hind Ⅲ和SpeⅠ酶切位点,以备后续连接之用,同时添加ApaⅠ酶切位点,以备后续鉴定。寡核苷酸基因片段由英潍捷基(上海)贸易有限公司合成。
1.2.2.2 靶基因载体构建 退火:两条寡核苷酸片段在1×的退火Buffer中,95 ℃变性5 min,每分钟下降1 ℃直到30 ℃,作为与pMIR-REPORTTMLuciferace荧光素酶载体连接的插入片段。退火体系:互补寡核苷酸片段各0.5 μL,11.5 μL的 1×退火Buffer,终浓度2 ng/μL。目的基因片段保存4 ℃,长期不用可-80 ℃保存;pMIR-REPORT荧光素酶连接载体制备:采用感受态E.coli DH5α扩增LUC质粒,抽提质粒并凝胶提纯,行限制性内切酶HindⅢ和SpeⅠ酶切和片段凝胶回收。HindⅢ和SpeⅠ酶切双酶切体系:LUC质粒30.0 μL,双蒸水4.0 μL,HindⅢ酶1.0 μL,SpeⅠ酶1.0 μL,10×Buffer 4.0 μL,L1低温链接仪金属浴37 ℃培养24 h;靶基因的连接:体系:目的基因 4.0 μL,连接载体 0.2 μL,2×连接缓冲液5.0 μL,双蒸水 0.8 μL,L1低温链接仪金属浴16 ℃培养16 h。
1.2.2.3 转化 120 μL E.coli DH5α感受态细胞冰水浴融化(1~2 min),加入11 μL连接产物,置于冰水浴35 min,擦干离心管后置于42 ℃热休克90 s,迅速置于冰水浴5 min;加入氨苄西林的LB液体培养基800 μL,37 ℃摇床培养1 h;吹打混匀沉淀,取300 μL细菌悬液均匀涂布与Amp+平板上,置于37 ℃恒温箱培养10 h。
1.2.2.4 挑选菌落及重组质粒的鉴定 挑取白色光亮的单菌落,接种于5 mL的LB液体培养基,37 ℃摇床孵育6.5 h(致培养基变浑浊),按质粒抽提试剂盒实验步骤提取重组质粒;将提取的质粒载体,用ApaⅠ单酶切后,1%琼脂糖凝胶电泳,待溴酚蓝迁移至凝胶2/3处,用凝胶扫描系统检测DNA的位置及条带术; 将ApaⅠ单酶切检测符合的样品送北京博爱永华公司测序。
1.2.3 重组质粒转染与双荧光素酶活性检测 转染前24 h将2×105/mL的HEK-293AD细胞接种于96孔板,每孔加100 μL无抗1640培养基,当细胞生长密度至培养板底部的75%~80%时开始转染。转染分组:pMIR-NFAT5+miR-control组、pMIR-NFAR5+miR-155 mimics组、pMIR-NFAR5+miR-155+inhibitor组、pMIR-NFAT5-mu+miR-155 mimics组;各组中均转入对照质粒pRL-TK,按每孔25.0 μL opti-MEM培养基稀释0.5 μL LipofectmineTM2000脂质体,轻柔混合,室温静置5 min(小于25 min);按每孔量用25.0 μL opti-MEM培养基稀释0.20 μg 报告载体、0.01 μg pMIR-TK 和0.375 μL寡核苷酸,轻柔混合;将两者混合,室温孵育 20 min。每组设3个复孔,分别将 50 μL质粒DNA-寡核苷酸-转染试剂混合物加至 96 孔板中,稍微震荡混匀,4 h后更换1640培养基,37 ℃ 细胞培养箱共培养24 h后。按照Dual LuciferaseTM报告基因检测试剂盒说明书进行操作,在荧光仪检测得到各组萤火虫荧光素酶活性值(F)和海肾荧光素酶活性值(R),取F/R 为相对活性值进行数据统计。
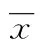
2 结 果
2.1 靶向关系预测 应用3个软件预测及相关文献查阅,初步筛选出miR-155相关靶点是NFAT5和TRAF3(图2),miR-155与靶基因的3′-UTR序列部分互补,与NFAT5和TRAF3的“seed sequences”都在7-mer 以上。靶点预测结果设计的靶基因序列及突变的对照序列,见图3。

图2 miR-155与靶基因的3′-UTR 序列比对

图3 靶基因序列及突变序列
2.2 靶基因的载体的构建与鉴定 将目的基因与PMIR-REPORT荧光素酶连接空载体连接,转化扩增后提取重组质粒,进行酶切鉴定。行ApaⅠ单酶切可见重组质粒能够线性化,比在pMIR-REPORTTMLuciferace质粒的条带靠后,进一步测序证实插入片段与预期设计完全相符(图4)。同时将上述目的连接产物送北京博艾永华公司测序,测序结果证实与设计合成的序列完全吻合,见图5。
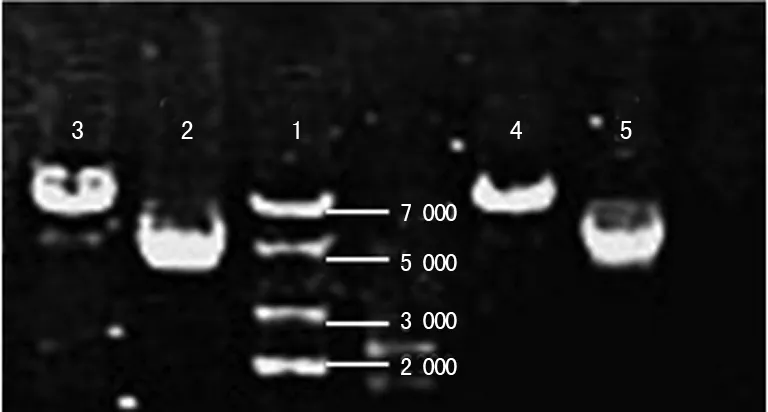
1:DNA分子标记物;2:NFAT5质粒;3:NFAT5质粒ApaⅠ单酶切;4:NFAT5-mu质粒 ApaⅠ单酶切;5:NFAT5-mu质粒。
图4 ApaⅠ单酶切鉴定图

图5 靶基因及突变基因3′UTR测序结果
2.3 双荧光素酶活性检测 为了研究miR-155是否直接调控NFAT5的表达,本研究成功构建双荧光素酶报告基因载体,通过Dua-l LuciferaseTM报告基因检测系统检测各组F和R,取F/R值,见图6。
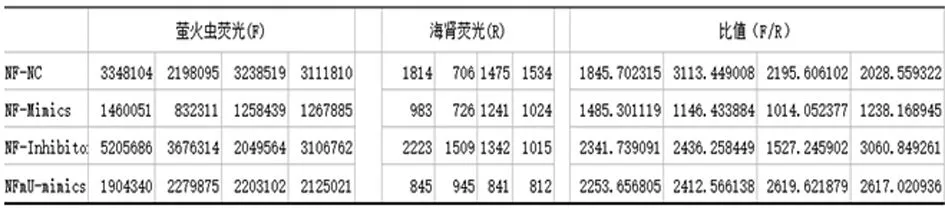
图6 双荧光素酶活性及比值
2.4 各组相对荧光素酶值比较 pMIR-NFAT5+miR-control组(2 295.83±563.50)与pMIR-TMEM33+miR155-mimics组(1 220.99±198.78)相对荧光素酶值比较差异有统计学意义(P<0.01);pMIR-NFAT5-MU+miR-155组(2 475.72±176.99)与pMIR-NFAT5+miR-control组相比,其相对荧光素酶值差异无统计学意义(P>0.05)。
3 讨 论
吸入性肺损伤因发病机制错综复杂,其关键因素始终未能得到突破性进展。临床研究和动物实验均表明炎细胞浸润、大量自由基生成及促炎症介质在肺组织过度表达是烟雾吸入肺损伤的早期主要病理特征[8]。而NF-κB信号通路的激活诱导的失控炎症反应起着重要的促进作用[9-11]。研究表明,肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)、白细胞介素(IL)-1、IL-6、IL-8、IL-12、IL-10、巨噬细胞炎性蛋白-1α(MIP-1α)、环氧化酶-2(COX-2)及前列腺素等炎性因子都是NF-κB调控的下游基因。大量炎症因子及炎症因子间的级联放大作用,加重吸入性肺损伤的进展。
NFAT5是一种广泛表达的核转录因子,细胞外液渗透压能能够调节其活性,在肾、脑、肺、皮肤及眼等多种组织中表达[13]。除了在维持渗透压有重要作用外,近些年的研究表明其在胚胎的形成和发育、肝脏解毒和肿瘤转移方面都有重要的生物学作用。研究表明,血糖波动大的患者,血浆中促炎因子IL-6,IL-8和TNF-α等水平明显增高,且患有糖尿病微血管并发症的患者中,外周血单核细胞中NFAT5明显增多,且与弹性反应增强子结合蛋白的DNA结合能力明显增多[14]。在海水诱导的吸入性肺损伤模型中,肺组织中NFAT5及炎症因子在mRNA和蛋白水平上表达量上升。并且体外实验使用NFAT5 siRNA抑制NFAT5的表达后p-NF-κB 和炎症因子水平的显著下降[15]。因此,笔者猜想NFAT5与肺损伤关系密切,可能参与NF-κB信号转导通路激活,从而调节吸入性肺损伤。
miRNA作为最大的一类基因表达调控因子,在维持自身的稳态,调节机体的生长发育及疾病的发生、发展方面起着重要的作用。miR-155参与机体对炎症刺激的应答,维持机体的免疫功能[16-17]。研究表明,miR-155通过其靶基因IKK激酶家族、Smad2、Fas相关死亡蛋白等减少NF-κB通路的激活,以及次级效应方式抑制炎症因子的表达,从而减少对机体的损伤。
本研究结果证实,miR-155能够与NFAT5 mRNA-3′UTR互补结合,负向调控海参荧光素酶的表达。吸入性损伤的研究一直是国内外研究的焦点,本课题组立足miRNA,拟在ALI、NFAT5和NF-κB架起桥梁,在基因层面转录后水平研究ALI。本实验成功构建荧光素酶报告基因重组质粒,并验证miR-155对NFAT5基因mRNA 3′-UTR具有靶向调控作用。为进一步研究miR-155在吸入性肺损伤机制中的作用奠定了基础。
[1]柴家科.实用烧伤外科[J].北京:人民军医出版社,2014:300-301.
[2]包校伟,袁华,吴忠好,等.烧伤治疗5 235例回顾分析[J].中国现代手术学杂志,2015,19(5)379-380.
[3]Lange M,Hamahata A,Traber DL,et al.A murine model of sepsis following smoke inhalation injury[J].Biochem Biophys Res Commun,2010,391(3):1555-1560.
[4]罗慧,李孝建,曹雯娟.烧伤并发脓毒症后免疫与凝血功能及营养代谢变化对创面愈合的影响研究进展[J].中华烧伤杂志,2014,30(2):137-140.
[5]Musilova K,Mraz M.MicroRNAs in B-cell lymphomas:how a complex iology gets more complex[J].Leukemia,2015 29(5):1004-1017.
[6]Ivey KN,Srivastava D.microRNAs as developmental regulators[J].Cold Spring Harb Perspect Biol,2015,7(7):a008144.
[7]李文婷,舒彬,刘真,等.微小RNA-155对脂多糖所致小鼠急性肺损伤的干预作用[J].中华烧伤杂志.2015,95(28):2310-2314.
[8]Lange M,Hamahata A,Traber DL,et al.A murine model of sepsis following smoke inhalation injury[J].Biochem Biophys Res Commun,2010(391):1555-1560.
[9]Cox RA,Burke AS,Jacob S,et al.Activated nuclear factor kappa B and airway inflammation after smoke inhalation and burn injury in sheep[J].J Burn Care Res,2009(30):489-498.
[10]Shwartz MD,Moore EE,Moore FA,et al.Nudcerfactor-κB is activated in alveolar macripages from patients with acute respiriatory distress syndrome[J].Cict Care Med,1996,24(8):1285-1292.
[11]Musilova K,Mraz M.MicroRNAs in B-cell lymphomas:how a complex Biology gets more complex[J].Leukemia,2015,29(5):1004-1017.
[12]Kempson SA,Zhou Y,Danbolt NC.The betaine/GABA transporter and betaine:roles in brain,kidney,and liver[J].Front Physiol,2014(5):159.
[13]Farnkvist LM,Lundman BM.Outcomes of diabetes care:a population-based study[J].Int J Qual Health Care,2003,15(4):301-307.
[14]薄丽燕,NFAT5和Ang-Ⅱ及其受体AT1在海水吸入型肺损伤中的作用及其机制的研究[D].西安:第四军医大学,2014.
[15]Zhen Liu et al.MicroRNA-146a negatively regulates PTGS2 expression induced by Helicobacter pylori in human gastric epithelial cells[J].J Gastroenterol,2013,48(1):86-92.
[16]Xiao B,Liu Z,Li BS,et al.induction of miR-155 during Hericobater pylri infection and its negative regulatory in the inflammatory respons[J].J Infect Dis,2009,200(6):916-925.
Construction of nuclear factor of activated T-cells 5 mRNA 3′-untranslated region reporter vector and targeting verification between NFAT5 and miR-155*
ShuBin1,LiWenting2,LiuZhen2,ZhangYajie2,YinBin2,ZhaoPan1,ZhangTongwei2,JiaChiyu2△
(1.GraduateSchool,HebeiNorthUniversity,Zhangjiakou,Hebei075000,China;2.DepartmentofBurnandPlasticSurgery,the309thHospitalofPeople′sLiberationArmy,Beijing100091,China)
Objective To construct a Luciferace reporter vector containing the 3′ untranslated region (3′UTR) of NFAT5 and measure the correlation between NFAT5 and miR-155.Methods The miR-155 targeting NFAT5 3′UTR was predicted by Target Scan,Mir Base and Pic Tar.NFAT5 and mutant NFAT5 sequence(NFAT5-mu) were then designed and synthesized,and they were cloned into pMIR-REPORTTMLuciferace reporter vector.Human embryonic kidney-293AD (HEK-293AD) cells of the 4th passage were divided into 4 groups according to the random number table.cells in plasimd +miR-155 mimics groups were transfected with pMIR-NFAT5 recombinant plasimid,pRL-Tk plasmid and miR-155 mimics;cells in plasimd +miR-155 mutated groups were transfected with pMIR-NFAT5-mu recombinant plasimid,pRL-Tk plasmid and miR-155 mimics;cells in plasimd +miR-155 control groups were transfected with pMIR-NFAT5 recombinant plasimid,pRL-Tk plasmid and miR-155 Negative control;cells in plasimd +miR-155 inhibitor were transfected with pMIR-NFAT5 recombinant plasimid,pRL-Tk plasmid and miR-155 inhibitor;and were respectively transfected into together by liposome.After culture for 24 h,the luciferase activity was detected by dual luciferase reporter assay system.Results TargetScan,Miranda and PicTar shared the results that NFAT5 has the complementary binding sites with 3′UTR of miR-155.And luciferase reporter vectorwas constructed.Therefore the result of sequencing and double digesting of recombined plasmid were completely correct.Dual-luciferase reporter assay showed that miR-155 possesses a target effect on 3′UTR of NFAT5.Compared to the pMIR-NFAT5+miR-control group,the luciferase activity of the pMIR-NFAT5 +miR-1 55 mimics group was decreased,with statistically significant difference(P<0.01),while there was no significant difference at other time points(P>0.05).Conclusion The pMIR-NFAT5 recombinant plasmid and pMIR-NFAT5 recombinant mutated plasmid were confirmed with successful construction.and it was found that miR-155 can target NFAT5 mRNA 3′-UTR.The results provide the experiment data for further disclosing the mechanism of inhalation injury on the level of gene expression.
nuclear factor of activated T-cells 5;microRNA-155;luciferase reporter gene vector
10.3969/j.issn.1671-8348.2017.08.001
国家自然科学基金面上资助项目(81372051;81670009);总参军事医学和老年病科研基金项目(ZCWS14B06);解放军309医院院管课题(2014MS-001);北京市科技计划“首都特色”专项基金资助项目(Z151100004015199);全军医学科技青年培育项目(15QNP049)。 作者简介:舒彬(1988-),在读研究生,主要从事烧伤整形、吸入性肺损伤相关研究。△
,E-mail:1922616763@qq.com。
R604
A
1671-8348(2017)08-1009-03
2016-09-21
2016-11-19)
