壳聚糖复合膜在草鱼保鲜中的应用
2017-05-02周强刘蒙佳蔡倩敏田陈聃
周强++刘蒙佳++蔡倩敏++田陈聃

摘要:以草鱼为原料,通过测定不同温度及不同贮藏方式下复合保鲜液的pH值变化、挥发性盐基氮含量、细菌总数、失质量率、感官评分,研究草鱼在复合型保鲜液中的保鲜效果。结果表明:贮藏期与感官评分呈负相关,且壳聚糖复合膜组能有效保持鱼肉的感官品质,防止草鱼肉营养价值及鲜度的下降,明显改善鱼肉品质;贮藏期与氢离子浓度指数的大小(pH值)、挥发性盐基氮含量、细菌总数、失质量率呈正相关,且壳聚糖复合膜处理能有效缓解氢离子浓度[JP3]指数、挥发性盐基氮含量、细菌总数、失质量率的上升。由结果还可知其他处理情况相同时,4 ℃的保鲜效果明显优于10 ℃。[JP]
关键词:壳聚糖复合膜;草鱼;保鲜;感官品质
中图分類号: TS254.4文献标志码: A
文章编号:1002-1302(2017)03-0159-04
收稿日期:2015-12-14
基金项目:福建省省级实验教学示范中心专项“化学实验教学示范中心”;福建省大学生创新项目(编号:201412992019)。
作者简介:周强(1979—),男,江西樟树人,硕士,副教授,主要从事农产品贮藏及其深加工研究。E-mail:407825829@qq.com。
草鱼(Ctenopharyngodon idellus)别称鲩鱼,属鲤形目鲤科草鱼属[1]。草鱼是我国“四大家鱼”中养殖规模、销售额最大且最受欢迎的鱼类。淡水鱼的生长环境导致其肉质含有较多水分和易氧化的不饱和脂肪酸,在体内组织酶和细菌的作用下,如果存储环境不佳极易引发腐败。在我国的淡水渔业总产量中,草鱼、鲢鱼、鳙鱼等低值淡水鱼类所占比例超过50%,但活体难以存储等因素限制了其市场潜力和价值,一直难以拓展。淡水渔业每年因腐败损失巨大,发展更加先进的储藏及加工方法已成为拓展淡水渔业的重中之重,找到保鲜草鱼的适当方式极为迫切。
壳聚糖别称脱乙酰甲壳素,是通过甲壳素脱乙酰化而形成的多糖类物质。其原料甲壳素散布于虾、蟹、某些昆虫的外壳或真菌的细胞壁中,极易提取。壳聚糖具有无毒、生物相溶性好、可降解的特点,并具有良好的成膜性,抑制细菌效果明显,同时是一种可再生资源,作为食品包装的制造材料具有广阔前景。壳聚糖膜可食用,安全环保,对大肠杆菌、表皮葡萄球菌等细菌的抑制作用十分明显,浓度越大则抑制细菌的效果越好。大量研究表明,采用壳聚糖膜涂抹处理水产品可明显改善水产品的保鲜效果,延长水产品类食物的保质期,防止水产品腐败变质[2-3]。
天然香辛料是一种拥有香、辛、麻、辣、苦、甜等一系列风味的天然防腐剂和调味品[4],不仅能够赋予水产品独特的风味、良好的色泽及生理保健功能,还能提高和改善水产品的保鲜功能,从而延长水产品的货架期。从生姜中提取的姜辣素、姜酚以及从大蒜中提取的大蒜素、蒜痒酸均可干扰细菌的氧化还原作用,抑制鲜肉中腐败菌的活跃性,同时可抑制和灭杀黄曲霉、黑根霉等容易污染食品的真菌[5],对细菌正常的氧化还原过程造成影响,特别是对肉类中导致腐败的细菌具有极强的抑制能力,同时还能杀灭常大量存在于食品中的各种细菌。月桂氮卓酮、二甲基亚砜不但可加速花椒中易挥发性油渗入真菌的细胞内,从而促进细胞衰亡,而且还对真菌起到一定抑制及杀灭作用[6]。
本研究主要针对草鱼的保鲜储存问题,以壳聚糖复合膜作为保鲜剂,在低温下对草鱼鱼肉块进行保鲜处理,利用其抗菌及抗氧化特性,通过检测储藏期间草鱼的酸碱性变化、挥发性盐基氮含量、细菌总量、视觉评分[7],比较不同温度下壳聚糖复合膜与清水处理对鱼块的保鲜效果。本研究为壳聚糖复合膜在延长水产品货架期、提升水产品品质等不同方向的运用提供依据。
1材料与方法
1.1材料与试剂
新鲜草鱼购自康美农贸市场,姜片、花椒、大蒜购自康美豪利友超市。壳聚糖为食品级,氯化钠、碳酸钾、阿拉伯胶、甘油、硼酸、盐酸、甲基红、乙醇、次甲基蓝指示剂均为分析纯。平板计数琼脂,生化试剂(BR)。
1.2主要仪器
PHS-25C型数显酸度计(南京互川电子有限公司),DHG-9141A型电热恒温鼓风干燥箱(北京成萌伟业科技有限公司),HH-8型数显恒温水浴锅(金坛市金城国胜实验仪器厂),JA2003N型电子精密天平(郑州万博仪器设备有限公司),DRP-9082型电热恒温培养箱(上海森信实验仪器有限公司),YXQ-LS-40S11型立式压力蒸汽灭菌器(中国西安常仪仪器设备有限公司),BCD-215KS型冰箱(青岛海尔股份有限公司),WSC-S型测色色差计(上海荆和分析仪器有限公司),微量扩散皿。
1.3处理方法
壳聚糖保鲜液的配制过程:称取壳聚糖粉15 g,加入 1 000 mL 纯水,于4 ℃下储藏备用。
混合型香辛料保鲜液的配制过程:分别称取姜片 100 g、大蒜100 g、花椒50 g,将其均匀混合并搅拌研磨制成浆状物,添加蒸馏水至1 000 mL,将搅拌后的混合物体置于 60 ℃条件下,于0.2 kW、40 kHz的超声波中提纯约30 min,随后进行过滤,弃去滤渣,得到滤液,并于4 ℃储藏备用。
将活鱼用清水洗净并除去鱼头、鱼尾、内脏、皮、鳞片,然后将其切割为厚度约2 cm、质量约50 g的鱼块,作为后备使用。将切下的鱼块放入香辛料保鲜液中浸泡约30 min,浸泡过程中使鱼块质量、复合液体积比保持在1 ∶[KG-*3]3,取出沥干,采用壳聚糖保鲜膜涂抹鱼块。设对比对象,将鱼块在未加保鲜液的清水中浸泡30 min,取出沥干,采用以下4种不同贮藏方式进行处理:于4 ℃冰箱和浸泡过壳聚糖-香辛料混合保鲜液的条件下进行储藏;于4 ℃冰箱和浸泡过清水的条件下进行储藏;于10 ℃培养箱和浸泡过壳聚糖-香辛料混合保鲜液的条件下进行储藏;于10 ℃培养箱和浸泡过清水的条件下进行储藏。
1.4测定指标及方法
1.4.1pH值的测定
样品预处理:挑选出正常鱼块,绞碎拌匀,将其置于封闭的器皿中。
测定试样的制备:称取约10 g鱼肉,置于烧杯中。将 150 mL 沸腾且温度降至约75 ℃的水和烧杯中的样品倒入250 mL容量瓶,将其置于沸水浴中煮沸0.5 h。煮沸过程中适时摇晃容量瓶使其保持均匀,以便鱼肉中的有机酸完全溶解到溶液中。取出后冷却至室温,采用烧沸过的水将试样液体定容至250 mL。将其过滤,除去滤渣,收集滤液以便测定备用。
样品测定:将pH计放入滤液中,读取数值。每个样液测试2次,取2次测量的平均值[8]。
1.4.2挥发性盐基氮的测定(微量扩散法)[9]
樣液制备:取适量鱼肉,用研钵研磨成均匀的碎屑,称取约10 g置于量瓶中,加入100 mL清水,适时摇晃量瓶使其保持均匀。样液浸泡约30 min后进行过滤,置于冰箱中冷藏[10]。
用水溶性胶涂抹扩散皿的四周,于内室中添加约1 mL的吸收液和1滴混合指示剂。量取1 mL样液以及1 mL饱和碳酸钾溶液,将2种溶液各自均匀地置于扩散皿外室的两边,切勿使2种溶液发生混合。
盖上扩散皿的皿盖,将其封装,之后在桌上缓慢旋转扩散皿,以便试样液体和饱和碳酸钾溶液均匀混合。将扩散皿存放于37 ℃培养箱中保温约2 h[11]。取出扩散皿,揭开皿盖,使用标定过的盐酸标准溶液将其滴定至颜色变为蓝紫色,同时设空白对照。计算公式:
[JZ]X=(V1±V2)×C×14/[JB((]m×[SX(]1100[SX)][JB))]×100。
式中:X为挥发性盐基氮含量,mg/100 g;V1为测定样液消耗盐酸标准溶液体积,mL[12];V2为试样空白消耗盐酸标准溶液体积,mL[13];C为盐酸的实际浓度,mol/L;m为试样质量,g;14为与1.00 mL盐酸标准滴定溶液相当的氮的质量。
1.4.3细菌总体数量的测定(涂布平板培养法)
培养基的制作:按平板计数琼脂的配方,称取23.5 g琼脂并添加1 L水煮沸,分别存放于若干个三角瓶中,包扎后置于121 ℃高压环境下灭菌处理15 min。
生理盐水的制作:称取8.5 g NaCl,加入1 000 mL蒸馏水溶解;量取225 mL装于若干个250 mL三角瓶中,并加入适量的玻璃珠;另取9 mL装于试管中,包扎后于121 ℃下高压灭菌15 min。
样品的处理:在无菌环境中称取试样25 g,剪碎后置于无菌乳钵,加入少量稀释液浸泡、研磨,再转入含有225 mL无菌医用盐水和适量玻璃珠的三角瓶中,然后充分摇晃,将其制成10-1稀释度的均匀稀释液[14]。
编号:取灭菌平皿若干个,各自采用标签标示不同的稀释程度,分别标示4份。采用20支装有9 mL灭菌医用盐水的试管,分别标记其稀释程度[15]。
样品的稀释:采用灭菌移液枪吸取1 mL 10-1稀释液,将其沿着试管内壁缓慢加入标有10-2无菌医用盐水的试管中[16]。更换新移液枪头在10-2试管中吸吹液体至少10次,使其充分振荡,即为10-2稀释液[17]。按照相同操作分别制成10-3、10-4、10-5、10-6稀释液。对1个稀释浓度液体进行操作后,制作其他浓度液体之前须要取用全新的移液枪头[18]。
菌落计数方法:记录每个平板的菌落数量,计算得出同一稀释浓度下每个平板的平均菌落数量[19]。
标准平皿菌落数量的选取方式:将菌落数量为30~300 CFU 的平板视为菌落总数检测的基准,且每个稀释浓度下采用2个平板的菌落数量,将其平均值作为该浓度下的菌落数[20]。如果其中1个平板存在连接成整片的菌落,或存在点样菌落蔓延生长的情况,则此平板不进行数量统计[21]。
菌落数[CFU/mL(g)]=相同稀释浓度下2次测量结果的平均值×稀释倍数×10[22]。
1.4.4失质量率的测定[23]
将草鱼肉切为厚度约2 cm、质量20 g的肉片。采用精密电子天平称量处理过的草鱼肉,记录原始质量。将草鱼肉置于一次性杯中,用保鲜膜密封并再次称量,记录鱼肉、一次性杯、保鲜膜的总质量。测量后分别于4、10 ℃下保存。平均每4 d进行称量,每次称量重复3次。失质量率的计算公式:
[JZ]草鱼肉的失质量率=[SX(]初始质量-贮藏后质量初始质量[SX)]×100%。
1.4.5色差值的测定
采用WSC-S型测色色差计对草鱼肉进行a*值的检测[24]。L*表示明度,取值范围在0~100;+a*、-a*分别表示偏红色、偏绿色,取值范围在-60~60;+b*、-b*分别表示偏黄色、偏蓝色,取值范围在-60~60。对a*进行10次测量,计算10次测量结果的平均值。
1.4.6感官评定标准
将鱼肉的感官表现转化为分值,进行综合感官评分的判定。对贮藏期间草鱼肉的色泽、气味、质地进行综合评分(表1),最高分为10分。每3 d测评1次,对综合评定结果进行统计分析。
将鱼肉的气味表现转化为分值,进行脱腥效果感官评分的判定。对贮藏期间草鱼肉的气味进行脱腥效果评分(表2),最高分为10分。每3 d测评1次,对气味评定结果进行统计分析。
2结果与分析
2.1鱼肉贮藏期内的pH值变化
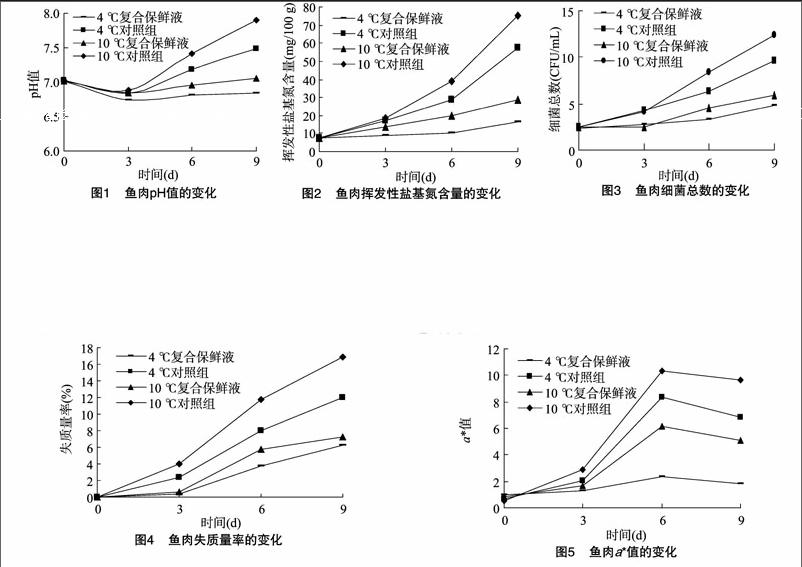
由图1可知,在贮藏期内草鱼内部的pH值均呈先下降、后上升的趋势;处理组与对照组鱼肉的初始pH值分别为702、7.03。贮藏3 d时鱼肉pH值出现明显下降,这是由于草[CM(25]鱼死后微生物作用于鱼肉内部的蛋白质类物质,将其分解成小分子氨基酸,从而使草鱼pH值缓慢下降。对照组鱼肉pH值于贮[JP3]藏6 d时迅速上升,鱼体鲜度逐渐下降,这是由于鱼体内碱性挥发性物质生成,使得pH值呈上升趋势。经壳聚糖复合膜溶液处理后,草鱼块的pH值变化较缓慢,其中 4 ℃ 壳聚糖复合膜溶液处理的保鲜效果较明显,起到了保鲜作用。[JP]
2.2鱼肉贮藏期内挥发性盐基氮含量的变化
挥发性盐基氮是动物类食品中蛋白质被内源酶和细菌分解,从而生成的氨及胺类碱性含氮物质的概括性称呼,是评定肉质新鲜程度的关键指标。鱼肉贮藏期内挥发性盐基氮含量的变化情况见图2,可见贮藏刚开始时,各组的变化差异很小,添加了复合保鲜液的鱼肉,其挥发性盐基氮含量均低于空白对照组。鱼肉中的挥发性盐基氮含量大致随着时间的延长而递增。贮藏9 d时,测得4 ℃复合保鲜液组的挥发性氨基氮含量为16.21 mg/100 g,仍在二级标准范围内;而10 ℃复合保鲜液、4 ℃对照组、10 ℃对照组的挥发性氨基氮含量分别达到28.98、57.20、75.30 mg/100 g,表明肉已发生变质(图2)。可见,复合保鲜液能有效抑制草鱼体内挥发性盐基氮的产生,其中4 ℃处理的效果最佳。
2.3鱼肉贮藏期内细菌总数的变化
细菌总数的多少可反映鱼肉被微生物作用而引起腐败的程度,从而预测鱼肉的货架期。由图3可见,菌落的总体数量随着贮藏时间的延长而逐渐增加,对照组鱼肉中的细菌总数于贮藏3 d开始急剧上升,而加入复合保鲜液的鱼肉中细菌总数增长较缓慢。可见,复合保鲜液对鱼肉中细菌总数的增长具有抑制效果。
2.4鱼肉贮藏期内失质量率的变化
[JP3]失质量率可反映贮藏期内草鱼肉水分减少的程度。添加了复合保鲜液的鱼肉和对照组鱼肉的失质量率变化情况见图4,可见在贮藏期间,草鱼肉的失质量率呈上升趋势;复合保鲜液组的失质量率明显低于对照组,表明添加复合保鲜液的鱼肉其水分散失速度明显降低,对草鱼肉保鲜具有明显的积极作用。
2.5色差值的变化
色差分析中的a*值可反映贮藏期内草鱼肉的颜色差异程度。添加了复合保鲜液的鱼肉和对照组鱼肉的a*值变化情况见图5,可见a*值随着贮藏时间的延长先提高、后稍微降低,而添加了复合保鲜液的鱼肉中a*值的提高较缓慢。这是由于复合保鲜液能使鱼肉和外界氧气有效隔绝,从而阻止鱼肉发生变质。由此可见,复合保鲜液可有效减缓草鱼肉颜色的改变。
2.6贮藏期内鱼肉的感观评分变化
2.6.1综合感官评分的变化
贮藏期内草鱼的感官评分值见图6,可见草鱼肉的初始综合评分值均为29,贮藏9 d时,4、10 ℃ 对照组的综合评分值分别为22、18分,而4、10 ℃复合保鲜液组的综合评分值分别为13、9分。草鱼的感官状态随着贮藏时间的延长而下降,对照组草鱼感官状态的下降趋势快于复合保鲜液组。添加了复合保鲜液的鱼肉,其外观、气味、质地的变化不明显,表明复合保鲜液对鱼肉具有一定保鲜作用。对照组的鱼肉在贮藏期内感官变化明显,变化趋势从贮藏3 d时开始明显增加。
2.6.2脱腥效果单项评分的变化
贮藏期内草鱼的脱腥效果评分见图7,可见草鱼肉的初始综合评分值均为9.5分,贮藏9 d时,4、10 ℃对照组的综合评分值分别为3.8、2.8分,而4、10 ℃复合保鲜液组的综合评分值分别为7.4、6.0分。草鱼肉的腥味变化幅度随着贮藏时间的延长呈下降趋势,而对照组草鱼肉的下降趋势快于复合保鲜液组。添加了复合保鲜液的草鱼肉其腥味变化不明显,与综合感官评分的情况大体一致,表明复合保鲜液对草鱼肉具有一定的去腥作用。
[TPZQ7.tif][FK)]
3结论
购买草鱼后应尽量缩短贮藏期和运输周转期,最好置于低温下贮藏,以延缓草鱼肉的腐败,并防止因微生物污染而引起的腐变,从而达到保鲜目的。本试验结果表明,复合保鲜液于4 ℃贮藏的保鲜效果优于10 ℃。通过比较4、10 ℃复合保鲜液及对照组的保鲜效果发现,草鱼肉经复合壳聚糖涂抹后贮藏,能有效保持其感官品质,减轻水分含量损失,保持鱼肉的鲜度,同时可减缓鱼肉变质和鱼肉pH值的升高,降低挥发性盐基氮含量的增加速度,对鱼肉中细菌的增长也具有一定抑制作用。
[HS2]参考文献:
[1]成媛媛,刘永乐,王建辉,等. 普鲁兰多糖在草鱼鱼肉保鲜中的应用[J]. 食品科学,2012,33(2):272-275.
[2]Ghaouth A,Ponnampalam R,Castaigne F,et al. Chitosan coating to extend the storage life of tomatoes[J]. HortScience,1992,27(9):1016-1018.
[3]Zhang D L,Quantick P C. Effects of chitosan coating on enzymatic browning and decay during postharvest storage of litchi (Litchi chinensis Sonn.) fruit[J]. Postharvest Biology and Technology,1997,12(2):195-202.
[4]汤蕾. 植物性香辛料及其在食品工业中的应用[J]. 中国调味品,2008,33(11):80-83.
[5]夏凡,琚争艳,何健,等. 冷却肉天然香辛料植物源保鲜剂应用及其安全性研究进展[J]. 肉类研究,2008(6):51-56.
[6]陈建宏. 抗真菌颗粒剂治疗足廯的临床观察和实验研究[D]. 广州:广州中医药大学,2006.
[7]赵莉君,顾卫瑞,赵思明,等. 包装方式对冰温贮藏鲩鱼片品质的影响[J]. 华中农业大学学报,2010,29(5):639-643.
[8]余小领,白云,李学斌,等. 宰后不同时间冻结对猪肉保水性和组织结构的影响[J]. 食品与发酵工业,2007,33(3):18-22.
[9]钟鸣,刘小敏,高利红. 几种常见的动物源性饲料中挥发性盐基氮的测定[J]. 粮食与饲料工业,2006(7):43-44.
[10]刘学辉,沈崇钰,李超美,等. 对进口美国冻猪副、鸡副产品新鲜度的检验[J]. 中国动物检疫,2001,18(3):32-33.
[11]王启军. 食品分析实验[M]. 北京:化学工业出版社,2010.[HJ1.7mm]
[12]何孟杭. 全自动凯氏定氮仪测定酱油中全氮含量不确定度的评定[J]. 质量技术监督研究,2010,28(3):23-27.
[13]王彦斌,苏琼. 室内装饰装修材料中甲醛的限量及测定[J]. 西北民族大学学报(自然科学版),2007,28(1):22-26,29.
[14]李奇英. 应用TTC显色测定食品中菌落总数[J]. 食品工业科技,1998(4):74-75.
[15]陈勤超. 水流式与气泡式蔬菜清洗机清洗效果的比较与研究[D]. 武汉:华中农业大学,2007.
[16]陈悟. 硫酸盐还原菌多相分类系统与综合防治方法研究[D]. 武汉:华中科技大学,2006.
[17]柴彤涛. 原料奶中芽孢、耐热芽孢、嗜冷菌及抗生素残留的测定[J]. 中国乳业,2002(3):28-30.
[18]刘志华,迟刚,朱平,等. 国家纺织行业抗菌标准FZ/T 01021—1992测试方法中的注意点[J]. 印染助剂,2006,23(11):42-44.
[19]陆汉希. 牛冷冻精液微生物学检验菌落总数测定[J]. 河北畜牧兽医,1990(3):46-47.
[20]王红花,王红英,郭晨光,等. 糖蜜粉霉变规律的试验研究[J]. 饲料工业,2002,23(12):16-17.
[21]张兰. 膏状浴盐菌落总数的测定及方法探讨[J]. 中国盐业,2011(18):143-147.
[22]马青竹,李学军. 一种兽用多菌株混合微生态制剂质量标准研究[J]. 饲料工业,2010,31(11):56-60.
[23]劉文全. 失重率法测定秸秆腐熟剂施用效果试验[J]. 农村科技,2012(12):18.
[24]朱钦龙. 色差计在测定蛋黄色中的应用[J]. 畜禽业,1999(9):15-16.
