烯效唑浸种对红小豆种子萌发及幼苗生长的影响
2017-05-02刘丽琴张永清李鑫王姣
刘丽琴++张永清 +李鑫 王姣


摘要:采用种子萌发和水培试验相结合的方法,以京农8号红小豆为材料,设置7个浸种浓度,研究烯效唑浸种对红小豆种子萌发、幼苗形态、根冠比、壮苗指数、叶绿素、叶绿素荧光参数、根系生理特性的影响。结果表明:随着烯效唑浸种浓度升高,对红小豆幼苗株高的抑制作用增强;在一定浓度范围内烯效唑浸种可以显著提高红小豆种子发芽势、发芽率,使红小豆根系表面积、根系体积、根系平均直径、总根长、最长根长、根系活力以及茎粗、壮苗指数、叶面积、根冠比明显增加,同时提高叶绿素含量、最大光化学效率(Fv/Fm)、光系统(PSⅡ)的潜在活性(Fv/Fo)、光化学猝灭系数(qP),降低非光化学猝灭系数(NPQ),从而增强光合作用能力;烯效唑浸种还显著提高了根系SOD、POD活性,降低了MDA含量;用于红小豆浸种的最佳处理为20 mg/L 5%烯效唑可湿性粉剂。
关键词:红小豆;烯效唑;种子萌发;幼苗生长;幼苗形态;生理指标
中图分类号:S521.04文献标志码: A
文章编号:1002-1302(2017)03-0064-06
收稿日期:2016-05-09
基金项目:国家自然科学基金(编号:31571604);山西省自然科学基金(编号:2013011030-1)。
作者简介:刘丽琴(1991—),女,山西吕梁人,硕士研究生,主要从事植物生理生态研究。E-mail:liuliqin010203@163.com。
通信作者:张永清,博士,教授,主要从事土壤及植物生理生态研究。E-mail:yqzhang208@163.com。
农业生产上将植物生长调节剂按其作用效果分为3类,即促进剂、抑制剂、延缓剂[1]。烯效唑是目前抑制效应最强的生长延缓剂,具有生物活性高、使用安全等特点[2-3]。研究表明,烯效唑浸种可以矮化植株,促进植物根系生长,还具有提高叶绿素含量,缓解膜脂过氧化程度,降低丙二醛(MDA)含量,增加超氧化物歧化酶(SOD)、过氧化物酶(POD)活性,提高植物抗逆性等作用[4-6]。但目前关于烯效唑浸种的研究集中在小麦、大豆、谷子、番茄等作物上,在红小豆(Phaseolus angularis Wight)等小杂粮作物方面的相关研究鲜有报道。红小豆别称小豆、赤豆等,是豆科、豇豆属一年生草本植物。我国是红小豆原产地,已有2 000多年的栽培历史[7],但因其具有较强的抗逆性而多被种植在旱薄地区。研究促进红小豆根系生长、提高其抗旱性的措施,具有重要的理论与实践意义。本研究探讨了不同种类烯效唑浸种处理对红小豆种子萌发及幼苗根系生长的影响,旨在为生产上合理应用烯效唑促进红小豆根系生长提供依据。
1材料与方法
1.1材料
供试红小豆品种为京农8号,由山西省农业科学院作物科学研究所提供。供试药剂分别为江苏剑牌农药化工有限公司生产的5%烯效唑可湿性粉剂和上海伊卡生物技术有限公司生产的98%烯效唑生物学试剂。
1.2试验方法
试验开始于2015年5月,在山西师范大学试验基地进行。采用烯效唑种类、浓度2个因素随机设计。烯效唑种类为2个,即5%烯效唑可湿性粉剂、98%烯效唑生物学试剂,分别记作A剂、B剂。烯效唑浸种浓度为7个水平,分别为0、10、20、40、100、150、200 mg/L。以蒸馏水浸种作对照。试验时,先将大小一致、健壮饱满的红小豆种子经0.1% HgCl2消毒10 min,再用各自的处理溶液浸种6 h,其间每30 min搅动1次,取出后于5月1日播于铺有2层湿滤纸的培养皿(直径150 mm)内,每皿50粒,置于25 ℃的人工气候箱中培养。在萌发阶段每天09:00浇等量蒸馏水保持滤纸湿润,从培养第4天开始每天16:00记录发芽粒数,以胚根突破种皮、长度达种子长度一半时视为发芽种子,以连续2 d内发芽数不变视为萌发结束。在萌发结束(5月15日)后选择长势一致的健壮幼苗,用脱脂棉固定在事先打有定植孔的泡沫塑料板上,移入水培盘中培养,每盘装培养液6 L,定时通气,每3 d更换1次营养液,连续培养20 d后取样测定幼苗形态及生理指标。每个处理重复3次。
1.3项目测定与方法
1.3.1发芽试验试验第7天统计发芽势,发芽结束时统计发芽率。发芽势、发芽率计算方法如下:
[JZ]发芽势=7 d内发芽种子数/供试种子数×100%。
[JZ]发芽率=15 d内发芽种子数/供试种子数×100%。
1.3.2水培试验
1.3.2.1形态指标红小豆幼苗株高、最长根长用直尺测量;茎粗用游标卡尺测量;地上部、地下部干质量用烘干称质量法测定;叶面积、根系体积、表面积、平均直径、总根长用英国产Delta-T SCAN分析系统测定;叶绿素荧光参数用美国产OS5P型便携式型叶绿素荧光仪在晴朗无风天气于 09:00—11:00测定植株顶部第1张三出复叶,取平均值。壮苗指数计算方法如下:
壮苗指数=(茎粗/株高+地下部干质量/地上部干质量)×全株干质量。
1.3.2.2生理指标[JP2]叶绿素含量采用丙酮法测定[8];根系活力采用氯化三苯基四氮唑法测定[8];根系超氧化物歧化酶活性采用氮蓝四唑法测定[8];根系过氧化物酶活性采用愈创木酚比色法测定[8];根系丙二醛含量采用硫代巴比妥酸法测定[8]。[JP]
1.4数据处理
采用Excel 2003软件对数据进行处理与作图,用SPSS 17.0软件进行统计分析,采用Duncans法进行多重比較。
2结果与分析
2.1烯效唑浸种对红小豆种子萌发的影响
由图1可以看出,随着烯效唑浸种浓度升高,红小豆种子发芽势呈先升高、后降低的趋势,其中以20 mg/L烯效唑处理效果最佳,但不同种类烯效唑处理的红小豆种子发芽势随烯效唑浓度变化的幅度不同。20 mg/L A剂、B剂处理下红小豆种子发芽势分别比对照增加173.91%、100.00%。除 40 mg/L 浓度处理外,在相同浸种浓度下,A剂处理下的发芽势均高于B剂处理。分析表明,除B剂下100、150 mg/L浸种浓度处理外,其他处理的发芽势均与对照差异显著。
[TPLLQ1.tif][FK)]
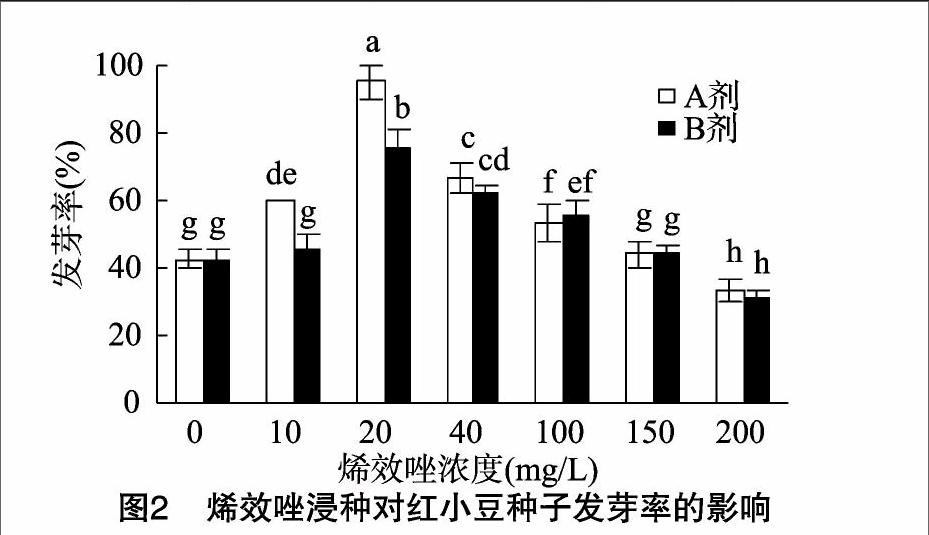
由图2可见,2种烯效唑对红小豆种子发芽率影响的趋势相同,均表现为随着烯效唑浸种浓度升高,红小豆种子发芽率先升高、后降低的趋势,且均在烯效唑浓度为20 mg/L时达到最高,这与不同烯效唑处理下红小豆发芽势的变化趋势相一致。20 mg/L A劑浸种处理下红小豆种子发芽率达到 95.33%,比对照高123.44%,且各A剂处理的红小豆种子发芽率均与对照差异显著。20 mg/L B剂浸种处理下红小豆种子发芽率达到76.00%,仅比对照高78.12%,除10、150 mg/L浓度处理外,其他B剂处理的红小豆种子发芽率均与对照差异显著。在较低浓度(小于40 mg/L)范围内,相同浸种浓度处理下,A剂处理下红小豆种子发芽率均显著高于B剂处理,如在20 mg/L浸种浓度下,比B剂高25.44%。但在较高浓度(100~200 mg/L)范围内,二者未达显著差异水平。
2.2烯效唑浸种对红小豆幼苗形态的影响
2.2.1对地上部生长的影响与对照相比,不同种类烯效唑处理均能抑制红小豆幼苗的株高,且随着浸种浓度升高,抑制效应增强(表1),当达到最高浸种浓度(200 mg/L)时,A剂、B剂处理下株高分别较对照下降了82.57%、87.43%,各烯效唑浸种处理下红小豆幼苗株高均与对照有显著差异。在B剂处理下,部分浸种浓度处理下的红小豆幼苗株高差异不显著;但在A剂处理下,各浸种浓度下的红小豆幼苗株高均差异显著。在相同浸种浓度下,B剂处理对红小豆幼苗株高矮化率均高于A剂,如在浸种浓度为10 mg/L时,A剂、B剂矮化率分别为23.26%、51.85%。
如表1所示,除200 mg/L B剂浸种处理外,其他烯效唑处理均可显著提高红小豆幼苗的茎粗,但提高幅度各有不同。在烯效唑浓度≤20 mg/L时红小豆幼苗茎粗提高幅度较大,烯效唑浓度>20 mg/L时红小豆幼苗茎粗提高幅度相对较小。当烯效唑浓度为20 mg/L时,A剂、B剂处理下红小豆幼苗茎粗分别较对照升高了61.51%、53.38%,提高幅度达到最大,且差异达到显著水平。
由表1可见,红小豆幼苗叶面积随烯效唑浸种浓度升高呈先升高、后降低的趋势,烯效唑浓度为20 mg/L时红小豆幼苗叶面积达到峰值,且显著高于对照,A剂、B剂处理下红小豆幼苗叶面积分别比对照高60.06%、37.48%。
2.2.2对根系生长的影响总根长、根系表面积、根系体积、根系平均直径、最长根长是表示根系生长发育程度的重要参数,可以在一定程度上反映植株的整体生长状况[9]。由表2可以看出,从整体来讲,红小豆幼苗的总根长、根系表面积、根系体积、根系平均直径、最长根长对烯效唑浸种的响应表现出一致趋势,均为先升高、后降低的单峰曲线,低浓度烯效唑浸种处理能够显著提高红小豆幼苗总根长、根系表面积、根系体积、根系平均直径、最长根长,高浓度烯效唑浸种处理则起到抑制作用。本研究的7个浸种浓度中,20 mg/L浓度处理的促进效果最明显,且显著高于对照,表明适宜浓度烯效唑浸种可以显著促进红小豆根系生长。20 mg/L A剂处理使红小豆幼苗总根长、根系表面积、根系体积、根系平均直径、最长根长分别提高58.44%、29.79%、27.08%、40.23%、70.44%;而20 mg/L B剂处理使红小豆幼苗总根长、根系表面积、根系体积、根系平均直径、最长根长分别提高37.08%、6.99%、34.23%、35.28%、45.16%。
2.3烯效唑浸种对红小豆幼苗干物质积累与分配和壮苗指数的影响
由表3可见,红小豆幼苗的地上部、地下部干质量对烯效唑浸种处理的响应呈一致的变化规律,10~40 mg/L烯效唑处理可以显著提高红小豆幼苗地上部、地下部干质量,100~200 mg/L烯效唑处理则使其明显低于对照。20 mg/L A剂、B剂浸种使红小豆幼苗的地上部、地下部干质量均处于较高水平,分别比对照高78.72%、210.38%和69.87%、127.05%,与对照差异显著。
红小豆幼苗根冠比反映了地上部与地下部的生长关系,在苗期促进地下部生长有助于积累更多营养物质,为后期植物的生殖生长创造有利条件。由表3可以看出,随着浸种浓度升高,红小豆幼苗根冠比呈现先升高、后降低的趋势。烯效唑浓度为20 mg/L时,根冠比达到最大值,显著高于其他各处理,且A剂处理显著高于B剂。烯效唑浓度为40 mg/L时,根冠比开始下降,在200 mg/L降到最低。
如图3所示,A剂、B剂处理对红小豆壮苗指数均呈低浓度促进、高浓度抑制的趋势,且均显著高于对照。烯效唑浓度为20 mg/L[JP2]红小豆壮苗指数最大,显著高于其他浓度处理,且A剂处理下的红小豆壮苗指数显著高于B剂处理。当烯效唑浓度为10、40 mg/L时,B剂处理的红小豆壮苗指数显著高于A剂处理;烯效唑浓度为100~200 mg/L时,二者差异不显著。[JP]
[TPLLQ3.tif][FK)]
2.4烯效唑浸种对红小豆幼苗叶绿素含量和叶绿素荧光参数的影响
植物叶绿素含量是衡量叶片光合功能的一个关键指标[10]。由图4可以看出,A剂、B剂处理下红小豆幼苗叶绿素含量的变化趋势一致。A剂处理下,10~100 mg/L浸种浓度处理的叶绿素含量显著高于对照,150、200 mg/L浸种浓度处理的叶绿素含量虽高于对照,但差异不显著;B剂处理下,10、20 mg/L浸种浓度处理的叶绿素含量显著高于对照,40~100 mg/L浸种浓度处理的叶绿素含量虽高于对照,但差异不显著,150 mg/L浸种浓度处理的叶绿素含量与对照差异不显著,200 mg/L浸种浓度处理的叶绿素含量显著低于对照。20 mg/L A剂、B剂处理下叶绿素含量均达到最大值,分别比对照提高了65.28%、49.61%,A剂处理下的提高幅度明显大于B剂处理。
[TPLLQ4.tif][FK)]
由表4可见,烯效唑浸种对红小豆幼苗最大光化学效率(Fv/Fm)和光系统Ⅱ(PSⅡ)的潜在活性(Fv/Fo)均有一定影响,其中20 mg/L A剂浸种处理使Fv/Fm、Fv/Fo达到最大值,分别比对照增加7.11%、58.22%,且差异显著。20 mg/L B劑浸种处理也使Fv/Fm、Fv/Fo达到最大值,但就其提高幅度来看,A剂处理的增加幅度更大。
烯效唑浸种处理下红小豆幼苗光化学猝灭系数(qP)均提高,以20 mg/L A剂浸种处理的效果最明显,且在设定浓度范围内,A剂处理下的提高幅度大于B剂处理。与qP的变化相反,烯效唑浸种降低了红小豆幼苗非光化学猝灭系数(NPQ),但各处理间的降幅不同,随着浸种浓度升高呈先降低、后升高的趋势,20 mg/L处理时降到最低,A剂、B剂处理下分别比对照降低了42.31%、29.78%,且二者之间以及与对照的差异均达显著水平。
2.5烯效唑浸种对红小豆根系生理特性的影响
2.5.1对根系活力的影响根系是植物吸收水分和养分的主要器官,其活力直接影响植株地上部生长情况。由图5可见,A剂处理使红小豆幼苗根系活力明显提高,除200 mg/L处理外,其他浓度处理下的根系活力都显著高于对照,其中20 mg/L处理的根系活力增幅最大,为对照的2.12倍,其次依次为10、40、100、150 mg/L处理,分别为对照的1.54、1.44、1.38、1.22倍。B剂处理下红小豆幼苗根系活力的增幅较小,其中150、200 mg/L处理的红小豆幼苗根系活力与对照相比差异不显著。
2.5.2对根系保护酶(SOD、POD)活性、丙二醛(MDA)含量的影响SOD、POD是清除膜脂过氧化作用中氧自由基的关键酶,可以缓解和减轻膜脂过氧化作用,从而延缓植物衰老过程[CM(25]。如表5所示,红小豆幼苗根系SOD、POD活性随着烯效[CM)]
[TPLLQ5.tif][FK)]
唑浸种浓度升高呈先升后降的单峰趋势,各浸种浓度A剂处理均显著提高了根系SOD活性,200 mg/L处理下POD活性与对照差异不显著;200 mg/L B剂处理的SOD活性和40~200 mg/L B剂处理的POD活性与对照差异不显著。在所设定浓度范围内,20 mg/L浸种浓度使红小豆幼苗根系SOD、POD活性均处于较高水平,且显著高于其他浓度处理,20 mg/L A剂、B剂处理下SOD活性分别比对照高68.37%、52.12%,POD活性分别比对照高120.01%、97.39%。
由表5可见,在同种烯效唑处理下,红小豆根系MDA含量随浸种浓度升高呈先降低、后升高的趋势,最低值均出现在20 mg/L处理下,显著低于其他浓度处理,A剂、B剂处理下分别比对照下降了56.96%、46.89%。在相同浸种浓度下,A剂处理的红小豆幼苗根系MDA含量均低于B剂处理,在 20 mg/L 浓度处理下差异显著。
3结论与讨论
种子萌发是植株生长发育过程中极其重要的环节,它关系到成苗数及其质量,而种子发芽率、发芽势均可反映种子发芽速度和整齐度,是衡量种子质量的重要标准[11-12]。本研究表明,2种烯效唑(A剂、B剂)处理下红小豆种子发芽势、发芽率变化趋势一致,低浓度烯效唑浸种处理能显著提高红小豆种子发芽势、发芽率,随着浸种浓度升高,其促进效果开始下降。该结果与姚雄等在水稻上的研究结论[13]不一致,但与金喜军等的研究结果[14-15]一致,这可能是因为不同作物对烯效唑的敏感程度不同所致。本研究还表明,在较低浓度(<40 mg/L)范围内,A剂处理下的红小豆种子发芽率均显著高于B剂处理,在较高浓度(150~200 mg/L)范围内,二者差异不显著,且20 mg/L处理下二者均达到最大值。
生产上一般认为,壮苗的形态特征主要表现在株高适中、茎粗壮、节间较短、根系发达等方面[16]。本研究表明,2种烯效唑浸种对红小豆幼苗的株高均有抑制作用,随着浸种浓度升高,抑制作用越明显,且B剂对株高的矮化率大于A剂。在一定浓度范围内,烯效唑浸种对红小豆叶面积、根冠比、根系生长(总根长、根系表面积、体积、平均直径、最长根长)有明显促进作用,浓度过大反而会产生抑制作用,体现适宜浓度烯效唑具有“控上促下”的效果,这与以往对小麦、大豆、玉米等作物的研究结果[16-18]一致。另外,低浓度烯效唑处理显著提高了红小豆幼苗茎粗、壮苗指数,高浓度烯效唑处理下茎粗、壮苗指数提高幅度则较小。以上指标均在20 mg/L处理下效果最好,这与杨文钰等研究烯效唑对小麦根叶生理功能影响的最佳拌种浓度[19]一致,[JP2]表明生产上可以用烯效唑浸种来培育红小豆壮苗,且浸种浓度以20 mg/L最佳。本研究还表明,对于培育壮苗来说,5%烯效唑可湿性粉剂强于98%生物学试剂。众多研究表明,发达根系有利于提高植物的吸收范围而明显增加植物的抗旱性、耐瘠性[20]。红小豆为杂粮作物,一般会被种植在土壤肥力较低且干旱的地区,苗期又是红小豆最易受干旱的关键时期,使用烯效唑浸种对红小豆苗期根系生长的促进作用,必将有利于提高红小豆的抗旱与耐瘠能力。[JP]
叶绿素荧光参数和叶绿素含量可以揭示光系统及其电子传递情况,是分析植物光合功能的重要手段,也是研究植物光合生理状况的理想探针[21-22]。本研究中,低浓度烯效唑浸种处理增加了红小豆幼苗Fv/Fm、Fv/Fo、qP,降低NPQ,说明烯效唑浸种处理增加了PSⅡ反应中心开放比例和氧化态质体醌(QA)比例,提高了光合作用的原初光能转换效率,将PSⅡ天线色素吸收的光能用于光合电子传递的部分增多,减少了在非光化学过程热耗散的比例,这与李伟才等的研究结果[23]一致。其中20 mg/L A剂处理使Fv/Fm、Fv/Fo、qP均达到最大值,且显著高于对照,NPQ降到最低值,表明在该处理下最有利于红小豆幼苗的光合作用,增加营养物质的合成,为植株生长提供物质基础。另外,对红小豆叶绿素含量的研究表明,10~100 mg/L A剂浸种处理能够显著提高红小豆幼苗叶绿素含量,而10、20 mg/L B剂浸种浓度能够提高其叶绿素含量,且200 mg/L处理下叶绿素含量明显低于对照,但二者均在 20 mg/L [JP2]处理时达到最大值,并且A剂处理下的叶绿素含量显著高于B剂处理,说明20 mg/L A剂浸种浓度较 20 mg/L B剂处理能够更好地提高叶绿素含量,增强植株光合能力,这与王小春等研究喷施玉米叶片的最适烯效唑浓度结果[24]一致。[JP]
根系活力可反映根系的整体机能状况,即根系的吸收、合成、呼吸作用和向地上部运输水分、养分的能力,其变化直接影响地上部的生长和最终产量[25-26]。本研究表明,A剂、B剂处理均可提高红小豆幼苗根系活力,其最大值均出现在浸种浓度为20 mg/L时,且A剂处理下根系活力的提高幅度大于B剂处理。因此适当浓度的烯效唑浸种有利于提高红小豆幼苗根系活力,以维持水分、养分吸收,来满足红小豆幼苗生长。正常条件下植物体内活性氧自由基的产生和消除处于相对动态平衡中,植物体内清除氧化自由基主要由SOD、POD、CAT、GR等酶系统及抗坏血酸、谷胱甘肽的抗氧化物质来完成,其中SOD、POD是主要的抗氧化物酶,主要功能是清除超氧自由基,提高抗氧化能力,防御活性氧或其他氧化物自由基对细胞膜系统的伤害,其活性高低在一定程度上可反映植物抗逆性的强弱[27-28]。本研究表明,不同种类烯效唑处理下,红小豆幼苗根系SOD、POD活性均随着浸种浓度升高呈先增加、后减少的单峰曲线变化,均明显高于对照,特别是 20 mg/L A剂处理下根系SOD、POD活性的提高幅度最大,表明使用20 mg/L A剂(5%烯效唑可湿性粉剂)处理能更大幅度提高红小豆幼苗根系保护酶活性,及时清理植株体内的活性氧,从而减轻根系的受损程度,提高植株抗逆性。MDA是植物细胞膜脂过氧化的主要产物之一,其含量反映了膜脂过氧化程度,同时也是植株衰老进程的一个重要标志[29]。本研究表明,烯效唑浸种处理抑制红小豆幼苗根系MDA的产生,低浓度烯效唑处理抑制作用较强,在浓度为20 mg/L时MDA含量降到最低值,且A剂处理降低效果较明显,表明烯效唑浸种提高了植株抗氧化能力,延缓了植株衰老,为培育壮苗和抗逆性奠定了基础,这与张永清等的研究结果[30]一致。
本研究表明,20 mg/L烯效唑浸种处理对促进红小豆种子萌发和幼苗根系生长,进而增强其抗旱性的效果最明显,且5%烯效唑可湿性粉剂的药效强于98%烯效唑生物学试剂。但该结果是否适用于大田栽培,尚有待进一步考证。
[HS2]参考文献:
[1]刘子记,牛玉,曹振木,等. 多效唑对辣椒幼苗的矮化效应[J]. 北方园艺,2013(7):13-16.
[2]Leul M. Alleviation of waterlogging damage in winter rape by uniconazole application:effects on enzyme activity,lipid peroxidation,and membrane integrity[J]. Journal of Plant Growth Regulation,1999,18(1):9-14.
[3]Izumi K,Kamiya Y,Sakurai A,et al. Studies of sites of action of a new plant growth retardant(E)-1-(4-chlorophenyl)-4,4-dimethyl-2-(1,2,4-triazol-1-yl)-1-penten-3-ol(S-3307)and comparative effects of its stereoisomers in a cell-free system from Cucurbita maxima[J]. Plant & Cell Physiology,1985,26(5):821-827.
[4]李宁毅,时彦平,王吉振. 水分胁迫下烯效唑对百日草幼苗光合特性及叶解剖结构的影响[J]. 西北植物学报,2012,32(8):1626-1631.
[5]马冲,张成玲,刘震,等. 烯效唑对花生生长调节作用研究[J]. 中国农学通报,2012,28(24):222-225.
[6]闫艳红,杨文钰,张新全,等. 套作遮阴条件下烯效唑对大豆壮苗机理的研究[J]. 中国油料作物学报,2011,33(3):259-264.
[7]赵建京,范志红,周威. 红小豆保健功能研究进展[J]. 中国农业科技导报,2009,11(3):46-50.
[8]張志良,瞿伟菁,李小方. 植物生理学实验指导[M]. 4版.北京:高等教育出版社,2009:32-227.
[9]李鑫,张永清,王大勇,等. 水氮耦合对红小豆根系生理生态及产量的影响[J]. 中国生态农业学报,2015,23(12):1511-1519.
[10]余凯凯,宋喜娥,高虹,等. 不同施肥水平下多效唑对马铃薯光合及叶绿素荧光参数的影响[J]. 核农学报,2016,30(1):154-163.
[11]宋胜,冯乃杰,郑殿峰. 烯效唑浸种对大豆种子萌发及保护酶系的影响[J]. 大豆科学,2008,27(2):259-261.
[12]孙运波,陈翔,陈垣,等. 种荚预处理对红芪种子发芽特性的影响[J]. 草业学报,2015,24(6):159-167.
[13]姚雄,任万军,杨文钰,等. 烯效唑浸种对水稻种子萌发及秧苗生长的影响[J]. 作物杂志,2008(1):75-78.
[14]金喜军,张盼盼,屈春媛,等. 烯效唑浸种对盐胁迫下糜子萌发和幼苗质量的调控效应[J]. 干旱地区农业研究,2015,33(6):149-154.
[15]田再民,张瑞玖,许明丽,等. 不同浓度烯效唑浸种对玉米巡天969种子萌发及生长的影响[J]. 安徽农学通报,2015,21(6):28-29.
[16]闫艳红,李波,杨文钰. 烯效唑浸种对大豆苗期抗旱性的影响[J]. 中国油料作物学报,2009,31(4):480-485.
[17]廖尔华,丁丽,罗延宏,等. 烯效唑浸种对玉米种子萌发及幼苗生长的影响[J]. 西南农业学报,2014,27(6):2339-2344.
[18]刘良全,张水利,景小元,等. 几种化学调控物质对盐胁迫下小麦幼苗生长及生理指标的调控作用[J]. 麦类作物学报,2010,30(1):73-78.
[19]杨文钰,樊高琼,任万军,等. 烯效唑干拌种对小麦根叶生理功能的影响[J]. 中国农业科学,2005,38(7):1339-1345.
[20]丁红,张智猛,戴良香,等. 不同抗旱性花生品种的根系形态发育及其对干旱胁迫的回应[J]. 生态学报,2013,33(17):5169-5176.
[21][JP2]许耀照,曾秀存,郁继华,等. 水杨酸对高温胁迫下黄瓜幼苗叶绿素荧光参数的影响[J]. 西北植物学报,2007,27(2):267-271.[JP]
[22]冯伟,李晓,王永华,等. 小麦叶绿素荧光参数叶位差异及其与植株氮含量的关系[J]. 作物学报,2012,38(4):657-664.
[23]李伟才,张红娜,石胜友,等. 成花诱导期喷施烯效唑和赤霉素对荔枝叶片叶绿素荧光特征的影响[J]. 热带作物学报,2014,35(12):2414-2419.
[24]王小春,杨文钰,陈刚,等. 喷施烯效唑对玉米叶片衰老特性和产量的影响[J]. 玉米科学,2009,17(1):86-88.
[25]Daimon H,Yoshioka M. Responses of root nodule formation and nitrogen fixation activity to nitrate in a splitroot system in peanut (Arachis hypogaea L.)[J]. Journal of Agronomy and Crop Science,2001,187(2):89-95.[HJ][FL)]
[KH*4D]
[HT8.]
[26]廉华,谢秀芳,李欣,等. 磷素对甜瓜幼苗根系生理活性物質的影响[J]. 核农学报,2015,29(8):1632-1639.
[27]张永清,刘凤兰,贾蕊,等. La(NO3)3浸种对盐碱胁迫下红小豆幼苗生长和抗氧化酶活性的影响[J]. 生态与农村环境学报,2009,25(4):12-18.
[28]郭天荣,陈丽萍,冯其芳,等. 铝、镉胁迫对空心菜生长及抗氧化特性的影响[J]. 核农学报,2015,29(3):571-576.
[29]王海茹,张永清,董文晓,等. 水氮耦合对黍稷幼苗形态和生理指标的影响[J]. 中国生态农业学报,2012,20(11):1420-1426.
[30]张永清,裴红宾,刘良全,等. 烯效唑浸种对谷子植株生长发育的效应[J]. 作物学报,2009,35(11):2127-2132.
