以甲酸溶液为介质的磁性介孔硅纳米材料的制备及其吸附性能
2017-04-27章弘扬王月荣华东理工大学化学与分子工程学院上海市功能性材料化学重点实验室上海20027青海大学化工学院西宁8006华东理工大学药学院上海市新药设计重点实验室上海20027
付 华, 胡 静, 章弘扬, 王月荣, 张 敏, 胡 坪(.华东理工大学化学与分子工程学院,上海市功能性材料化学重点实验室,上海 20027; 2.青海大学化工学院,西宁8006; .华东理工大学药学院,上海市新药设计重点实验室,上海20027)
以甲酸溶液为介质的磁性介孔硅纳米材料的制备及其吸附性能
付 华1,2, 胡 静1, 章弘扬1, 王月荣1, 张 敏3, 胡 坪1
(1.华东理工大学化学与分子工程学院,上海市功能性材料化学重点实验室,上海 200237; 2.青海大学化工学院,西宁810016; 3.华东理工大学药学院,上海市新药设计重点实验室,上海200237)
以甲酸溶液为介质,采用溶剂热法、改良的Stober法,用聚乙烯-聚乳酸共聚物做模板剂制备磁性介孔硅纳米材料,通过X射线衍射(XRD)、扫描电镜(SEM)、透射电镜(TEM)、综合物性测量系统(PPMS)、比表面积及孔径分布测量仪等分析测试手段对所得磁性介孔硅纳米材料进行表征,并研究了其吸附性能。结果显示,以0.2 mol/L甲酸溶液为介质制备的磁性介孔材料孔径为8.2 nm、比表面积为258 m2/g、孔体积为0.32 cm3/g,饱和磁化强度达53 A·m2/kg。这种磁性介孔硅纳米材料对牛血清蛋白、中性红、亚甲基蓝等物质有良好的吸附能力,其饱和吸附量分别达到53.6、24.1、66.8 mg/g,表明制备的磁性介孔硅纳米材料在复杂环境样品的分离和富集方面具有一定的应用前景。
磁性介孔硅纳米材料; 甲酸; 吸附性能; 制备
以介孔二氧化硅包覆的磁性纳米粒子具有良好生物相容性,其介孔结构使材料具有较大比表面积,磁性内核具有超顺磁性,在外磁场作用下有较好的磁响应性,广泛应用于催化剂载体、靶向载药、传感器及富集萃取等领域[1-2]。常用的磁性硅介孔材料的介孔外包覆层是以十六烷基三甲基溴化铵(CTAB)为模板剂制备的MCM-41,其孔径分布通常在2.4~3.8 nm[3-4],因介孔孔径较小而不能满足某些需要较大孔径的场合。近年来,以三嵌段共聚物聚环氧乙烷-聚环氧丙烷-聚环氧乙烷(P123)为模板剂制备的SBA-15也被作为磁性内核的介孔外包覆层,其孔径可达8.2~16 nm[5-7],这种介孔材料可吸附蛋白质,在生物医学方面有较好的应用前景。以P123为模板剂制备磁性介孔材料时,介孔层的生长往往是在盐酸等较强酸性条件下进行,四乙氧基硅烷水解后,在模板剂周围形成稳定的交联层,最后再将模板剂去除,从而形成介孔层[7-9]。但在这种盐酸介质的酸性条件下制备磁性介孔材料容易因铁核被腐蚀而导致磁性丧失。
本课题组前期尝试采用聚乙烯-聚乳酸共聚物为模板剂[7],以盐酸溶液为介质,所制备的磁性介孔材料孔径可达4.7~8.5 nm,比表面积最高达800 cm2/g。在介孔层的制备过程中加入乙醇可有效抑制过高浓度的盐酸对四氧化三铁磁核的腐蚀,但得到的介孔层较厚,饱和磁化强度较弱。为了实现单层包覆,提高介孔的利用率及饱和磁化强度,本研究以甲酸溶液作为介质解决强酸性介质对磁核的腐蚀问题,制备了孔径约为8 nm的单层包覆磁性介孔材料(MMNS),并将该材料应用于大分子化合物牛血清蛋白及小分子染料的吸附。
1 实验部分
1.1 实验试剂及仪器
实验药品:无水三氯化铁、柠檬酸三钠、无水乙酸钠、氨水、无水乙醇、甲酸、乙二醇、中性红、亚甲基蓝,均为分析纯,购自国药集团化学试剂有限公司;四乙氧基硅烷(TEOS),购自萨恩化学技术(上海)有限公司;聚乙二醇-聚乳酸共聚物(PEG-PLA);购自济南岱罡化学技术有限公司;牛血清蛋白,购自Amersco生化试剂有限公司。
实验仪器:Nicolet 380 红外光谱仪(美国赛默飞公司);METTLER AE240 电子天平及CH-8606 微量分析天平(德国梅特-勒托利多公司);EPED-E1-T型实验室超纯水机(南京易普达科技发展有限公司);TL-5.0 台式离心机(上海市离心机械研究所);DZX-3 真空干燥箱(上海福玛实验设备有限公司);KQ-500DE型加热超声波清洗机(功率500 W,昆山超声仪器有限公司);DF-101S 集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);JJ-1 精密增力电动搅拌器(常州国华电器有限公司);X’Pert Pro型全自动X-射线衍射仪(荷兰帕纳科公司);JSM-5610LV型低真空扫描电子显微镜(日本电子);JEM-2100型高分辨透射电镜(日本电子);ASAP-2010型N2吸脱附仪(美国麦克默瑞提克公司);PPMS-9T (EC-II)型物性测试仪(美国量子设计公司);Mastersizer 2000型激光粒度分析仪(英国马尔文);DACT-11接触角测量仪(德国DATEPHYSICS)。
1.2 磁性Fe3O4及Fe3O4@nSiO2的制备
制备方法参照参考文献[7],具体步骤如下:
将0.15 g FeCl3和0.2 g柠檬酸三钠分散在70 mL乙二醇中,再加入2.8 g醋酸钠,混合物剧烈搅拌30 min后,将其封入聚四氟乙烯反应釜中,在自生压力下,于200 ℃保温10 h,将反应釜取出后自冷至室温,得到Fe3O4黑色微粒,用乙醇和去离子水多次洗涤。
称取0.1 g Fe3O4微粒于50 mL的0.1 mol/L HCl水溶液中超声分散,分离出磁性微粒后,再用去离子水洗涤3遍。将Fe3O4微粒置于40 mL乙醇、10 mL去离子水及0.8 mL浓氨水混合溶剂中,搅拌30 min,使其分散,然后向溶液中加入50 μL TEOS,室温搅拌,分离得到Fe3O4@nSiO2产物。
1.3 MMNS的制备
将0.05 g PEG-PLA溶解于含有80 mL去离子水及528 μL甲酸的混合溶液中,40 ℃下搅拌6 h,使其形成胶束,再加入60 mL乙醇及0.10 g Fe3O4@nSiO2,剧烈搅拌0.5 h后,缓慢滴加150 μL TEOS,约30 min滴加完毕,继续搅拌6 h。将上述溶液密封于反应釜中,110 ℃下保温48 h。待反应釜冷却至室温后,分离出磁性产物,用去离子水和乙醇洗涤干净,置于真空干燥箱中于60 ℃下干燥24 h,在马弗炉中550 ℃下焙烧5 h以除去模板剂,得到终产物MMNS。
1.4 材料吸附能力测试
1.4.1 对蛋白质的吸附能力测试[7]取质量浓度为1.2 mg/mL的牛血清蛋白磷酸盐(PBS)缓冲液(pH=7.4)溶液10 mL,加入60 mg MMNS,在25 ℃摇床中150 r/min转速条件下震荡吸附。每隔一定时间取上清液100 μL,用微量比色皿于紫外-可见分光光度计上278 nm处测定吸光度。以时间为横坐标,吸附量为纵坐标,绘制吸附曲线,计算MMNS对牛血清蛋白的饱和吸附量。
取吸附了牛血清蛋白达饱和的磁性介孔材料,以pH=4.7的PBS缓冲液1 mL超声洗脱30 min,在外加磁场作用下分离MMNS,将上清液转移至5 mL容量瓶中。再重复上述步骤2次,合并上清液,以w为5% NaOH溶液调节pH=7.4,定容至5 mL,于278 nm处测定吸光度值,并计算牛血清蛋白的回收率。
1.4.2 对染料的吸附能力测试 取适量的中性红,用φ为50%乙醇配制成质量浓度为100 μg/mL的中性红溶液。取适量的亚甲基蓝,以pH=7.4的PBS缓冲液配制成质量浓度为100 μg/mL的亚甲基蓝溶液。分别取上述溶液10 mL,各自加入60 mg MMNS,在25 ℃摇床中150 r/min转速条件下震荡吸附。每隔一定时间取中性红溶液100 μL,稀释2倍,用微量比色皿于紫外-可见分光光度计上455 nm处测定吸光度;每隔一定时间取亚甲基蓝溶液100 μL,用微量比色皿于紫外-可见分光光度计上655 nm处测定吸光度。以时间为横坐标,吸附量为纵坐标,绘制吸附曲线,计算MMSN对两种染料的饱和吸附量。
将吸附了中性红的磁性介孔材料分散于1 mL丙酮中,超声洗脱10 min后,外加磁场分离MMNS,将上清液转移至10 mL离心管中。重复上述步骤3次,将所得上清液合并,氮吹挥干丙酮溶剂,以50%的乙醇溶液复溶,在455 nm处测试吸光度,并计算中性红的回收率。
将吸附了亚甲基蓝的磁性介孔材料分散于0.5 mL的2 mol/L NaOH的甲醇溶液(VCH3OH∶VH2O=1∶1)中,超声洗脱10 min,用外加磁场分离MMNS,将上清液转移至10 mL离心管中。重复上述步骤3次,氮吹挥去甲醇后,滴加HCl溶液中和,再以pH=7.4的PBS缓冲液定容至5 mL,于660 nm处测试吸光度,并计算亚甲基蓝的回收率。
2 结果与讨论
2.1 MMNS制备过程中模板剂的加入量
二嵌段聚合物PEG-PLA具有非离子表面活性剂特性,因此本文将其用作制备介孔材料时的模板剂。为了考察模板剂加入量的影响,采用激光粒度仪和接触角测量仪测定了PEG-PLA临界胶束浓度和胶团粒度大小,结果见图1。图1(a)所示为PEG-PLA临界胶束浓度测定结果,图1(b)所示为不同浓度的PEG-PLA的粒径分布曲线。由图1(a)可知,当PEG-PLA浓度为2.52×10-8mol/L时达到临界胶束浓度;由图1(b)则可知,该浓度下胶束粒度为60 nm左右。当模板剂的加入量为临界胶束浓度的10倍时,胶束粒径为100 nm左右。当加入量为临界胶束浓度的100倍时,胶束粒径的平均粒径为200 nm。然而,通过实验发现,虽然模板剂的加入量对胶束粒径的影响较大,但用这3种级数浓度的模板剂制备的介孔材料孔径却差别不大,均为8 nm左右,这可能与超声搅拌和有机酸溶液为介质等制备条件有关。本实验还测定了PEG-PLA浓度分别为2.55×10-8、4.55×10-7、6.06×10-6、1.21×10-5mol/L时所制备的磁性介孔材料的BET数据,结果如表1所示。

表1 不同PEG-PLA加入量下磁性介孔材料的比表面积、平均孔径和总孔体积
由表1可以看出,随着模板剂PEG-PLA用量的增加,制得的磁性介孔材料的比表面积显著增大,而孔径和孔体积略有增大。且当PEG-PLA用量增大到6.06×10-6mol/L后,比表面积和孔径的变化不再明显。综合考虑,可以认为PEG-PLA的加入量为6.06×10-6mol/L较为合适。
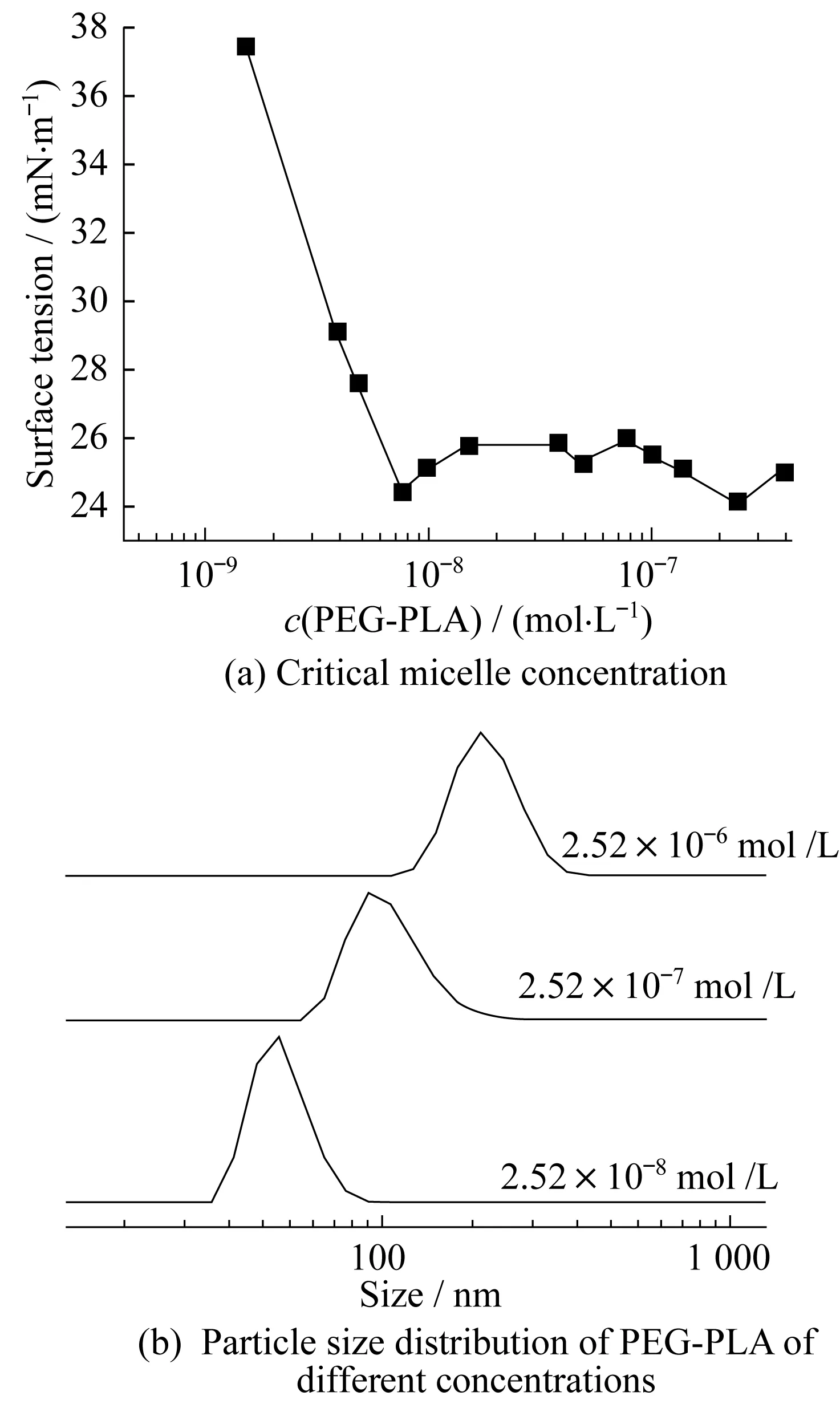
图1 PEG-PLA的临界胶束浓度及粒度分布
2.2 介孔材料制备过程中甲酸浓度的影响
固定其他条件不变,以浓度为0.2 mol/L及2 mol/L的甲酸溶液分别作为介质,制备的磁性介孔材料的BET曲线如图2(a)所示。由氮气吸脱附测试获得的比表面积分别为258 m2/g和187.4 m2/g,平均孔径分别为8.2 nm和8.8 nm,孔体积分别为0.32 m3/g和0.24 m3/g。由图2(a)可以看出,在两种甲酸浓度下制备得到的介孔硅纳米材料,其等温吸脱附曲线都是属于IV型H1迟滞环,具备典型的介孔特征。两根孔径分布曲线中,在8 nm左右的位置都只出现一个峰,其中2 mol/L甲酸介质中制备的介孔材料的峰型较尖锐,说明其孔径分布较窄,而0.2 mol/L甲酸介质中制备的介孔材料的孔径分布较宽,为6~8.5 nm。由图2(b)和2(c)可知,两种浓度的甲酸介质中所得到的介孔材料都具有较均一的孔径及蠕虫状的形貌,同时也可以看出,0.2 mol/L甲酸溶液中得到的MMNS外包覆层接近于单层包覆;而在2 mol/L甲酸条件下,包覆层较厚,这将导致磁性减弱。因此尽管0.2 mol/L甲酸介质制备的介孔材料孔径分布较宽,仍可认为0.2 mol/L的甲酸溶液作为介质较为合适。
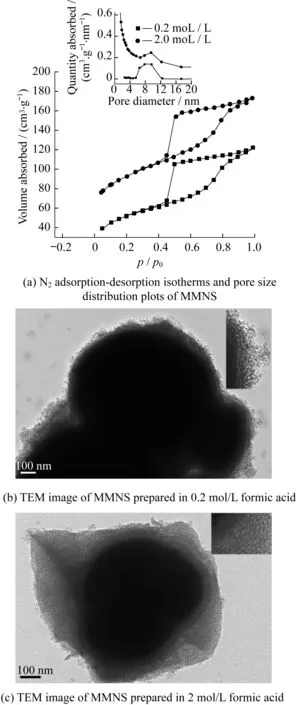
图2 MMNS的孔结构表征
2.3 磁性纳米颗粒MMNS的物相、形貌及磁性表征
由图2(b)可知,采用甲酸作为酸性介质制备的介孔材料具备球形单分散Fe3O4的特征形貌,介孔结构为无序蠕虫状介孔。由图3可知,以0.2 mol/L的甲酸溶液为介质,模板剂浓度为6.06×10-6mol/L时制备的MMNS具备超顺磁性,且与本课题组以盐酸乙醇溶液为介质制备的MS-48[7]比对,磁性有较大程度的提高。VSM数据表明,Fe3O4磁化强度为78 A·m2/kg,MS-48为44 A·m2/kg,MMNS达到53 A·m2/kg,说明当以甲酸溶液为介质制备介孔层时,不会发生对Fe3O4的酸蚀现象。
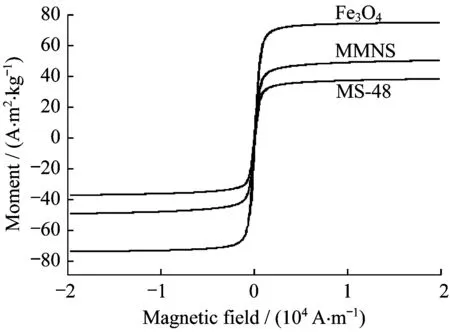
图3 Fe3O4、MS-48及MMNS纳米粒子的磁滞回线
2.4 蛋白质和染料吸附
为了评价MMNS的应用性能,本文使用平均相对分子质量为66.4 kDu的牛血清蛋白及常见的环境污染染料中性红和亚甲基蓝作为吸附对象。MMNS对牛血清蛋白、中性红和亚甲基蓝的吸附量与时间关系如图4所示。由图可知,MMNS对亚甲基蓝的吸附速度最快,120 min内即能达到吸附平衡,对中性红的吸附平衡时间约为180 min,对大分子化合物牛血清蛋白在240 min内能达到饱和吸附,这说明MMNS拥有较合适的介孔孔径,对大分子化合物的吸附能在较短时间内完成饱和。
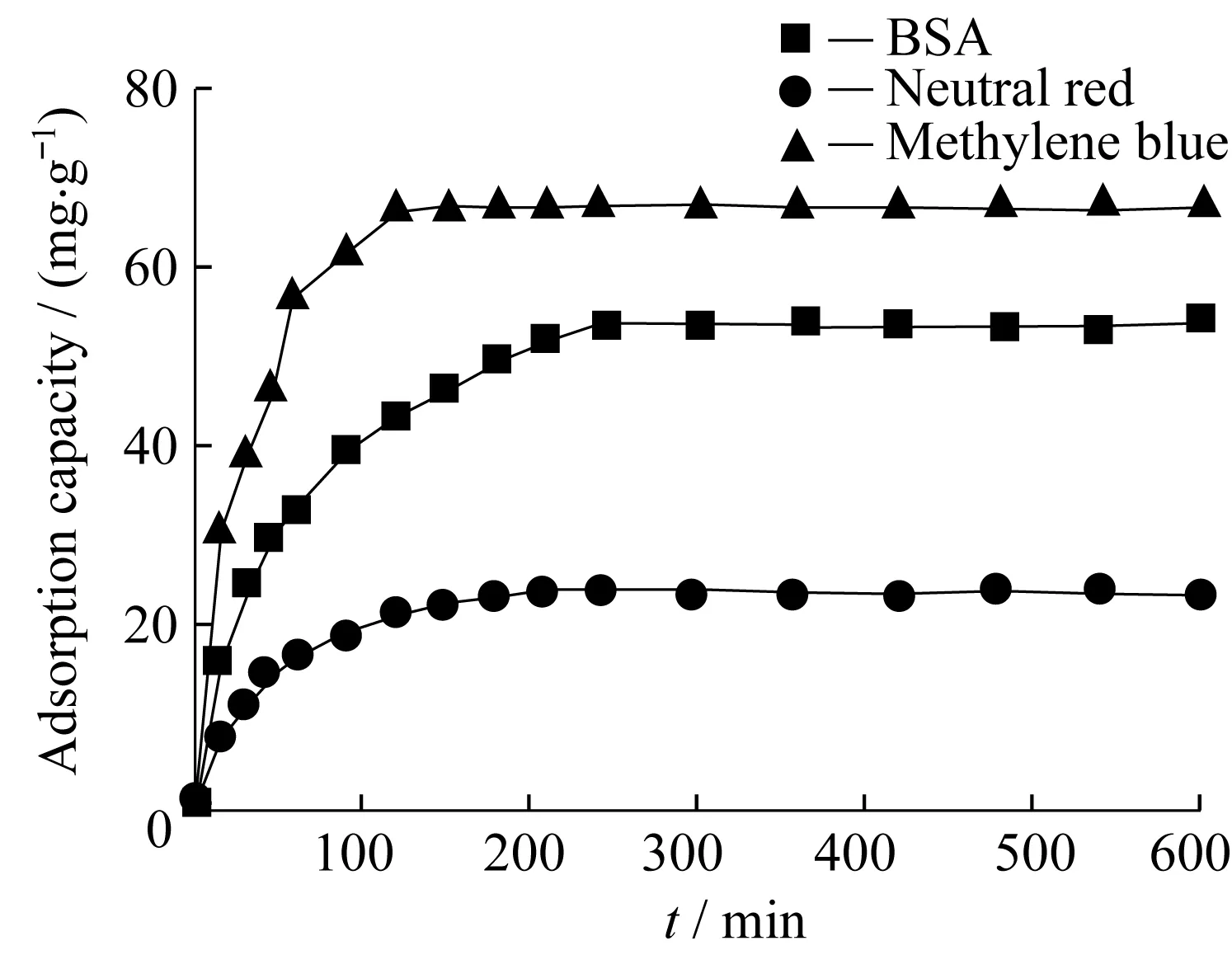
图4 BSA、中性红和亚甲基蓝的吸附曲线
MMNS吸附前后BSA溶液的吸收曲线见图5。由图可知,吸附4 h后,上清液中BSA的浓度明显下降。经计算,MMNS对牛血清蛋白的吸附量达53.6 mg/g,说明制备的磁性介孔材料对蛋白质有较好的吸附作用。以PBS缓冲溶液(pH=4.7)对牛血清蛋白脱附,回收率可达81%。说明该材料可以用于含大分子化合物样品的净化、富集萃取及分离。
MMNS吸附前后中性红及亚甲基蓝溶液的吸收曲线见图6。由图可知,MMNS对中性红的吸附良好,吸附量达24.1 mg/g,以丙酮对其脱附,回收率可达94%。MMNS对亚甲基蓝的吸附量高达66.8 mg/g,以2 mol/L氢氧化钠甲醇水溶液对其洗脱,回收率可达87%。说明该材料可以用于中性红及亚甲基蓝等染料污染的环境水样的净化、富集萃取及定量分析。
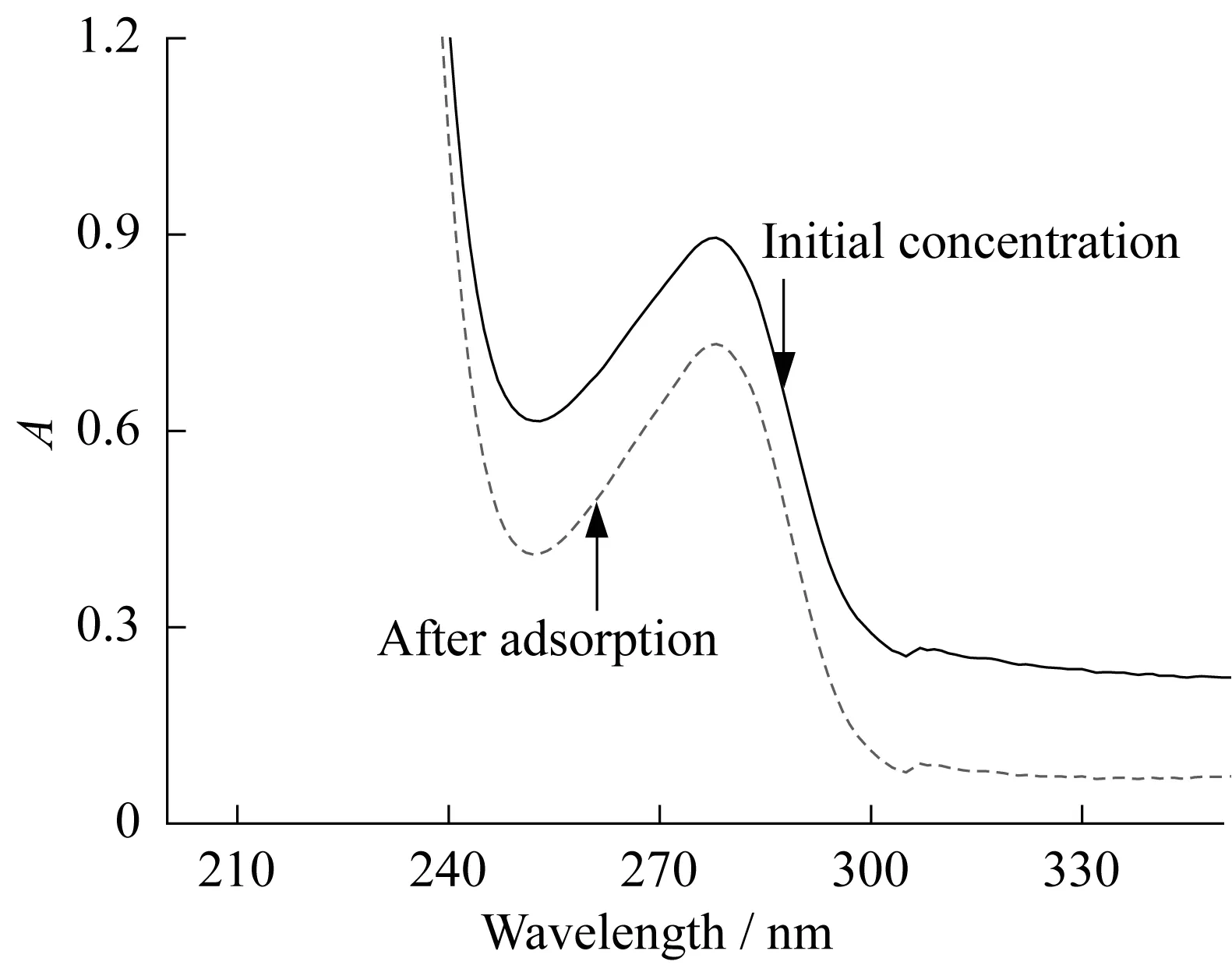
图5 MMNS吸附前后BSA溶液的吸收曲线
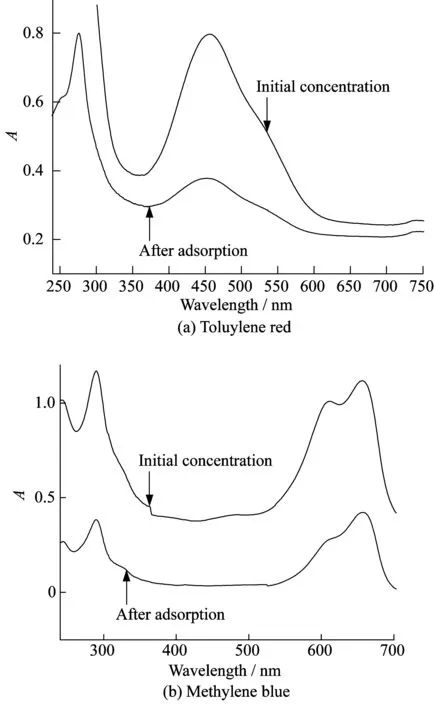
图6 MMNS吸附前后染料溶液的吸收曲线
3 结 论
本研究以PEG-PLA作为模板剂,甲酸溶液作为酸性介质,制备了具有蠕虫状介孔的磁性硅介孔纳米材料MMNS。结果表明:当PEG-PLA的投料量为0.2 g、甲酸加入浓度为0.2 mol/L时所制备的纳米材料比表面积为258 m2/g,平均孔径约为8.2 nm,孔体积为0.32 m3/g。该MMNS材料的制备方法解决了盐酸介质中磁核易被酸蚀的问题,且材料介孔层接近单层包覆,使饱和磁化强度达到53 A·m2/kg,具有较强的超顺磁性。制备的介孔层孔径不仅适合于小分子化合物如染料的吸附,也可用于大分子化合物如蛋白质的吸附,因此具有良好的应用前景。
[1]ROSENHOLM J M,SAHLGREN C,LINDÉN M.Towards multifunctional,targeted drug delivery systems using mesoporous silica nanoparticles-opportunities & challenges[J].Nanoscale,2010,2(10):1870-1883.
[2]KIM J,KIM H S,LEE N,etal.Multifunctional uniform nanoparticles composed of a magnetite nanocrystal core and a mesoporous silica shell for magnetic resonance and fluorescence imaging and for drug delivery[J].Angewandte Chemie International Edition,2008,47(44):8438-8441.
[3]KIM J,LEE J E,LEE J,etal.Magnetic fluorescent delivery vehicle using uniform mesoporous silica spheres embedded with monodisperse magnetic and semiconductor nanocrystals[J].Journal of the American Chemical Society,2006,128(3):688-689.
[4]FARAJI M,YAMINI Y,REZAEE M.Magnetic nanoparticles:Synthesis,stabilization,functionalization,characterization,and applications[J].Journal of the Iranian Chemical Society,2010,7(1):1-37.
[5]ZHAO W,GU J,ZHANG L,etal.Fabrication of uniform magnetic nanocomposite spheres with a magnetic core/mesoporous silica shell structure[J].Journal of the American Chemical Society,2005,127(25):8916-8917.
[6]LI H,SHAN Y,QIAO L,etal.Facile synthesis of boronate-decorated polyethyleneimine-grafted hybrid magnetic nanoparticles for the highly selective enrichment of modified nucleosides and ribosylated metabolites[J].Analytical Chemistry,2013,85(23):11585-11592.
[7]FU H,CHEN Y Q,ZHANG H Y,etal.Synthesis of mesoporous silica-coated magnetic nanocomposites using polyethylene glycol-polylactic acid as a new template[J].Journal of Nanoscience and Nanotechnology,2017,17(5):3077-3083.
[8]YANG J,ZHANG F,LI W,etal.Large pore mesostructured cellular silica foam coated magnetic oxide composites with multilamellar vesicle shells for adsorption[J].Chemical Communications,2014,50(6):713-715.
[9]ROSENHOLM J M,ZHANG J,SUN W,etal.Large-pore mesoporous silica-coated magnetite core-shell nanocomposites and their relevance for biomedical applications[J].Microporous and Mesoporous Materials,2011,145(1):14-20.
Preparation of the Magnetic Mesoporous Silica Nanomaterials with Formic Acid Solution as the Medium and Its Adsorption Properties
FU Hua1,2, HU Jing1, ZHANG Hong-yang1, WANG Yue-rong1, ZHANG Min3, HU Ping1
(1.Shanghai Key Laboratory of Functional Materials Chemistry,School of Chemistry and Molecular Engineering,East China University of Science and Technology,Shanghai 200237,China; 2.School of Chemical Engineering,Qinghai University,Xining 810016,China; 3.Shanghai Key Laboratory of New Drug Design and Modern Engineering Center for TCM,School of Pharmacy, East China University of Science and Technology,Shanghai 200237,China)
A new magnetic mesoporous silica nano material was synthesized by using improved Stober and solvothermal methods with formic acid solution as acidic medium and PEG-PLA as template.X-ray diffraction (XRD),field emission scanning electron microscopy (FE-SEM),transmission electron microscopy (TEM),physical property measurement system (PPMS),and specific surface area and pore size distribution measuring instrument were applied to characterize this material.The results showed that the magnetic mesoporous silica nano material which was synthesized in 0.2 mol/L formic acid solution had 8.2 nm of pore cavities,258 m2/g of surface area,0.32 cm3/g of pore volume and 53 A·m2/kg of saturation magnetization.This magnetic mesoporous silica nano material had favorable adsorption capacity of bovine serumalbumin,toluylene red and methylene blue with 53.6,24.1,66.8 mg/g respectively,which indicated it had certain application prospect in the separation and enrichment complex aspects of environmental samples.
magnetic mesoporous silica nano material; formic acid; adsorption capacity; preparation
1006-3080(2017)02-0207-06
10.14135/j.cnki.1006-3080.2017.02.009
2016-09-06
国家自然科学基金(81273481,81202493);澳门科技大学开放基金(MUST-SKL-2016-06);青海省科技厅自然基金(2016-ZJ-734)
付 华(1978-) ,女,河南人,副教授,博士生,研究方向为固相萃取。
胡 坪,E-mail:huping@ecust.edu.cn
TB34
A
