Streptomyces sp.Tü 4128中新型抗生素bagremycins抗性基因bagJ的研究
2017-04-27张玉琛吴海珍祁双双张惠展华东理工大学生物反应器工程国家重点实验室上海200237
张玉琛, 吴海珍, 鞠 诚, 祁双双, 叶 江, 张惠展(华东理工大学生物反应器工程国家重点实验室,上海 200237)
Streptomycessp.Tü 4128中新型抗生素bagremycins抗性基因bagJ的研究
张玉琛, 吴海珍, 鞠 诚, 祁双双, 叶 江, 张惠展
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
通过框内敲除鉴定了链霉菌Streptomycessp.Tü 4128中基因bagJ的功能。HPLC结果表明,敲除基因bagJ导致抗生素生产水平大幅降低;回补菌株恢复了抗生素的生产;过表达菌株大幅提高了抗生素的产量,证明基因bagJ在新型抗生素bagremycins的生物合成中必不可少。抑菌圈实验表明基因bagJ敲除菌株较野生菌株对bagremycins更加敏感;BagJ在StreptomyceslividansTK64中异源表达后使该菌株对bagremycins的耐受性增强,证明bagJ是新型抗生素bagremycins的抗性基因。扫描电镜的结果证明了BagJ异源表达后导致StreptomycesTK64的菌丝形态发生了改变。其他抗生素的敏感性实验表明,BagJ可能是一个逆向转运蛋白。
bagremycins;Streptomycessp.Tü 4128;bagJ; MFS家族; 抗性基因
从印度尼西亚土壤中分离得到的Streptomycessp.Tü 4128 (S. sp. Tü 4128)菌株可以生产两种新型的反式香豆酸衍生类抗生素bagremycin A和bagremycin B。bagremycin A和bagremycin B对多种革兰氏阳性菌、真菌以及一种人类腺癌细胞系具有相当可观的生物学活性。其中bagremycin A对SaccharomycescerevisiaeATCC9080和Candidaalbicans具有活性,而bagremycin B能作用于Botrytiscinerea和人类腺癌细胞[1-2]。这两种抗生素在医药和农业领域具有潜在的应用价值。
与bagremycins生物合成相关的基因在菌株S. sp.Tü 4128的染色体上成簇排列。在前期的研究中,本课题组成功克隆并鉴定了bagA,bagB,bagC,bagE和bagI等结构基因,但至今仍未发现该生产菌的抗性基因[3-5]。作为抗生素的生产者,除了有一些菌株对自身产生的抗生素不敏感,大多数微生物都需要一个或多个相应的抗性基因来维持抗生素生产的能力,同时抵抗自身产生的毒性代谢产物[6-8]。这种抵抗作用主要包括以下几种机理:抗生素失活[9-10]、修饰抗生素作用的靶点[11-12]以及改变抗生素的转运量和外膜的通透性等[13-16]。
为了维持细胞的长期稳定,微生物进化出了多种通道系统以及转运蛋白用于转运金属离子和亲水分子等。在细菌中主要存在3种转运机制:初级转运、次级转运和基团移位系统。主要协助转运蛋白的超家族(Major facilitator superfamily,MFS)属于次级多重药物转运蛋白,并且是这一类型中最大的超家族[17-18]。这种转运蛋白通过“Rocker-switch”机制实现底物转运[19]。MFS转运系统是一个典型的多特异性转运蛋白,因为具有多功能的底物结合疏水腔,使得不同结构的底物分子可以穿膜[20-21]。一般来说,MFS转运系统包含12个或14个跨膜片段(transmembrane segment,TMS)[22-23]。典型的MFS家族成员可以分为3类:(1)单一转运蛋白:只能运输1个底物;(2)同向转运蛋白:同时同向运输2个以上底物;(3)逆向转运蛋白:同时逆向转运2个以上底物[19]。
本研究鉴定了一个MFS家族的新成员BagJ,该蛋白在菌株S.sp. Tü 4128中具有逆向转运蛋白的功能。就目前的数据所知[1-5],bagJ是第一个在S.sp. Tü 4128中鉴定出的bagremycins抗性基因,这为进一步研究bagremycins的抗性机制以及生产菌S.sp. Tü 4128转运代谢物的途径提供了新的思路。
1 材料与方法
1.1 菌株,质粒及生长条件
表1列出了本文涉及到的所有菌株和质粒,Escherichiacoli和Streptomyces的培养条件参照本实验室前期研究中的标准流程[5]。

表1 本文中所用的菌株和质粒
1.2 基因的敲除、回补、过表达及异源表达
根据本实验室前期所建立的流程[3],将基因bagJ的上游691 bp和下游640 bp同源臂克隆至穿梭质粒pOJ260-neo上,利用同源重组的方式,对基因bagJ进行框内敲除。在含有萘啶酮酸的SMA(Soybean Mannitol Agar)平板上,通过卡那霉素抗性筛选阳性克隆并进行测序验证。在回补实验中,将基因bagJ的ORF(Open Reading Fram)克隆至质粒pIB139的启动子PermE*下游构建回补质粒pIB139-bagJ,并分别将该质粒导入bagJ敲除菌株ΔbagJ、野生菌株WT以及S.lividansTK64中,从而实现回补菌株bagJ+、过表达菌株bagJ++以及异源表达菌株S. lividans TK64/bagJ的构建。
1.3 发酵及发酵产物的HPLC分析
发酵产物的提取以及HPLC分析方法在本实验室前期研究中已有详细说明[5]。
1.4 扫描电镜方法
将S.lividansTK64和S.lividansTK64/bagJ在YEME (Yeast Extract-Malt Extract)培养基中培养3 d。收集1.5 mL菌液,用双蒸水和0.1 mol/L PBS缓冲液分别洗涤1次。洗涤好的细胞用新鲜配制的φ=25%戊二醛溶液固定过夜。此后,用0.1 mol/L PBS缓冲液洗涤细胞3次,并用双蒸水洗涤1次。用体积分数分别为30%,50%,70%,90%和100%的乙醇进行梯度脱水。在自然风干后,将样品进行黏台和喷金,随后用JSM-6360LV扫描电镜进行检测。
1.5 抑菌圈实验
本文通过抑菌圈实验检测了野生菌株WT、敲除菌株ΔbagJ、回补菌株bagJ+、S.lividansTK64和异源表达菌株S.lividansTK64/bagJ对不同浓度bagremycins粗提物及其溶剂甲醇的敏感性。在培养了5 d的SMA平板上,收集上述菌株的孢子并测定浓度。在每个平板上,放置4个钢圈,每个钢圈内包含特定浓度的bagremycins。另外,用150 μg卡那霉素(KAN)、500 μg壮观霉素(SP)、100 μg氯霉素(C)、40 μg四环素(TC)以及400 μg氨苄青霉素(AMP)检测S.lividansTK64和S.lividansTK64/bagJ对不同抗生素的敏感性。与此同时,将配制上述抗生素时使用到的特殊溶剂DMSO (Dimethyl sulfoxide)以及乙醇作为空白对照。上述抑菌圈实验用到的平板在28 ℃孵育4 d,最后取出钢圈观察抑菌圈大小。
2 实验结果
2.1 BagJ的生物信息学分析
表2的数据表明,在Uniprot数据库中,通过在线BLAST (Basic Local Alignment Search Tool)比对,发现BagJ和其他放线菌属中已经确认的MFS转运蛋白或预测具有MFS转运功能的蛋白非常类似。

表2 S.sp.Tü 4128中BagJ蛋白与其他放线菌属蛋白序列相似性分析
NCBI(National Center for Biotechnology Informaion)生物信息学分析结果表明,在BagJ第33~444个氨基酸之间存在一个MFS特征保守结构域(MFS superfamily [cl21472])。此外,通过3个不同的在线平台(TMHMM Server v.2.0:Prediction of transmembrane helices in proteins,TopPred0.01:Topology prediction of membrane proteins and SACS HMMTOP Transmembrane)预测BagJ存在14个潜在的TMS,预测结果见图1。图1(a)预测了BagJ的跨膜螺旋结构;图1(b)预测了BagJ的拓扑结构,其中14个明显的疏水峰用图顶端的垂直线条标出。2条水平线之间的面积用于识别潜在的TMS,横、纵坐标分别代表了氨基酸的位置及相对的疏水性;图1(c)所示为BagJ二维模型及膜定位的分析。这种构象与MFS转运蛋白家族的14-TMS典型结构一致。综合上述信息生物学分析的结果,本文推测BagJ是一个具有14个TMS的疏水蛋白,并且作为MFS家族的一个成员定位在细胞膜上。
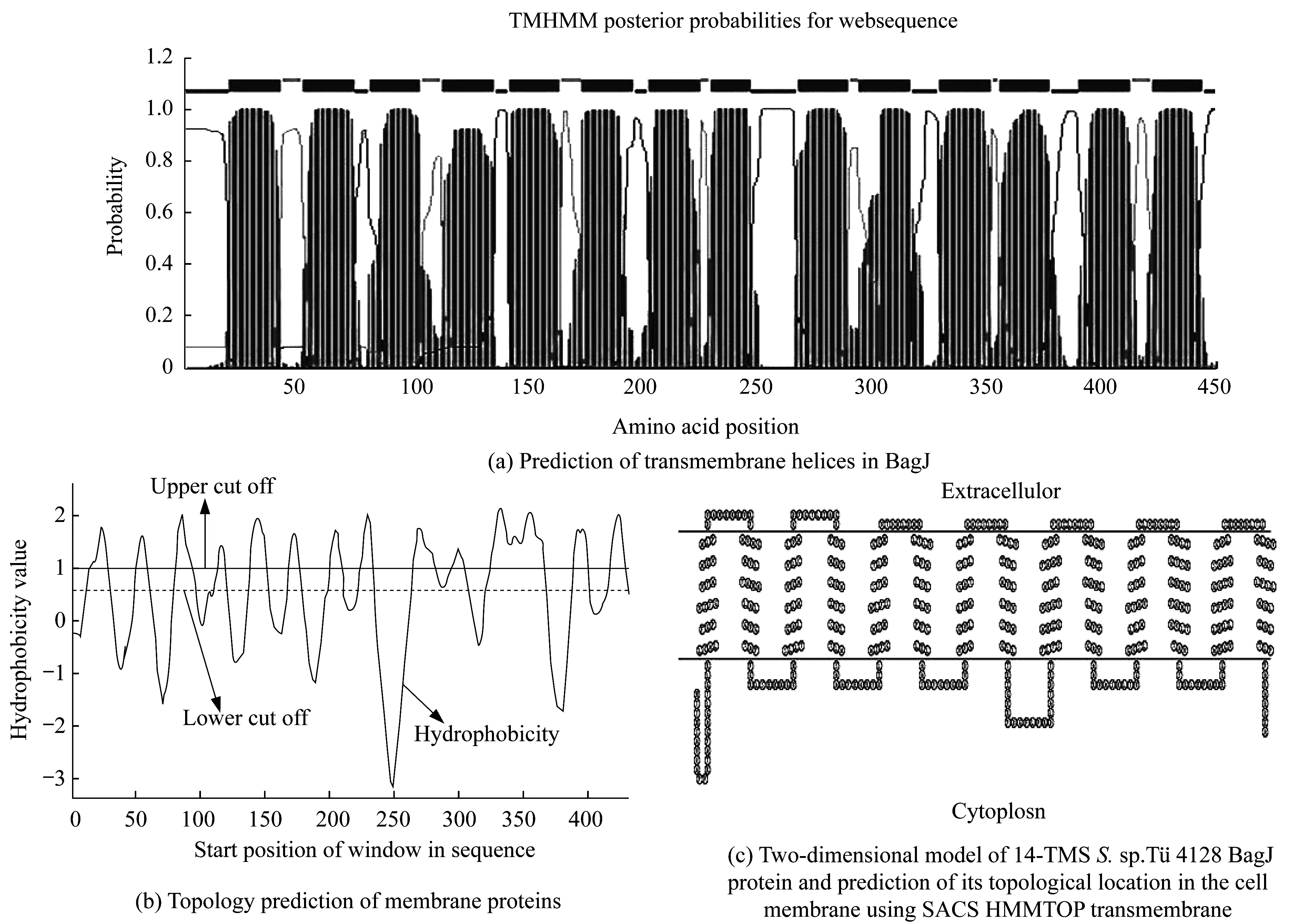
图1 BagJ的生物信息学分析
2.2 基因bagJ对bagremycins产量的影响
为了探究bagJ的功能,本文用框内敲除的方法构建了基因bagJ的单敲除菌株ΔbagJ。图2(b)显示当基因bagJ缺失时,ΔbagJ的发酵产物中检测不到bagremycin A,这表明基因bagJ与抗生素的合成和(或)外排密切相关。为了进一步证明基因bagJ的缺失是导致bagremycin A不产生的原因,本文构建了基因bagJ的回补菌株bagJ+和过表达菌株bagJ++。HPLC的结果显示bagJ+恢复了生产bagremycin A的能力,但产量并没有恢复到WT的水平。此外,bagJ++的bagremycin A和bagremycin B产量均远远高于WT的水平,其结果如图2(c)和2(d)表示。从上述结果可以得出结论,敲除菌株ΔbagJ生产bagremycin A能力的丧失是由基因bagJ的缺失造成的。
2.3 基因bagJ的过表达对bagremycin产量的影响
为了进一步证明基因bagJ的过表达会影响bagremycins的产量,本文对WT和bagJ++进行了大规模的发酵培养。提取第3,5,7,9,11,13,15,17,19天的发酵上清液,过滤后通过HPLC的方法分析bagremycins的产量。在bagJ++中的bagremycins产量远大于WT,其中bagremycin A的产量增加了7倍,bagremycin B的产量增加了28倍,如图3所示。这与前文推测的BagJ是一个MFS转运蛋白,并能将bagremycins转运到S.sp.Tü 4128胞外一致。同时,基因bagJ的过表达也为新型抗生素bagremycins的高产提供了新的策略。

图2 抗生素bagremycins产量的HPLC分析
2.4 基因bagJ与菌株对bagremycins敏感性的关系
抗生素bagremycins会抑制生产菌S.sp.Tü 4128的生长,为了进一步评估BagJ是否与该菌株对bagremycins的耐受性相关,本文测试了菌株WT、ΔbagJ和bagJ+对不同浓度bagremycins粗提物的耐受性。图4中左上角的圈中包含了甲醇(空白对照),平板上顺时针方向粗提液的体积依次为50、100、200 μL(图4(a)~图4(e))。菌株ΔbagJ相比于WT,在相同浓度的抗生素作用下,抑菌圈直径更大(图4(a)和图4(b))。此外,bagJ+恢复了对bagremycins的耐受性(图4(c))。在用溶剂甲醇作对照的情况下,3株菌株均生长正常,并且抑菌圈状态相似。以上结果表明基因bagJ与生产菌S.sp.Tü 4128对bagremycins的敏感性有关,推测这种现象是BagJ通过将抗生素跨膜转运至胞外来实现的。
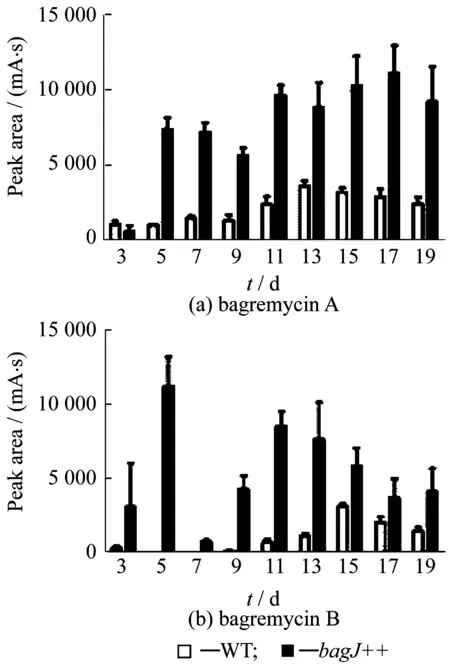
图3 WT和bagJ++中bagremycins产量的定量分析
2.5bagJ异源表达菌株对bagremycins敏感性的验证
为了证明bagJ是S.sp.Tü 4128中bagremycins的抗性基因,本研究将质粒pIB139-bagJ导入S.lividansTK64中,使其异源表达基因bagJ,并在不同的bagremycins粗提物的浓度下,对S.lividansTK64和S.lividansTK64/bagJ进行了抑菌圈实验。图4(d)和4(e)表明,在相同浓度的bagremycins作用下,异源表达菌株的抑菌圈半径远小于TK64的抑菌圈半径。2种菌株在对照组甲醇的作用下均正常生长。综上所述,bagJ是S.sp.Tü 4128的抗性基因。
2.6 异源表达bagJ对S.lividansTK64菌丝形态的影响
抑菌圈实验观察到S.lividansTK64/bagJ的菌丝形态与S.lividansTK64明显不同。为了探究基因bagJ是否与菌丝形态的改变相关,分别在3块SMA培养基上涂布了S.lividansTK64、S.lividansTK64/bagJ和S.lividansTK64/pIB139的新鲜孢悬液。培养3 d之后发现三者的生长形态出现了一定的差异,其中,S.lividansTK64/bagJ的菌丝呈现明显的皱缩状态。为了进一步确定这种宏观的变化是否由菌丝形态的改变造成,本研究通过扫描电镜(SEM)对上述3个菌株的菌丝形态进行了深入分析。图5中扫描电镜的结果表明,S.lividansTK64/bagJ的气生菌丝比对照组的S.lividansTK64/pIB139粗壮,而S.lividansTK64/pIB139和S.lividansTK64的菌丝体粗细一致,这暗示由于BagJ在细胞膜上的定位导致异源表达菌株S.lividansTK64/bagJ的菌丝体表面积增加,从而增加了该菌株向胞外转运bagremycins的几率。扫描电镜的结果和上述的推断进一步解释了S.lividansTK64/bagJ对bagremycins的敏感性小于S.lividansTK64的现象。

(a~e):Sensitivity tests of different strains to bagremycins:(a) WT,(b) ΔbagJ,(c)bagJ+,(d)S.lividansTK64,(e) Heterologously express strainS.lividansTK64/bagJ;(f) Sensitivity ofS.lividansTK64 (f1) andS.lividansTK64/bagJ (f2) to kanamycin,ampicillin,spectinomycin and DMSO;(g) Sensitivity ofS.lividansTK64 (g1) andS.lividansTK64/bagJ (g2) to ethanol,chloromycetin and tetracycline.
图4 敏感性实验结果
Fig.4 Results of sensitivity tests
2.7 BagJ是一个新型的MFS家族逆向转运蛋白
为了进一步确认BagJ属于MFS家族中的哪一类型,本课题组进一步对S.lividansTK64和S.lividansTK64/bagJ进行了抑菌圈实验。本实验选择了氨基糖苷类的卡那霉素(溶于双蒸水)、壮观霉素(溶于DMSO)、胺酰醇类的氯霉素(溶于乙醇)、β-内酰胺类的氨苄青霉素(溶于双蒸水)以及四环素(溶于乙醇)。在进行一系列尝试后,选定了使抑菌圈边界最清晰的抗生素剂量进行抑菌圈实验,即卡那霉素150 μg,氨苄青霉素300 μg,壮观霉素50 μg,氯霉素100 μg以及四环素50 μg。其中DMSO和乙醇分别作为对照。
图4(f)和图4(g)表明,菌株S.lividansTK64菌对乙醇不敏感,这说明氯霉素和四环素造成的抑菌圈没有受到乙醇的影响。然而,DMSO对S.lividansTK64具有一定的抑制作用。DMSO被称为“万能溶剂”,常用来促进药物的吸收,而高浓度的DMSO会结合蛋白质疏水基团,从而引起蛋白的变性并诱导细胞凋亡。从实验结果来看,四环素和氨苄青霉素在菌株S.lividansTK64和S.lividansTK64/bagJ中产生的抑菌圈并没有显著差异。在氯霉素和卡那霉素的作用下,S.lividansTK64/bagJ中产生的抑菌圈均大于S.lividansTK64的抑菌圈,这可能是由于BagJ能够将这两种抗生素转运到细胞内的原因。此外,上述结果还表明BagJ能够增强S.lividansTK64/bagJ将DMSO转运至细胞外的能力。排除DMSO的影响,壮观霉素造成的抑菌圈并不显著。结合BagJ能够将细胞内的bagremycins运输到细胞外这一结果,本文认为BagJ所转运的底物并不具有特异性,推测BagJ属于逆向转运蛋白。
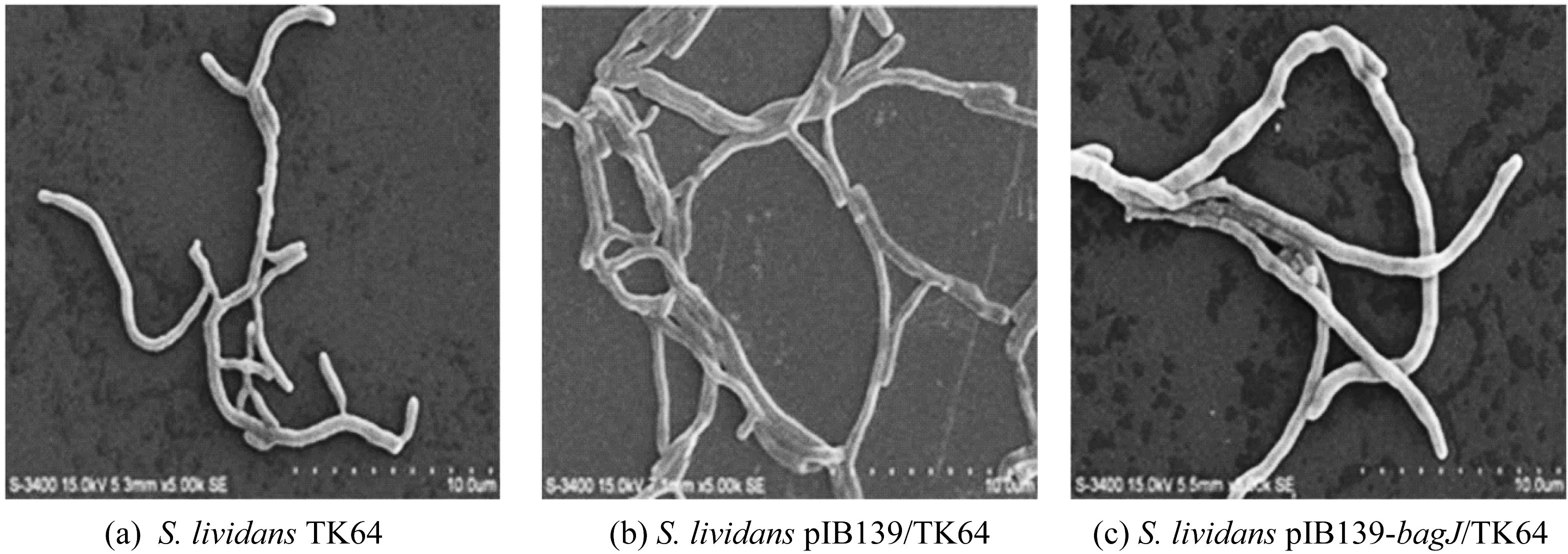
图5 BagJ对S.lividans TK64菌丝形态的影响
3 讨 论
随着细菌耐药性的广泛存在,病原菌对人类的威胁日益严重。WHO认为这种趋势会使“后抗生素时代”提前到来。因此,对于新型抗生素及其抗性基因和耐药机理的研究十分紧迫。
多种抗性基因都是膜转运蛋白。其中,原核生物已知的膜转运蛋白中,有25%属于MFS家族[24]。MFS家族蛋白可以实现不同底物的跨膜运输从而维持胞内渗透压的平衡及细胞本身的稳定性。MFS家族的成员不仅能从外环境中摄取营养物质及必需分子,还能将有毒的代谢产物排出细胞。此外,MFS家族还与药物分子的转运和耐药性密切相关。典型的MFS家族蛋白包含400~600个氨基酸[19],且其中的大部分成员包含12个或14个TMS。在S.lincolnensis中,lmrA是一个具有14个TMS的MFS转运蛋白,并可以赋予林可霉素敏感菌株S.lividansTK23相应的抗性。此外,S.coelicolor的次甲霉素抗性基因与Staphylococcusaureus的QacA编码基因有着类似的功能[25]。
本研究鉴定出一个在bagremycins生物合成中必不可少的抗性基因bagJ。BagJ具有452个氨基酸,与Kibdelosporangiumsp.MJ126-NF4中MFS家族转运蛋白A0A0B7CV45有着55.8%的一致性。此外,序列比对和二级结构分析表明,BagJ具有MFS家族特征保守结构域以及典型的14-TMS结构。这些数据均为BagJ在S.sp.Tü 4128中的膜转运功能和bagremycins抗性基因作用提供了依据。
通过敲除、回补以及过表达实验,证明了基因bagJ在bagremycins抗生素生产中的重要作用。敲除基因bagJ使bagremycin A停止生产,bagremycin B几乎检测不到。回补基因bagJ后,菌株恢复抗生素的生产,但并未达到野生菌株水平,推测这是由于在回补质粒中使用的PermE*启动子并没有基因bagJ自身启动子合适。图2显示,过表达后抗生素的产量大大提升,bagremycin A与bagremycin B的产量分别达到了野生菌株的182%和128%。另外,在图3的结果中,bagremycin A和bagremycin B在过表达菌株中的产量与野生菌株相比分别高了7倍和28倍。上述这一系列结果不仅证明了基因bagJ在bagremycins生物合成中必不可少,也为新型抗生素bagremycins的高产提供了新的思路,即通过过表达BagJ将更多的bagremycins转运至胞外。
抑菌圈实验进一步证明了基因bagJ的缺失使菌株对bagremycins更加敏感,而该基因在S.lividansTK64中的异源表达,使得到的异源表达菌株对bagremycins存在更强的耐受性。扫描电镜的结果表明在异源表达基因bagJ后S.lividansTK64菌丝表面积增大,从而使更多bagremycins转运出细胞。
MFS家族中的逆向转运蛋白可以同时逆向转运多种底物,一般其中一种离子或分子顺电化学梯度转运,其产生的能量驱动其他离子或分子逆电化学梯度转运。例如常见的Na+/Ca2+交换蛋白便是一种逆向转运蛋白,它可以利用储存在Na+电化学梯度中的能量将Na+转运至细胞内,同时,使Ca2+逆向转运从而排出细胞。此蛋白是细胞外排Ca2+最重要的机制之一[27],该蛋白排出1个Ca2+的同时摄入3个Na+[28]。
逆向转运蛋白家族成员转运的底物十分多样化,它们可以协助一些金属离子、磷酸糖类物质、多种药物、神经递质、氨基酸、核苷和多肽类[29]等物质跨越胞质及内膜。甚至有一些该家族的蛋白对底物不具有选择性,对多种药物和外源性物质均具有外排的作用[30-32]。本文选取了实验室内现有的不同种类的抗生素对S.lividansTK64和异源表达菌株S.lividanspIB139-bagJ/TK64进行了抑菌圈实验,实验结果表明BagJ既可以向胞外转运bagremycins和DMSO从而减小抑菌圈的直径,又可以向胞内转运卡那霉素和氯霉素,使抑菌圈直径增加。该现象结合生物信息学比对结果,可以推测BagJ是一个逆向转运蛋白。
综上所述,本文首次鉴定出了S. sp.Tü 4128的抗性基因bagJ,它作为MFS家族逆向转运蛋白存在于bagremycins的生物合成途径中。当前的研究主要集中于基因bagJ的缺失、回补、过表达对bagremycins产量和菌株敏感性的改变,以及对其他抗生素敏感性的分析。后续的研究将延伸到bagremycins的高产和实际应用。众所周知,肺癌已成为中国男性发病率最高的癌症,其中超过85%是非小细胞肺癌,腺癌占非小细胞肺癌的50%,而针对肺腺癌,由于其发病机制复杂,并没有特效药[26]。bagremycins抗生素对特定类型的腺癌具有一定程度的杀灭作用。随着基因组测序技术的广泛普及,以及蛋白质组技术的飞速发展,肺癌的癌症分型正在趋于明朗化,因此,如果bagremycins可以针对某一亚型的腺癌细胞具有不错的清除作用,必将广泛应用于临床,成为抗击癌症的一种新型药物。
[1]BERTASSO M,HOLZENKMPFER M,ZEECK A,etal.Bagremycin A and B,novel antibiotics fromS.sp.Tü 4128 [J].Journal of Antibiotics,2001,54(9):730-736.
[2]BERTASSO M,HOLZENKMPFER M,ZEECK A,etal.Bagremycins are two new para-coumaric acid derived antibiotics produced byS.sp.Tü 4128[C]//Biotechnological Advances and Applications in Bioconversion of Renewable Raw Materials.Braunschweig:BGBF and InWEnt,2004:86-91.
[3]LIU Feng,XU Dakui,ZHANG Yuchen,etal.Identification of BagI as a positive transcriptional regulator of bagremycin biosynthesis in engineeredStreptomycessp.Tü 4128 [J].Microbiological Research,2015,173:18-24.
[4]ZHU Yunxia,LIAO Siyi,YE Jiang,etal.Cloning and characterization of a novel tyrosine ammonia lyase-encoding gene involved in bagremycins biosynthesis inStreptomycessp.Tü 4128 [J].Biotechnology Letters,2012,34(2):269-274.
[5]ZHU Yunxia,XU Dakui,LIAO Siyi,etal.Cloning and characterization ofbagBandbagC,two co-transcribed genes involved in bagremycin biosynthesis inS.sp.Tü 4128 [J].Annals of Microbiology,2013,63(1):167-72.
[6]CUNDLIFFE E.How antibiotic producing organisms avoid suicide [J].Annual Review of Microbiology,1989,3(1):207-233.
[7]VECCHIONE J J,SELLO J K.Characterization of an inducible,antibiotic-resistant aminoacyl-tRNA synthetase gene inStreptomycescoelicolor[J].Journal of Bacteriology,2008,190(18):6253-6257.
[9]HOTTA K,YAMAMOTO H,OKAMI Y,etal.Resistance mechanisms of kanamycin-,neomycin-,and streptomycin- producing streptomycetes to aminoglycoside antibiotics [J].Journal of Antibiotics,1981,34(9):1175-1182.
[10]YAMAMOTO H,HOTTA K,OKAMI Y,etal.Mechanism of resistance to aminoglycoside antibiotics in nebramycin-producingStreptomycestenebrarius[J].Journal of Antibiotics,1982,35(8):1020-1025.
[11]YAMAMOTO H,HOTTA K,OKAMI Y,etal.Self-resistance of aStreptomyceswhich produces istamycins [J].Journal of Antibiotics,1981,34(7):824-829.
[12]CUNDLIFFE E.Mechanism of resistance to thiostrepton in the producing-organismStreptomycesazureus[J].Nature,1978,272(5656):792-795.
[13]SUGIYAMA M,MOCHIZUKI H,NIMI O,etal.Mechanism of protection of protein synthesis against streptomycin inhibition in a producing strain [J].Journal of Antibiotics,1981,34(9):1183-1188.
[14]WEISBLUM B.Erythromycin resistance by ribosome modification [J].Antimicrobial Agents and Chemotherapy,1995,39(3):577-585.
[15]NAKANO M M,MASHIKO H,OGAWARA H.Cloning of the kanamycin resistance gene from a kanamycin-producingStreptomycesspecies [J].Journal of Bacteriology,1984,157(1):79-83.
[16]LOMOVSKAYA N,HONG S K,KIM S U,etal.TheStreptomycespeucetiusdrrCgene encodes a UvrA-Like protein involved in daunorubicin resistance and production [J].Journal of Bacteriology,1996,178(11):3238-3245.
[17]MATIN JF,CASQUEIRO J,LIRAS P.Secretion systems for secondary metabolites:How producer cells send out messages of intercellular communication [J].Current Opinion in Microbiology,2005,8(3):282-293.
[18]NEYFAKH A A.Mystery of multidrug transporters:The answer can be simple [J].Molecular Microbiology,2002,44(5) :1123-1130.
[19]LAW C J,MALONEY P C,WANG D N.Ins and outs of major facilitator superfamily antiporters [J].Annual Review of Microbiology,2008,62(62):289-305.
[20]FERNANDEZ-AGUADO M,MARTIN J F,RODRIGUEZ-CASTRO R,etal.New insights into the isopenicillin N transport inPenicilliumchrysogenum[J].Metabolic Engineering,2014,22(2):89-103.
[21]PAULSEN IT.Multidrug efflux pumps and resistance:Regulation and evolution [J].Current Opinion in Microbiology,2003,6(5):446-451.
[22]SUN J,BANKSTON J R,PAYANDEH J,etal.Crystal structure of the plant dual-affinity nitrate transporter NRT1.1 [J].Nature,2014,507(7490):73-77.
[23]REDDY V S,SHLYKOV M A,CASTILLO R,etal.The major facilitator superfamily (MFS) revisited [J].Febs Journal,2012,279(11) :2022-2035.
[24]SAIER J R M H,BEATTY J T,GOFFEAU A,etal.The major facilitator superfamily [J].Journal of Molecular Microbiology and Biotechnology,1999,1(2):257-279.
[25]ZHANG Huizhan,SCHMIDT H,PIEPERSBERG W.Molecular cloning and characterization of two lincomycin-resistance genes,ImrAandlmrB,fromStreptomyceslincolnensls78-11 [J].Molecular Microbiology,1992,6(15):2147-2157.
[26]CHEN Zhao,FILLMORE C M,HAMMERMAN P S,etal.Non-small-cell lung cancers:A heterogeneous set of diseases [J].Nature Reviews Cancer,2014,14(8):535-546.
[27]DIPOLO R,BEAUGE L.Sodium/calcium exchanger:Influence of metabolic regulation on ion carrier interactions [J].Physiological Reviews,2006,86:155-203.
[28]YU Shanping,Choi D W.Na+-Ca2+exchange currents in cortical neurons:Concomitant forward and reverse operation and effect of glutamate [J].European Journal of Neuroscience,1997,9(6):1273-1281.
[29]DOKI S,KATO H E,SOLCAN N,etal.Structural basis for dynamic mechanism of proton-coupled symport by the peptide transporter POT [J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(28):11343-11348.
[30]JIANG Daohua,ZHAO Yan,WANG Xianping,etal.Structure of the YajR transporter suggests a transport mechanism based on the conserved motif A[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(36):14664-14669.
[31]PUTMAN M,VAN VEEN H W,KONINGS W N.Molecular properties of bacterial multidrug transporters [J].Microbiology and Molecular Biology Reviews,2000,64(4):672-693.
[32]YIN Yong,HE Xiao,SZEWCZYK P,etal.Structure of the multidrug transporter EmrD fromEscherichiacoli[J].Science,2006,312(5774):741-744.
Identification ofbagJas A Resistant Gene for Novel Antibiotic Bagremycins inStreptomycessp.Tü 4128
ZHANG Yu-chen, WU Hai-zhen, JU Cheng, QI Shuang-shuang, YE Jiang, ZHANG Hui-zhan
(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China)
The function of genebagJvia in-frame deletion inStreptomycessp.Tü 4128 was identified.The result of HPLC analysis showed that the production of bagremycins was significantly decreased in the single knock-out strain ofbagJ.The production of bagremycins was recovered in the complementation strain.The overexpression of genebagJresulted in producing far more bagremycins,which indicated thatbagJwas indispensable in the biosynthesis of bagremycins.The test of inhibition zones showed that thebagJmutant was more sentitive to bagremycins than the wild type.Heterogenous expression of BagJ inStreptomyceslividansTK64 enhanced its endurance to bagremycins which suggested thatbagJmight be a resistant gene of the novel antibiotics bagremycins.SEM showed that the morphology of the mycelia was changed in the heterogenous expression strain of BagJ inS. lividams TK64.The sensitivity assays of other antibiotics showed that BagJ was probably an antiporter.
bagremycins;Streptomycessp.Tü 4128;bagJ; MFS family; resistant gene
1006-3080(2017)02-0184-09
10.14135/j.cnki.1006-3080.2017.02.006
2016-07-12
国家自然科学基金(31200026)
张玉琛(1990-),女,安徽淮南人,硕士生,研究方向为生物化学与分子生物学。E-mail:zhangyuchen613@163.com
张惠展,E-mail:huizhzh@ecust.edu.cn
Q71
A
